上皮间质转化与哮喘气道重塑的研究进展
魏 盼,李恋曲,吴 鹏,贾志荣,王晓钰,洪 敏,江国荣
(1.南京中医药大学药学院,科技部国家规范化中药药理实验室,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023; 2.南京中医药大学附属苏州市中医医院苏州市吴门医派研究院,江苏 苏州 215003)
据Global Burden of Disease Study资料显示,全世界约有2.4亿哮喘患者,且有增加趋势,预计到2025年将达到3亿。我国至少有2 000万以上哮喘患者,儿童哮喘患者约1 000万,患病率约为1.05%~4%,个别地区甚至高达5%以上,且近年来有上升趋势[1]。支气管哮喘是变应原或其他因素引起肺功能异常的疾病,而气道重塑是肺功能异常的病理基础,也是哮喘难以根治的根本原因。支气管哮喘患者反复的气道炎症、组织损伤以及随后不正常修复导致气道壁结构改变被称为气道重塑,其主要病理学改变涉及气道的各层组织及细胞的异常变化,包括上皮细胞损伤脱落、黏膜下层杯状细胞化生、平滑肌细胞增生和肥大、成纤维细胞增生、气道壁增厚、管腔狭窄等。其中,气道上皮是接触过敏原和有害物质的第一道天然屏障,其通过促炎因子释放、杯状细胞化生及黏液过度的分泌参与了气流受限的形成,更重要的是通过上皮间质转化(epithelial-mesenchymal transition,EMT)参与了气道的重塑。
EMT是指胚胎发育、肿瘤转移以及器官纤维化过程中,上皮细胞形态与表型发生改变,并具有间质细胞特性的现象。研究表明[2], EMT能导致哮喘气道上皮的纤维化并促进平滑肌增生,破坏上皮屏障,加重气道炎症,在气道重塑中发挥重要作用。本文对EMT的调节因素进行简述,就EMT与哮喘气道重塑的研究重点综述。
1 EMT的调节因素
至今已发现有许多细胞因子和转录因子与EMT相关。细胞因子如转化生长因子β(transforming growth factor β,TGF-β)、表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factor,FGF),转录因子如Snail、Zeb、Twist等,参与了EMT的调节,其中TGF-β被认为是参与EMT的关键因子。TGF-β是一种多效性的细胞因子,不仅参与调节细胞的生长、分化、凋亡、迁移和免疫,并且可介导多种信号通路,如Smad、PI3K/Akt、NF-κB通路等,参与EMT过程[3]。TGF-β在调节EMT过程中,首先与TGF-β的II型受体结合进行信号的启动;接着激活I型受体激酶,导致Smad2和Smad3磷酸化;随后,活化的Smad2和Smad3与Smad4形成异三聚体,此异三聚体发生核转移并参与基因的调控[4]。在与DNA结合过程中,需要Snail、Zeb转录因子的参与,去辅助靶基因获取更好的亲和力及选择性[5]。另外,EGF与FGF等细胞因子也能通过激活PI3K通路,活化蛋白激酶,进而上调Snail和β-catenin,降低E-cadherin的表达,发生EMT[6]。
2 EMT与哮喘的气道重塑
气道重塑是呼吸道疾病共同的病理特征,气道重塑的发生与气道炎症引起的气道上皮组织的反复损伤和修复有关。研究表明,哮喘与EMT有着密切联系,EMT引起细胞外基质沉积,进而造成的上皮下纤维化以及平滑肌的增生与迁移导致了气道壁的增厚。
尘螨诱导的小鼠哮喘模型中,气道上皮细胞连接蛋白(E-cadherin、Occludin)的表达逐渐缺失,而间质蛋白(如Vimentin、α-SMA)的表达增加[2],提示EMT伴随在哮喘疾病发展过程中。Fischer等[7]在哮喘小鼠中,观察到其气道壁增厚明显,且气道上皮的E-cadherin大量减少,同时N-cadherin、Vimentin的表达明显增加,这说明EMT可能导致气道壁的增厚。Liu 等[8]同时在哮喘病人和卵清蛋白(ovalbumin, OVA)哮喘模型小鼠的气道中观察到了气道壁的重构,并伴随着EMT的发生。然而,给小鼠气管滴注嗜酸性粒细胞,小鼠气道壁的E-cadherin表达减少,Vimentin、α-SMA的表达升高[9],同时,体外共培养嗜酸性粒细胞与支气管上皮细胞,支气管上皮细胞也发生了间质转化[8],表明哮喘典型的嗜酸性炎症有助于EMT的发生。de Groot等[10]发现,患有重度哮喘的病人气道细胞外基质有明显沉积,这导致上皮下纤维化过程以及气流受限,从而加重哮喘症状。OVA诱导的大鼠哮喘模型气道中同样发现了气道结构的改变,如上皮下出现纤维化、杯状细胞化生及平滑肌细胞的增生,并且伴随着上皮细胞标志物E-cadherin的表达下调,间质细胞的标志物纤维粘连蛋白与α-SMA表达上调[11]。哮喘大鼠气道结构改变过程中,上皮下出现纤维化,同时上皮形态逐渐缺失,并出现EMT的改变(E-cadherin下调,α-SMA、N-cadherin上调),蛋白骨架的变化导致上皮损伤脱落,进而引起促炎因子的释放,杯状细胞增生与黏液分泌,提示EMT可能通过诱导上皮持续性损伤,参与气道重塑的发展[12](炎症与气道重塑的关系见Fig 1)。对气道壁波形蛋白的定量研究进一步表明了间质细胞有30%来源于上皮细胞的转化。对气道上皮以及上皮下黏膜进行标记,发现了促I型胶原的产生,说明气道上皮通过间质转化产生胶原沉积和上皮下纤维化过程,参与气道重塑[2]。这些研究说明了哮喘支气管气道壁的增厚过程伴随着EMT的发生,而且有近1/3的间质细胞来源于上皮细胞的转化,这一比例也提示了EMT在支气管气道重塑中的重要地位。
3 EMT在哮喘气道重塑中的发生机制
3.1TGF-β介导的信号通路临床病人及动物模型的气管哮喘气道中均有TGF-β的表达升高[13]。研究表明,嗜酸性粒细胞、上皮细胞、成纤维细胞均能分泌TGF-β[14]。TGF-β作为EMT最重要的感应器,提示很有可能通过TGF-β介导EMT来促进气道重塑。TGF-β1诱导支气管上皮细胞发生间质转化的过程[15],是通过丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和Smad信号的激活调节(Fig 1)。通过Smad机制诱发EMT涉及转录因子Zeb2和Snail的上调,其可抑制E-cadherin、ZO-1、Occludin等的表达[16]。此外,TGF-β还能够通过活化β-catenin-Wnt信号通路,该通路能调节Snail2的表达,从而抑制E-cadherin mRNA的表达[17]。体外TGF-β刺激支气管上皮细胞72 h后,检测到细胞形态和表型的改变,细胞从鹅卵石状的形态变成梭形,并且细胞与细胞间的连接丢失。Western blot与免疫荧光的结果表明,上皮细胞的标志物E-cadherin减少且分布发生紊乱,间质细胞的标志物Vimentin与N-cadherin、α-SMA出现,这是EMT发生的标志,且Smad2/3和 p38 MAPK信号通路均被激活,E-cadherin下调可通过Smad2/3或者p38 MAPK信号通路完成[18]。同时研究发现,体外用TGF-β诱导支气管上皮细胞发生间质转化过程中,蛋白酶激活受体-1(protease-activated receptor-1,PAR-1)被激活,说明PAR-1参与调节了EMT;PAR-1能抑制E-cadherin的表达,同时促进α-SMA的生成[12]。PAR-1通路是与杯状细胞化生和肺气肿相关的通路,提示PAR-1可能通过诱导杯状细胞的化生,损伤上皮屏障来促进EMT的过程。
3.2肿瘤坏死因子α(tumornecrosisfactorα,TNF-α)通路TNF-α也参与了EMT过程,并且TNF-α能促进炎症因子的产生,以及进一步加剧EMT的过程[19]。Cmara等[20]证实,TNF-α通过Smad非依赖途径,协同TGF-β诱导EMT过程。提示TNF-α通路可能也是引起EMT过程的因素之一。
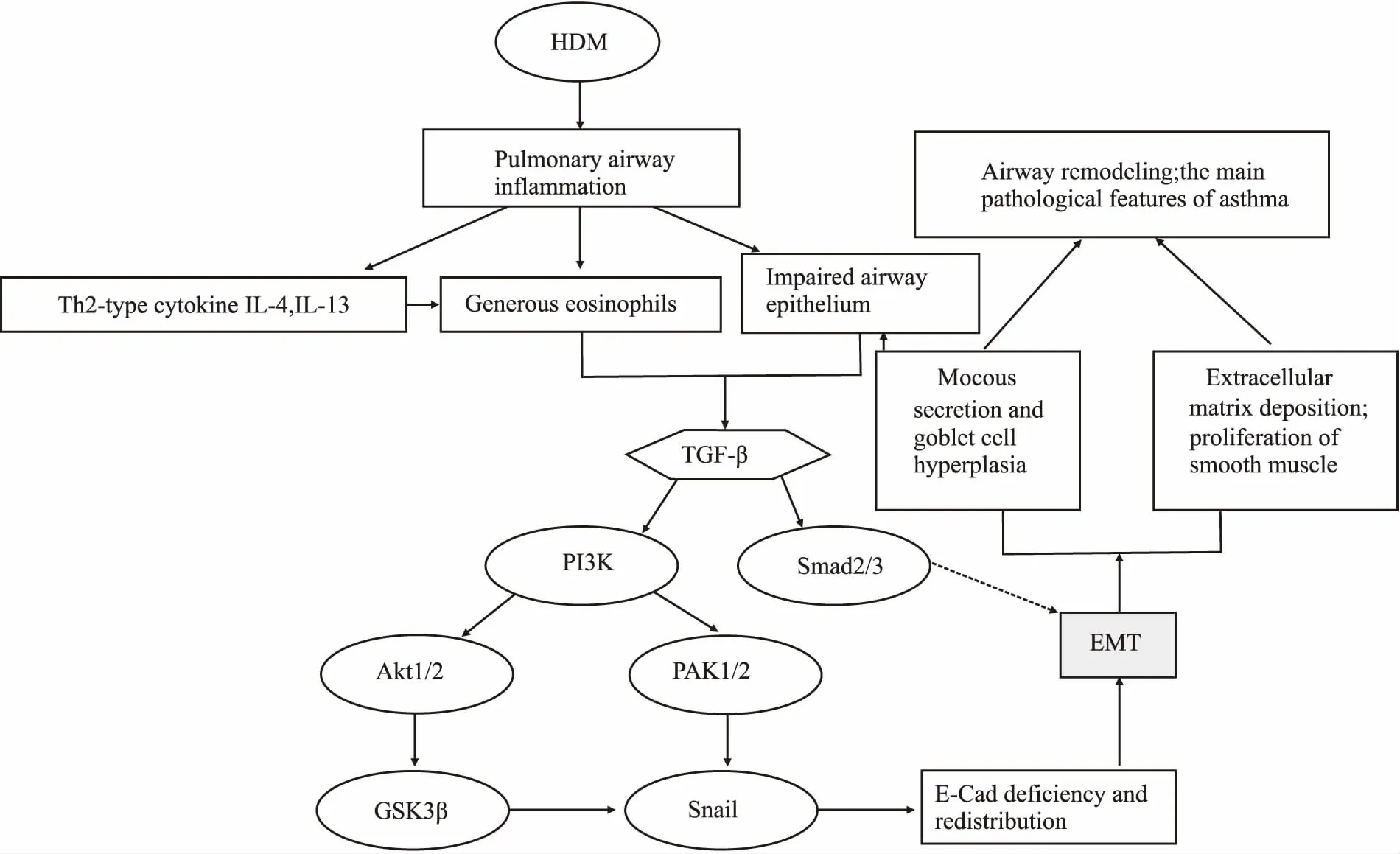
Fig 1 Relationship among inflammation, EMT and airway remodeling in asthma
3.3活性氧(reactiveoxygenspecies,ROS)/MAPK通路在体外诱导人支气管上皮细胞发生间质转化过程中,一段时间后,细胞内的ROS增加,且还原型烟酰胺腺嘌呤二核苷酸磷酸氧化单元氮氧化合物的mRNA和蛋白表达增加,ROS的产生和氮氧化合物的表达均可被抗氧化物(cAMP类似物)所抑制,表明ROS在cAMP下调过程中起作用。提示ROS/MAPK的激活促进EMT,参与了哮喘气道重塑的发生[21]。
3.4骨成型蛋白通路McCormack等[22]发现,外源性的骨成型蛋白(BMP2、BMP4、BMP7)能够诱导大鼠正常气道上皮细胞发生间质转化,并提高细胞的迁移率,应用BMP的拮抗剂可抑制细胞的迁移。表明BMP信号通路介导了EMT过程,其可能参与气道重塑的发展。
3.5晚期糖基化终产物受体(receptorofadvancedglycationendproducts,RAGE)通路Chen等[23]研究表明,高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)能够诱导正常人气道上皮细胞发生间质转化,沉默其受体RAGE能够抑制EMT的发生,说明了RAGE信号通路介导了EMT的发生[24]。
4 小结
综上所述,在哮喘气道炎症导致的损伤修复过程中,气道上皮可能通过相关通路发生了间质转化过程,并引起上皮受损、细胞外基质的沉积以及上皮下纤维化,在气流受限的形成中发挥重要作用。目前,有关EMT的研究主要集中在肿瘤的转移以及器官纤维化,近年来,越来越多的研究表明,哮喘、鼻炎等呼吸道疾病中出现EMT现象,引起了人们的高度重视。然而,EMT在哮喘气道重塑中的发生机制尚不全面。哮喘所带来的危害是有目共睹的,气道重塑导致临床哮喘患者气道阻塞和呼吸困难,是哮喘难以根治的根本原因。目前,临床用于抗哮喘的药物沙丁胺醇与特布他林作为β受体激动剂代表药物,能通过激动呼吸道的β2受体,激活腺苷酸环化酶,使细胞内的环磷酸腺苷含量增加,进而松弛支气管平滑肌,其可能是通过保护平滑肌功能来治疗哮喘的。因此,抑制或逆转EMT可能是治疗气道重塑新的途径。进一步研究EMT在哮喘气道重塑中的机制,为哮喘提供新的治疗靶点是非常有意义的。
参考文献:
[1] Fehrenbach H, Wagner C, Wegmann M.Airway remodeling in asthma: what really matters [J].CellTissueRes, 2017,367(3):551-69.
[2] Johnson J R, Roos A, Berg T, et al.Chronic respiratory aeroallergen exposure in mice induces epithelial-mesenchymal transition in the large airways [J].PLoSOne, 2011,6(1):e16175.
[3] Hata A, Chen Y G.TGF-beta signaling from receptors to Smads [J].ColdSpringHarbPerspectBiol, 2016,4(9):a022061.
[4] Xu F, Liu C, Zhou D, Zhang L.TGF-beta/Smad pathway and its regulation in hepatic fibrosis [J].JHistochemCytochem, 2016,64(3):157-67.
[5] Yeung K T, Yang J.Epithelial-mesenchymal transition in tumor metastasis [J].MolOncol, 2017,11(1):28-39.
[6] Zhang H Y,Wang Z Q,Li Y Y,et al.Transforming growth factor-β1-induced epithelial-mesenchymal transition in human esophageal squamous cell carcinoma via the PTEN/PI3K signaling pathway [J].OncolRep,2014,32(5): 2134-42.
[7] Fischer K D, Hall S C, Agrawal D K, et al.Vitamin D supplementation reduces induction of epithelial-mesenchymal transition in allergen sensitized and challenged mice [J].PLoSOne, 2016,11(2):e0149180.
[8] Liu T, Liu Y, Miller M,et al.Autophagy plays a role in FSTL1-induced epithelial mesenchymal transition and airway remodeling in asthma [J].AmJPhysiolLungCellMolPhysiol, 2017,313(1):L27-40.
[9] Yasukawa A, Hosoki K, Toda M, et al.Eosinophils promote epithelial to mesenchymal transition of bronchial epithelial cells [J].PLoSOne, 2013,8(5):e64281.
[10] de Groot J C, Storm H, Amelink M, et al.Clinical profile of patients with adult-onset eosinophilic asthma [J].ERJOpenRes, 2016,2(2).pii: 00100-2015.
[11] Tian X, Tian X, Huo R, et al.Bacillus Calmette-Guerin alleviates airway inflammation and remodeling by preventing TGF-beta1 induced epithelial-mesenchymal transition [J].HumVaccinImmunother, 2017,13(8):1758-64.
[12] Gong J H, Cho I H, Shin D, et al.Inhibition of airway epithelial-to-mesenchymal transition and fibrosis by kaempferol in endotoxin-induced epithelial cells and ovalbumin-sensitized mice [J].LabInvest, 2014,94(3):297-308.
[13] Song L, Sen S, Sun Y, et al.Ketamine inhalation ameliorates ovalbumin-induced murine asthma by suppressing the epithelial-mesenchymal transition [J].MedSciMonit, 2016,22:2471-83.
[14] Wynn T A.Cellular and molecular mechanisms of fibrosis [J].JPathol, 2008,214(2):199-210.
[15] Itoigawa Y, Harada N, Harada S, et al.TWEAK enhances TGF-β-induced epithelial-mesenchymal transition in human bronchial epithelial cells [J].RespirRes, 2015,16(1): 48.
[17] Heijink I H, Postma D S, Noordhoek J A, et al.House dust mite-promoted epithelial-to-mesenchymal transition in human bronchial epithelium [J].AmJRespirCellMolBiol, 2010,42(1):69-79.
[18] Hackett T L, Warner S M, Stefanowicz D, et al.Induction of epithelial-mesenchymal transition in primary airway epithelial cells from patients with asthma by transforming growth factor-beta1 [J].AmJRespirCritCareMed, 2009,180(2):122-33.
[19] Zhao Y, Tian B, Sadygov R G, et al .Integrative proteomic analysis reveals reprograming tumor necrosis factor signaling in epithelial mesenchymal transition [J].JProteomics, 2016,148:126-38.
[21] Ge A, Ma Y, Liu Y N, et al.Diosmetin prevents TGF-beta1-induced epithelial-mesenchymal transition via ROS/MAPK signaling pathways [J].LifeSci, 2016,153:1-8.
[22] McCormack N, Molloy E L, O’Dea S.Bone morphogenetic proteins enhance an epithelial-mesenchymal transition in normal airway epithelial cells during restitution of a disrupted epithelium [J].RespirRes, 2013,14:36.
[23] Chen Y C, Statt S, Wu R, et al.High mobility group box 1-induced epithelial mesenchymal transition in human airway epithelial cells [J].SciRep, 2016,6:18815.
[24] 李留成,高 建,李 俊, 等.HMGB1在呼吸系统疾病中的作用及其机制 [J].中国药理学通报,2015,31(1): 15-8.
[24] Li L C,Gao J,Li J, et al.The role and mechanism of HMGB1 in respiratory diseases[J].ChinPharmacolBull, 2015,31(1): 15-8.