丹酚酸B通过调控SIRT1/NF-κB/p53通路减轻缺氧/复氧诱导的大鼠肝细胞损伤
万 磊,陈青松,周 壮,周翔宇,郑道峰,吴忠均
(重庆医科大学附属第一医院肝胆外科,重庆 400016)
肝脏缺血/再灌注损伤(ischemia/reperfusion injury, IRI)是指肝脏在缺血一段时间后恢复血液供应,该过程不仅不利于肝功能的恢复,往往造成更严重的肝脏功能障碍。在肝脏IRI进程中,氧化应激反应、炎症反应、肝细胞的凋亡、坏死等都是引起肝损伤的重要原因[1]。沉默信息调节因子1(silent information regulator 1, SIRT1)作为一种广泛存在于人类细胞中的III组蛋白去乙酰化酶,通过其去乙酰化作用,调控抑癌因子p53、核因子κB(nuclear factor-κB, NF-κB)、叉头蛋白转录因子(forkhead-box transcription factor, FOXO)等多种因子,发挥各种生物活性[2]。NF-κB作为体内关键的信号分子,精确调控炎症反应,而通过SIRT1的效应,可以降低其亚单位NF-κB p65的表达,抑制下游炎症因子的活性[3]。p53在细胞内主要表现为阻滞细胞周期、促进细胞凋亡等作用,而SIRT1可以降低p53的结合能力,减少细胞凋亡[4]。丹酚酸 B(salvianolic acid B, Sal B)是从丹参中提取的高活性、低毒性的水溶性化合物,具有改善心脑血流量、抗氧化、抗炎等生物活性,近年来研究也证明Sal B对心肌梗死有保护作用,且能改善心脑IRI[5]。本研究拟通过建立大鼠肝细胞株BRL-3A的缺氧/复氧(hypoxia/reoxygenation,H/R)模型[6],观察Sal B是否减轻H/R诱导的肝细胞损伤,并初步探讨其潜在机制,为临床治疗肝IRI提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞株与试剂 大鼠BRL-3A肝细胞株购自武汉Procell公司;Sal B购自上海Winherb医药科技发展有限公司;胎牛血清(fetal bovine serum,FBS)购自BI公司;DMEM/F12培养基购自Hyclone公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒购自南京建成生物公司;肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β (interleukin 1β,IL-1β) ELISA试剂盒购自Neobioscience公司;逆转录all in one试剂、SYBR荧光染料、CCK-8试剂购自Biotool公司;TRIzol试剂购自TaKaRa公司;引物购自上海生工有限公司;RIPA裂解液、BCA蛋白浓度检测试剂盒购自碧云天公司;ECL发光液购自Advansta公司;兔抗NF-κB p65抗体购自北京中杉金桥生物公司;兔抗SIRT1、p53、Bax、Bcl-2抗体购自沈阳万类公司;兔抗β-actin抗体及山羊抗兔IgG购自武汉博士德公司。
1.1.2仪器 3131型三气培养箱(美国Thermo Scientific公司);MSS酶标仪(芬兰雷勃公司);Allegra 64R 型超速冷冻离心机(美国Beckman公司);PowerPac 300型电泳仪、CFX96 型荧光定量PCR仪(美国Bio-Rad公司);流式细胞仪(美国BD公司)。
1.2方法
1.2.1大鼠BRL-3A肝细胞培养及Sal B药物配制 将BRL-3A正常培养在含10% FBS的DMEM/F12培养基中,置于普通的培养箱(37℃、5% CO2、95%空气)中,观察细胞形态。将 Sal B溶解在无菌的PBS液中,配成浓度10 μmol·L-1的基础液,封口避光保存于-20℃冰箱,根据实验需要,再用 DMEM/F12培养基将基础母液稀释到相应的浓度。
1.2.2实验分组及H/R模型构建 实验分为对照组:正常培养的细胞;对照处理组:正常培养的细胞中加入实验最适浓度Sal B(0.5 μmol·L-1)干预;模型组:H/R诱导培养的细胞;实验处理组:在需要H/R诱导培养的细胞中分别加入0.25、0.5 μmol·L-1Sal B干预。H/R模型构建:正常条件培养肝细胞生长至融合度70%左右后,改用不含血清的饥饿培养液,置于三气培养箱(37℃、94% N2、1% O2、5% CO2)缺氧培养12 h,再置入普通孵箱培养4 h[6]。在缺氧前2 h加入相应浓度药物干预。
1.2.3CCK-8检测细胞活力 选取状态良好的细胞计数,然后按1.2×104个/孔接种到2块96孔板里,随机将两板分为对照组和H/R组;对照组设置空白对照及调零组,H/R组设置空白H/R、H/R加药及调零组;空白对照组正常孵育,空白H/R组缺氧培养12 h后再复氧培养4 h,H/R加药组在不同浓度药物干预2 h后再H/R处理,调零组没有细胞,每组设置3个复孔。接种完毕后,将孔板放入普通培养箱正常培养24 h,再按实验要求药物干预,按需行缺氧/复氧处理,根据说明书,再混入10 μL CCK-8反应液,于正常孵箱中反应90 min,测OD值。
1.2.4ELISA检测TNF-α和IL-1β水平 将细胞接种到2块6孔板中正常培养,待细胞贴壁融合到70%左右,开始药物干预,随机选择1块孔板,设置空白对照组及加入0.5 μmol·L-1药物干预对照组,另一块孔板设置空白H/R组和分别加入0.25、0.5 μmol·L-1药物干预的H/R组。H/R后收集各组细胞液,按说明书要求检测TNF-α和IL-1β水平。
1.2.5微板法检测ALT和AST水平 将细胞接种到2块6孔板中正常培养,随机选择孔板设置分组,按上述方法处理,收集培养液,按试剂盒要求检测ALT、AST水平。
1.2.6流式细胞术检测细胞凋亡 用T25培养瓶正常培养细胞,待贴壁融合70%左右开始药物干预处理细胞,分为对照组、加0.5 μmol·L-1药物干预的对照组、H/R组、加0.25、0.5 μmol·L-1药物干预的H/R组。H/R完成后收集上清,与消化的细胞一起离心,PBS多次冲洗,重复离心步骤,最后收集细胞,按说明操作,检测凋亡。
1.2.7Western blot检测蛋白表达 实验分组和处理方法同上,H/R后提取细胞总蛋白,并用BCA法测定蛋白浓度,绘制标准曲线后,按每孔30 μg计算上样量。浓缩胶80 V电泳,等蛋白预染标记物完全分开后,120 V继续电泳下层胶;充分分离后,250 mA电转至PVDF膜;膜在环境温度下用5%的脱脂牛奶于70 r·min-1的摇床上封闭90 min,再孵育一抗(β-actin、SIRT1、p53、Bax、Bcl-2为1 ∶500,NF-κB p65为1 ∶800),置于4℃过夜;隔天将膜夹入TBST中,于110 r·min-1摇床上洗3遍,各10 min,再孵育二抗(1 ∶5 000),置于37℃培养箱反应1 h,之后再将膜用TBST洗3次;最后曝光显影,用软件进行蛋白表达量的定量分析。
1.2.8实时荧光定量PCR检测mRNA表达 实验分组和处理方法同上,H/R后用TRIzol法提取各组细胞总RNA,按说明书逆转录为cDNA,并取cDNA行荧光定量PCR,检测SIRT1、NF-κB p65、p53、Bax、Bcl-2的mRNA表达水平,以GADPH作为内参,独立实验,重复3次。PCR反应体系: cDNA 1 μL、SYBR Green 5 μL、上下游引物各0.2 μL、无酶水3.6 μL。引物序列见Tab 1。

Tab 1 Sequences of primers for selected genes
2 结果
2.1SalB对H/R后细胞活力的影响在不同浓度Sal B(0.05、0.1、0.25、0.5、1、2.5、5、10 μmol·L-1)预处理后,对细胞行H/R诱导,通过检测分析发现,H/R组与对照组相比,细胞活力明显下降(P<0.01);0.05、0.1、0.25、0.5、1、2.5 μmol·L-1药物干预后的H/R组与H/R组对比,肝细胞活力升高(P<0.05,P<0.01),5、10 μmol·L-1药物干预后的H/R组与H/R组对比,肝细胞活力升高不明显,差异无统计学意义,且0.5 μmol·L-1Sal B预处理后肝细胞活力提高最明显,所以将该浓度作为后续实验的药物最佳预处理浓度(Fig 1)。
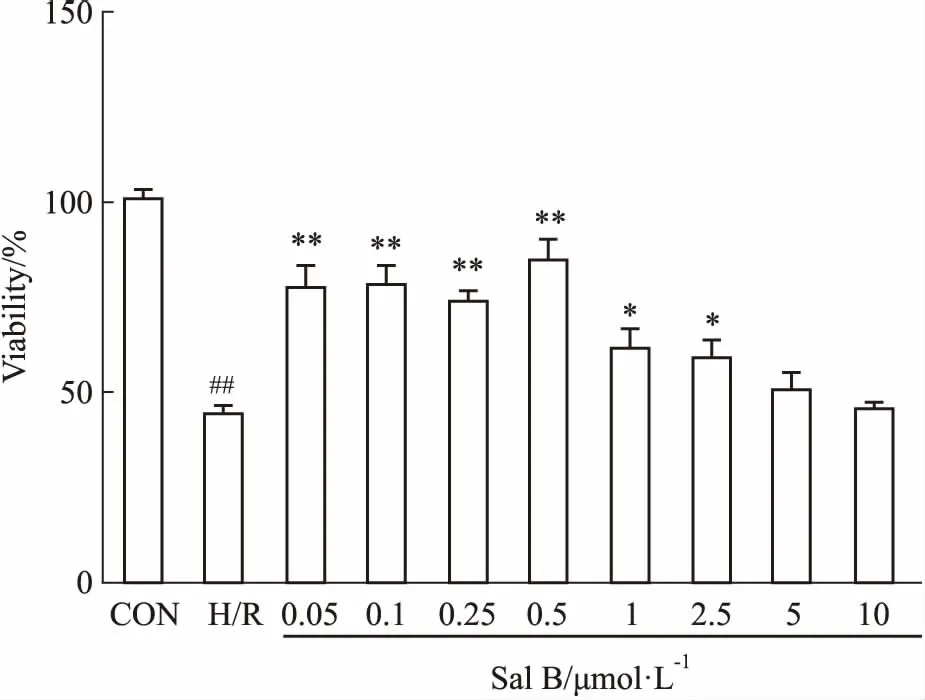
Fig 1 Effect of Sal B on viability of BRL-3A cells induced by H/R
CON: Control group; H/R: Hypoxia 12 h/reoxygenation 4 h.##P<0.01vsCON;*P<0.05,**P<0.01vsH/R.
2.2SalB降低H/R诱导的肝细胞上清液中ALT和AST水平对照组中ALT、AST水平较低,0.5 μmol·L-1Sal B干预后的对照组中ALT、AST水平变化不大,差异无统计学意义。H/R诱导后,细胞培养液中ALT、AST水平明显上升,预处理后,H/R中ALT、AST水平降低(P<0.01,Fig 2A)。
2.3SalB降低H/R诱导的肝细胞上清液中TNF-α和IL-1β水平药物干预的对照组与空白对照组相比,细胞培养液中TNF-α、IL-1β的分泌变化不明显,H/R诱导的细胞培养液中TNF-α、IL-1β水平明显高于对照组,而药物干预降低了H/R组TNF-α、IL-1β的分泌(P<0.01,Fig 2B)。
2.4SalB降低H/R诱导的肝细胞凋亡率与空白对照比较,药物干预的对照组凋亡率无明显变化,而H/R组细胞凋亡率明显升高(P<0.01);与H/R组相比,药物干预的H/R组细胞凋亡率降低,差异有统计学意义(P<0.01),见Fig 3。
2.5SalB影响H/R后肝细胞SIRT1、NF-κBp65、p53、Bax、Bcl-2的蛋白表达水平与空白对照相比,H/R组NF-κB p65、p53、Bax蛋白表达上调,SIRT1、Bcl-2蛋白表达降低(P<0.01);与H/R组相比,Sal B预处理后的H/R组NF-κB p65、p53、Bax表达下调,SIRT1、Bcl-2表达增高(P<0.05,P<0.01),见Fig 4。
2.6SalB影响H/R后肝细胞SIRT1、NF-κBp65、p53、Bax、Bcl-2的mRNA表达水平如Fig 5所示,与空白对照相比,H/R组NF-κB p65、p53、Bax的mRNA表达水平明显增高,SIRT1、Bcl-2的mRNA表达水平降低(P<0.01);与H/R组相比,药物预处理后的H/R组NF-κB p65、p53、Bax的mRNA表达水平降低,SIRT1、Bcl-2的mRNA表达水平增高(P<0.05,P<0.01)。
3 讨论
肝IRI作为一个复杂的病理生理过程,在大型的肝脏手术中,尤其是肝移植术中常常是无法避免的。通过了解肝 IRI发生的机制发现,炎症反应、肝细胞的凋亡、坏死等都是引起肝损伤的重要原因,因此,控制细胞凋亡和炎症的发生可以减轻IRI[7]。Sal B由于其改善血流量、抗炎、抗氧化等功能,已经应用于大量心脑血管疾病的研究[8]。Wang等[9]发现,Sal B通过调控TLR4/MyD88/TRAF6信号通路,使NF-κB p65的表达降低,减轻了心脏IRI。Li等[10]发现,Sal B通过SIRT1作用,降低乙酰化p53表达,从而对抗乙醇性的急性肝损伤。因此,我们推测Sal B也能够通过减轻炎症及凋亡,缓解肝脏IRI。研究中我们建立了 BRL-3A的H/R模型模拟肝脏IRI,用各种浓度的Sal B干预H/R处理的细胞,发现Sal B 0.5 μmol·L-1时,H/R的肝细胞活力最强,且该浓度能明显抑制H/R后的细胞凋亡,降低转氨酶AST、ALT含量,降低 TNF-α、IL-1β分泌,表明Sal B能够减少炎性反应和凋亡来保护 H/R诱导的肝细胞损伤。这与Lv等[11]通过建立大鼠大脑中动脉闭塞手术模型,验证Sal B作用时所得结果是一致的。
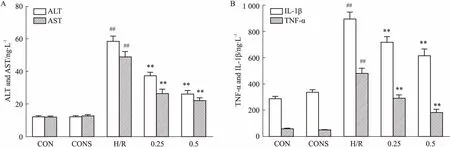
Fig 2 Effect of Sal B on levels of ALT, AST, TNF-α and IL-1β in supernatant of BRL-3A cells induced by H/R
A:Expression of ALT and AST was detected by microplate assay; B: Levels of TNF-α and IL-1β were determined by ELISA.CON: Control group; CONS: CON+0.5 μmol·L-1Sal B; H/R: Hypoxia 12 h/reoxygenation 4 h; 0.25: H/R+0.25 μmol·L-1Sal B; 0.5: H/R+0.5 μmol·L-1Sal B.##P<0.01vsCON;**P<0.01vsH/R.
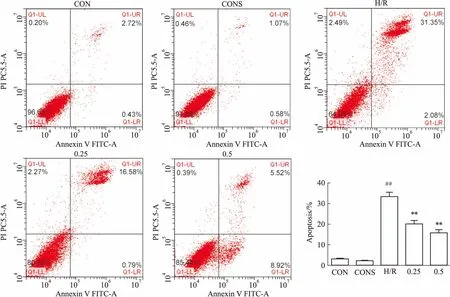
Fig 3 Effect of Sal B on apoptosis in BRL-3A cells induced by H/R
##P<0.01vsCON;**P<0.01vsH/R
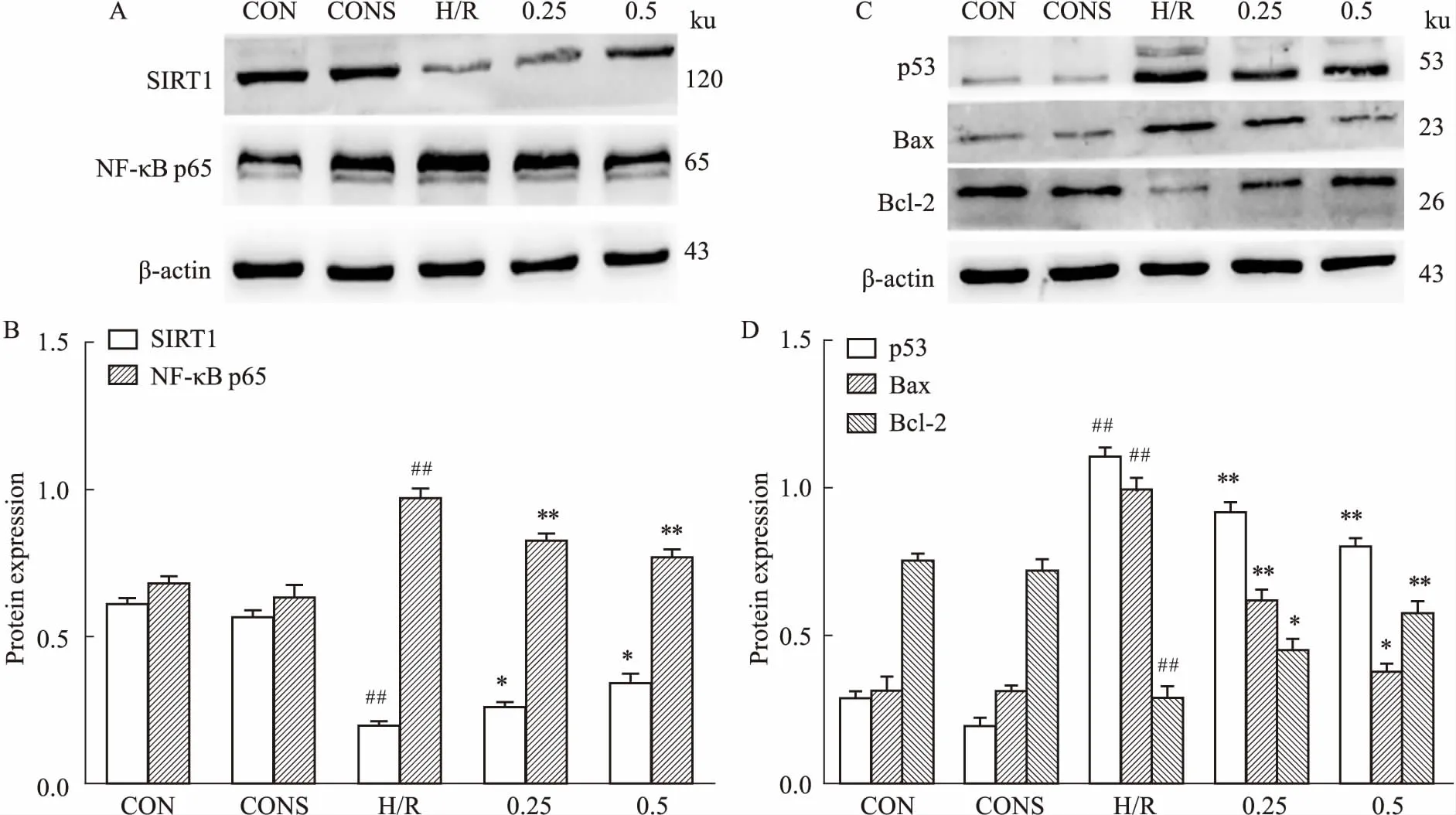
Fig 4 Effect of Sal B on relative protein expression in BRL-3A cells induced by H/R
A, C: Expression of relative protein were detected by Western bolt; B, D: Semi-quantitative analysis of expression of relative protein.##P<0.01vsCON;*P<0.05,**P<0.01vsH/R.
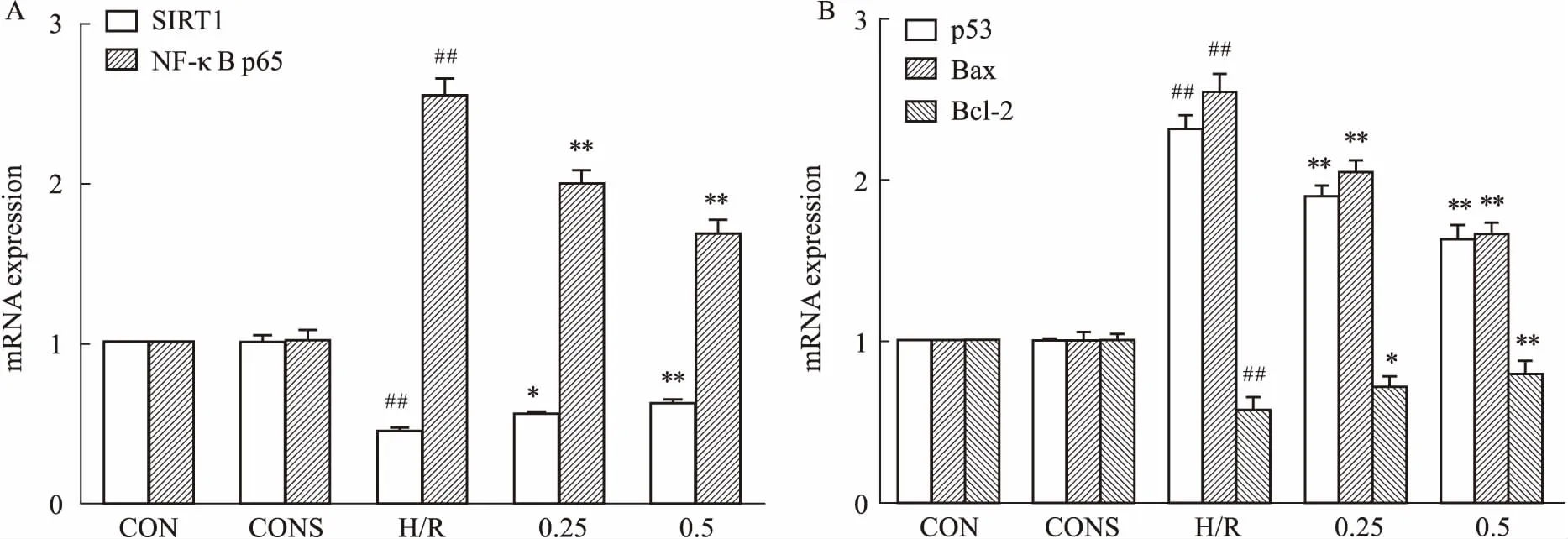
Fig 5 Effect of Sal B on relative mRNA levels in BRL-3A cells induced by H/R
A:mRNA expression levels of SIRT1, NF-κB p65; B: mRNA expression levels of p53, Bax, Bcl-2.##P<0.01vsCON;*P<0.05,**P<0.01vsH/R.
SIRT1作为一种依靠NAD+的Sirtuin蛋白家族中的重要一员,因为其去乙酰化作用,调控p53、NF-κB p65等常见的转录因子,发挥抗炎症反应和抗凋亡的作用[12]。本实验研究证实,不管在蛋白还是mRNA层面,与空白对照相比,H/R诱导后,NF-κB p65、p53、Bax表达明显上调,SIRT1、Bcl-2表达下调;而Sal B干预后,与H/R组相比,NF-κB p65、p53、Bax表达下调,SIRT1、Bcl-2表达增高。这与Hernández-Jiménez等[13]通过对SIRT1沉默的转基因小鼠脑缺血/再灌注处理后得到的结果一致。Liu等[14]也证实了在H/R条件下,激活SIRT1能降低Bax、p53等的表达。但本实验只在体外进行了验证,未能对相关通路进行更充分的研究,后续实验中我们会加入动物实验,明确Sal B对IRI更加确切的机制。
综上,Sal B能保护H/R诱导的肝细胞损伤,其机制可能与SIRT1/NF-κB/p53通路有关系。
(致谢:本实验在重庆医科大学附属第一医院实验研究中心完成,在此感谢在实验中给予指导和帮助的各位老师和同学。)
参考文献:
[1] Hu J, Zhu X, Zhang X, et al.Targeting TRAF3 signaling protects against hepatic ischemia/reperfusions injury [J].JHepatol, 2016,64(1):146-59.
[2] Lin Y, Sheng M, Weng Y, et al.Berberine protects against ischemia/reperfusion injury after orthotopic liver transplantation via activating Sirt1/FoxO3α induced autophagy [J].BiochemBiophysResCommun, 2017,483(2):885-91.
[3] Huang W, Shang W, Wang H, et al.Sirt1 overexpression protects murine osteoblasts against TNF-α-induced injuryinvitroby suppressing the NF-κB signaling pathway [J].ActaPharmacolSin, 2012,33(5):668-74.
[4] Datta G, Fuller B, Davidson B.Molecular mechanisms of liver ischemia reperfusion injury: insights from transgenic knockout models [J].WorldJGastroenterol, 2013,19(11):1683-98.
[5] 林 超,刘兆国,钱 星,等.丹酚酸B在心血管疾病中药理作用研究进展[J].中国药理学通报,2015,31(4):449-51.
[5] Lin C, Liu Z G, Qian X, et al.Research progress of salvianolic acid B in cardiovascular diseases[J].ChinPharmacolBull, 2015,31(4):449-51.
[6] Wang R, Huang F, Chen Z, et al.Downregulation of connexin 32 attenuates hypoxia/reoxygenation injury in liver cells [J].JBiochemMolToxicol, 2015,29(4):189-97.
[7] He D, Guo Z, Pu J, et al.Resveratrol preconditioning protects hepatocytes against hepatic ischemia reperfusion injury via toll-like receptor 4/nuclear factor-κB signaling pathwayinvitroandinvivo[J].IntImmunopharmacol, 2016,35: 201-9.
[8] 王新宇, 王 曼, 孙帅军, 等.丹酚酸B保护大鼠缺血心肌与炎症小体NLRP3表达的相关性研究[J].中国药理学通报,2016,32(10):1383-8.
[8] Wang X Y, Wang M, Sun S J, et al.Protective effects of salvianolic acid B on isoproterenol induced myocardial ischemic rats and its relation with NLRP3 expression[J].ChinPharmacolBull, 2016,32(10):1383-8.
[9] Wang Y, Chen G, Yu X, et al.Salvianolic acid B ameliorates cerebral ischemia/reperfusion injury through inhibiting TLR4/MyD88 signaling pathway [J].Inflammation,2016,39(4):1503-13.
[10] Li M, Lu Y, Hu Y, et al.Salvianolic acid B protects against acute ethanol-induced liver injury through Sirt1-mediated deacetylation of p53 in rats [J].ToxicolLett, 2014,228(2):67-74.
[11] Lv H, Wang L, Shen J, et al.Salvianolic acid B attenuates apoptosis and inflammation via Sirt1 activation in experimental stroke rats [J].BrainResBull, 2015,115:30-6.
[12] Nakazawa H, Chang K, Shinozaki S, et al.Inos as a driver of inflammation and apoptosis in mouse skeletal muscle after burn injury: possible involvement of SIRT1 S-nitrosylation-mediated acetylation of p65 NF-κB and p53 [J].PLoSOne, 2017,12(1):e0170391.
[13] Hernández-Jiménez M, Hurtado O, Cuartero M, et al.Silent information regulator 1 protects the brain against cerebral ischemic damage [J].Stroke,2013,44(8):2333-7.
[14] Liu L, Wang P, Liu X, et al.Exogenous NAD+supplementation protects H9c2 cardiac myoblasts against hypoxia/reoxygenation injury via SIRT1-p53 pathway [J].FundamClinPharmacol, 2014,28(2):180-9.