枳壳多糖对辐射损伤小鼠的防护作用研究
舒尊鹏,杨燕妮,王 毅,王秋红,匡海学,2
(1.广东药科大学中药学院,广东 广州 510006;2.黑龙江中医药大学北药基础与应用研究教育部重点实验室,黑龙江 哈尔滨 150040)
随着臭氧层逐渐稀薄、手机等电子产品使用频率增加、放化疗病人人数持续增长,以及近年来的核泄漏事件都提示着辐射已成为一个威胁人类健康不可忽视的重要因素。辐射可以导致机体产生大量内源性自由基,降低免疫力,损伤组织脏器,加速机体衰竭,严重影响生命质量。此外,辐射还可直接导致多种DNA损伤[1],造成染色体畸变和基因突变,危害久远。因而,从传统天然中草药中寻找出毒副作用低、不良反应少,具有抗辐射作用明显的有效成分显得极为重要。
多糖是一类由醛糖或酮糖通过糖苷键连接成的天然大分子多聚物[2],是中药中主要药效物质基础之一。研究表明,多糖具有一定的抗辐射作用,可清除自由基,降低造血系统损伤,是一类很有前景的天然辐射防护剂。例如黑木耳多糖对60Co照射的动物能够提高其存活率[3],王庆宾等[4]发现香菇多糖、枸杞多糖也同样具有抗辐射作用。枳壳为芸香科植物酸橙CitrusaurantiumL.及其栽培变种的干燥未成熟果实,为中医临床常用中药,始载于《神农本草经》,被列为木部中品。枳壳中所含的化学成分较复杂,其中枳壳多糖类成分具有一定的抗氧化和免疫调节作用[5],为新一代安全的抗氧化剂及免疫调节剂[6],同时也为枳壳多糖抗辐射研究奠定了理论基础。因此,本实验将枳壳热提粗多糖(CitrusaurantiumL.polysaccharides-B,CALB)作为研究对象,并对其抗辐射作用进行初步研究。
1 材料
1.1药材枳壳药材0.8 kg,粗粉碎后加入体积分数为0.95的乙醇浸泡过夜,加热回流提取3次,每次3 h,体积分数为0.95的乙醇脱脂后,冷水浸提。浸提后的药渣,用热水煎煮3次,每次3 h,冷却后滤过、合并滤液。滤液减压浓缩,经醇沉、透析、冷冻干燥得CALB。
1.2实验动物BALB/c小鼠(合格证号SCXK2),♀♂各半,体质量(18±2)g,由北京维通利华生物科技公司提供。
1.3试剂小牛血清(Sigma公司);Giemsa染液(中国惠世生化试剂有限公司);丙二醛(malondialdehyde, MDA)测定试剂盒、超氧化物岐化酶(superoxide dismutase, SOD)测定试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase, GSH-Px)测定试剂盒、总乙酰胆碱酯酶(total cholinesterase, TChE)测定试剂盒,均购自南京建成生物工程研究所。
1.4仪器765型紫外可见分光光度计(上海光谱仪器有限公司);GAMMA 1-16 LSC plus型真空冷冻干燥机(Marin Christ公司);KQ-5200型超声波破碎仪(北京益植康生物科技有限公司);SpectraMax plus型酶标仪(Molecular Devices公司);TDL-5型台式离心机(上海科兴仪器有限公司);CX23型显微镜(日本奥林巴斯公司)。
2 方法
2.1实验分组及造模处理取BALB/c小鼠360只,随机分为6组,每组60只,分为空白对照组(Control)、辐射模型组(Model)、CALB高、中、低剂量组(400、200、100 mg·kg-1)、阳性对照黑木耳多糖组(HP 200 mg·kg-1),按照小鼠体质量10 mL·kg-1给予不同体积药液,空白对照组和辐射对照组给予生理盐水。每天1次,连续灌胃给药30 d。末次给药3 h后,随机6组小鼠分为两批,一批(20只)采用60Co γ-射线一次性全身照射(7 Gy),于照射后记录各组d 2(10只)、d 14(10只)小鼠存活率;另一批(40只)60Co γ-射线一次性全身照射(3 Gy),于照射后d 2(20只)、d 14(20只)分别采取小鼠眼球取血,随后脱颈处死,取相应组织(骨髓、脑、肝、脾和胸腺),用于后续实验。
2.2实验检测指标及方法颈椎脱臼处死小鼠,剥离出股骨,用注射器吸取D-Hank’s溶液,冲出股骨中的全部骨髓细胞,用分光光度计在260 nm处测定小鼠骨髓DNA含量。挤出适量骨髓液与玻片一端的小牛血清混匀,常规涂片。甲醇固定,放入Giemsa应用液中,染色后,立即用磷酸盐缓冲液冲洗,晾干,测定小鼠骨髓微核细胞含量。按说明书要求,用分光光度计于波长412 nm处测定小鼠脑组织中TChE的吸光度值。另按说明书要求,测定血清中、脑中和肝脏中MDA含量,以及SOD和GSH-Px活性。同时,测定脾指数及胸腺指数。计算公式为:脾(胸腺/肝)指数=脾(胸腺/肝)重量/小鼠体质量×10。
3 结果
3.1CALB对辐射小鼠存活率的影响如Tab 1所示,与辐射组相比,d 2检测存活率发现,各给药组辐射小鼠的存活率均较高,其中CALB高、中剂量组效果较好,存活率接近于空白对照组;d 14检测存活率发现,CALB药效呈剂量依赖性,且高剂量组好于阳性对照药。
3.2CALB对辐射小鼠骨髓细胞DNA含量的影响如Fig 1所示,与空白对照组相比,模型组小鼠骨髓细胞的含量明显下降(P<0.01),说明60Co γ-射线可造成骨髓细胞的损伤。与模型组相比,CALB中、高剂量组小鼠骨髓DNA含量呈上升趋势,差异有显著性 (P<0.01),说明CALB具有一定保护骨髓细胞DNA的作用。
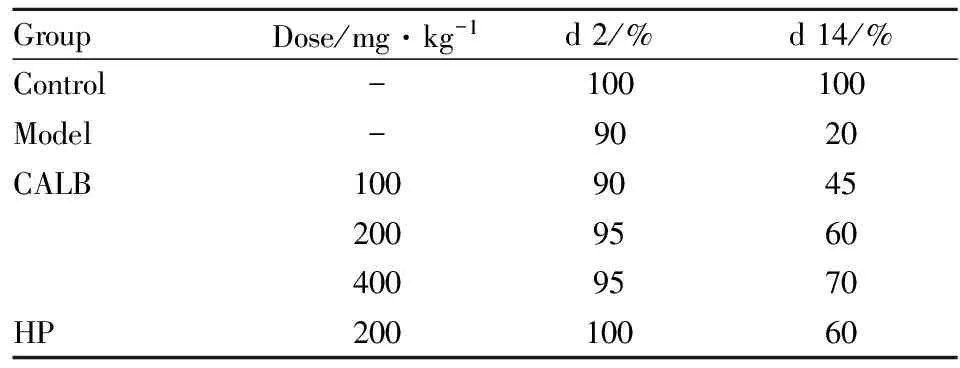
Tab 1 Influence of CALB on survival rate
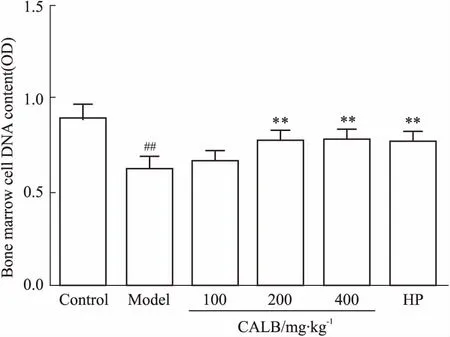
Fig 1 Comparison of bone marrow cell DNA content in different CALB groups
##P<0.01vscontrol;**P<0.01vsmodel
3.3CALB对辐射小鼠骨髓细胞微核的影响如Fig 2所示,d 14取材,与空白对照相比,模型组小鼠骨髓细胞微核数明显增加(P<0.01),说明辐射对小鼠骨髓细胞有明显的损伤作用,即骨髓细胞凋亡,染色体溢出。与模型组相比,CALB中、高剂量组和阳性对照组对小鼠骨髓细胞微核数增高有明显的抑制作用(P<0.05,P<0.01)。
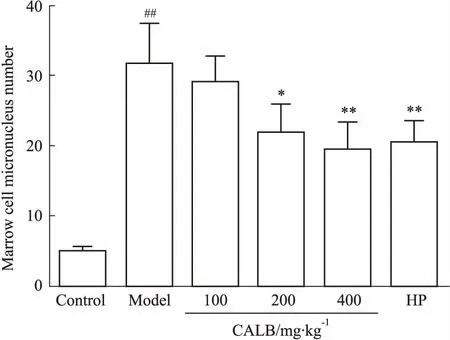
Fig 2 Effect of CALB on micronucleus
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
3.4CALB对辐射小鼠脑组织中MDA、SOD、GSH-Px和TChE的影响Tab 2结果显示,d 14取材,模型组小鼠与空白对照组相比,脑组织MDA含量明显升高(P<0.01),SOD、GSH-Px和TChE活性均明显下降(P<0.01)。与模型组相比,CALB高剂量组和阳性对照组可使小鼠脑组织中MDA含量降低,SOD和GSH-Px活性升高,差异有显著性 (P<0.01)。CALB各剂量给药组及阳性对照药组小鼠脑中的TChE活性均无明显变化(P>0.05)。
3.5CALB对辐射小鼠血清MDA、SOD和GSH-Px的影响Tab 3结果显示,在辐射后d 2,与空白对照组相比,模型组小鼠血清中MDA含量明显升高,SOD与GSH-Px活性明显降低(P<0.01),但是各给药组差异均无统计学意义(P>0.05)。在辐射后d 14,与模型组相比,CALB中、高剂量组及阳性对照组小鼠血清MDA含量均有明显降低,SOD与GSH-Px活性明显升高,差异均有显著性 (P<0.01)。
3.6CALB对辐射小鼠肝组织MDA、SOD和GSH-Px的影响Tab 4结果显示,在辐射后d 2,与空白对照组相比,模型组小鼠肝组织中MDA含量明显升高,GSH-Px与SOD活性明显降低(P<0.01)。与模型组相比,CALB各剂量组对GSH-Px与SOD活性的提高无明显影响,但CALB中、高剂量组对MDA含量有明显的降低趋势(P<0.05,P<0.01),并呈现一定的剂量依赖性。在辐射后d 14,与模型组相比,CALB中、高剂量组及阳性对照组小鼠肝组织中GSH-Px活性明显升高(P<0.05,P<0.01)。CALB各剂量组及阳性对照组小鼠肝组织中SOD活性明显升高,MDA含量明显降低,差异有显著性 (P<0.01)。
3.7CALB对辐射小鼠脾、胸腺指数的影响Tab 5结果显示,在辐射后d 2,与空白对照组相比,模型组小鼠脾指数及胸腺指数明显降低(P<0.01)。与模型组相比,CALB高剂量组脾指数有明显增加的趋势(P<0.01),CALB中、低剂量组无明显变化。此外,CALB中、高剂量组胸腺指数有明显增加的趋势(P<0.01),而低剂量组差异无统计学意义。在辐射后d 14,与模型组相比,CALB中、高剂量组小鼠脾指数、胸腺指数明显升高,差异有显著性 (P<0.01),阳性对照组差异无统计学意义(P>0.05)。
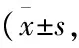
Tab 2 Effect of CALB on MDA, SOD, GSH-Px and TChE in brain n=18)
##P<0.01vscontrol;**P<0.01vsmodel
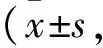
Tab 3 Effect of CALB on MDA, SOD, GSH-Px in blood n=17)
##P<0.01vscontrol;**P<0.01vsmodel
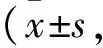
Tab 4 Effect of CALB on MDA, SOD and GSH-Px in liver n=18)
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
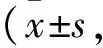
Tab 5 Effect of CALB on spleen index and thymus index n=15)
##P<0.01vscontrol;**P<0.01vsmodel
4 讨论
辐射损伤是由电离辐射引起的急性、慢性或迟发性的机体损伤,在有氧条件下,电离辐射会导致机体内产生大量自由基,而自由基的产生会引起生物膜磷脂中脂质的过氧化,造成氧化应激损伤,进而引起细胞代谢障碍[7]。MDA是生物膜上不饱和脂肪酸受自由基攻击发生脂质过氧化的产物,其含量可以作为衡量机体内脂质过氧化程度和自由基水平的一项重要指标[8]。SOD是清除氧自由基的重要酶系,可阻止氧化自由基链式反应扩大,是生物体内氧自由基清除系统的重要防线[9],其活性的高低间接地反映机体清除氧自由基的能力[10]。GSH-Px则主要通过催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物[11]。抗氧化酶SOD、GSH-Px活性降低,造成过量的ROS得不到有效的清除。这些过量的ROS会氧化生物膜的磷脂、酶和膜受体相关的生物大分子,并产生有害的脂质过氧化产物MDA[12-13]。因此,增强SOD活性来清除辐射所引起的自由基,促使MDA含量减少,可对由辐射造成的机体损伤起到保护和修复作用。
多糖具有一定的免疫调节作用,是固有免疫系统的主要靶分子,也是许多中药的主要活性成分,具有调节机体免疫、抗肿瘤、抗病毒、抗氧化等功效。本实验通过检测辐射后小鼠的存活率、骨髓细胞DNA、骨髓细胞微核含量,小鼠脑组织、血清及肝脏中SOD和GSH-Px活性,MDA含量和脑组织中TChE活性,以及脾、胸腺指数等,探讨了CALB对60Co γ-射线照射小鼠的保护作用。骨髓细胞DNA、骨髓细胞微核含量可作为诊断辐射损伤的重要依据。通常情况下,电离辐射直接作用于核酸、蛋白质及酶类等分子水平上,引起细胞结构破坏,DNA损伤或是DNA分子交联。因此,微核的检出率能够准确地反映出辐射损伤的程度、DNA受损的情况,以及机体的修复能力。研究表明,CALB能明显提高辐射小鼠的存活率,对辐射小鼠骨髓DNA具有保护作用,并且可降低骨髓细胞微核数,呈剂量依赖性。实验结果还发现,60Co γ-射线(3 Gy)辐射照射后d 2取材,模型组辐射小鼠与空白组相比,脑组织中MDA、SOD、GSH-Px和TChE不存在明显差异,因此在本实验结果中未展现数据。但照射后d 14取材,模型组小鼠较空白对照组相比,脑组织中MDA、SOD、GSH-Px和TChE均有明显变化。推测60Co γ-射线(3 Gy)这种低剂量辐射可能先对血液、肝脏、胸腺、脾等脏器造成氧化应激损伤,随着时间的推移,氧化损伤逐步延伸至脑组织。数据表明CALB可降低辐射小鼠脑组织、血液及肝脏中MDA的含量,升高SOD和GSH-Px的活性,通过抑制氧自由基的方式达到抗辐射作用。但对TChE未产生变化,其原因可能为辐射小鼠的脑损伤为辐射后逐步形成的,而CALB给药周期后的延迟效果还不足以扭转TChE在脑组织中的表达。另外,胸腺与脾脏是重要的免疫器官,本实验通过对辐射小鼠脾、胸腺指数的测定,进一步说明CALB还可通过调节免疫系统起到抗辐射损伤的作用。
综上研究结果表明,辐射对小鼠的多项生理指标产生了明显的损伤作用,而各剂量的CALB可通过抗氧化和免疫调节机制对辐射损伤产生不同程度的保护作用。
参考文献:
[1] 段雅彬, 姚星辰, 王 财,等.黑果枸杞对X射线辐射小鼠的保护作用研究[J].天然产物研究与开发, 2015,27(1):148-52.
[1] Duan Y B, Yao X C, Wang C, et al.Study on the protective effect of Lycium barbarum on X ray radiation mice[J].NatProdResDev, 2015,27(1):148-52.
[2] 宁书年, 张 桂.生物多糖类物质对人体的作用[J].食品科学, 2005,26(9):613-4.
[2] Ning S N,Zhang G.The effect of biological polysaccharides on human body[J].FoodSci, 2005,26(9):613-4.
[3] 樊黎生, 龚晨睿, 张声华.黑木耳多糖抗辐射效应的动物实验[J].营养学报, 2005,27(6):525-6.
[3] Fan L S, Gong C R, Zhang S H.Animal anti-radiation effect of Auricularia auricula polysaccharides on animal experiment[J].ActaNutrSin, 2005,27(6):525-6.
[4] 王庆宾, 韩 婷, 孙连娜,等.抗辐射的天然药物研究进展[J].药学实践杂志, 2012,30(3):171-4.
[4] Wang Q B, Han T, Sun L N, et al.Research progress of anti-radiation natural drugs[J].JPharmPract, 2012,30(3):171-4.
[5] 邢 娜, 舒尊鹏, 徐炳清,等.枳壳多糖CALB-1的提取、分离纯化及免疫调节活性研究[J].中草药, 2015,46(5):639-44.
[5] Xing N, Shu Z P, Xu B Q, et al.Study on the activity of extraction, purification and immune regulation of polysaccharide CALB-1 from Fructus aurantii[J].ChinTraditHerbDrugs, 2015,46(5):639-44.
[6] Wang Q H, Shu Z P, Xu B Q, et al.Structural characterization and antioxidant activities of polysaccharides fromCitrusaurantiumL.[J].IntJBiolMacromol, 2014,67(6):112.
[7] 王 程, 杨金平, 罗 炜,等.藻蓝蛋白、铁皮石斛多糖及两者配伍对辐射损伤模型小鼠保护作用的研究[J].中南药学, 2016,14(10):1033-6.
[7] Wang C, Yang J P, Luo W, et al.Study on the protective effects of phycocyanin, Dendrobium candidum polysaccharides and their combination on radiation injury model mice[J].CentSouthPharm, 2016,14(10):1033-6.
[8] Del R D, Stewart A J, Pellegrini N.A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J].NtrMetabCardiovas, 2005,15(4):316.
[9] Huang X, Moir R D, Tanzi R E, et al.A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J].AnnNYAcadSci, 2004,1012(1):153-63.
[10] 杨 芳, 索有瑞, 胡 娜.沙棘Vp对辐射损伤小鼠的保护及免疫功能作用研究[J].天然产物研究与开发, 2016,28(12):1947-51.
[10] Yang F, Suo Y R, Hu N, Study on the protection and immune function of seabuckthorn Vp in radiation injured mice[J].NatProdResDev, 2016,28(12):1947-51.
[11] 王莹莹, 宋修云, 王 奇,等.人参皂苷Rg1通过抗氧化应激保护冈田酸诱导的PC12细胞损伤[J].中国药理学通报, 2016,32(10):1364-70.
[11] Wang Y Y, Song X Y, Wang Q et al.The protective effects of Ginsenosides Rg1 in AD-like pathological model induced by okadaic acid[J].ChinPharmacolBull, 2016,32(10):1364-70.
[12] 董 曦, 孙桂波, 罗 云,等.异鼠李素对H2O2引起的H9c2细胞氧化应激损伤的保护作用研究[J].中国药理学通报, 2015,31(6):853-60.
[12] Dong X, Sun G B, Luo Y, et al.Protective effect of isorhamnetin on H9c2 cell line against oxidative stress[J].ChinPharmacolBull, 2015,31(6):853-60.
[13] 陈 文, 王沛明, 张 祎,等.基于TLR4通路初探黄芩对内毒素血症大鼠肝肺组织中细胞因子IL-1β、IL-6、TNF-α以及氧化应激因子MDA、SOD水平的影响[J].中药药理与临床, 2016,32(3):87-92.
[13] Chen W, Wang P M, Zhang Y, et al.Based on the TLR4 pathway, the effects of Scutellaria baicalensis Georgi on cytokines, IL-1 beta, IL-6, TNF-α and oxidative stress factors MDA and SOD in liver and lung tissues of endotoxemia rats[J].PharmacolClinChinMaterMed, 2016,32(3):87-92.