紫铆因通过抑制p53信号通路对抗丙酮醛诱导的PC12细胞凋亡
乐 亮,徐 江,姜保平,许利嘉,胡克平,陈士林,肖培根
(1.中国医学科学院北京协和医学院药用植物研究所,北京 100193; 2.中国中医科学院中药研究所,北京 100700;3.中国中医科学院博士后科研流动站,北京 100700)
糖尿病脑病是一种糖尿病引起的脑部病变,主要包括糖尿病性酮症酸中毒昏迷及糖尿病性高渗性非酮症性昏迷[1]。随着糖尿病人群的增多,糖尿病脑病也逐渐受到人们的重视。脑血管改变、氧化应激、糖基化终末端产物(glycation end products, AGEs)和大脑胰岛素信号系统损伤被认为是糖尿病脑病的主要病因[2]。多项研究结果表明,有毒的α-羰基醛如丙酮醛的脑部聚积是认知功能障碍的关键因素[3]。临床研究也显示,糖尿病患者血液中丙酮醛水平明显升高[4]。丙酮醛是一种由糖酵解过程产生的有毒副产物,能影响糖和脂代谢[5]。在正常的哺乳动物细胞中,丙酮醛能通过谷胱甘肽依赖性乙二醛酶系统降解,而在高血糖及糖代谢受损的条件下,丙酮醛往往累积以致损伤机体[6]。过量的丙酮醛诱导线粒体损伤、增加活性氧的产生[7]。此外,由于大脑的高氧耗,比其他器官更易受到氧化损伤。有研究表明,丙酮醛能通过线粒体和Fas受体信号通路诱导海马神经元的凋亡[8]。而在线粒体凋亡机制中,p53基因是一种重要的促凋亡基因,主要调控两条凋亡途径,一是p53基因对外源性凋亡途径的调节,如激活死亡受体(death receptor, DR)4、DR5、Fas受体等;另一条是p53内源性凋亡途径的调控,主要通过线粒体信号通路调节。
两色金鸡菊CoreopsistinctoriaNutt.又名雪菊、金鸡菊,系菊科(Asteraceae)金鸡菊属(Coreopsis)的干燥头状花序。《新华本草纲要》记载,其味甘、性平,具有清热解毒、化湿止痢的功效。课题组前期探讨了两色金鸡菊的7种主要成分——奥卡宁、3’,4’,8-三羟基黄铜-7-O-β-吡喃葡萄糖苷、槲皮素、黄诺马苷、马里苷、豆甾醇、紫铆因的对抗HepG2细胞胰岛素抵抗作用[9]。同时,我们也研究了马里苷对抗丙酮醛诱导的PC12细胞凋亡的作用,发现马里苷能通过激活AMPK信号通路,降低丙酮醛诱导的线粒体损伤[10]。紫铆因是一种植物来源的多酚类化合物, 大量存在于紫铆属的多种植物中,在雪菊中也具有一定含量的紫铆因。紫铆因具有广泛的生物学活性, 如抗炎、抗纤维化等。因其具有一定的神经毒性, 紫铆因常用于蜗牛等害虫的防治。本文探讨了紫铆因对抗丙酮醛诱导的PC12细胞凋亡的作用及其抗凋亡的机制。
1 材料
1.1细胞株与试剂PC12细胞购自北京协和医学院细胞库。紫铆因购自美国ChromaDex公司,纯度为94.3%;6-羟基多巴(HY-B1081)、牛血清白蛋白(HY-D0842)、碘化丙啶(propidium iodide,PI, HY-D0815)、Hoechst 33342(HY-15559)均购自MedChemExpress公司;乳酸脱氢酶(LDH)细胞毒性检测试剂盒(C0017)购自碧云天生物技术有限公司;马血清(16050130)、胎牛血清(30044184)、链青霉素(15140122)、RMPI 1640(11875176) 培养基均购自赛默飞世尔科技(中国)有限公司;p53(ab26)、caspase-9 (ab32539)抗体购自艾博抗(上海)贸易有限公司;β-actin(HX1827)购自北京华兴博创基因技术有限公司;逆转录试剂盒(AS111-01)购自北京全式金生物有限公司。
1.2仪器Infinite 1000 M荧光酶标仪(Tecan公司);CO2培养箱(Thermo Forma公司);超净工作台(日本AIRTECH公司);低温离心机(德国Eppendorf公司);倒置显微镜与照像系统(日本Nikon公司);DeltaVision高分辨率活细胞成像系统(瑞典通用电气医疗);电热恒温水浴箱(北京长安科学仪器厂)。
2 方法
2.1细胞培养PC12细胞置于含10%马血清、5%胎牛血清、1×105U·L-1青霉素和100 mg·L-1链霉素的RMPI 1640培养基中,37℃、5% CO2细胞培养箱培养。传代的PC12 细胞分别先用2.5、5 μmol·L-1的紫铆因预处理1 h,然后加入1.5 mmol·L-1丙酮醛,再置于37℃、5% CO2细胞培养箱培养24 h,用于实验。
2.2MTT法检测各模型组细胞存活率细胞培养及药物分组同“2.1”,在不同浓度的紫铆因或丙酮醛处理相应的时间后,每孔加入5 g·L-1MTT溶液20 μL,继续孵育4 h,弃上清,吸干残留液,每孔加入DMSO 150 μL,摇床上振摇10 min至生成的蓝紫色甲臜结晶完全溶解,置于酶标仪570 nm处测其吸光度值。
2.3LDH试剂盒检测细胞坏死PC12细胞经过处理后,取细胞上清液检测LDH释放值,LDH释放实验按照LDH试剂盒说明书操作,配制检测液,共孵育4 h,用酶标仪检测340 nm处的光密度值。
2.4PI和Hoechst33342染色检测细胞凋亡PC12细胞经处理后,用4%多聚甲醛固定10 min,使用50 mg·L-1PI和5 mg·L-1Hoechst 33342暗处染色15 min,在荧光显微镜下,以340 nm和560 nm的激发光波长观察染色情况,并计算细胞核形态改变所占比例。
2.5逆转录PCR检测基因表达利用合成的特异引物,对不同药物刺激的PC12细胞的cDNA进行扩增。扩增方法按照逆转录试剂盒的说明书进行操作。PCR扩增体系如下:2×EasyTaq PCR SupperMix 25 μL,上、下游引物各1 μL,模板20 ng cDNA,用0.1% DEPC水补足50 μL。引物序列见Tab 1。反应程序为:94℃ 2 min;55℃ 30 s;72℃ 1 min;循环35次,最后一轮延伸5 min,4℃保存。
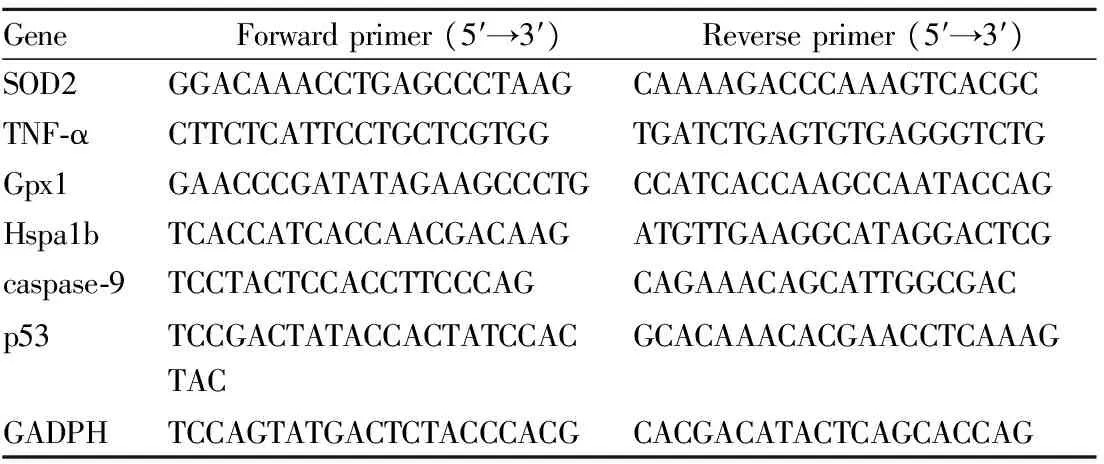
Tab 1 Gene-specific primers of rats used for reverse transcription PCR
2.6Westernblot检测蛋白表达PC12细胞经药物处理后,加入RIPA裂解液裂解细胞,12 000×g离心,取上清进行蛋白定量,取40 μg蛋白经聚丙烯酰胺变性凝胶电泳分离,电转膜法转移到硝酸纤维素膜上,5% BSA封闭,分别加入p53、caspase-9、β-actin抗体孵育4 h或过夜,随后用辣根过氧化酶标记的二抗孵育1 h,ECL显色,凝胶成像系统分析结果。
3 结果
3.1紫铆因改善丙酮醛诱导的PC12细胞损伤为建立丙酮醛诱导的PC12细胞损伤模型,检测不同浓度的丙酮醛对PC12细胞的毒性作用。如Fig 1A所示,1 mmol·L-1丙酮醛即有一定的毒性,丙酮醛对PC12细胞的半数致死浓度为1.6 mmol·L-1。由于紫铆因具有一定的神经毒性,因此我们对紫铆因对PC12细胞的毒性也进行了研究,如Fig 1B所示,50 μmol·L-1紫铆因使细胞活性下降36%,而25 μmol·L-1以下的紫铆因均没有细胞毒性。因此,我们采用0.625~10 μmol·L-1的紫铆因预处理PC12细胞1 h,随后用1.5 mmol·L-1丙酮醛处理24 h,测定紫铆因对抗丙酮醛损伤的保护作用。如Fig 1C所示,2.5、5、10 μmol·L-1的紫铆因均能提高丙酮醛导致的PC12细胞活性的下降。LDH释放实验被用以检测细胞毒性,Fig 1D结果表明,1.5 mmol·L-1丙酮醛大量升高LDH的值,而紫铆因则下调丙酮醛诱导的LDH释放。
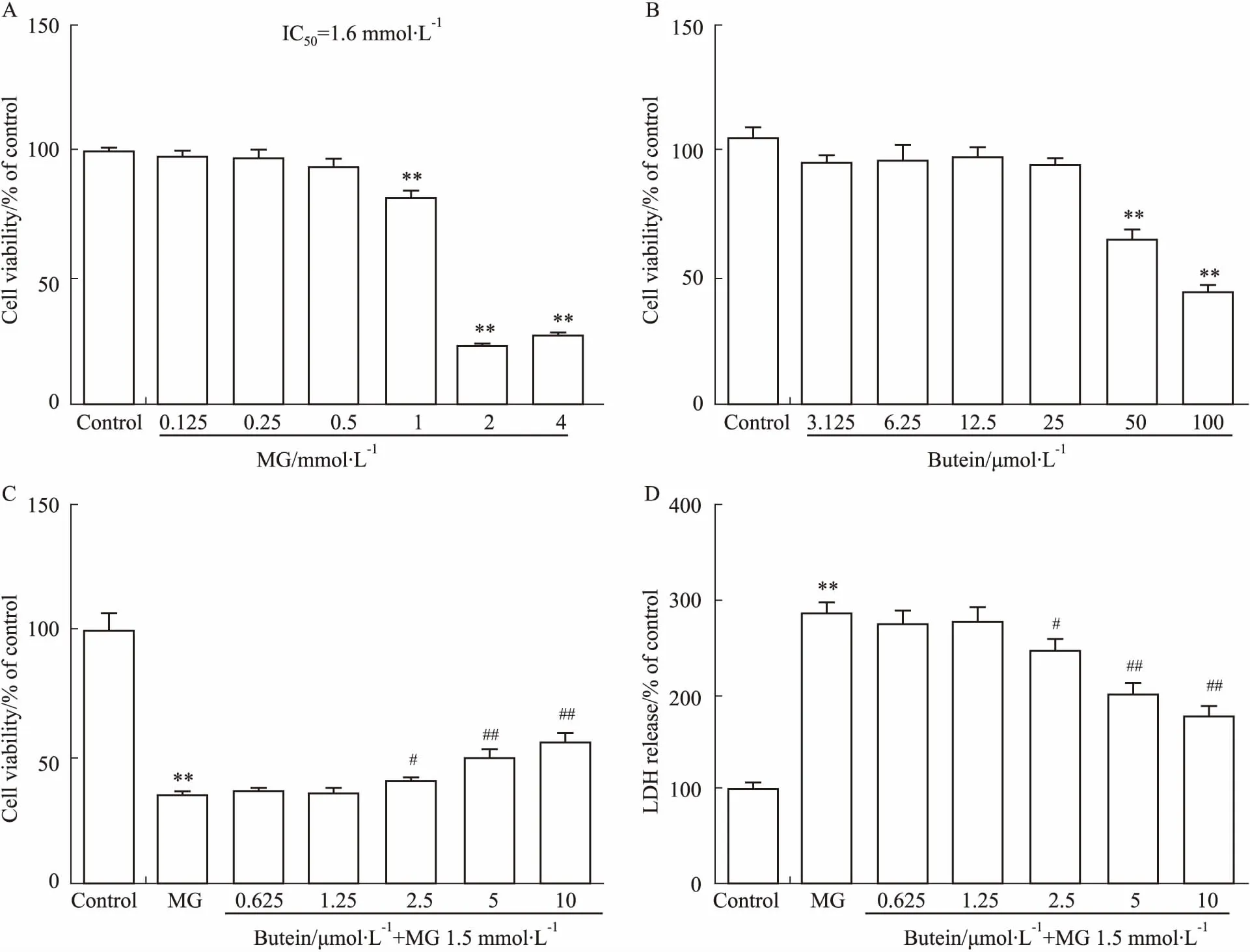
Fig 1 The protective effect of butein on decreased cell viability induced by methylglyoxal (MG) in PC12 cells n= 5)
A: Cell viability was detected by MTT method in PC12 cells treated by MG; B: Cell viability was detected by MTT method in PC12 cells treated by butein; C: Cell viability was detected by MTT method in PC12 cells induced by 1.5 mmol·L-1MG before being pretreated by butein; D: Cell death was quantified by the release of LDH from the cells into the medium.**P<0.01vscontrol group;#P<0.05,##P<0.01vsMG group.
3.2紫铆因降低丙酮醛诱导的PC12细胞凋亡及坏死PI用以检测细胞坏死,而Hoechst 33342则用以检测细胞凋亡。如Fig 2所示,1.5 mmol·L-1的丙酮醛明显增加PI红色荧光,同时也可见蓝色荧光显示的细胞核固缩,可见丙酮醛能引起PC12细胞坏死,也诱导其凋亡。加入2.5、5 μmol·L-1的紫铆因预处理PC12细胞1 h,则明显改善细胞的坏死及凋亡情况。星形孢菌素(Staurosporine,STS)被作为细胞坏死和凋亡的阳性对照。
3.3丙酮醛诱导PC12细胞凋亡基因的表达为了探索丙酮醛诱导PC12细胞坏死及凋亡的机制, RT-PCR检测了caspase-9、Hspa1b、Gpx1、p53、SOD2、TNF-α基因的表达。如Fig 3所示,丙酮醛明显升高促凋亡基因caspase-9和p53的表达,而降低细胞自由基清除基因SOD2的表达,但对于TNF-α基因的表达却没有明显影响,表明其可能不引起TNF-α炎症因子的过度产生。
3.4紫铆因降低促凋亡基因的过表达及增加抗氧化基因的表达如Fig 4所示,2.5、5 μmol·L-1的紫铆因能明显降低caspase-9和p53的过度表达,同时也能明显提高抗氧化基因SOD2的表达。
3.5紫铆因降低丙酮醛诱导的caspase-9和p53蛋白的过度表达如Fig 5所示,1.5 mmol·L-1丙酮醛明显增加促凋亡蛋白caspase-9和p53的表达(P<0.01)。2.5、5 μmol·L-1的紫铆因能明显抑制caspase-9和p53蛋白的过表达(P<0.05)。
4 讨论
紫铆因是一种多酚类化合物,多来自于紫铆属植物,而我们前期在两色金鸡菊中也分离得到了紫铆因。由于其具有一定的神经毒性,对蛞蝓和蜗牛具有较强的毒性作用,另外,紫铆因还具有一定的胃毒性,其神经毒性比胃毒性作用更强。本研究发现,高剂量的紫铆因的确具有一定的细胞毒性,因此本实验采用较低剂量的紫铆因进行实验。研究发现,2.5、5、10 μmol·L-1紫铆因能明显改善丙酮醛导致的细胞活性下降、细胞凋亡及坏死,同时降低促凋亡基因的过度表达,升高自由基清除蛋白SOD2的表达,且紫铆因明显改善丙酮醛诱导的促凋亡蛋白p53的过度表达。
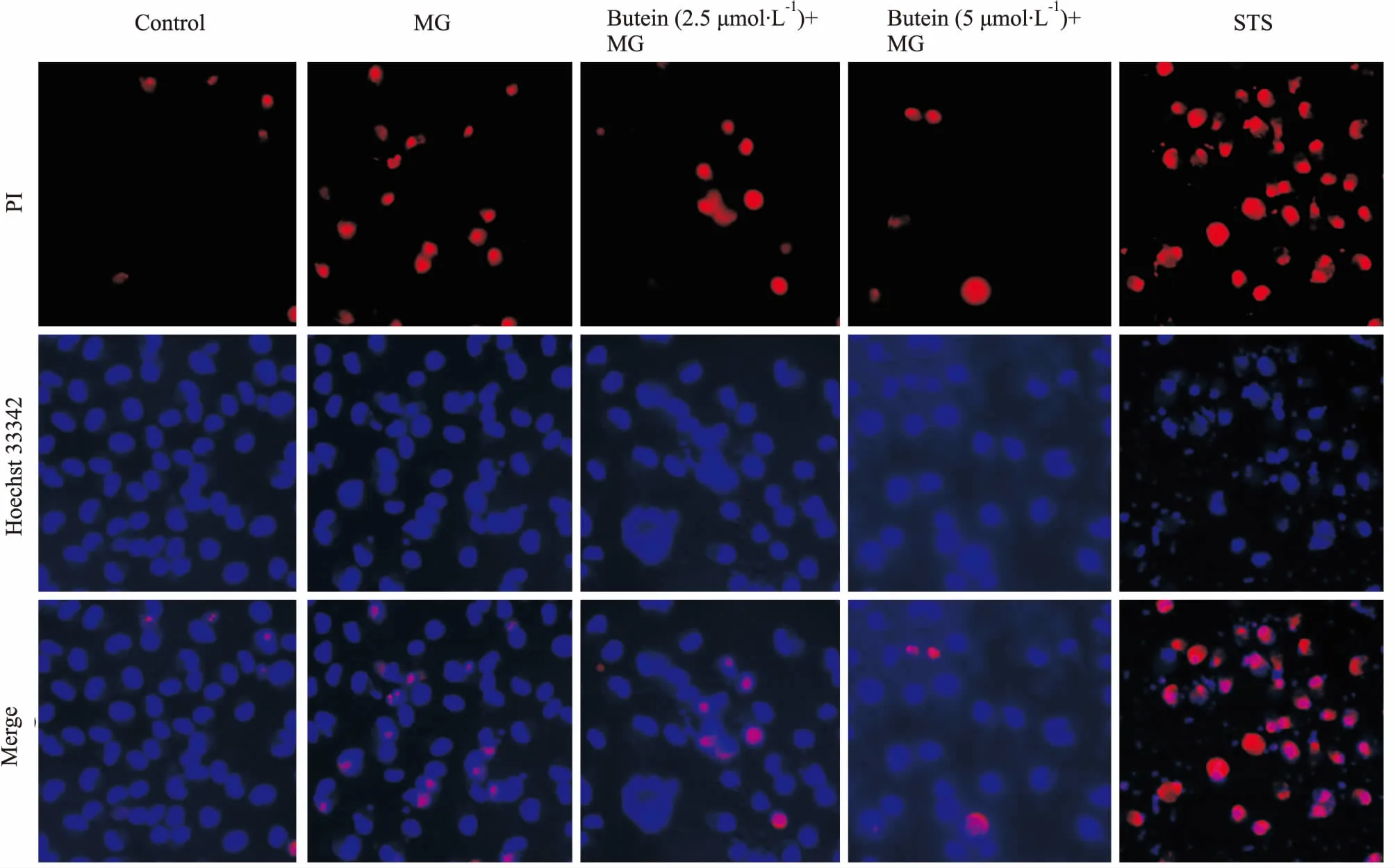
Fig 2 Butein inhibited PC12 cells apoptosis induced by MG(scale bar: 50 μm)
The cells were treated with 1.5 mmol·L-1MG for 24 h before pretreatment with butein (2.5, 5 μmol·L-1) for 1 h.PI and Hoechst 33342 was used to determine cell apoptosis.
丙酮醛在糖尿病患者的血液中大量累积,对于各类器官都有损伤,如损伤脑部引起糖尿病脑部病变,损伤肾脏引起糖尿病肾损伤。丙酮醛是机体糖酵解产生的内源性物质,在正常情况下主要由乙二醛酶系统代谢形成缩醛,并被乙二醛酶I代谢成D-乳酸,从而排出体外。而在糖尿病患者中,细胞内谷胱甘肽及乙二醛酶I活性下调,影响丙酮醛的正常代谢,导致其累积,损伤机体器官。有研究表明,在阿尔茨海默病患者的脑脊液中发现大量的丙酮醛,显示其聚积对于形成阿尔茨海默症有一定的影响。本研究发现,丙酮醛明显抑制PC12细胞的生长,增加其细胞毒性、LDH的释放,且丙酮醛明显激活促凋亡基因p53的表达。p53基因是一种最常见的促凋亡基因,可使细胞的增殖停滞于G期,是细胞凋亡及细胞阻滞的关键分子。在p53调节的凋亡细胞中,SOD2酶活性被抑制,而增加SOD2基因表达及酶活性,能明显下调p53导致的细胞凋亡[11]。caspase-9是caspase凋亡家族的一员,由线粒体释放的细胞色素C激活caspase-9的酶原剪切成caspase-9,发挥促凋亡的作用。研究发现,丙酮醛及高糖处理激活人脐静脉内皮细胞p53信号通路,促进caspase-9活性的升高,从而导致内皮细胞凋亡[12-13]。本实验发现,1.5 mmol·L-1丙酮醛明显导致细胞核固缩、聚积和碎裂成核小体,而紫铆因处理组则明显减少细胞核固缩,核小体的数量。丙酮醛剂量依赖性地抑制抗氧化基因SOD2的表达,促进促凋亡基因p53和caspase-9的表达。有研究表明,用丹参酮IIA处理明显下调p53蛋白的过量表达,从而降低丙酮醛诱导的脑微血管内皮细胞的凋亡[14-15]。本实验发现,低剂量紫铆因同样具有降低p53基因及蛋白过表达的作用,增加SOD2基因表达,从而调控caspase-9的高表达,起到降低丙酮醛诱导的PC12细胞凋亡的作用。
糖尿病发病机制异常复杂,丙酮醛的毒性机制也并不十分清楚。紫铆因作用于p53基因的具体机制还不清楚,因此,紫铆因下调促凋亡蛋白p53、caspase-9,上调抗氧化基因SOD2的表达,起到对抗丙酮醛诱导的细胞凋亡的具体机制还需要进一步的深入研究。
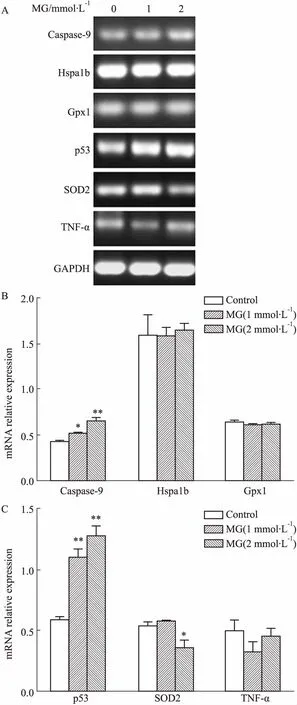
Fig 3 MG induced cell apoptotic gene expressions and inhibited antioxidant gene n=5)
A: RT-PCR analysis for mRNA obtained from cells treated by different concentrations of MG; B: Optical density of the bands was analyzed with ImageJ software.*P<0.05,**P<0.01vscontrol group.
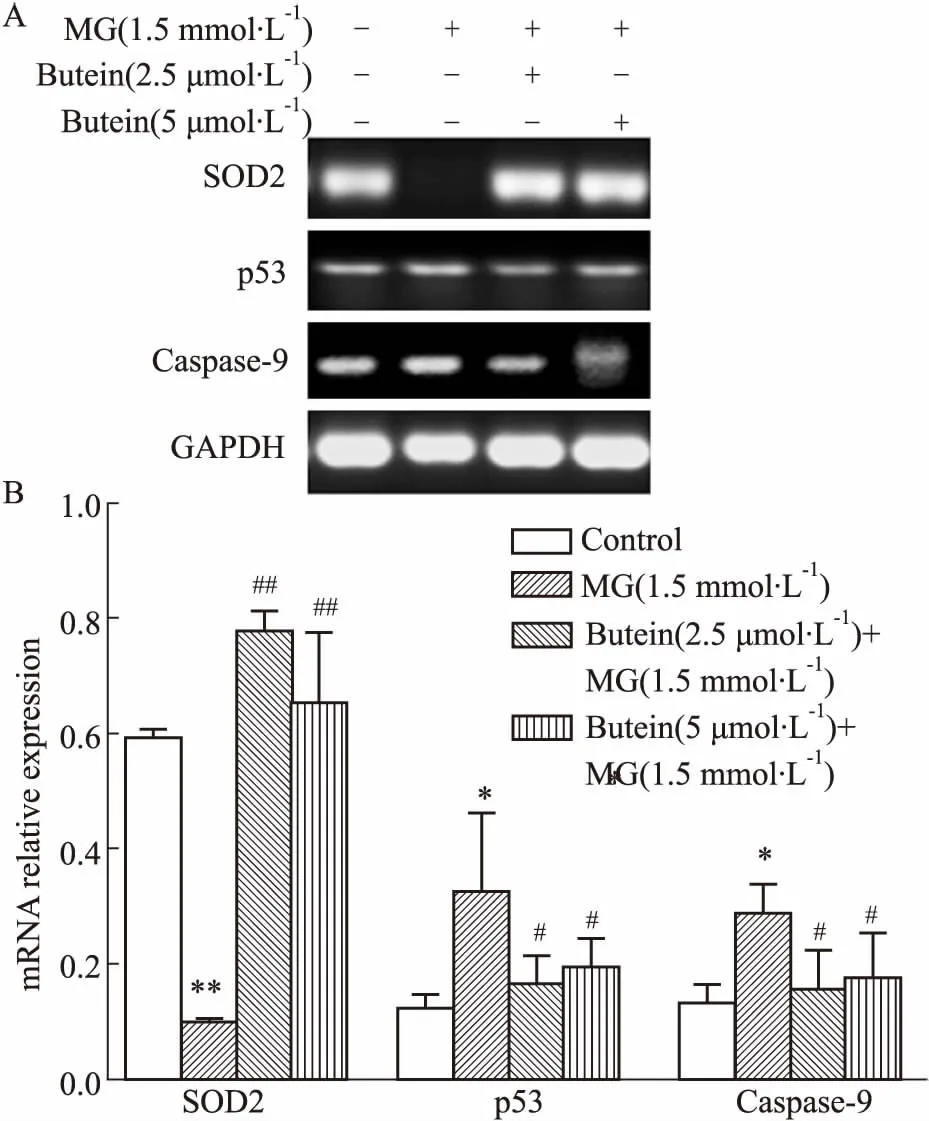
Fig 4 Butein improved key gene expressions involved
A: RT-PCR analysis for mRNA obtained from cells treated by butein in presence or absence of MG; B:Optical density of the bands analyzed with ImageJ software.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsMG group.
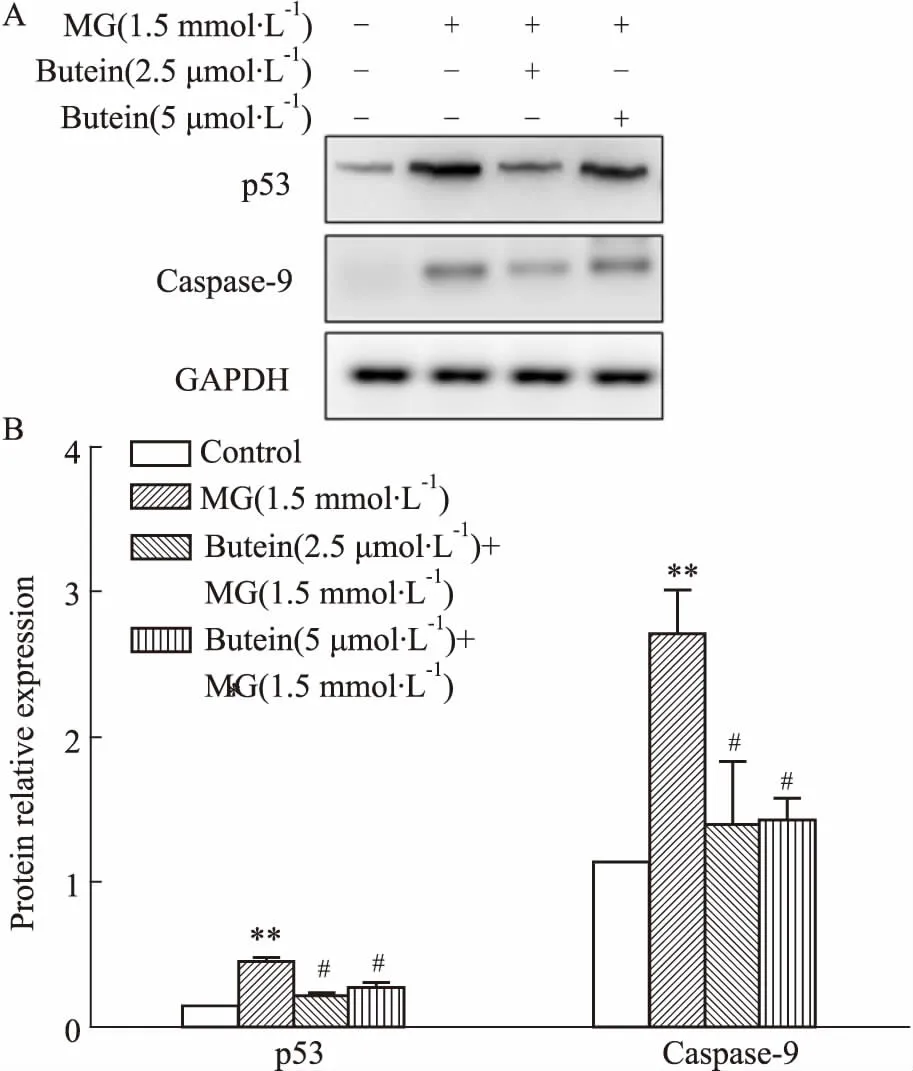
Fig 5 Butein inhibited p53 and caspase-9 protein
A: Western blot analysis for protein expression obtained from cells treated by butein in presence or absence of MG; B Optical density of the bands analyzed with ImageJ software.**P<0.01vscontrol group;#P<0.05vsMG group.
参考文献:
[1] Kwon D J,Ju S M,Youn G S, et al.Suppression of iNOS and COX-2 expression by flavokawain A via blockade of NF-kappaB and AP-1 activation in RAW 264.7 macrophages [J].FoodChemToxicol, 2013,58:479-86.
[2] Feroz S R, Mohamad S B,Bujang N, et al.Multispectroscopic and molecular modeling approach to investigate the interaction of flavokawain B with human serum albumin [J].JAgricFoodChem, 2012,60(23):5899-908.
[3] Di Loreto S,Zimmitti V,Sebastiani P, et al.Methylglyoxal causes strong weakening of detoxifying capacity and apoptotic cell death in rat hippocampal neurons [J].IntJBiochemCellBiol, 2008,40(2):245-57.
[4] Eguchi T,Kumagai C,Fujihara T, et al.Black tea high-molecular-weight polyphenol stimulates exercise training-induced improvement of endurance capacity in mouse via the link between AMPK and GLUT4 [J].PLoSOne, 2013,8(7):e69480.
[5] Guo W Z,Miao Y L,An L N, et al.Midazolam provides cytoprotective effect during corticosterone-induced damages in rat astrocytes by stimulating steroidogenesis [J].NeurosciLett, 2013,547:53-8.
[6] Wang X J,Li Y, Song Q Q, et al.Corticosterone regulation of ovarian follicular development is dependent on the energy status of laying hens [J].JLipidRes, 2013,54(7):1860-76.
[7] Luiken J J, Vertommen D,Coort S L, et al.Identification of protein kinase D as a novel contraction-activated kinase linked to GLUT4-mediated glucose uptake, independent of AMPK [J].CellSignal, 2008,20(3):543-56.
[8] Schwenk R W, Dirkx E, Coumans W A, et al.Requirement for distinct vesicle-associated membrane proteins in insulin- and AMP-activated protein kinase (AMPK)-induced translocation of GLUT4 and CD36 in cultured cardiomyocytes [J].Diabetologia, 2010,53(10):2209-19.
[9] 姜保平,乐 亮,姚 霞,等.HepG2 细胞胰岛素抵抗模型的建立及在筛选两色金鸡菊活性化合物中的应用 [J].中国现代中药, 2017,19(2):165-73.
[9] Jiang B P, Le L, Yao X, et al.Establishment of insulin resistance HepG2 cell model and its application in screening bioactive components ofCoreopsistinctoria[J].ModChinMed, 2017,19(2): 165-73.
[10] Jiang B, Le L,Liu H, et al.Marein protects against methylglyoxal-induced apoptosis by activating the AMPK pathway in PC12 cells [J].FreeRadicRes, 2016,50(11): 1173-87.
[11] Drane P, Bravard A, Bouvard V, et al.Reciprocal down-regulation of p53 and SOD2 gene expression-implication in p53 mediated apoptosis [J].Oncogene, 2001,20(4):430-9.
[12] Chan W H, Wu H J.Methylglyoxal and high glucose co-treatment induces apoptosis or necrosis in human umbilical vein endothelial cells [J].JCellBiochem, 2008,103(4):1144-57.
[13] Hsieh M S,Chan W H.Impact of methylglyoxal and high glucose co-treatment on human mononuclear cells [J].IntJMolSci, 2009,10(4):1445-64.
[14] Zhou W J, Gui Q F, Wu Y, et al.Tanshinone IIA protects against methylglyoxal-induced injury in human brain microvascular endothelial cells [J].IntJClinExpMed, 2015,8(2):1985-92.
[15] 刘 静,张 瑞,李冠青, 等.SRT1720对高糖诱导的小鼠系膜细胞凋亡的影响 [J].中国药理学通报, 2017,33(8):1164-9.
[15] Liu J, Zhang R, Li G Q, et al.Influence of SRT1720 on apoptosis of high glucose-induced mouse mesangial cells [J].ChinPharmacolBull, 2017,33(8): 1164-9.