奥曲肽对隐孢子虫感染后乳鼠空肠生长抑素受体4和5 mRNA表达的影响
刘 新,朱 锐,白 杰
(新疆医科大学基础医学院药理学教研室,新疆 乌鲁木齐 830011)
感染后肠易激综合征(post-infectious irritable bowel syndrome,PI-IBS)可发生于肠道急性感染后,是肠易激综合征的常见类型,临床表现为腹痛、胀气和排便异常。其病理生理学机制尚不清楚,可能与肠道持续存在低度炎症、黏膜免疫系统被激活、黏膜神经丛和肌神经纤维密度增加以及肠道高敏性有关[1]。
隐孢子虫(Cryptosporidium.parvum)属于顶复合器门隐孢子属的细胞外寄生虫,是引起腹泻的主要原因之一,人群普遍易感。免疫功能正常的人体或动物感染后,产生自限性腹泻;免疫缺陷性病人如艾滋病,引起的慢性腹泻是致死的重要原因。该原虫主要感染肠上皮细胞,在肠道形成卵囊后,随粪便排出[2]。本课题组以往在出生5日龄有免疫力的乳鼠上,通过灌胃105隐孢子虫卵囊, 已成功建立PI-IBS动物模型[3]。结果表明,从感染后d 10~17腹腔注射奥曲肽(50 μg·kg-1·d-1)可降低肠敏感性,减少空肠肥大细胞和淋巴细胞数量,降低神经纤维密度[3],但其机制不清。
奥曲肽作为生长抑素类似物,是生长抑素受体2(somatostatin receptor 2,SSTR2)和SSTR5激动剂。本课题组前期研究表明[4],SSTR1、SSTR2 mRNA在隐孢子虫感染后14 d增加,奥曲肽能降低感染后37 d的SSTR2 mRNA水平,但在感染后50 d,奥曲肽使SSTR1、SSTR2、SSTR3 mRNA表达增加。而SSTR4、SSTR5 mRNA水平在感染过程中是否有变化,及奥曲肽是否能影响SSTR4、SSTR5 mRNA表达水平尚不清楚。本研究拟观察隐孢子虫感染乳鼠后,空肠SSTR4、SSTR5 mRNA表达的变化,同时探讨奥曲肽对感染后SSTR4、SSTR5 mRNA表达的影响。
1 材料
1.1实验动物SPF级2日龄SD大鼠138只,由新疆医科大学动物实验中心提供,生产许可证号:SCXK(新)2016-0003,使用许可证:SYXK(新)2016-0002。
1.2试剂醋酸奥曲肽注射液(0.1 g·L-1,批号:S0452,Novartis Pharma Stein AG);TRNzol 试剂(天根DP405-02);Bestar qPCR RT Kit、Bestar SYBRGreen qPCR Mastermix(DBI Bioscience公司);SSTR4抗体、SSTR5抗体(Thermo Fisher公司);兔二步法免疫组化检测试剂盒(中杉金桥PV-6001);氯仿、异丙醇、无水乙醇均为国产分析纯。
1.3仪器RETSCH混合冷冻混合球磨仪MM 400(Retsch GmbH公司);Legend Micro21R高速低温离心机(Thermo公司);Nano Drop 1000核酸定量仪(Thermo Gene公司 );Gel Doc XR凝胶成像仪(Bio-Rad公司);QuantStudio 6 Flex实时荧光定量PCR仪(ABI公司);尼康Ti荧光倒置显微镜(日本Nikon公司)。
2 方法
2.1PI-IBS动物模型的建立SD乳鼠适应性饲养3 d,按照分层,随机将乳鼠分为感染组和非感染组,感染组74只,非感染组64只。感染组通过灌胃给予105隐孢子虫卵囊混悬液(每只0.1 mL,109·L-1),未感染组给予等体积磷酸缓冲液。在感染的高峰期即感染后d 7,感染组处死10只乳鼠,取十二指肠、空肠、回肠、结肠固定,石蜡包埋后,通过HE染色确定是否感染成功。
2.2奥曲肽处理在感染后的11~17 d,给药对照组和治疗组腹腔注射奥曲肽(50 μg·kg-1·d-1),对照组和感染组给予等量生理盐水。分别在感染后d 14、17、37、50,每组处死8只大鼠,取2 cm空肠近端组织,其中1 cm组织固定于4%多聚甲醛中,1 cm组织迅速放入液氮后,移至-80℃冰箱保存。
2.3免疫组化法检测大鼠空肠SSTR4和SSTR5表达组织固定48 h后,常规脱水包埋,切片后烤片过夜,切片脱蜡至水,3% H2O2室温浸泡10 min,蒸馏水洗1次,PBS洗3次。0.01 mol·L-1柠檬酸盐缓冲液解冻加热13 min,抗原修复。PBS洗3次,加60 μL山羊血清覆盖组织,37℃恒温箱30 min,弃去多余液体,加60 μL一抗稀释液(1 ∶1 000), 4 ℃冰箱过夜。次日平衡至室温,PBS洗5 min×3次,加60 μL二抗,37℃ 30 min,PBS洗5 min×3次,DAB显色,显微镜下控制染色时间,苏木精复染5 min,脱水,透明,封片,200倍显微镜观察,采集图像。利用Image-pro Plus 6.0 软件测定样本的积分光密度值(IOD)。
2.4Realtime-PCR检测空肠SSTR4、SSTR5mRNA水平称取50 mg冻存组织提取RNA,用核酸定量仪测定总RNA含量及纯度。用1.2%琼脂糖变性凝胶电泳检测总RNA质量。根据试剂盒操作合成cDNA,于-20℃保存备用。根据NCBI GenBank中基因序列,使用Primer premier 6.0 软件进行引物设计,引物序列见Tab 1。根据NCBI Primer-BLAST 功能对产物进行第1次验证,将合适引物由生工生物工程股份有限公司合成。依据2-△△CT法分析mRNA的表达,得到该基因的标准曲线和扩增效率。将样本cDNA稀释10倍备用,每个样本均为2复孔。总反应体系为25 μL,反应体系为: SYBR Green qPCR master mix 12.5 μL ,上、下游引物各0.5 μL,DEPC水9.5 μL,ROX 0.05 μL,cDNA 2 μL。反应条件为:95℃ 2 min,95℃ 10 s,60℃ 34 s,72℃ 30 s,40个循环。根据样本CT值进行相关计算,根据熔解曲线判断PCR产物是否具有特异性。
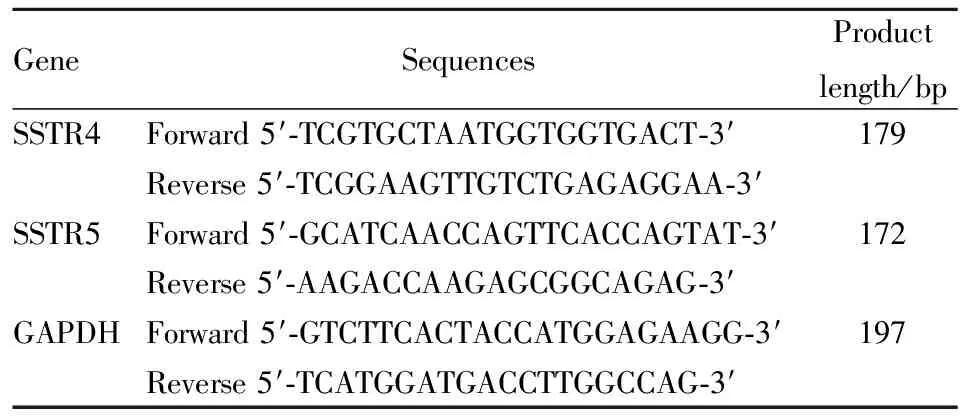
Tab 1 Primer sequences used for SSTR4 and SSTR5 detection with real time-PCR
3 结果
3.1HE染色结果大鼠感染后d 7的肠道各段进行HE染色,与正常组比较,感染组在空肠绒毛部位发现隐孢子虫(箭头所示),并且绒毛高度降低(红色直线),隐窝高度增加(黄色直线),黏膜层无明显变化,证明模型构建成功(Fig 1)。
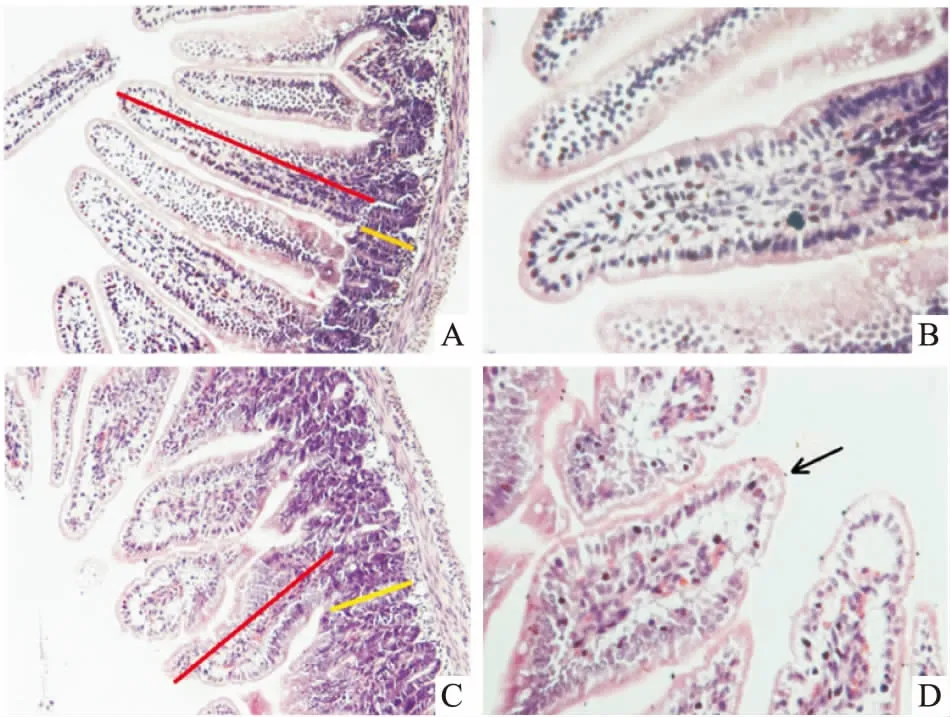
Fig 1 HE staining of rat jejunum on d 7 post infection
A: Control group (×200); B: Control group (×400); C: Infection group (×200); D: Infection group (×400)
3.2SSTR4、SSTR5免疫组化结果大鼠空肠组织在200倍光镜下,随机选取5个视野,观察不同时期SSTR4和SSTR5的表达。如Fig 2、3所示,SSTR4在感染后d 14、17、50主要表达部位为隐窝,而感染后d 37,SSTR4主要在黏膜下层表达。SSTR5在感染后d 14,主要在黏膜下层和肠黏膜部位表达,感染后d 17、37主要在黏膜下层表达,而感染后d 50主要在隐窝部位表达。计算IOD值后进行统计学分析,结果表明,与对照组相比,空肠SSTR4在感染后d 14、17、37明显增加。在感染后d 14、17、37、50,奥曲肽使SSTR4明显减少。与对照组比较,空肠SSTR5在感染后d14、17、50表达增加,而奥曲肽可降低其表达。
3.3空肠中SSTR4、SSTR5mRNA表达分析如Fig 4所示,在大鼠空肠中,与对照组相比,感染组在感染后的d 14、17、37、50,空肠SSTR4、SSTR5 mRNA的表达明显升高(P<0.01)。给药对照组空肠SSTR4 mRNA在感染后d 14表达升高,感染后d 50表达明显降低(P<0.01),给药对照组SSTR5 mRNA在感染后d 14、17、37表达升高,感染后d 50表达明显降低(P<0.01)。与感染组相比,感染后d 17、37、50,给药组空肠SSTR4、SSTR5 mRNA表达明显下降(P<0.01)。
4 讨论
有研究证实,生长抑素参与肠道炎症时的免疫调节[4]。本研究进一步证实了SSTR4和SSTR5在肠道炎症过程中的变化,以及奥曲肽改善PI-IBS症状涉及的可能机制。隐孢子虫感染后,空肠的SSTR4、SSTR5分布的组织学特征与文献报道一致[5-7],免疫组化结果表明,SSTR5主要表达在大鼠空肠黏膜下层,SSTR4主要表达在肠隐窝。有研究报道,生长抑素的抗炎作用一方面与合成和释放炎症介质的细胞有关,如抑制淋巴细胞的分化及白介素、干扰素的释放[1,8]。另一方面,与抑制感觉神经末梢释放炎性多肽有关[6]。提示生长抑素的神经抑制效应和镇痛作用可能更多地与SSTR4有关。
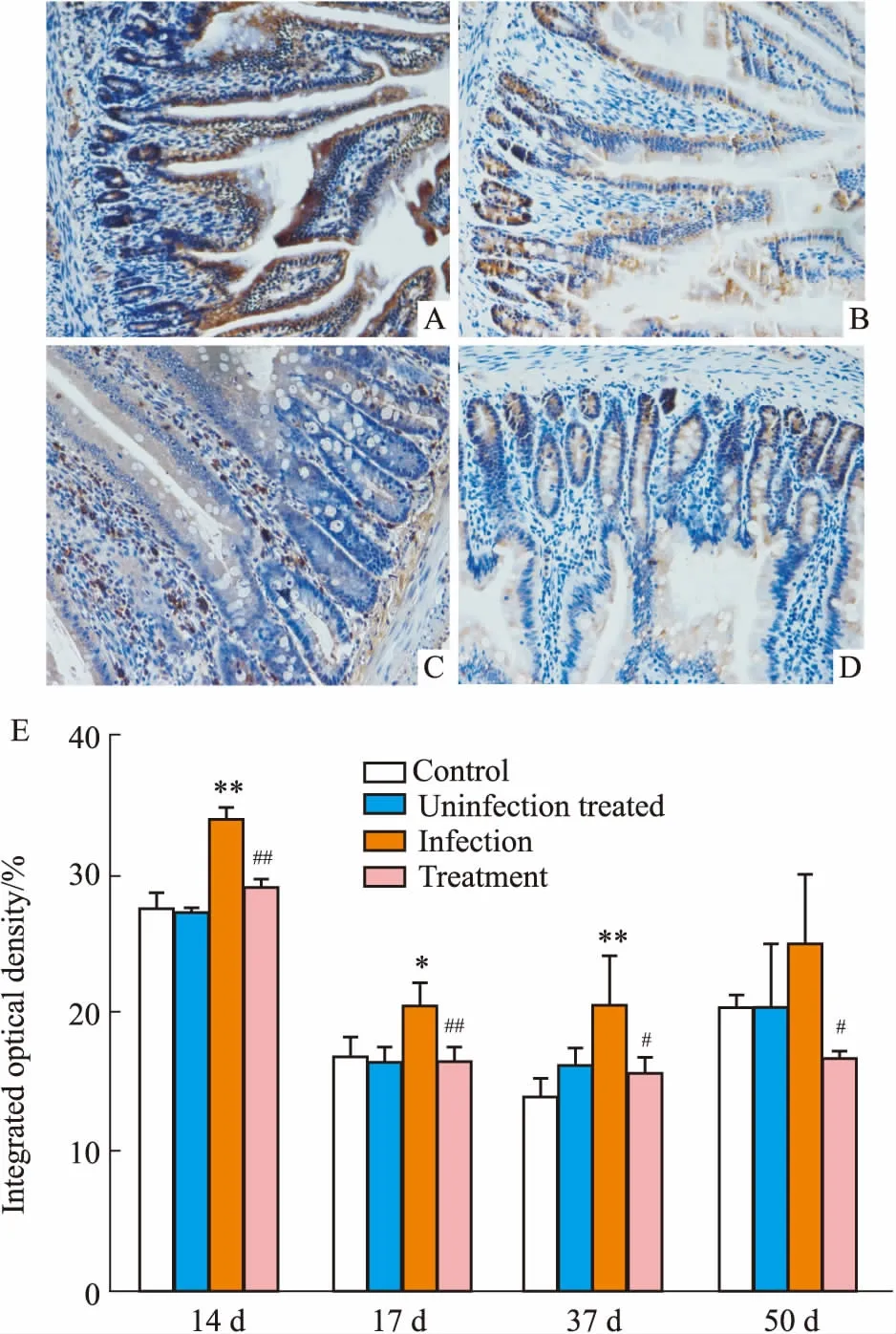
Fig 2 Expressions of SSTR4 in jejunum determined by immunohistochemistry
A: 14 d post infection; B: 17 d post infection; C: 37 d post infection; D: 50 d post infection; E: Semiquantity of SSTR4 in jejunum determined by Image-pro Plus.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsinfection.
本实验发现,在隐孢子虫感染后d 14、17、37、50,SSTR4、SSTR5 mRNA水平都升高。课题组以往研究证实,感染后d 37、50,大鼠空肠固有层肥大细胞数目、上皮淋巴细胞数目及黏膜下和肌层神经纤维密度都增加,在感染100 d后,空肠对胀气的敏感性也增加[4]。提示SSTR4、SSTR5 mRNA水平升高早于淋巴细胞和神经元数目的增加,SSTR4、SSTR5表达的增加可能与炎症反应有关,进一步证实了SSTR4和SSTR5参与了肠道感染的免疫反应。另外,在感染d 10-17给予奥曲肽(50 μg·kg-1·d-1),降低了感染后d 17、37、50的SSTR4、SSTR5 mRNA水平。以往研究发现,奥曲肽可降低感染后d 37、50黏膜肥大细胞数目,减少感染后d 50上皮淋巴细胞数目及肌层神经丛的密度,同时降低了感染后120 d空肠对胀气的高敏性[4]。提示奥曲肽的降低痛觉、抗炎作用可能与SSTR4和SSTR5有关[6]。即使在停药20 d甚至更长时间,奥曲肽仍表现出生物学效应,可能奥曲肽改善急性PI-IBS症状与SSTRs介导的免疫调节和抗炎作用有关。
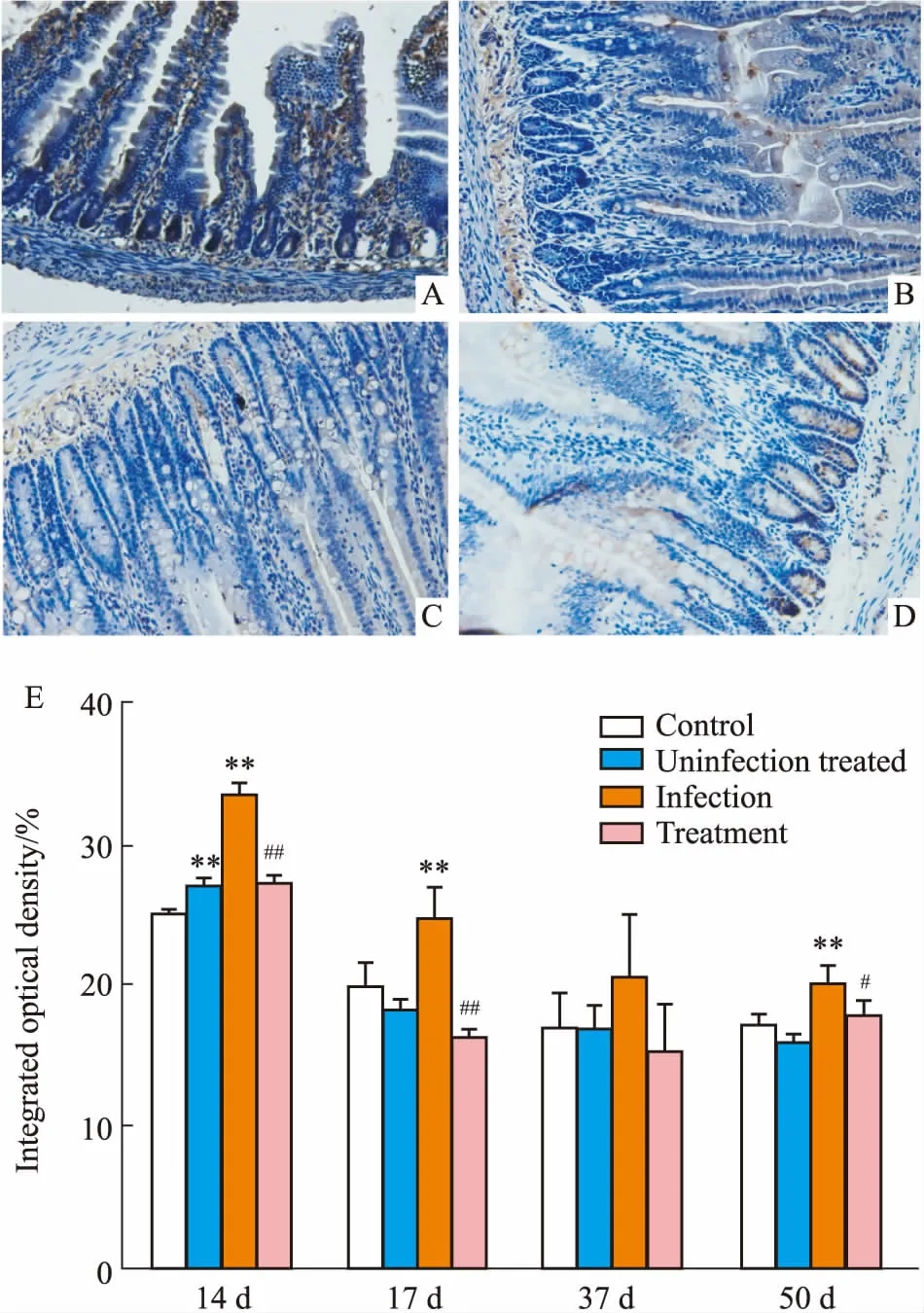
Fig 3 Expressions of SSTR5 in jejunum determined by immunohistochemistry
A: 14 d post infection; B: 17 d post infection; C: 37 d post infection; D: 50 d post infection; E: Semiquantity of SSTR5 in jejunum determined by Image-pro Plus.**P<0.01vscontrol;#P<0.05,##P<0.01vsinfection.
总之,在隐孢子虫感染有免疫力的新生乳鼠模型中,空肠SSTR4和STTR5在感染后增加,奥曲肽能不同程度地降低感染后增加的SSTR4和SSTR5水平。提示SSTR4和SSTR5也参与了感染大鼠空肠的免疫调节作用。推测可能涉及的下游效应与激活肥大细胞、淋巴细胞、黏膜神经丛的相互作用有关[9-11]。今后拟进一步在SSTR4和SSTR5基因敲除小鼠模型上,对SSTRs与肥大细胞之间的相互作用及可能介导的下游细胞信号转导通路做进一步研究,以阐明SSTRs在炎症过程中的作用。
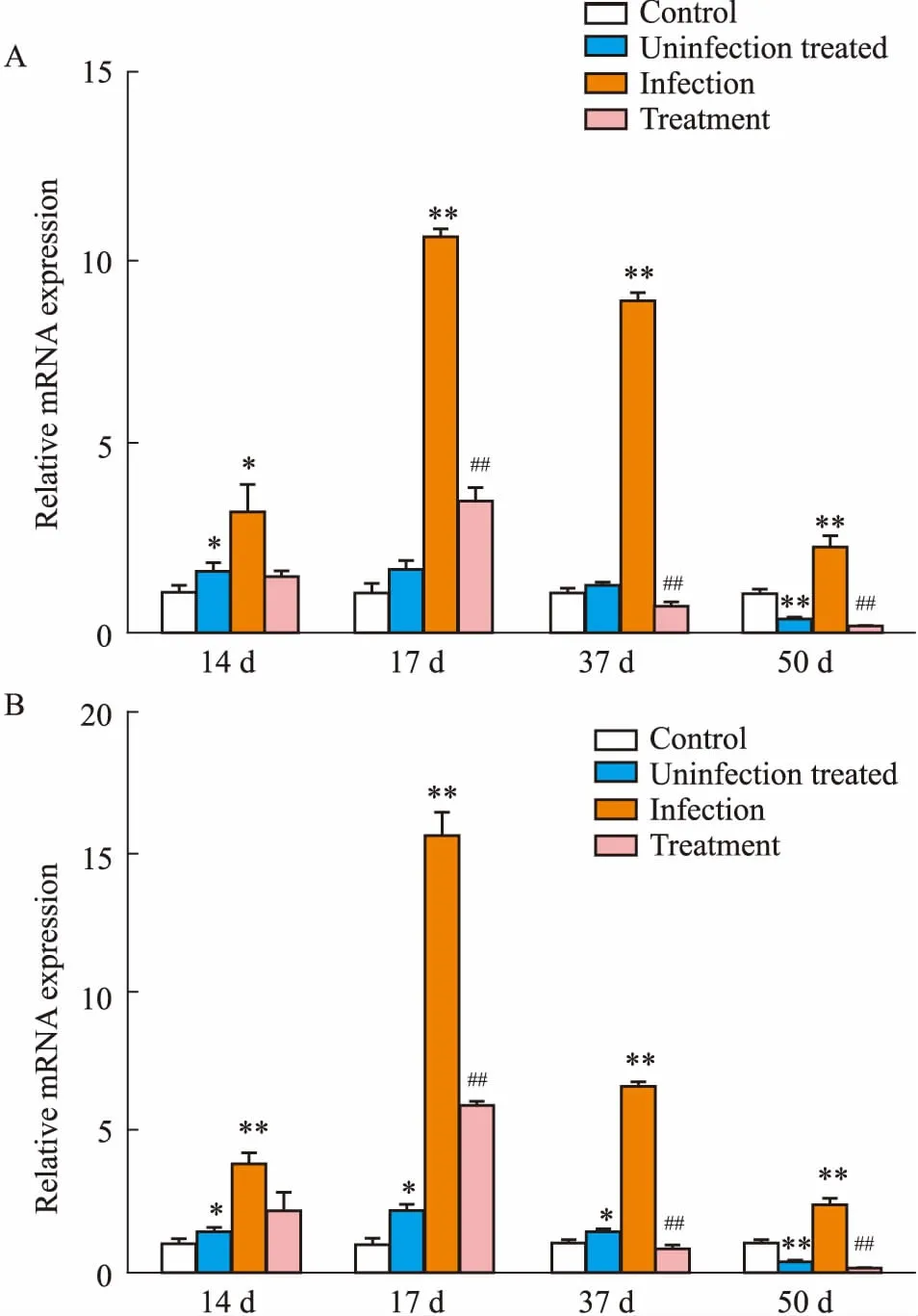
Fig 4 Expression of SSTR4 (A), SSTR5 (B) mRNA in jejunum determined by real time PCR
*P<0.05,**P<0.01vscontrol;##P<0.01vsinfection.
(致谢: 衷心感谢中国农业大学索勋教授对本实验提供隐孢子虫卵囊。感谢新疆医科大学第一附属医院临床研究院和生物芯片北京国家工程研究中心新疆分中心的吕国栋老师、刘辉老师对实验提供的无私帮助和技术指导。)
参考文献:
[1] 颜秀娟, 陈胜良.肠黏膜肥大细胞参与感染后肠易激综合征内脏高敏感机制的研究进展[J].胃肠病学,2011,16(7):435-7.
[1] Yan X J,Chen S L.Research progress of mucosal mast cells in mechanism of visceral hypersensitivity in postinfectious irritable bowel syndrome[J].Gasrtoenterology, 2011,16(7):435-7.
[2] Hunter P R, Nichols G.Epidemiology and clinical features of Cryptosporidium infection in immunocompromised patients[J].ClinMicrobiolRev, 2002,15:145-54.
[3] Khaldi S, Garqaia G,Le Goff L, et al.Cryptosporidiumparvumisolate-dependent postinfectious jejunal hypersensitivity and mast cell accumulation in an immunocompetent rat model[J].InfectImmun, 2009,77(11):5163-9.
[4] Bai J, Khaldi S, Garqaia G, et al.Effects of octreotide on jejunal hypersensitivity triggered byCryptosporidiumparvumintestinal infection in an immunocompetent suckling rat model[J].NeurogastroenterolMotil, 2011,23(11):1043-50.
[5] 马腾飞,王业秋,张 宁,等.菝葜治疗便秘型肠易激综合征作用机制的实验研究[J].中国药理学通报,2012,28(1):109-14.
[5] Ma T F,Wang Y Q,Zhang N,et al.An experimental study of Smilax treatment of constipation predominant irritable bowel syndrome and its mechanism[J].ChinPharmacolBull, 2012,28(1):109-14.
[6] Rai U, Thrimawithana T R, Valery C, Young S A.Therapeutic uses of somatostatin and its analogues: current view and potential applications[J].PharmacolTher,2015,152(8):98-110.
[7] Krempels K, Hunyady B, O’Carroll A M, Mezey E.Distribution of somatostatin receptor messenger RNAs in the rat gastrointestinal tract[J].Gastroenterology, 1997,112(6):1948-60.
[8] 唐洪梅, 房财富, 廖小红,等.神经肽Y和5-羟色胺在腹泻型肠易激综合征模型大鼠中表达的研究[J].中国药理学通报, 2012,28(7):916-20.
[8] Tang H M,Fang C F,Liao X H,et al.Expression of NPY and 5-HT in rat model of diarrhea-predominant irritable bowel syndrome[J].ChinPharmacolBull, 2012,28(7):916-20.
[9] 刘丽娜, 周 梁, 田 超,等.金荞麦总黄酮下调NR2B表达改善IBS大鼠痛觉过敏[J].中国药理学通报, 2012,28(9):1289-93.
[9] Liu L N, Zhou L, Tian C,et al.Improvement of IBS rats hyperalgesia by total flavones ofFagopyrumcymosumvia down-regulation of NR2B expression[J].ChinPharmacolBull, 2012,28(9):1289-93.
[10] 刘雁冰, 孙 燕, 刘 菲.辣椒素受体TRPV1在大鼠内脏高敏感性发病机制中的作用[J].临床和实验医学杂志, 2016,15(10):936-9.
[10] Liu Y B,Sun Y,Liu F.The role of vanilloid receptor TRPV1 in visceral hypersensitivity in rat[J].JClinExpMed, 2016,15(10):936-9.
[11] Szolcsányi J, Pintér E, Helyes Z, Petho G.Inhibition of the function of TRPV1-expressing nociceptive sensory neurons by somatostatin 4 receptor agonism: mechanism and therapeutical implications[J].CurrTopMedChem, 2011,11(17):2253-63.