人U87-MG脑胶质瘤细胞裸鼠原位移植模型的建立
王艳华,楚建杰,李子敏,胡娜平,李会会,郑建民,张彩勤,师长宏, 杨志福,奚苗苗,文爱东,翁 琰
(西京医院 1.药剂科、2.放射科;3.空军军医大学实验动物中心,陕西 西安 710032)
脑胶质瘤是由于大脑和脊髓胶质细胞癌变所产生的一种最常见的原发性颅脑恶性肿瘤,约占颅内肿瘤的35%~61%。目前,虽然有手术、放疗、化疗、基因治疗及综合治疗等多种治疗方法,但因其侵袭性强、复发率高、位置特殊、预后差,具有很高的病死率和致残率,严重威胁人类健康[1]。肿瘤细胞所处的微生态环境是其生长不容忽视的重要因素[2],建立一个可靠的能模拟人脑胶质瘤微环境以及生物学特性的动物模型,是进一步了解和研究胶质瘤发病机制及治疗方法的基础和前提。虽然异位(如皮下接种)移植简单方便,易于观察,但越来越多的资料表明异位移植瘤并非长在脑内,因此与原位移植瘤在血管生成、浸润性、转移性、瘤细胞生物活性物质的表达、瘤组织微环境渗透压等许多生物学行为上存在明显差异[3-4]。肿瘤的原位移植动物模型与临床脑胶质瘤的发生情况最为接近,包括脑胶质瘤发生、发展的各个环节,从临床模拟性来说,是目前研究脑胶质瘤最为理想、可靠的肿瘤模型[3, 5]。为此,我们应用脑立体定位仪,将不同数量的人脑胶质瘤细胞U87-MG单细胞悬液接种于免疫缺陷裸鼠的脑内右侧尾状核区,建立人脑胶质瘤原位移植裸鼠模型。采用核磁共振扫描(magnetic resonance imaging, MRI)方法,在不对裸鼠造成伤害的前提下,实现了动态监测造模后裸鼠颅内移植瘤的生长,同时结合HE染色和免疫组化等病理学检查分析结果,确立了造模后成模的最佳时间。
1 材料与方法
1.1细胞株与实验动物人脑胶质瘤U87-MG细胞系由西京医院神经外科教研室惠赠。BALB/c-nu/nu裸鼠24只,♂,6~8周龄,清洁级,购于上海斯莱克实验动物有限责任公司,许可证号:FCXK(沪)2003-0003,饲养于空军军医大学实验动物中心[SYXK(军)2012-0023]。裸鼠随机分为4组,正常对照组、A组、B组、C组,每组6只。A、B、C组接种细胞数分别为1.5×105个、2.0×105个、2.5×105个(悬浮于无血清DMEM培养液),分别在接种后7、14、21、28 d对每组裸鼠进行核磁共振扫描,并在28 d时取对照组鼠1只、造模组每组1只(共3只)裸鼠行4%多聚甲醛心内灌注并固定,对获取的全脑标本进行切片,并进行病理学观察,取其心、肝、脾、肺、肾、脊髓等主要脏器,检查有无转移灶,剩余裸鼠正常饲养,观察生存期。
1.2试剂胎牛血清(西安沃德生物科技有限公司);DMEM高糖培养粉(美国Gibco公司);胰蛋白酶(美国Sigma公司);钆喷酸葡胺注射液(广州康臣药业有限公司);兔抗人胶质纤维酸性蛋白(glial fibrillary acidic protein ,GFAP)、S-100蛋白多克隆抗体、SABC试剂盒(武汉博士德公司)。
1.3仪器SW-CJ-2F超净工作台(苏州安泰空气技术有限公司);QP-160型二氧化碳培养箱(山东博科生物产业有限公司);ALC-H型动物脑立体定向仪、ALC-IP600型微量注射泵、ALC-CED9型动物颅骨钻(北京吉安得尔科技有限公司);3.0T MAGNETOM Trio Tim核磁共振成像系统(德国西门子公司);3T老鼠线圈(上海辰光医疗科技有限公司); Olympus IX71倒置荧光显微镜(日本奥林巴斯公司)。
1.4方法
1.4.1细胞培养 将人脑胶质瘤细胞U87-MG分装于数只底面积为75 cm2的培养瓶中,按常规方法培养,即用含10%胎牛血清的DMEM培养液,置37℃、5% CO2的恒温恒湿培养箱中培养。在细胞处于对数生长期时,以0.25%胰酶消化,收集消化液,离心后去除上清液,Hanks液洗2次后制成细胞悬液,调节至各种所需细胞浓度的悬液用于接种。
1.4.2脑内原位接种 整个接种过程在层流超净台进行,接种部位为裸鼠右侧大脑尾状核。裸鼠经0.8%的戊巴比妥钠腹腔注射麻醉(20 mL·kg-1),俯卧位将其头部固定在脑立体定向仪上。75%乙醇消毒头顶部皮肤后,先于颅中线处眼裂后开1个垂直切口,暴露前囟。接种部位的确定参照文献[6],取前囟中点前l mm、矢状缝向右旁开2.5 mm处,用直径为1 mm的动物颅骨钻小心钻穿颅骨,然后用吸有5 μL瘤细胞悬液的微量进样器经孔垂直进入脑白质区中,进针深度为针尖距颅骨表面3.5 mm,注射前将针稍微退回约0.5 mm,以0.5 μL·min-1注射速度将瘤细胞悬液缓慢注入,除针前停留2 min后再缓慢拔针,用骨蜡封闭骨孔,生理盐水冲洗术野,缝合头皮,最后用碘酒消毒。正常对照组接种时以同体积Hanks液替代。术后先将裸鼠置于37℃恒温板上保温,待苏醒后再放回笼中,术后无需抗感染治疗。每天观察其生活状态,包括精神、饮食、活动、体质量等情况。
1.4.3MRI检测 裸鼠经0.8%的戊巴比妥钠腹腔注射麻醉后,按1 mmol·kg-1的剂量静脉注入钆喷酸葡胺注射液,置于3T老鼠线圈中,采用3.0T MAGNETOM Trio Tim核磁共振成像系统对裸鼠头部横断面、冠状面、矢状面分别行T1加权快速自旋回波序列(TSE)增强扫描。具体参数为:横断面层厚0.8 mm,间隔0.2 mm,FOV 39 mm×50 mm,矩阵296×384,TR/TE=1 130 ms/15 ms;冠状面层厚1.0 mm,间隔0.2 mm,FOV 39 mm×50 mm,矩阵296×384,TR/TE=1 130 ms/15 ms;矢状面层厚1.0 mm,间隔0.2 mm,FOV 31 mm×40 mm,矩阵296×384,TR/TE=1 000 ms/17 ms。观察裸鼠脑内移植瘤成像情况及位置,并用自带软件测量肿瘤的最大前后、左右和上下径,计算不同瘤龄的肿瘤体积(mm3)=前后径×左右径×上下径[7]。
1.4.4脑组织心内灌注固定 将裸鼠麻醉,直接开胸,在右心耳处用针扎出1个小孔,用装有肝素的输液器在左心室进行穿刺,缓慢灌注用生理盐水稀释的肝素钠(20 IU·mL-1)10 mL,刚开始裸鼠剧烈抽动,待流出液不再有血时,改为4%多聚甲醛灌注,待裸鼠两前肢及两肺变白,后肢绷直,尾部竖起成一直线时表明灌注成功。此时脑组织白而硬。用弯镊小心取出灌注后的脑组织,置4%甲醛溶液中过夜固定。
1.4.5病理形态学及免疫组化检查 将获取的全脑标本按裸鼠脑表面的接种穿刺点做横断面取材,脱水,石蜡包埋,厚1 μm切片,行以下检查:① 常规HE染色,光镜下观察;② 免疫组化检查。用SABC法观察GFAP及S-100蛋白表达情况。所有的标本均采用免疫组化ABC法进行染色。阴性对照切片的染色以PBS代替一抗,其余的步骤和方法与阳性对照切片相同。阳性强度判断标准是以细胞质内出现浅棕色细颗粒为弱阳性,以细胞质内出现深棕色粗颗粒为强阳性,中度阳性则介于二者之间。
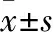
2 结果
2.1荷瘤裸鼠一般状况本实验接种人脑胶质瘤细胞U87-MG的18只裸鼠接种后全部存活,且穿刺点无出血感染,也未出现手术损伤神经的症状。实验组自接种后2 d起逐渐恢复正常觅食、饮水;接种后7 d,B、C组肉眼可见小瘤结节,生存状态良好,体质量上升。各组裸鼠生活状态见Tab 1。
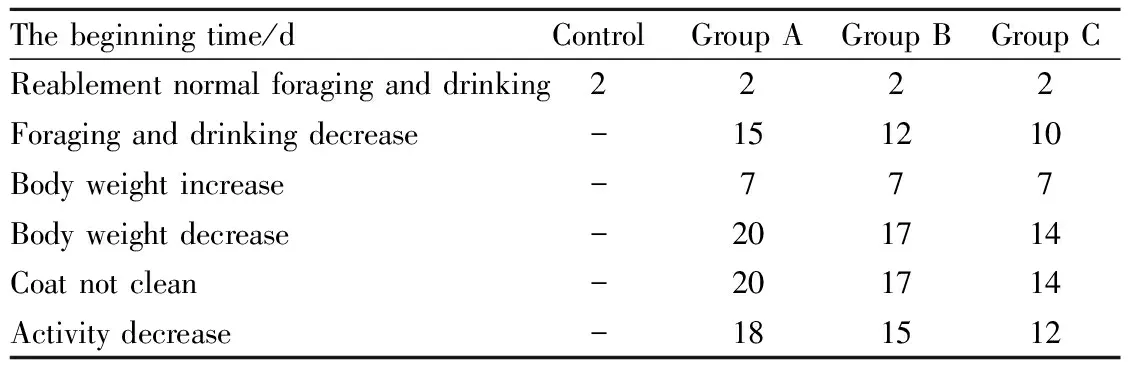
Tab 1 The living condition of rats
2.2裸鼠的生存时间对照组裸鼠一直存活。3组接种U87-MG的裸鼠中,A组裸鼠最长活到了50 d,平均生存时间(46.50±3.27) d;B组裸鼠最长活到了42 d,平均生存时间(38.50±3.28) d,A组与B组生存时间比较差异有显著性(P<0.05);C组裸鼠最长活到了34 d,平均生存时间(30.67±3.51) d,B组与C组生存时间比较差异有显著性(P<0.05),见Tab 2。
Tab 2 Survival time of nude n=5)
*P<0.05vsgroup A;#P<0.05vsgroup B
2.3荷瘤裸鼠的MRI扫描结果及肿瘤体积各组裸鼠接种7 d时T1加权TSE增强扫描发现,B、C组裸鼠脑内有异常信号,接种14 d与21 d的增强扫描均显示接种肿瘤显像清楚,呈高信号,大小和位置非常明确,同周围正常脑组织有明显差异,28 d肿瘤生长更快,均可准确测得其横断面、冠状面和矢状面3个方向上的最大径(Fig 1)。肿瘤呈圆形或类圆形肿块,肿瘤较大时其内可有坏死和出血信号,占位效应表现为中线结构向对侧移位,同侧脑室受压扩大移位。通过公式计算出肿瘤成像的体积见Tab 3。
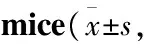
Tab 3 Tumour volume of nude n=5)
**P<0.01vsgroup A;##P<0.01vsgroup B
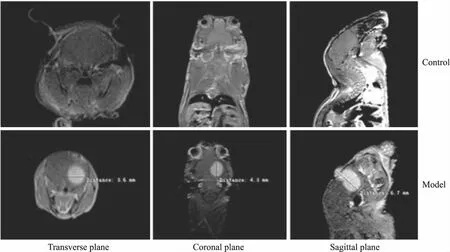
Fig 1 MRI of gliomas in nude mice
2.4病理解剖学检查经心脏灌注固定的模型组裸鼠脑组织内均可见瘤组织形成,移植瘤组织位于右大脑实质内,呈圆形或椭圆形浸润生长,较周围正常组织颜色深,边界清晰,周边脑组织肿胀,瘤体较大时可见中线向对侧移位,切面可见肿瘤内出血和坏死。其他脏器未见转移。
2.5移植瘤的HE染色HE染色切片光镜下可见,造模14 d的裸鼠肿瘤均有胶质瘤细胞和栅栏状坏死,此为胶质瘤的特征。瘤细胞呈长梭形和星形,胞核大而圆,核深染,病理性核分裂象多见,偶见双核,瘤组织内有出血和坏死以及丰富的微血管。肿瘤细胞排列密集,常围绕小血管呈局灶性浸润性生长,生长活跃,排列呈束状、小团块状。肿瘤区染色较周围正常脑组织深,与正常组织交界处虽能见到肿瘤细胞浸润,但仍能见到一个较明显的界线(Fig 2)。
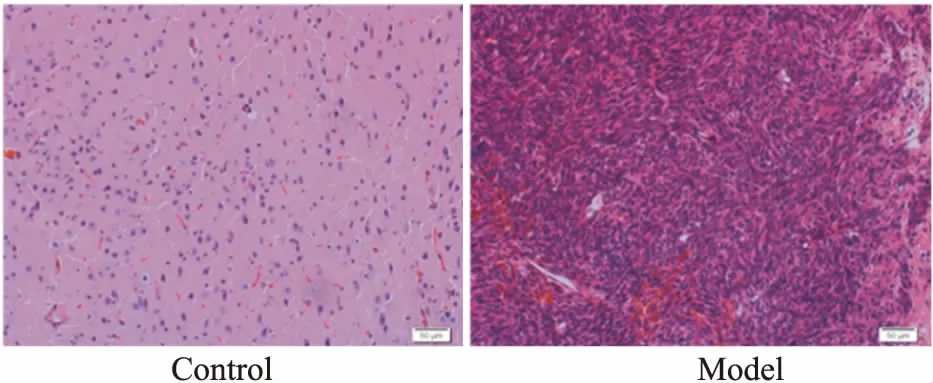
Fig 2 Morphology of gliomas in nude mice (×400)
2.6移植瘤的免疫组化染色GFAP是星形细胞胶质瘤的特异性表达蛋白,S-100也是脑肿瘤诊断的免疫学标记蛋白[1]。造模14 d的裸鼠脑内移植胶质瘤免疫组化染色结果中,瘤细胞胞质呈GFAP阳性表达(Fig 3),胞质/胞核呈S-100阳性表达(Fig 4),说明裸鼠从造模14 d开始便形成了有人脑神经胶质瘤特性的脑肿瘤。
3 讨论
本模型制备的结果受多种因素的影响,为保证造模成功,造模过程要注意:① 保证细胞活力及接种数量。保证细胞计数准确,尽量使细胞悬液的制备和裸鼠的麻醉、消毒、固定定位同时进行,以保证细胞悬液在最短时间内接种至裸鼠体内。另外,整个接种过程中要将细胞悬液置于冰上保存,用时摇匀,避免细胞贴壁、堆积,保持浓度均匀。② 选择合适的接种部位。我们将人脑胶质瘤细胞U87-MG接种于裸鼠右侧大脑尾状核,坐标为前囟中点前 1 mm、矢状缝向右旁开2.5 mm,深度为硬膜下3 mm。选择此注射点的目的是保证肿瘤能在该位点的前后、左右、上下方向有足够的生长空间,从而保证肿瘤生长的大小和良好的生长形态。采取立体定向仪下准确的定位,既保证足够的深度,又防止肿瘤细胞进入侧脑室。③ 防止肿瘤细胞沿针道扩散。我们采用进针3.5 mm、回退0.5 mm的方法,保证足够的接种空间;0.5 μL·min-1的缓慢注射速度、注射后停针2 min和骨蜡封闭骨孔的方法,防止细胞悬液外溢,保证准确的细胞接种数量。④ 防止动物模型感染。整个手术过程在层流超净台进行,术前75%乙醇消毒头顶部皮肤,术后碘酒消毒伤口。本实验建立人脑胶质瘤原位移植裸鼠模型的关键在于准确定位接种点和严格控制接种量,同时要特别注意注射和拔针的速度以及停针时间。只有保证了瘤细胞的接种位置和接种数量的一致性,才能确保移植瘤生长的一致性、稳定性和可比性。实验采用的动物为免疫缺陷动物,饲养环境要求高,实验费用较高。
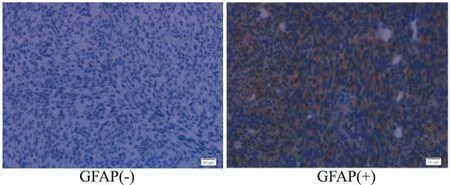
Fig 3 GFAP protein expression in gliomas of nude mice by immunohistochemical staining (×400)
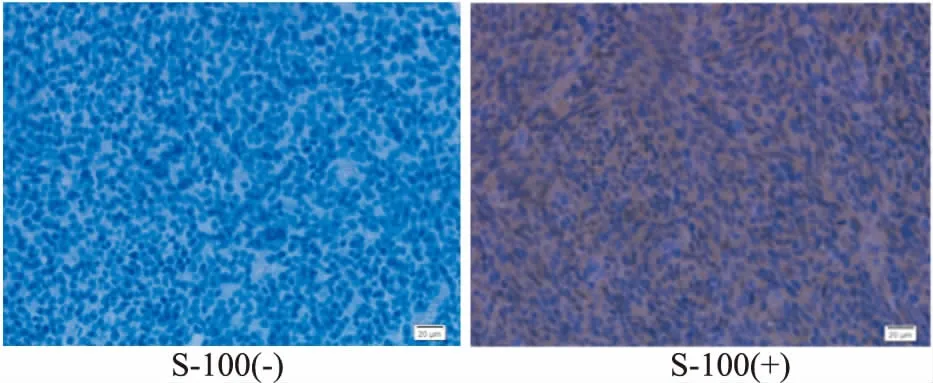
Fig 4 S-100 protein expression in gliomas of nude mice by immunohistochemical staining(×400)
文献报道的人脑胶质瘤裸鼠原位移植模型通常采用培养细胞悬液或肿瘤组织经消化后处理成的细胞悬液颅内注射法,其成功率仅为70%[3]。本实验结合前人的造模经验,借助立体定向仪的辅助,在预实验结果的基础上,改进并确定了最终造模条件,采用此方法,本研究中18只裸鼠造模后全部成瘤,移植成瘤率100%。说明实验范围内的接种数量与模型制备的成功率无关,但实验范围内各组部分时段肿瘤的体积差异有显著性,可根据实验的不同研究需要,选择不同的细胞接种数量。肿瘤颅内生长稳定,接种后相同时间肿瘤大小和形态相似,都表现为类圆形,肿瘤生长特性及病理特性与人脑胶质瘤相似,具有分化程度低、微血管丰富、生长速度快等特点,初期以针道的上下方向生长明显,后期则以前上至后下的大脑纵轴方向生长较为明显,符合该部位裸鼠脑的解剖学特征。早期荷瘤裸鼠体质量呈轻微的上升趋势, A、B和C组裸鼠分别从接种后20 d、17 d和14 d开始体质量下降,14 d后肿瘤的体积开始迅速增长,提示裸鼠体质量一旦出现明显下降趋势,则意味着肿瘤已生长进入中后期。就生存时间来说,A组(1.5×105)生存时间较长,且和B组(2.0×105)相比,差异有统计学意义,C组(2.5×105)生存时间较短,这主要是因为接种细胞量不同。免疫组化标记所有裸鼠肿瘤均有GFAP和S-100蛋白阳性表达;HE染色可观察到移植瘤在脑实质内呈高度浸润性生长、无包膜形成、血管丰富、瘤细胞异型性明显,均符合星形细胞来源特点。3组裸鼠均于接种U87-MG细胞后14 d即可见脑胶质瘤形成,随后肿瘤生长明显加快,21 d时肉眼可见肿瘤的生长已冲破颅骨而凸显出来,裸鼠出现偏瘫、弓背、激惹、癫痫等神经症状,28 d后裸鼠陆续出现死亡,与临床具有良好的模拟性。根据本模型的生物学特性,提示接种后14 d左右为利用此模型的最佳时期。我们利用此方法造模14 d后的实验模型开展了抗肿瘤药对脑胶质瘤治疗作用的研究,取得的结果进一步证明了该造模方法的稳定性和可重复性。本实验建立的人脑胶质瘤裸鼠原位移植模型造模方法成瘤率高、重复性好、实验周期短、移植瘤生长稳定、颅外远隔部位转移率低,诱导的肿瘤生长符合人脑胶质瘤的生物学特性,可为模拟人脑胶质瘤微环境,更好地研究人脑胶质瘤的发病机制,探寻各种实验性治疗方法,以及筛选有效的抗胶质瘤新药提供理想的动物模型。
(致谢:本实验于空军军医大学动物中心、空军军医大学西京医院放射科和药剂科新药研发中心完成。感谢课题组成员提供的大力帮助。)
参考文献:
[1] Weiss W A, Burns M J, Hackett C, et al.Genetic determinants of malignancy in a mouse model for oligodendroglioma[J].CancerRes, 2003,63(7): 1589-95.
[2] 黄 强.胶质瘤干细胞研究的现状与未来[J].中华神经医学杂志,2007,6(9): 865-8.
[2] Huang Q.Glioma stem cells: current situation and prospects[J].ChinJNeuromed, 2007,6(9):865-8.
[3] Antunes L, Angioi-Duprez K S, Bracard S R, et al.Analysis of tissue chimerism in nude mouse brain and abdominal xenograft models of human glioblastoma multiforme: what does it tell us about the models and about glioblastoma biology and therapy[J]?JHistochemCytochem, 2000,48(6): 847-58.
[4] Brekken C, Bruland S, de Lange Davies C.Interstitial fluid pressure in human osteosarcoma xenografts: significance of implantation site and the response to intratumoral injection of hyaluronidase [J].AnticancerRes, 2000,20(5B): 3503-12.
[5] 崔白苹,陈 平,孙安阳.脑转移瘤动物模型的制备方法及研究进展[J].中国药理学通报,2016,32(3):304-9.
[5] Cui B P, Chen P, Sun A Y.Animal models of brain metastasis: preparation methods and research progress [J].ChinPharmacolBull, 2016,32(3):304-9.
[6] 徐承平,卞修武.人CHG-5胶质瘤细胞裸鼠原位移植模型的建立及其生物学特性分析[J].第三军医大学学报, 2003,25(4):287-90.
[6] Xu C P, Bian X W .Establishment of orthotopic implantation model of human CHG-5 glioma cell line in nude mice and analysis of its biological features[J].2003,25(4):287-90.
[7] 余永强,陈 骏,钱银锋,等.立体定向建立人鼠C6脑胶质瘤模型[J].中国药理学通报,2003,19(2):222-5.
[7] Yu Y Q,Chen J,Qian Y F,et al.Establishment of rat C6 glioma model by intracranial injection[J].ChinPharmacolBull,2003,19(2):222-5.