海带多糖对脂多糖致慢性炎症大鼠血管内皮的保护作用
王靳琎,杨晓梅,苏丽万,钱 航,谢 露
(1.广西医科大学生理学教研室,广西 南宁 530021;2.湖北医药学院附属东风医院实验中心,湖北 十堰 442000)
动脉粥样硬化(atherosclerosis,AS)是目前严重威胁人类健康和生命的一种慢性疾病,而内皮功能障碍被认为是AS启动的关键环节。其病理基础是血管内皮细胞(vascular endothelial cells,VECs)损伤后,引发的一系列血管壁组织病理变化,而慢性炎症反应是AS形成的中心环节。因此,慢性炎症反应的调节可作为寻求抗AS药物研究的靶点。本课题组从广西北部湾海带中分离、提纯后得到一种含量较高的多糖组分L01,前期研究发现其具有抗凝和抗血栓形成作用,可对抗肾上腺素对VECs的损伤,保护VECs结构完整性,并能维持心理应激大鼠动脉内皮依赖性血管舒张功能[1-2],这些均提示L01在防止心血管疾病方面具有潜在价值。因此,我们假设L01对VECs的保护作用也与影响炎症反应有关,本研究以大鼠尾静脉间断注射小剂量脂多糖(lipopolysaccharide,LPS)制备慢性炎症模型,观察海带多糖L01对慢性炎症模型大鼠的内皮炎症因子及内皮源性舒张因子的影响,探讨其对血管内皮的保护作用。
1 材料
1.1动物SPF级SD大鼠,♀♂各半,体质量(190±10)g,由广西医科大学实验动物中心提供,动物合格证号:SYXK桂014-0003。
1.2药品与试剂海带多糖由本课题组自行提取,其糖含量占71.0%,硫酸根含量为83.28 mg·g-1,无菌生理盐水稀释过滤后备用。大肠杆菌脂多糖(血清型O55:B5),购自美国Sigma公司;大鼠超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)ELISA试剂盒,购自美国CLOUD-CLONE CORP公司;TRIzol Reagent购自美国Life Technologies公司;逆转录试剂盒购自美国赛默飞公司;PCR引物,由上海生工生物工程公司合成;2×Taq PCR Master Mix,购自北京天根生化科技有限公司。
1.3仪器全自动样品快速研磨仪(上海净信科技公司);台式低温离心机(德国Eppendorf公司);PCR仪(美国Life Technologies公司);紫外可见分光光度计(日本日立公司)。
2 方法
2.1海带多糖L01的提取按本实验室报道方法[3],使用酶解碱浸法消化海带细胞壁纤维素,提取胞壁多糖,并进一步采用DEAE-纤维素柱层析法,从海带胞壁多糖中分离纯化得到新的单一组分海带多糖L01。
2.2慢性炎症大鼠模型制备及方法可行性验证SD大鼠40只随机均分为对照组、LPS 1周组、LPS 2周组、LPS 3周组、LPS 4周组(分别用LPS处理1、2、3、4周),除对照组外,各LPS组大鼠按照分组设定的处理时限,尾静脉注射LPS(0.4 mg·kg-1),每周1次,对照组大鼠同法尾静脉注射等体积无菌生理盐水,观察各组大鼠的存活情况。分别于第1、2、3、4周末,将对应组大鼠进行全血白细胞(white blood cell,WBC)计数和血清hs-CRP测定,验证其炎症状态。
2.3分组与给药48只大鼠随机均分为6组,分别为对照组,LPS组,LPS+DXM(10 mg·kg-1)组, LPS+L01高、中、低剂量(50、30、10 mg·kg-1)组。除对照组外,其他各组大鼠尾静脉注射LPS(0.4 mg·kg-1)无菌生理盐水溶液,每周1次,共计4周。首次注射LPS后次日,各给药组开始腹腔注射相应剂量DXM或L01,对照组、LPS组腹腔注射生理盐水,每天1次,共4周。
2.4标本采集与指标检测
2.4.1样本采集 末次给药后,各组大鼠腹腔注射体积分数为0.1的水合氯醛(3 mL·kg-1)麻醉,大鼠仰卧固定于手术台上,正中切口打开腹腔,拨开覆盖下腔静脉的脏器,清晰暴露出血管,于下腔静脉穿刺取血,用于全血WBC计数和血清hs-CRP测定。钝性分离主动脉,置于冰生理盐水中,清洗血液,同时迅速去除血管周围组织,放入洁净EP管中,放置于-80℃超低温冰箱保存,用于抽提血管总RNA。
2.4.2全血WBC计数及血清hs-CRP、eNOS、iNOS测定 取全血20 μL,加入白细胞稀释液380 μL,充分混匀后充入细胞计数板进行WBC计数。全血标本离心后,取上层血清,采用ELISA检测试剂盒检测hs-CRP、eNOS、iNOS含量,检测方法按照试剂盒说明书操作。
2.4.3RT-PCR检测血管中 eNOS、iNOS、COX-2 mRNA表达 取约50 mg血管加入1 mL TRIzol,放置在冰上,用匀浆机进行匀浆处理。TRIzol法提取总RNA,按照逆转录试剂盒操作步骤合成cDNA。以目的基因与内参基因β-actin的比值作为基因的相对表达量。引物序列见Tab 1。
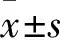
Tab 1 Primer sequence, amplification product length of RT-PCR reaction
3 结果
3.1大鼠慢性炎症模型验证尾静脉注射LPS 4周内,全部大鼠均存活,LPS给药结束后,大鼠全血WBC总数与血清hs-CRP质量浓度均明显增加并维持在较高水平,与对照组比较差异有显著性(P<0.01),且LPS 4个时间段组之间差异无统计学意义,提示每周尾静脉给与LPS制备大鼠慢性炎症模型是可行的(Fig 1)。
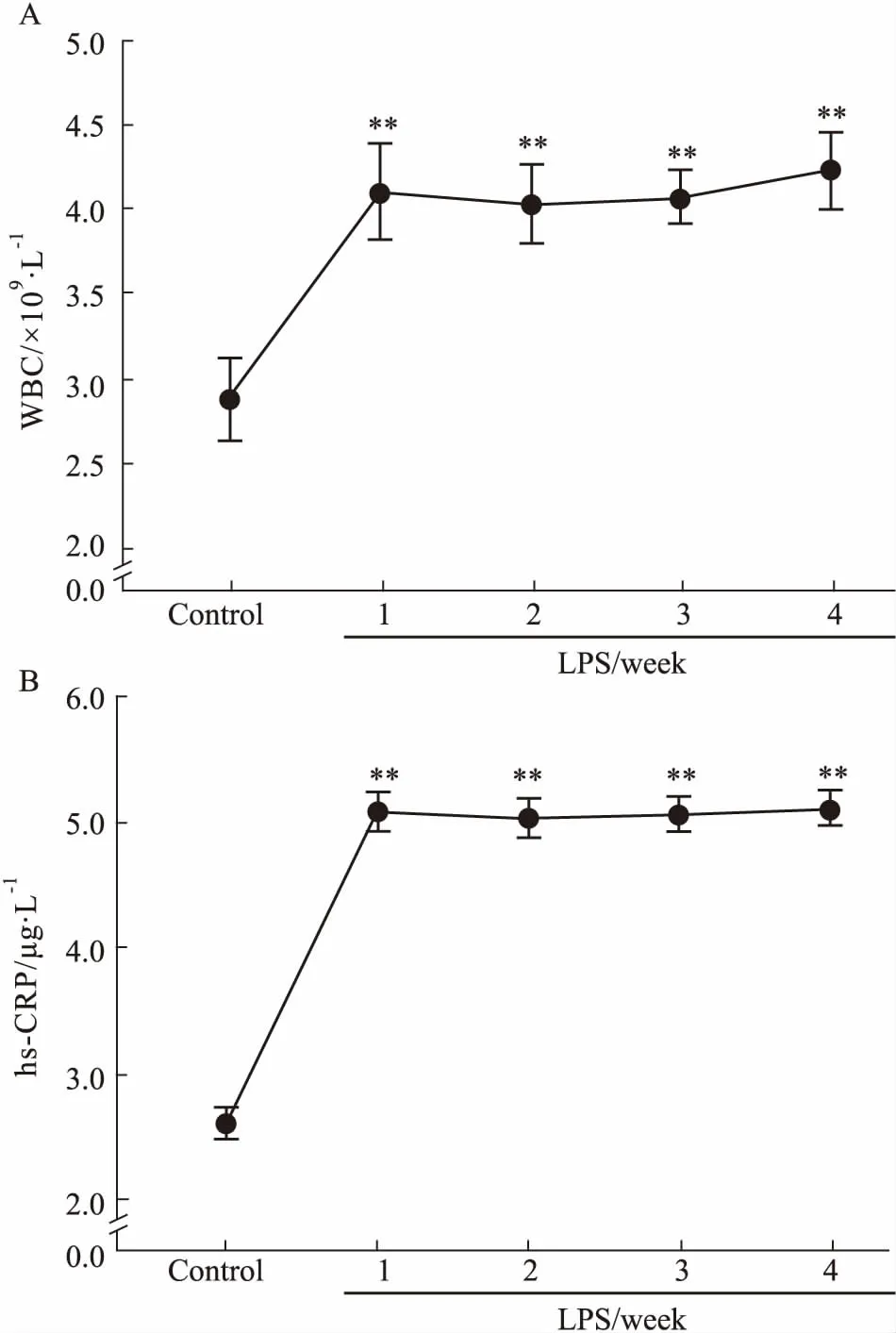
Fig 1 Peripheral blood leukocyte number(A) and level of serum hs-CRP(B) in rats with chronic n=8)
**P<0.01vscontrol group
3.2海带多糖L01对全血WBC数与血清hs-CRP水平的影响如Fig 2所示,与对照组比较,LPS组大鼠全血WBC计数与血清hs-CRP水平明显升高(P<0.01)。与LPS组比较,DXM和L01高剂量都能明显抑制LPS引起的全血WBC增多(P<0.05),L01中、低剂量虽然也有降低全血WBC作用,但与LPS组比较无统计学意义。DXM和L01高、中、低剂量都能明显抑制LPS引起的血清hs-CRP水平升高(P<0.01)。
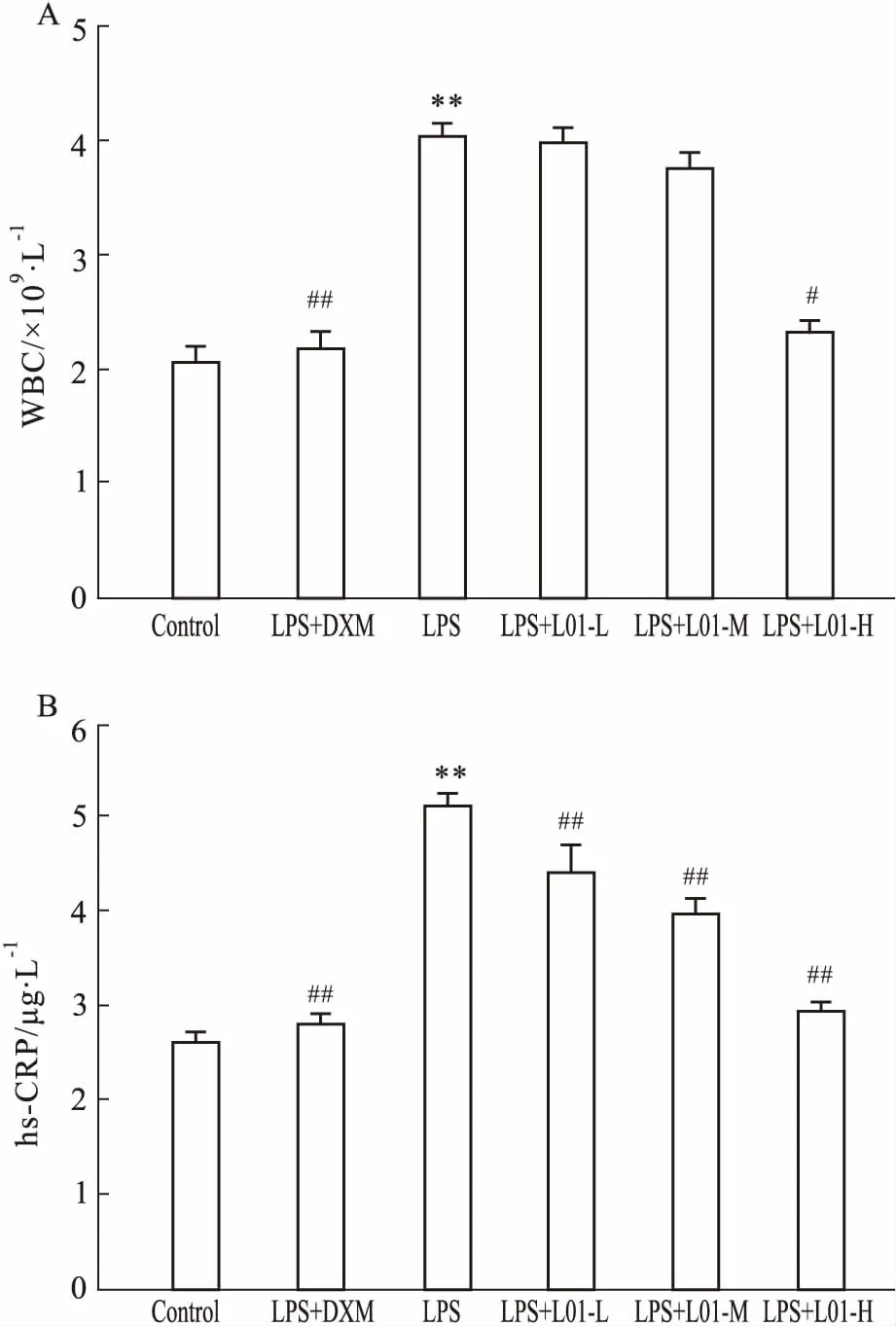
Fig 2 Effects of L01 on total number of peripheral blood leukocyte number(A) and level of serum hs-CRP(B) in rats
**P<0.01vscontrol group;#P<0.05,##P<0.01vsLPS group
3.3海带多糖L01对血清eNOS、iNOS水平的影响如Fig 3所示,与对照组比较,LPS组大鼠血清eNOS水平明显降低(P<0.01),iNOS水平明显升高(P<0.01)。与LPS组比较,DXM和L01高、中剂量明显抑制LPS引起的血清eNOS水平降低(P<0.01)。DXM和高剂量L01明显抑制了LPS引起的血清iNOS水平升高(P<0.01)。L01中、低剂量虽然也可降低血清iNOS水平,但与LPS组比较差异无统计学意义。
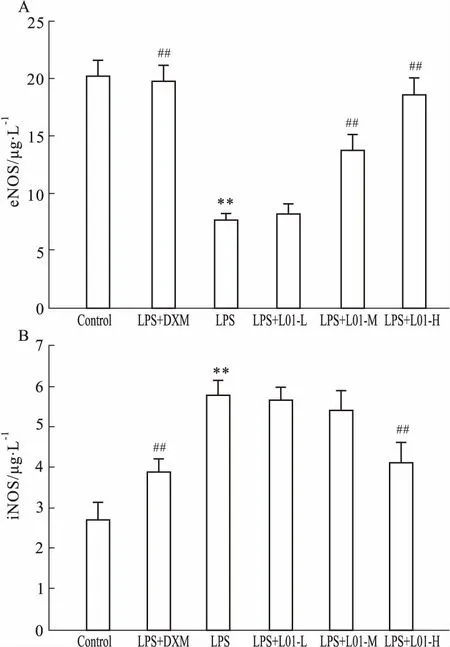
Fig 3 Effects of L01 on level of serum eNOS(A) and level of serum iNOS(B) in rats with chronic
**P<0.01vscontrol group;##P<0.01vsLPS group
3.4海带多糖L01对主动脉eNOS、iNOS、COX-2基因表达的影响如Fig 4所示,与对照组比较,LPS组大鼠主动脉eNOS基因表达明显下调(P<0.01), iNOS、COX-2基因表达明显上调(P<0.01)。与LPS组比较,DXM和L01高、中、低剂量明显抑制LPS引起的eNOS基因表达下调(P<0.01),以及iNOS、COX-2基因表达上调(P<0.05)。
4 讨论
慢性炎症反应是导致血管内皮功能紊乱的主要因素。革兰阴性杆菌感染及其诱导的内毒素血症是引发和加重多种慢性炎症疾病的主要原因,其菌体细胞壁的LPS是内毒素的主要成分[4],由 LPS介导的病理与生理变化在慢性炎症的发生、发展过程中至关重要。目前,国内外公认的建立慢性炎症模型的方法是间断尾静脉注射小剂量LPS[5]。许多实验表明,全血WBC计数与血清hs-CRP水平可作为评估LPS诱导炎症发生的指标[6-7]。本实验中,注射LPS后第1周末即出现WBC总数明显增加,以及循环中重要的炎性细胞因子hs-CRP水平的明显上升。
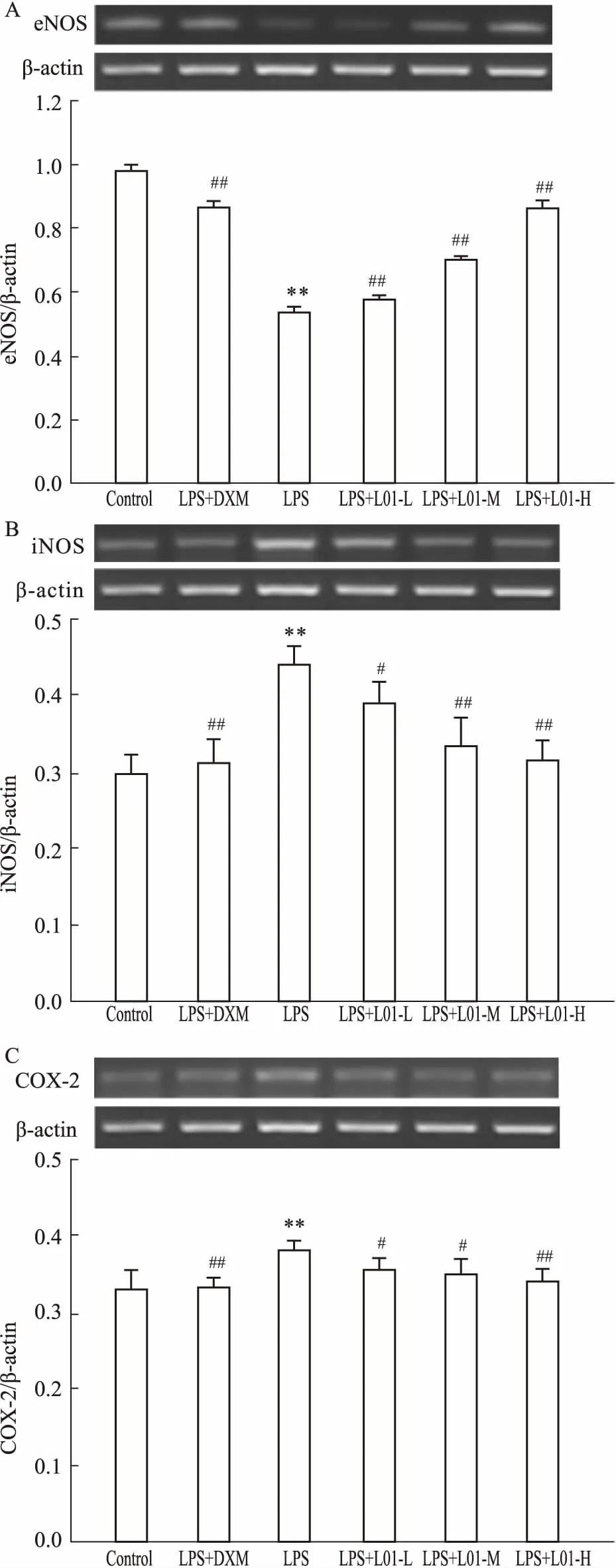
Fig 4 Effects of L01 on expression of eNOS(A), iNOS(B) and COX-2(C) mRNA in aorta in rats with
**P<0.01vscontrol group;#P<0.05,##P<0.01vsLPS group
随后3周WBC总数和血清hs-CRP水平虽有所下降,但仍维持较高的水平,且LPS给药组的4组之间差异无统计学意义,以上表明炎症持续存在并有慢性化的征象。慢性炎症的病程一般持续几周甚至数月,这些均提示以0.4 mg·kg-1LPS间断尾静脉注射4周制备SD大鼠慢性炎症模型是可行的。
AS的病理基础是内皮功能失调,而炎症反应是AS形成的中心环节。在慢性炎症过程中,调节NO等舒张因子是治疗心血管疾病的关键[8]。一氧化氮合酶是体内的NO合成关键酶,可以调节NO的生成、维持正常水平的NO浓度和内皮功能,其主要分为eNOS和iNOS。目前,抗炎药物对血管内皮功能有一定的调节作用,且表现出一定的抗AS作用,如甾体抗炎药DXM。因此,本实验选择DXM作为药物对照组[9]。
eNOS表达水平的变化是影响内皮NO产生的重要因素。血管内皮释放的NO可以使平滑肌松弛、动脉血管扩张,从而调节血流的分布[10],这些均有利于阻止AS的发生发展。eNOS活性降低时,NO产生减少,血小板易于黏附聚集,血管收缩,动脉内血栓形成,促使AS的发生和发展。本实验中,LPS组大鼠血清和主动脉eNOS水平明显低于正常组,L01给药治疗后明显提高了eNOS水平。正常情况下iNOS并不表达,一些外源刺激如干扰素类、炎症因子等都可激活iNOS[11]。LPS是最主要的iNOS诱导剂。本实验中,大鼠在LPS刺激下,血清和主动脉iNOS水平均明显升高。LPS是在DNA转录水平对iNOS的表达进行调控,该过程中iNOS表达及活性增加,诱导产生大量超出生理浓度的NO,使得过氧化硝酸盐的形成增加,导致血管一定程度的损伤,进而促进了AS的发展[12]。本实验中,L01给药治疗后明显降低了iNOS mRNA的表达水平。
COX-2是一种启动炎症反应的关键诱导型合酶。当COX-2被诱导大量生成与表达时,慢性炎性反应将被放大和增强[13-14]。COX-2可诱导血管生长因子的合成,使得新生血管增多,从而促进了粥样斑块病变的发生与发展。在整个炎症的发生与消退修复过程中,可见COX-2大量、持续的表达。本实验中,LPS组主动脉COX-2 mRNA水平明显升高,L01治疗性给药后能明显抑制这种现象。
综上所述, 海带多糖L01可明显改善血管内皮的依赖性舒张功能,其作用机制可能在于L01能明显提高eNOS mRNA的表达,降低炎症时活跃的iNOS mRNA表达。
参考文献:
[1] 谢 露,刘爱群,黎 静.海带多糖对肾上腺素致血管内皮细胞损伤的防护作用[J].中国应用生理学杂志, 2007,23(2):143-6.
[1] Xie L, Liu A Q, Li J.The protective effect of polysaccharide extracted from Laminaria japonica aresch on vessels endothelial cell injury inducing by adrenaline [J].ChinJApplPhysiol, 2007,23(2):143-6.
[2] 王界年,王圣泳,沈 斌.海带多糖对肾上腺素代谢产物损伤血管内皮依赖性舒缩功能的影响[J].中国药理学通报, 2012,28(3):351-4.
[2] Wang J N, Wang S Y, Shen B.Effect of Laminaria polysaccharide on the vascular endothelium-dependent relaxation and contraction injured by the metabolic product of adrenaline[J].ChinPharmacolBull, 2012,28(3):351-4.
[3] Xie L, Chen M H, Li J.Antithrombotic effect of a polysaccharide fraction from Laminaria japonica from the south China sea[J].PhytotherRes, 2011,25(9):1362-6.
[4] 袁 琴,袁 丁,周志勇.竹节参齐墩果烷皂苷对RAW264.7巨噬细胞SIRT1活性影响及抗炎作用研究[J].中国药理学通报, 2016,32(3):349-54.
[4] Yuan Q, Yuan D, Zhou Z Y.Anti-inflammatory effect of Chikusetsu oleanane saponin on RAW264.7 cell through regulating SIRT1 activity [J].ChinPharmacolBull, 2016,32(3):349-54.
[5] 邓家刚,阎 莉,卫智权.间断注射小剂量脂多糖建立大鼠的慢性炎症模型[J].华西药学杂志,2012,27(3):289-91.
[5] Deng J G, Yan L, Wei Z Q.Establishing a chronic inflammation model in rats by low dose intermittent injection of lipopolysaccharide[J].WestChinaJPharmSci, 2012,27(3):289-91.
[6] Pan A, Wang Y, Yuan J M.High-sensitive C-reactive protein and risk of incident type 2 diabetes: a case-control study nested within the Singapore Chinese Health Study [J].BMCEndocrDisord, 2017,17(1):8.
[7] Cavric G, Mihalic S N, Tesanovic S J.Relationship between polymorphonuclear leukocyte count in bronchoalveolar lavage fluid and bacterial content in Gram’s stain and bacterial content in final microbiological report [J].CollAntropol, 2010,34(1): 1-6.
[8] 袁文金,李玉光,谭学瑞.一氧化氮的抗炎作用与动脉粥样硬化[J].中国病理生理杂志,2003,19(9) :1276-8.
[8] Yuan W J, Li Y G, Tan X R.Anti-inflammatory effect of nitric oxide and atherosclerosis [J].ChinJPathophysiol, 2003,19(9):1276-8.
[9] 赵莉萍.一氧化氮在双氯芬酸钠肝损伤大鼠中的作用及地塞米松的影响研究[D].合肥:安徽医科大学, 2012.
[9] Zhao L P.The effect of nitric oxide on diclofenac-induced acute liver injury in rats and the influence of dexamethasone[D].Hefei: Anhui Medical University, 2012.
[10] Wadham C, Parker A, Wang L.High glucose attenuates protein S-nitrosylation in endothelial cells: role of oxidative stress [J].Diabetes, 2007,56(11):2715-21.
[11] 袁小媚,雷 寒,夏 勇.HSP70抑制剂PFTμ对干扰素γ诱导的iNOS表达的研究[J].中国药理学通报, 2016,32(3):390-4.
[11] Yuan X M, Lei H, Xia Y.Effects of HSP70 inhibitor on expression of iNOS induced by IFN-γ[J].ChinPharmacolBull, 2016,32(3):390-4.
[12] 李 岩,邝枣园,李 明.黄芩苷对脂多糖诱导巨噬细胞一氧化氮和一氧化氮合酶表达的影响[J].广东医学, 2010,31(6):675-7.
[12] Li Y, Kuang Z Y, Li M.Baicalin inhibits LPS-induced iNOS expression in macrophages[J].GuangdongMedJ, 2010,31(6):675-7.
[13] Wu C Y, Chi P L, Hsieh H L.TLR4-dependent induction of vascular adhesion molecule-1 in rheumatoid arthritis synovial fibroblasts: roles of cytosolic phospholipase A(2)alpha/cyclooxygenase-2[J].JCellPhysiol, 2010,223(2):480-91.
[14] 王 晶,丁少帧,胡 翠.同型半胱氨酸对实验性结肠炎模型中COX-2及5-LOX表达的影响[J].中国药理学通报, 2017,33(11):1627-8.
[14] Wang J, Ding S Z, Hu C.Effects of homocysteine on expression of COX-2 and 5-LOX in experimental colitis rat model[J].ChinPharmacolBull, 2017,33(11):1627-8.