补骨脂素对前列腺癌LNCaP-AI细胞增殖和周期调控及雌激素受体β表达的影响
李少鹏 蔡建通 翁铭芳 游翰林 陈书尚 吴卫真
前列腺癌高居美国男性死亡首位,在我国的发病率逐年上升[1]。在前列腺癌的临床治疗中,早期的去势治疗非常有效,但是经过一段时间的激素治疗,多数患者转变为雄激素抵抗性前列腺癌(castrationresistant prostate cancer,CRPC),目前临床上仍缺乏有效的治疗措施[2]。因此,寻找前列腺癌治疗的新型药物将是提高前列腺癌患者治疗效果、延长患者寿命的关键。越来越多的证据表明,雌激素及其受体对于前列腺癌的发展和发作起着重要作用,成为近年来前列腺癌的研究热点之一[3-5]。研究表明,补骨脂素是一种重要的植物雌激素,通过雌激素受体(estrogen receptor,ER)介导发挥作用。本研究观察了补骨脂素在体外对雄激素非依赖性前列腺癌LNCaP-AI[6-7]细胞增殖、周期变化和细胞增殖相关蛋白Ki67表达的影响,并通过检测LNCaP-AI细胞中雌激素受体β(ERβ)的表达情况,探讨其作用机制。
材料与方法
一、材料
补骨脂素(中国西亚公司),胎牛血清(美国HyClone公司),兔抗人Ki67抗体和兔抗人ERβ抗体(美国 Abcam 公司),鼠抗人 β-actin抗体(美国Sigma公司),Western bright ECL蛋白显色液(美国Advansta公司),EvoScipt RNA SYBR Green I Master试剂盒(瑞士Roche公司),LNCaP-AI细胞(第二军医大学孙颖浩教授惠赠)。
二、方法
1.细胞培养及分组:LNCaP-AI细胞用含10﹪胎牛血清的DMEM培养液在37 ℃、5﹪ CO2、饱和湿度下培养,融合达80﹪时,以0.25﹪胰蛋白酶进行消化后传代,取对数生长期细胞进行实验。设空白对照组和不同终浓度补骨脂素组。
2. CCK-8试剂盒检测细胞增殖:待体外培养的LNCaP-AI细胞生长至80﹪融合时,用胰蛋白酶消化细胞,移液枪吹打均匀,普通光学显微镜下计数,细胞以5×103个/孔接种于96孔板,培养8 ~ 12 h,分别加入不含补骨脂素细胞培养液、含10,30,50,100 μg/ml补骨脂素的细胞培养液 100 μl,每个浓度设置 5 个复孔。分别培养 24,48,72,96 h后,吸弃培养基,加PBS洗涤1 次,每孔加入10 μl CCK- 8+ 90 μl细胞培养液,以无细胞的空白孔加入10 μl CCK-8+ 90 μl细胞培养液为空白对照,于 2 h后用多波长酶标仪在450 nm处检测吸光度。以细胞存活率(T/C﹪)=(实验组细胞OD/对照细胞OD)×100﹪计算细胞的存活率。
3. Western blot法检测Ki67蛋白表达:LNCaPAI细胞悬浮后接种,按分组加入不同终浓度补骨脂素(0,30,50,100 μg/ml),培养 48 h,收集细胞,加入细胞裂解液,提取总蛋白并测定蛋白浓度。取等量蛋白,95 ℃水浴15 min,使蛋白充分变性,经聚丙烯酰胺凝胶电泳分离,电转至预先用甲醇活化的PVDF膜,5 ﹪牛奶4 ℃封闭1 h,根据检测目的,分别加入用封闭液稀释的一抗(Ki67、β-actin)4 ℃孵育过夜,TBST洗涤后,二抗室温孵育1 h,洗膜后滴加ECL蛋白显色液显色。取目标条带测灰度值,所有实验均重复3次。
4.流式细胞术检测细胞周期:LNCaP-AI细胞传代,待 8 ~ 12 h细胞贴壁,分别加入含 0,10,30,50,100 μg/ml补骨脂素的细胞培养液 12 ml,分别培养48 h后,胰蛋白酶消化细胞,离心后加入预冷的无水乙醇,4 ℃下固定 24 h,离心洗涤,加入 500 μl PBS+5 μl PI+25 μl RNase,震荡悬浮后按照流式细胞仪检测程序检测各组细胞周期。
5.实时定量RT-PCR检测ERβ mRNA表达:LNCaP-AI细胞悬浮后接种,分别加入不同终浓度补骨脂素(0,30,50,100 μg/ml),培养 48 h,收集细胞。采用一步法荧光定量PCR检测LNCaP-AI细胞ERβ mRNA表达。步骤如下:收集2×106个细胞到离心管,加入裂解液裂解并静置后取上清液,过柱、洗涤,最后加入洗脱液50 μl,分别得到各组的总RNA模板。ERβ引物由中国华大基因公司合成(表1)。按照反应体系:PCR Grade Water 10 μl+Master 4 μl+Primer Mix 1 μl,分别加入各组的 RNA 模板。密封,离心后上机检测。数据分析采用美国Bio.Rad公司的Opticon Monitor Software 3.1版。根据标准品制作标准曲线,用ΔΔCt 值来统计比较不同实验组目的基因的表达情况。

表1 ERβ及内参β-actin的引物序列
三、统计学分析方法
采用SPSS 12.0软件分析处理数据。细胞增殖、Ki67蛋白表达和细胞周期等数据以±s表示,组间均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
结 果
一、不同时间点各组细胞增殖抑制率比较
培养 24、48、72 h的 CCK-8检测结果显示,各个作用时间段,LNCaP-AI细胞的存活率随补骨脂素的浓度增加而明显降低(P均< 0.01)。随培养时间增加,各浓度组LNCaP-AI细胞的存活率亦明显降低(P 均 < 0.05)(表2)。
表2 补骨脂素干预后不同时间培养的LNCaP-AI细胞生存率的变化(n = 18,﹪,±s)

表2 补骨脂素干预后不同时间培养的LNCaP-AI细胞生存率的变化(n = 18,﹪,±s)
二、Western blot法检测补骨脂素对LNCaP-AI细胞Ki67表达的影响
Western blot法检测结果显示,各浓度梯度的补骨脂素作用48 h后,LNCaP-AI细胞Ki67蛋白的表达均显著低于对照组,且随着补骨脂素浓度增高,Ki67蛋白表达量降低更明显(27.82 ± 0.55 vs 25.27 ± 0.62 vs 23.93±0.50 vs 22.54±0.59,F =28.59,P < 0.01)(图1)。
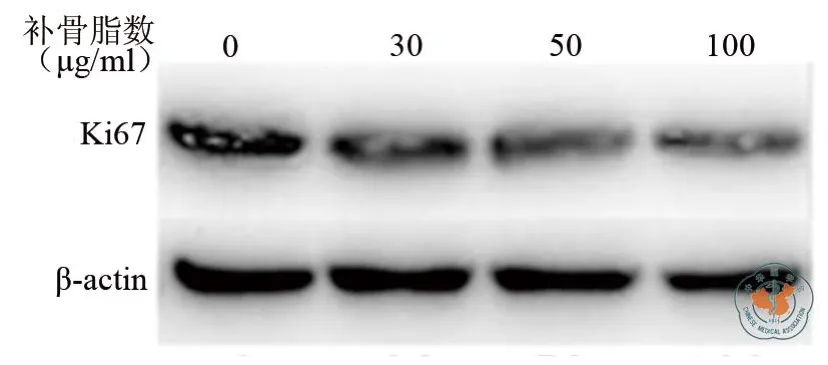
图1 不同浓度补骨脂素对LNCaP-AI细胞Ki67蛋白表达的影响
三、补骨脂素对LNCaP-AI细胞周期的影响
LNCaP-AI细胞与不同终浓度的补骨脂素共培养48 h后行流式细胞仪检测细胞周期,结果显示,随着药物浓度增高,G1期和G2期细胞均随之增多,而S期细胞则随之减少,差异均有统计学意义(F =38.26、216.63、153.58,P 均 < 0.01)(图2、表3)。提示补骨脂素将细胞阻滞于G1、G2期。
表3 流式细胞仪检测不同浓度补骨脂素对LNCaP-AI细胞周期的影响(﹪,±s)

表3 流式细胞仪检测不同浓度补骨脂素对LNCaP-AI细胞周期的影响(﹪,±s)
四、补骨脂素对LNCaP-AI细胞ERβ mRNA表达的影响
实时定量RT-PCR检测结果显示,终浓度分别为 30、50、100 μg/ml补骨脂素与 LNCaP-AI细胞共培养48 h后,随着药物浓度的增加,ERβ mRNA的表达量明显升高,差异有统计学意义(1±0 vs 2.197±0.225 vs 4.573±0.346 vs 6.590 ±0.334,F =264.09,P < 0.01)。
讨 论
常用的前列腺癌细胞株包括LNCaP、PC3和DU145。其中PC3和DU145为发生前列腺外转移的雄激素非依赖性细胞株[8]。LNCaP为雄激素依赖性,但经过雄激素剥夺诱导培养后,可转变为雄激素非依赖性,即为LNCaP-AI,表现为在含普通血清的培养基及含去雄激素血清的培养基中的细胞活力无明显差异[6-7]。LNCaP转变为LNCaP-AI的过程,类似于临床上前列腺癌经过去势治疗后,由雄激素依赖转变为CRPC的过程。因此在涉及CRPC这种难治性前列腺癌的相关基础研究中,LNCaP是一种理想的细胞模型。

图2 流式细胞仪检测不同浓度补骨脂素对LNCaP-AI细胞周期的影响
补骨脂素的抗肿瘤应用是近年来的研究热点之一。之前的研究发现,补骨脂素能有效抑制雄激素依赖性LNCaP-AD细胞增殖,且该抑制作用呈明显的浓度—时间关系[9]。本研究通过CCK-8检测进一步发现,补骨脂素对LNCaP-AI也具有类似的细胞增殖抑制作用。本研究还检测了补骨脂素对LNCaP-AI细胞Ki67表达的影响。Ki67是一种核抗原,在细胞的G0期不表达,只有在进入细胞周期(G1、S、G2和M)才表达,是反映肿瘤细胞增殖活性的标记物,其过量表达与多种恶性肿瘤的转移及预后相关[10-11]。本研究中,补骨脂素可降低LNCaPAI细胞中Ki67的表达水平,其作用呈浓度依赖性,与CCK-8检测结果一致,进一步证实了补骨脂素对LNCaP-AI细胞的增殖抑制作用。由于临床上CRPC的治疗比雄激素依赖性前列腺癌治疗棘手得多,因此本研究的结果相对更具有临床意义。
细胞周期是指细胞从一次分裂完成到下一次分裂结束的全过程。细胞增殖周期的失控与恶性肿瘤的无限增殖密切相关,通过影响细胞周期抑制肿瘤细胞无限增殖是预防和治疗肿瘤的一种方法。细胞周期调控机制中包含2个重要的调控点,分别位于G1/S期、G2/M期之间期[12]。既往的研究已发现,补骨脂素可对多种肿瘤细胞造成周期阻滞,但细胞不同,阻滞阶段也不同[13]。本研究结果显示,补骨脂素可对LNCaP-AI的细胞周期产生影响,随着补骨脂素浓度的增加,位于G1、G2期的细胞百分比增加,提示补骨脂素对LNCaP-AI细胞周期的2个重要调控点均具有作用。
雌激素受体有ERα、ERβ两种亚型,对前列腺癌的作用截然相反[14]。ERα可促进前列腺癌发生和发展,而ERβ则是一种抑癌基因,具有抑制增殖和肿瘤转移的作用[14]。这方面的证据包括:ERβ表达较低的前列腺癌患者预后较差[15-16]、雷洛昔芬(一种ERβ激动剂)能明显抑制前列腺癌细胞的增殖和转移[17]、三羟异黄酮可通过ERβ抑制前列腺癌的侵袭和转移[18]。植物性雌激素与ERβ的亲和力要比与ERα的亲和力高10倍[19]。因此推测,作为一种植物雌激素,补骨脂素对LNCaP-AI细胞的作用可能与ERβ有关。本研究发现,补骨脂素在抑制LNCaP-AI细胞增殖的同时,可提高其ERβ的mRNA表达水平,提示补骨脂素对LNCaP-AI细胞的增殖抑制作用,可能通过ERβ而发挥作用。但补骨脂素是否激活ERβ,以及其促进ERβ mRNA表达的具体机制有待进一步研究。
本实验表明,不同浓度的补骨脂素可抑制LNCaP-AI细胞的增殖,成剂量—时间依赖性关系,且降低LNCaP-AI细胞的Ki67表达水平。其可能的作用机制是诱导细胞发生G1期、G2期阻滞来实现,并与补骨脂素上调LNCaP-AI细胞ERβ的mRNA表达水平有关。
1 Ma L, Liu W, Sun F. Primary malignant melanoma of the prostate[J].Int J Urol, 2010, 17(1):94-95.
2 Zarour L, Alumkal J. Emerging therapies in castrate-resistant prostate cancer[J]. Curr Urol Rep, 2010, 11(3):152-158.
3 Li LC, Chui R, Nakajima K, et al. Frequent methylation of estrogen receptor in prostate cancer: correlation with tumor progression[J].Cancer Res, 2000, 60(3):702-706.
4 Hariri W, Sudha T, Bharali DJ, et al. Nano-targeted delivery of toremifene, an estrogen receptor-alpha blocker in prostate cancer[J].Pharm Res, 2015, 32(8):2764-2774.
5 Nelson AW, Tilley WD, Neal DE, et al. Estrogen receptor beta in prostate cancer: friend or foe?[J]. Endocr Relat Cancer, 2014,21(4):T219-234.
6 孔德玉, 杨冬梅, 陈艳媛. 雄激素非依赖性前列腺癌LNCaP-AI细胞亚系模型的建立[J]. 吉林医药学院学报, 2012, 33(6):361-363.
7 韩阳军, 王冰, 蒙学冰. SATB1在人不同前列腺癌细胞系中表达的实验研究[J]. 中国性科学, 2016, 25(6):5-8.
8 赵丕文, 牛建昭, 王继峰, 等. 补骨脂素的植物雌激素作用及其机制探讨[J]. 中国中药杂志, 2008, 33(1):59-63.
9 Shi XB, Ma AH, Tepper CG, et a1. Molecular alterations associated with LNCaP cell progression to androgen independence[J]. Prostate,2004, 60(3):257-271.
10 陈书尚, 翁明芳, 王水良, 等. 补骨脂素对前列腺癌LNCap-AD细胞增殖的影响及其分子机制研究[J/CD]. 中华细胞与干细胞杂志(电子版), 2017, 7(4):219-223.
11 Petric M, Martinez S, Acevedo F, et a1. Correlation between Ki67 and histological grade in breast cancer patients treated with preoperative chemotherapy[J]. Asian Pac J Cancer Prey, 2014, 15(23):10277-10280.
12 Ji Y, Zheng M, Ye S, et a1. PTEN and Ki67 expression is associated with clinicopathologic features of non-small cell lung cancer[J]. J Biomed Res, 2014, 28(6):462-467.
13 管若男, 范蕾, 刘丽娟. TPh对肝癌细胞HepG-2细胞周期、凋亡及相关因子表达的影响[J]. 中国生化药物杂志, 2017, 37(2):15-19.
14 赵万忠, 程凯, 王晓红, 等. 补骨脂素对乳腺癌耐药细胞株周期和细胞凋亡的影响[J/CD]. 中华临床医师杂志(电子版), 2016(14):2111-2115.
15 Li LC, Chui R, Nakajima K, et al. Frequent methylation of estrogen receptor in prostate cancer: correlation with tumor progression[J].Cancer Res, 2000, 60(3):702-706.
16 Christoforou P, Christopoulos PF, Koutsilieris M. The role of estrogen receptor beta in prostate cancer[J]. Mol Med, 2014, 20:427-434.
17 Zellweger T, Sturm S, Rey S, et aI. Estrogen receptor beta expression and androgen receptor phosphorylation correlate with a poor clinical outcome in hormone-naive prostate cancer and are elevated in castration-resistant disease[J]. Endoe Re1at Caneer, 2013, 20(3):403-413.
18 Kim IY, Seo ND, Kim BC, et a1. Raloxifene, a selective astrogen receptor modulator,induces apoptosis in androgen-responsive human prostate cancer cell line LNCaP through an androgenindependent pathway[J]. Cancer Res, 2002, 62(13):3649-3653.
19 Pavese JM, Farmer RI, Bergan RC. Inhibition of cancer cell invasion and metastasis by genistein[J]. Cancer Metastasis Rev, 2010, 29(3):465-482.
20 Glazier MG, Bowman MA. A review of the evidence for the use of phytoestrogens as a replacement for traditional estrogen replacement therapy[J]. Arch Intern Med, 2001, 161(9):1161-1172.

