间充质干细胞在恶性肿瘤生物学中作用的研究进展
肿瘤微环境指肿瘤组织中除肿瘤细胞外的巨噬细胞、免疫细胞和其它间质细胞等细胞成份,以及由它们产生并分泌的生长因子、细胞因子和促血管生成因子等,这些因素协同作用以影响肿瘤的发生、发展和转归[1]。间充质干细胞(mesenchymal stem cells,MSCs)系属来源于中胚层的多能干细胞,具有良好的损伤组织迁移能力和肿瘤靶向趋附性;作为肿瘤微环境中重要的细胞成份之一,诸多研究表明募集至肿瘤微环境中的MSCs其生物学功能依肿瘤类型及进展的阶段不同而各异[2-3]。本文就当前MSCs在恶性肿瘤发生发展中所起的生物学作用及其分子机制研究的相关进展作一综述。
一、MSCs概述
MSCs属成体干细胞范畴,最早于20世纪60年代末由Friedenstein等[4]从骨髓基质分离鉴定,并由Caplan于1991年正式命名为Mesenchymal Stem Cells(MSCs)[5]。MSCs存在于绝大部分组织,除骨髓外,MSCs还可从脐带、脂肪和其它组织中分离而得。鉴于迄今尚未发现MSCs特异性表达的表面分子标志物,因此目前通常采用形态学呈显微镜下成纤维样贴壁生长、细胞表面分子标志物的表达与 否(CD29+、CD51+、CD73+、CD90+、CD105+、CD146+;同时 CD31-、CD34-、CD45-)、并结合其高度自我更新能力和多向分化潜能等生物学特性而对MSCs进行鉴定[6]。随着相关研究的深入,科研共同体对MSCs生物学特性的认识也日益得以拓展,“间充质干细胞(MSCs)”之名是否贴切并能准确地涵盖所指称这类细胞的本质属性目前尚存争论,也有科学家建议将其更名为“间充质细胞(mesenchymal stromal cells)”和“药用信号细胞(medicinal signal cells)”[7-8]。
二、MSCs与恶性肿瘤细胞的生长增殖调控
正常组织通过严格控制生长促进信号的产生和释放以精确调控细胞的生长和增殖,这使得细胞的数目处于稳态平衡并藉以维系正常的组织结构和功能。与之不同的是,恶性肿瘤在其发生发展过程中,肿瘤细胞的生长增殖信号逐步失调控而获得无限生长增殖潜能。绝大部分生长增殖信号通过生长因子与细胞膜表面受体的结合而转导入细胞,受体进而通过激活其下游的多种细胞内信号通路以调控细胞周期的进展和细胞生长,通常这些信号通路同时还影响诸如细胞的生存和能量代谢等其它一些基本的细胞生物学特性。
既往长期的研究大多认为,肿瘤细胞可主要通过自分泌生长增殖信号分子、细胞表面生长因子受体(如ErbB家族成员等)突变和(或)高表达、生长增殖信号通路负反馈机制的缺陷(如PTEN表达缺失或功能缺陷)、以及下游关键信号分子(如RAS和PI3KCA)基因突变所致的组成性激活等多种途径获得自主增殖信号的能力[1]。事实上,在恶性肿瘤发生发展过程中,肿瘤细胞之所以“聪明”,不仅在于其自身的基因组不稳定,更在于它可通过细胞间的交互作用而有效“训导”趋聚至肿瘤微环境中的其它细胞成份为辅助自身恶性生物学特性的获得所用。譬如,De Boeck等[9]的研究发现,骨髓来源的MSCs即可通过旁分泌神经调节蛋白-1(NRG- 1)以激活肿瘤细胞HER2/HER3→PI3K→AKT信号转导通路,从而促进结直肠癌的恶性进展;我们课题组的研究则表明:MSCs可通过表达并分泌NRG-1等配体,从而激活Luminal B型乳腺癌细胞BT474的下游Akt和MAPK信号转导通路以上调细胞周期调控蛋白Cyclin D1的表达,进而促进其生长增殖[10]。Roccaro等[11]也发现,与正常骨髓MSCs来源的外泌体(Exosomes)相比较,多发性骨髓瘤患者骨髓MSCs来源的外泌体富含促癌蛋白、细胞因子和黏附分子并能显著促进肿瘤生长。在肿瘤细胞与MSCs交互作用的分子机制研究方面,最近,Abdul-Aziz等[12]的一项研究显示,急性髓性白血病细胞可通过其分泌的巨噬细胞迁移抑制因子作用于骨髓MSCs并诱导其IL-8的表达,而骨髓MSCs表达的IL-8则反作用于急性髓性白血病细胞以促进其增殖和存活。除自身的直接作用外,也有研究表明,MSCs还可通过募集肿瘤相关巨噬细胞或进一步分化为肿瘤相关成纤维细胞(cancer associated fibroblast,CAFs)而间接发挥促进肿瘤发生发展的作用[13-15]。诚然,鉴于MSCs自身的多向分化潜能以及肿瘤发生发展中多因素参与及其多步骤的复杂过程,有文献报道MSCs也可通过不同的分子机制抑制某些肿瘤的发生发展进程[16]。
除了生长因子信号等正向调控外,细胞周期的进展同时还受RB和TP53 2个重要抑癌蛋白参与的信号通路的负调控,因而肿瘤细胞要呈暴发性生长还须得通过累积相关重要调控分子的基因突变以拮抗多种细胞增殖的负调控机制[1,17]。MSCs是否也可通过某种机制影响肿瘤细胞生长增殖的负调控迄今尚未见有文献报道,这也是在今后相关研究中亟待予以重点阐明的问题。
三、MSCs与恶性肿瘤细胞凋亡的调控
与细胞生长增殖的失调控相对应,细胞凋亡也是恶性肿瘤在其发生发展过程中所必须逾越的生理性“屏障”。在致癌因素作用下,正常细胞经恶性转化获得自主和无限增殖潜能后,肿瘤细胞在快速生长增殖的同时,由于营养缺乏或低氧环境等应激因素作用、或因未经及时修复的损伤DNA的不断蓄积所致的DNA复制过程无法正常进行时,细胞凋亡程序将被启动。细胞的凋亡过程则受促凋亡蛋白以及抗凋亡蛋白家族成员的协同调控。肿瘤细胞对凋亡的拮抗主要在于其对内外源性凋亡信号的感知和传导异常、以及凋亡过程调控蛋白的表达异常。正常组织细胞中,为确保遗传信息在世代间的准确传递,损伤的DNA一般会触发DNA损伤反应(DDR)[19]。哺乳类细胞中DDR信号转导的关键因子是由双链DNA断裂(DSBs)和复制蛋白A(RPA)包埋的单链DNA(ssDNA)分别诱导和激活的ATM和ATR,蛋白激酶CHK1和CHK2则是ATM/ATR下游的2个重要靶蛋白,它们和ATM与ATR一起,可通过激活抑癌蛋白TP53等多种机制以下调周期蛋白依赖性激酶(CDK)的活性。肿瘤细胞则常因抑癌蛋白TP53基因突变导致的功能缺失致其对凋亡诱导信号的感知缺陷。此外,肿瘤细胞也可通过上调抗凋亡蛋白(如Bcl-2和Bcl-xL)或存活蛋白(Survivin)的表达、或下调促凋亡蛋白(BAX、BIM、PUMA)的表达、也或者使外源配体诱导的凋亡通路短路等多种途径规避细胞凋亡[18]。
有研究表明,经TNFα预处理的MSCs可通过旁分泌肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis inducing ligand,TRAIL)以触发肿瘤细胞的外源凋亡信号通路[20]。Reza等[21]的一项研究也显示,人脂肪来源的MSCs可主要通过外泌体中微小RNAs的介导在上调促凋亡蛋白BAX表达的同时还能下调抗凋亡蛋白Bcl-2的表达,进而诱导卵巢癌细胞的凋亡。Bruna等[22]的研究则证实,在癌前病变乳头瘤阶段输注外源MSCs的可通过诱导细胞凋亡而显著抑制口腔鳞癌的恶性进展。这些研究结果提示,对一些特定类型的肿瘤而言,早期迁移至肿瘤微环境中的MSCs可能主要通过辅助激活肿瘤细胞的外源凋亡信号转导通路而在肿瘤恶性进展中起负调控作用。
四、MSCs与恶性肿瘤的侵袭性生长和转移
侵袭性生长和转移是肿瘤最为重要的恶性生物学特性之一,绝大部分肿瘤患者(约90﹪以上)最终系因远端靶器官转移受累而致死[23-24]。肿瘤的侵袭性生长和转移包括一序列序贯发生的细胞恶性生物学改变:始于局部侵袭性生长,以上皮源性肿瘤为例,癌细胞一般经历典型的上皮-间质转换这一转分化过程以获得侵袭性和迁移性等恶性表型;继之肿瘤细胞穿入邻近的血管或淋巴管并在其中随血流或淋巴液循环的过程中存活下来;随后,从脉管腔穿出并侵入远端实质组织形成微转移灶,微转移灶再进一步克隆性生长并最终发展成肉眼可见的转移瘤[1]。
在恶性肿瘤侵袭性生长和转移这一多阶段过程中,每一过程均涉及由肿瘤微环境中的非肿瘤细胞所调控的限速步骤,这些细胞大多源自骨髓,它们被肿瘤细胞趋附并能增强肿瘤细胞的存活、生长、侵袭和播撒潜能[25]。2007年,Karnoub等[26]就发现,骨髓MSCs与弱转移潜能的乳腺癌细胞混合后接种至免疫缺陷小鼠可显著增强其转移性;分子机制的研究表明,这主要是由于乳腺癌细胞通过刺激骨髓MSCs趋化因子CCL5的表达和分泌,而CCL5再通过与乳腺癌细胞自身趋化因子受体CCR5结合并激活下游信号转导通路的介导促进其迁移、侵袭和转移性。新近,McAndrews等[27]的研究表明,MSCs还可以通过分泌TGF-β促进乳腺癌细胞定向侵袭和迁移。有意思的是,Yu等[28]发现MSCs对乳腺癌转移的调控与其对TGF-β的反应密切相关:原本MSCs通过其分泌的CXCL12作用于乳腺癌细胞后可诱导其CXCR7表达下调,从而抑制乳腺癌的转移;而当肿瘤微环境中的TGFβ含量升高时,其作用于MSCs则可显著抑制CXCL12的表达,进而解除其对乳腺癌细胞CXCR7表达的抑制以促进转移。纤维胶原作为原发肿瘤重要的促转移基质的成份,研究表明它的表达增高可促进基质的刚性并促进乳腺癌细胞的侵袭[29]。分子机制的探索则发现,胶原受体DDR2介导的MSCs与乳腺癌细胞间通讯对其转移表型的影响起重要调控作用[30-31]。除乳腺癌之外,Wu等[32]发现,MSCs可通过分泌CCN2的介导,在促进舌鳞状细胞癌细胞增殖的同时促进其侵袭性和迁移性。Jiang等[33]的研究则证实,MSCs可通过旁分泌IL-6的介导激活成釉细胞瘤细胞STAT3等下游信号通路以诱导其上皮-间质转换,表明MSCs在转移起始阶段即发挥重要的促进作用。
恶性肿瘤的转移有噬器官性,不同肿瘤其转移的好发靶器官各异,如乳腺癌易转移至肺、骨骼,肺癌的好发转移部位为肝脏、骨骼和大脑,神经母细胞瘤也易转移至骨骼[25]。早在1889年,Paget曾提出肿瘤转移噬器官性的“种子与土壤(seed and soil)”学说,认为对特定肿瘤而言,可能其好发靶器官特定的微环境更有利于循环系统中的肿瘤细胞的附着和克隆性生长。现在一般认为,早期播撒肿瘤细胞与好发靶器官微环境间的交互作用是决定微转移灶能否克隆性生长形成转移瘤的关键因素,但迄今其确切的分子机制大多还未知[34]。骨骼作为多种肿瘤转移共同的好发靶器官,诸多研究表明,由成骨细胞和破骨细胞动态调控的骨密度的改变在播撒性肿瘤细胞的定植和克隆性生长中发挥重要作用[35]。播撒至骨骼的乳腺癌细胞可通过产生集落刺激因子1等介导促进破骨细胞的活动;就神经母细胞瘤细胞而言,源自MSCs的IL-6不仅能促进破骨细胞的活动以利于转移微环境的形成,同时还对IL-6受体表达阳性的神经母细胞瘤细胞的增殖有显著的增强作用[36-37]。
长期以来认为原发肿瘤需长至一定大小,待其突破正常组织的空间局限并侵入血道或淋巴管道后方可能形成转移,所以一般认为实体瘤的转移通常发生在肿瘤进展的较晚期。事实上,随着研究的深入,多种实体瘤均被证实在其发生发展的极早期阶段即可在远端靶器官形成转移性播撒和微转移灶,微转移灶可长期处于蛰伏状态或随着原发肿瘤同步进展[38-39]。MSCs是否对肿瘤细胞的早期播撒和微转移灶的形成有影响值得深入探讨。此外,尚有研究报道MSCs可通过下调系统的抗肿瘤免疫反应以促进肺癌转移[40],Yu等[41]的研究也发现TNFα激活的MSCs可通过募集CXCR2阳性嗜中性粒细胞而促进乳腺癌转移。
五、MSCs在恶性肿瘤血管新生中的调控作用
在实体肿瘤恶性进展过程中,为适应肿瘤细胞快速生长增殖所需的营养和氧气的供应、以及肿瘤细胞旺盛的代谢所致的大量废物和二氧化碳能及时排出,肿瘤组织新生血管生成的开关被开启并处于持续激活状态,导致新生血管不断生成以维系肿瘤生长之所需[42]。正常生理过程中,新生血管生成的开(关)受两大类功能上相互拮抗的因子所调控,它们通过与血管内皮细胞上的刺激性或抑制性表面受体结合而激活下游信号通路。血管内皮生长因子(vascular endothelial growth factor,VEGF)和血小板衍生生长因子是最为熟知的新生血管生成诱导因子,而血小板结合蛋白-1则是最为重要的抑制血管新生调控因子[43]。在快速生长的肿瘤组织中心由于氧供不足而呈典型的低氧状态,这通常将导致低氧诱导转录因子1(hypoxia inducible factor-1,HIF1)表达的增高,HIF1再驱动其下游VEGF等血管生成相关靶基因的表达上调[44-45];在某些特定肿瘤中VEGF的表达也受癌基因信号所诱导而上调[46]。新近,有研究表明,低氧环境的诱导可通过激活Notch和SUMO信号转导通路的介导分别促进MSCs的迁移和增殖[47];HIF1还可显著增强MSCs中Jagged1的表达并包装入外泌体,并经其介导诱导血管生成[48]。外泌体还被证实可作为良好的穿梭载体将源自MSCs的促血管生成微小RNAs靶向输送至内皮细胞[49]。有意思的是,也有MSCs通过外泌体介导抑制乳腺癌血管生成的研究报道[50-51],提示MSCs可能对不同肿瘤血管生成的影响不一。
MSCs除外,现在已知,源自骨髓的多种其它细胞都在病理性血管生成中起重要作用,这些细胞包括浸润至癌前病变或进展期肿瘤灶的先天性免疫系统细胞如巨噬细胞、中性粒细胞、肥大细胞和髓系前体细胞等。除促进肿瘤的局部侵袭性生长外,肿瘤浸润性炎性细胞还有助于触发静息组织血管的新生以及维系已激活的肿瘤生长相关的血管生成,并能辅助拮抗靶向血管内皮细胞信号转导系统药物的作用而保护新生血管。鉴于此,MSCs也可能通过影响肿瘤浸润的炎性细胞如巨噬细胞而间接发挥促血管生成作用[52]。此外,尚有研究证实MSCs可作为“血管前体细胞”在特定情形下迁移入肿瘤灶并分化为周细胞或血管内皮细胞而直接参与血管新生[53]。有关MSCs对肿瘤血管生成的影响及其更多更详尽的分子机制可参见本刊此前发表的韩昌敏等人的综述[54]。
六、MSCs与恶性肿瘤细胞的能量代谢调控
早在20世纪初,德国科学家Otto Warburg就系统地探索过肿瘤细胞的能量代谢,他的研究揭示:与巴斯德效应相反的是,肿瘤细胞即使在氧供充分的情形下也优先通过糖酵解途径获得能量,即肿瘤细胞能量代谢极具特征性的“Warburg”效应[55]。事实上,单纯就生成ATP的效率而言葡萄糖的糖酵解比线粒体的氧化磷酸化低18倍。不过,糖酵解的增加可为多种生物合成途径如核苷和氨基酸的生物合成提供大量的各式中间代谢物,这对满足肿瘤细胞快速生长增殖时新生细胞组装所必须的生物大分子生物合成以及维持细胞内氧化还原态势的平衡至关重要[56]。有趣的是,鉴于肿瘤组织的异质性,在有些肿瘤中发现两类能量代谢途径迥异的肿瘤细胞亚群。依赖糖酵解途径的肿瘤细胞亚群可将代谢产生的乳酸分泌出胞,另一亚类肿瘤细胞则可摄入并利用乳酸作为其能量代谢的底物通过柠檬酸循环途径代谢乳酸以产能,这两亚类细胞群就能量物质的充分利用上而言形成一种功能性的共生模式[57]。此外,现在愈发明了的是,由于肿瘤新生血管生成的不稳定性和无序性,肿瘤组织中的氧供状态常呈时空特异性动态改变,而非静态的一成不变。
肿瘤细胞核心代谢的改变即能量代谢重编程受多种內源和外源的分子机制所共同协同调控,除癌基因和抑癌基因突变等遗传因素外,肿瘤细胞异常的微环境如低氧、pH改变和低糖等都在决定肿瘤细胞的代谢表型中起重要作用[58]。RAS和MYC等癌基因的激活和TP53等抑癌基因的失活都与肿瘤细胞的糖酵解相关,RAS癌蛋白和缺氧可独立地诱导转录因子HIF1α和HIF2α的表达以促进糖酵解。此外,在胶质瘤和其它一些人类肿瘤中还存在能量代谢关键酶类如异柠檬酸脱氢酶1/2基因的突变[59-60],这些改变赋予的肿瘤细胞能量代谢重编程对其选择性生长优势表型的获得大有裨益。
实体瘤中心在大多情况下处于低氧状态,因此肿瘤细胞对糖酵解的依赖在低氧条件下显得尤为重要,众多研究也证实低氧应对系统可通过多种途径上调葡萄糖转运蛋白和糖酵解途径中的多种酶[61]。低氧环境对MSCs靶向趋附至肿瘤微环境影响已如前述,鉴于此,MSCs自身能量代谢的改变以及对肿瘤细胞能量代谢的影响也吸引了较多研究人员的目光,不过大部分研究聚焦于MSCs分化而来的CAFs对肿瘤细胞代谢的影响[62]。比如,在包括乳腺癌在内的多种肿瘤中均发现,肿瘤细胞“驯化”的CAFs历经能量代谢重编程后可通过GLUT-1的表达上调增加葡萄糖的摄入,同时经单羧酸转运蛋白-4的介导提升乳酸的外泌[63];相应地,肿瘤细胞则通过单羧酸转运蛋白-1摄入微环境中的乳酸为自身所用[64]。此外,也有报道发现MSCs亦可通过外泌乳酸而直接与肿瘤细胞形成能量代谢偶联关系[65-66]。除了代谢底物间的交换外,MSCs还可通过某种机制直接调控肿瘤细胞的“Warburg”效应。Samudio等[67]将白血病细胞与MSCs共培养后发现其常氧条件下的糖酵解显著增加,但葡萄糖的消耗量并没有改变,提示乳酸的堆积是由于丙酮酸代谢的减少而产生的;机制研究则发现,共培养后经MSCs刺激的白血病细胞解偶联蛋白 2(UCP2)的表达明显增高,细胞的线粒体膜电位则因此显著降低并导致氧化磷酸化过程解偶联。无独有偶,Ohkouch等[68]通过共培养研究也发现,MSCs可通过分泌斯钙素1蛋白上调人肺腺癌细胞A549中UCP2蛋白的表达,进而降低其活性氧家族的产生并增强“Warburg”效应。尽管对肿瘤细胞能量代谢特别是有氧糖酵解复杂调控机制的认识仍有待更多的研究深入阐明,随着近年来肿瘤微环境中MSCs在肿瘤能量代谢调控中作用的逐渐凸显,进一步揭示其确切的分子作用机制对未来探索并发现抗肿瘤微环境的新治疗靶点有重要的指导意义。
七、MSCs与肿瘤免疫调控
长期以来认为免疫系统处于一种预警状态即免疫监测,能够迅速识别并清除绝大部分新生肿瘤细胞,而免疫功能低下个体特定肿瘤发病率极大增高也验证了免疫监测功能的缺陷在肿瘤形成过程中发挥的作用[69]。鉴于机体免疫系统在恶性肿瘤发生发展过程中重要的“屏障”作用,肿瘤细胞在克隆选择的压力下也相应进化出多种机制以规避免疫系统的打击:较早阐明的分子机制包括有肿瘤细胞的抗原缺失和调变、MHC-Ⅰ类分子的低表达或缺失、以及协同刺激信号的缺乏等[1]。近年来的研究发现,多种肿瘤细胞尚可通过高表达PD-L1和CD47等免疫抑制分子的介导抑制机体固有和适应性免疫系统的抗肿瘤功能[70-71]。
除肿瘤细胞本身与免疫系统的交互作用之外,愈来愈多的研究表明靶向趋附至肿瘤微环境中的MSCs亦可参与塑造和调控局部免疫微环境[72-73]。MSCs细胞表面低表达MHC-Ⅱ和协同刺激分子,因此它自身可被免疫系统豁免,但其对机体固有免疫和适应性免疫都有重要的调节作用[74-76]。迄今的绝大部分相关研究表明,MSCs对机体免疫系统的调节主要表现为免疫抑制[77]。经局部微环境中炎症因子特别是γ干扰素(IFNγ)激活的MSCs可通过表达并分泌TGF-β、趋化因子(如 CXCL9、CXCL10 和 CXCL11)、诱导型一氧化氮合酶(iNOS)以及吲哚胺2,3-二氧化酶(IDO)等的介导发挥其免疫调节功能[78-80]。新近,Fechter等[81]的研究即证实,Vδ2表达阳性T细胞分泌的IFNγ可诱导MSCs中多种因子包括IDO的表达,后者反作用于Vδ2表达阳性T细胞以抑制其增殖和细胞因子的产生,如此形成一个T细胞-MSCs的负反馈作用环路。Ghosh等[82]的一项研究也表明肿瘤相关MSCs可通过阻断树突状细胞半胱氨酸的输出以抑制幼稚T细胞的扩增。腺苷抑制NK细胞和CD8+T细胞的活化和细胞毒性效应已为诸多研究所证实[83-84],De LM等[85]发现宫颈癌组织来源的MSCs同正常宫颈组织来源的MSCs相比表达更高水平的CD39和CD73外核苷酸酶,将来源于二者的上清处理CD8+T细胞,宫颈癌组织来源MSCs的上清可抑制CD8+T细胞的增殖、活化和细胞毒性效应作用,其机制即是通过产生大量的腺苷而起作用的。Schuler等[86]也发现头颈部肿瘤中分离而得的MSCs其腺苷代谢异于自体正常组织来源的MSCs。除对适应性免疫中效应淋巴细胞的直接抑制作用外,MSCs还可通过诱导免疫抑制性T细胞如Tr1和Treg的发育以发挥间接的免疫调控作用[87-88],MSCs对Treg的诱导作用还被证实可为TLR3或TLR4的特异激活而显著增强[89]。对固有免疫调控方面,MSCs对巨噬细胞和嗜中性粒细胞的募集作用已如前述[13,41],MSCs对树突状细胞、NK细胞和巨噬细胞等免疫细胞活化的抑制作用也已为研究所证实[74-90]。
在绝大部分研究表明MSCs的免疫抑制功能的同时,Shou等[91]的研究却发现I型干扰素(IFNα和IFNβ)的刺激则可显著抑制MSCs中iNOS的表达从而逆转其介导的免疫抑制效应。Choi等[92]最新有关胶质母细胞瘤的研究则表明:病灶的手术切除可显著提高局部输注IFN-β高表达MSCs的抗肿瘤疗效,其主要机制在于肿瘤组织切除既极大地减少了局部髓源性抑制细胞的载量,同时又可有效募集CD4+(CD8+)T细胞,MSCs来源的IFN-β则可进一步增强术后CD8+T细胞的选择性浸润并诱导肿瘤细胞周期休止和凋亡。这些现象的发现提示MSCs对肿瘤免疫的调控具“双刃剑”性作用,其对肿瘤免疫是增强还是抑制与微环境和旁分泌信号的不同密切相关[93]。在肿瘤免疫治疗新时代已经来临的今天[94],在充分阐明特定肿瘤中MSCs介导免疫调控分子机理的基础上,如何有效规避MSCs的肿瘤免疫抑制效应的同时特异促进其免疫增强效应是未来肿瘤免疫治疗新措施探索的重要方向。
八、MSCs与肿瘤治疗抗性
由于环境污染以及个体不良生活习惯和人口老龄化等原因,我国以及全球范围内恶性肿瘤的发病率近年来呈持续攀升态势[95-96],恶性肿瘤也早已成为严重危害居民身心健康的重大公共卫生问题。尽管随着对恶性肿瘤发生发展及转归分子机制认识的不断深入,肿瘤的治疗手段日益丰富多样,迄今也已形成了以手术、化学治疗、放射治疗、靶向治疗等为主的多学科联合综合治疗体系,然而在治疗过程中肿瘤细胞对这些治疗产生原发或继发抵抗性则是导致疗效不佳和患者生存等预后不良的重要原因,因此进一步阐明肿瘤治疗抗性的分子机制对于开发新药或优化治疗方案是极其重要的。关于肿瘤治疗抗性产生的机制已有广泛的研究报道,以下重点就MSCs在此过程中所扮演的角色作一论述。
(一)MSCs与肿瘤化疗耐药性
化学治疗作为最早开发的肿瘤三大常规治疗手段之一,一直以来在恶性肿瘤患者的综合治疗中发挥着不可替代的重要作用,但肿瘤细胞对化疗药物的原发或继发耐药性是导致化疗失败的主要原因[97]。不同化疗药物其药理作用各异,肿瘤化疗耐药性产生的分子机理也复杂多样。较早的研究大多聚焦于肿瘤细胞本身的分子和细胞生物学改变在耐药性中的作用:如肿瘤细胞多药转运P糖蛋白的表达增高致胞内药物蓄积减少、药物代谢的改变、DNA损伤修复能力异常、药物作用靶基因的突变或扩增等[98-99]。近年来,肿瘤微环境在肿瘤化疗抵抗性中的作用日益凸显,其中尤以MSCs介导的肿瘤化疗抵抗分子机制的相关研究为著[100]。
MSCs作为肿瘤微环境中细胞成分的重要组成成员之一,迄今大多研究表明它主要是通过外泌炎症因子以及多种小分子配体以重塑肿瘤生化微环境的介导促进肿瘤细胞化疗耐药性的产生[101-102]。Chen等[103]就曾发现MSCs可通过分泌IL-8的介导诱导三阴性乳腺癌细胞对多柔比星的耐药性。Han等[104]发现当MSCs受炎症因子如IFN-γ或TNF-α等刺激后其TGF-β表达量上调并可诱发肝细胞癌细胞的自噬,进而使肝癌细胞对化疗药物产生耐药性;Yang等[105]在多发性骨髓瘤中的研究也证实了MSCs通过诱导肿瘤细胞的自噬所介导的化疗耐药性,自噬也因而成为靶向逆转肿瘤化疗耐药的候选靶标[106]。MSCs外泌的小分子配体对肿瘤细胞相关信号转导通路的激活是其化疗耐药分子机制的重要方面[107]。Ji等[108]的体内、外研究证实,来源于MSCs的外泌体可通过激活钙/钙调节蛋白依赖性蛋白激酶/Raf/MEK/ERK信号通路而显著地诱导胃癌细胞的5-氟尿嘧啶耐药性。而自身的研究曾表明erbB2/erbB3→PI3K/Akt→mTOR信号转导通路的激活通过上调Survivin蛋白的表达而促进erbB2高表达人乳腺癌细胞泰素耐药性的产生[109];新近的研究则发现源自MSCs的erbB3特异结合的激活性配体NRG-1在乳腺癌细胞上述信号转导通路的激活中发挥重要的作用[110]。此外,鉴于MSCs与肿瘤细胞之间可相互作用,研究人员发现MSCs与乳腺癌细胞共培养后可释放含有miR-222/223的外泌体,反过来促使部分癌细胞处于休眠期,并赋予其化疗耐药性[111]。另有研究人员将前列腺癌细胞与CAFs共培养,或将CAFs上清作用于前列腺癌细胞,发现可抵消化疗药物引起的DNA损伤和TP53活化反应以促进前列腺癌细胞的存活,其可能的机制是CAFs上调肿瘤细胞的谷胱甘肽水平,减少药物积累和对抗药物诱导的活性氧[112]。尚有研究表明,MSCs还可通过激活Drp1以诱导线粒体动力学的改变以保护肿瘤细胞免受化疗药物的攻击[113],说明MSCs所涉肿瘤化疗耐药分子机制的复杂性和多样性。
(二)MSCs与肿瘤靶向治疗耐药性
基于肿瘤细胞特异分子靶标的发现所开发的靶向治疗无疑在提高疗效的同时也极大地改善了患者的生活质量和生存预后,但与化疗相仿的是,原发或继发耐药性依然是临床上靶向治疗所面临的亟需解决的难题[114]。
目前关于靶向治疗的耐药机制也已有多种解释,原发耐药的机制如:肿瘤细胞的异质性、肿瘤干细胞的存在、靶标蛋白的过表达或低表达等;再如继发耐药机制包括治疗靶点的突变或甲基化、存活信号通路的过度激活、反馈信号通路的激活、表观遗传异常致相关微小RNAs的表达上调或下调等[115-116]。MSCs相关研究方面,有研究表明CAFs所分泌的HGF可通过重新激活PI3K和MAPK信号通路,导致BRAF-V600E突变型黑色素瘤对BRAF抑制剂产生耐药性[117-118]。另有研究发现CAFs分泌的血小板衍生生长因子C是导致EL-4淋巴瘤细胞对抗VEGF治疗耐药的关键分子,而阻断血小板衍生生长因子C后可恢复对抗VEGF治疗的敏感性[119]。小分子酪氨酸激酶抑制剂是BCR-ABL融合蛋白阳性急性淋巴母细胞白血病(ALL)的一线靶向治疗药,Mallampati等[120]的研究表明,暴露于酪氨酸激酶抑制剂的MSCs可通过表达趋附分子、黏附分子以及促细胞存活生长因子等的介导“庇护”ALL细胞免招攻击。
事实上,随着MSCs在肿瘤化疗和靶向治疗耐药性产生中的作用及其分子机制的逐步被阐明,肿瘤微环境中MSCs及其关键分子作为逆转肿瘤化疗和靶向治疗耐药性重要的候选治疗靶标吸引了大量科研人员的关注,初步的肿瘤细胞本身及微环境中MSCs联合靶向治疗的实验研究也取得令人振奋的协同疗效[106,121]。
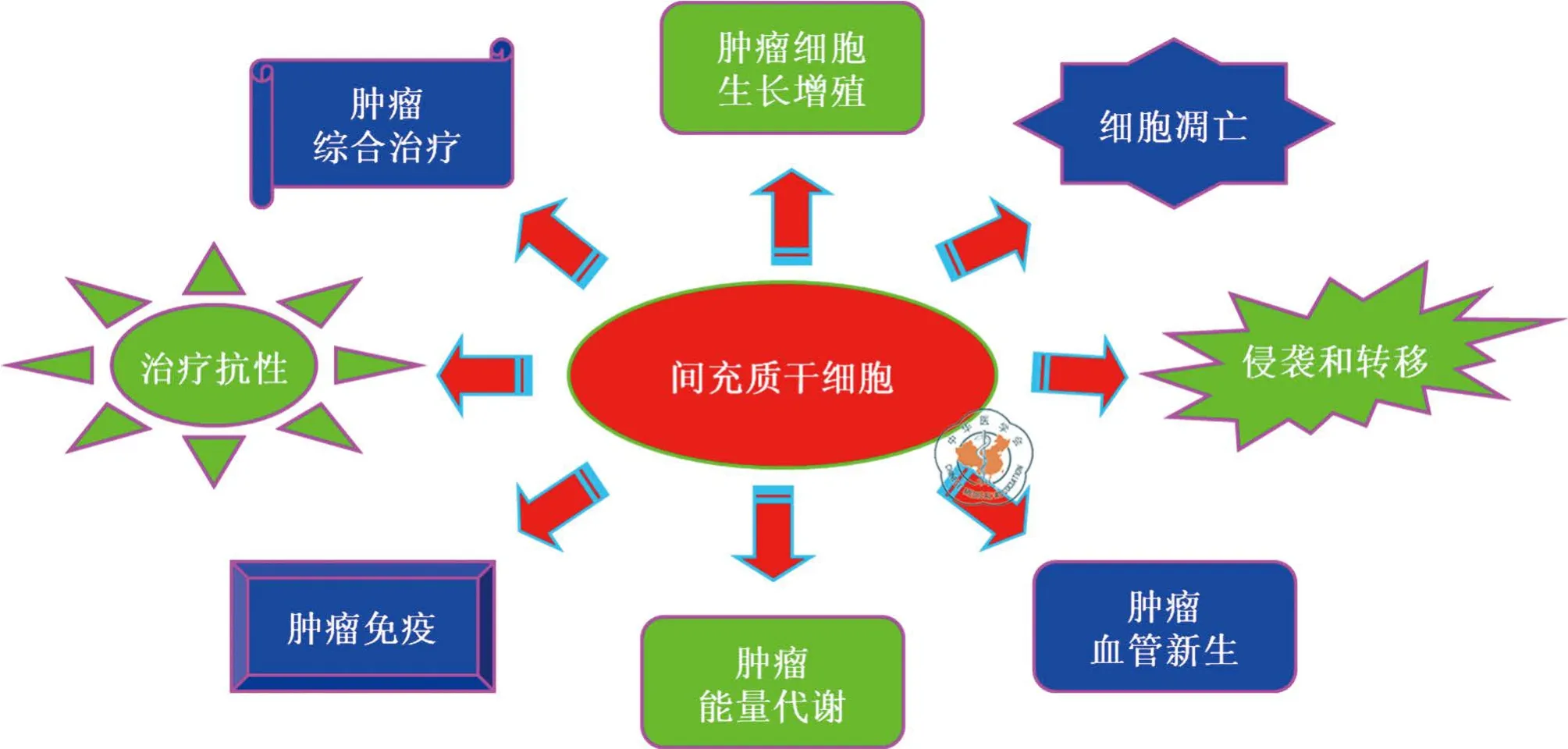
图1 间充质干细胞参与调控的肿瘤恶性生物学特性
(三)MSCs与肿瘤放疗抵抗性
放射治疗是利用α、β、γ和X射线对患者肿瘤组织靶区照射,通过电离辐射释放的能量破坏细胞染色体以特异杀死杀伤肿瘤细胞,从而达到治愈或提高肿瘤局部控制率以延长患者的生存预后等目的。放疗适用范围广,约50﹪癌症患者可首选放疗或将其作为重要的综合治疗手段之一,但放疗抵抗性却是限制其疗效和适应症拓展不可回避的问题[122]。迄今,肿瘤微环境中炎症因子、血管再生、免疫系统成份以及细胞外基质重塑和纤维化与放疗抵抗性的相关研究较多[123-124],但MSCs在肿瘤放疗抵抗性中可能的生物学作用及其可能的机制尚未引起应有的关注。有研究表明,尽管MSCs本身对辐射诱导的损伤不敏感[125]。不过分化自MSCs的CAFs分离并经体外培养和电离辐射后,其表达和分泌的细胞因子如SDF-1和bFGF等成份有显著的变化[126],同一课题组体内水平的研究则发现未经辐射的CAFs共移植可显著促进异种移植瘤的生长,但经辐射处理后CAFs其促进异种移植瘤生长的能力随之丧失[127]。Wang等[128]的研究也发现,立体定向放疗后可促进MSCs向肿瘤实质迁移并进一步分化为周细胞,进而诱导肿瘤血管新生以促进肿瘤复发。Alessio等[129]的研究则表明,携有RB1失活性突变的MSCs在低剂量的辐射下存活并蓄积损伤DNA,而这可能与放疗副作用及肿瘤复发相关。不过,也有辐射后MSCs显示一定辅助抗癌活性的研究报道[130]。综合而言,MSCs在放射治疗中所扮演的角色是“帮凶”或是“助攻”仍有待将来进一步的研究加以阐明。
九、MSCs在肿瘤综合治疗中的应用
随着MSCs在肿瘤发生发展过程中的作用及其机制的日渐明了,并基于其肿瘤组织靶向趋附的属性,如何通过药物或生物活性因子处理和(或)基因工程修饰等手段,将MSCs最终改造成为能靶向攻击特定肿瘤的工具细胞以服务临床肿瘤患者综合治疗之需具有极大的吸引力和挑战性[131-132]。
TRAIL可通过与细胞表面的跨膜死亡受体DR4和DR5结合而特异诱导特定肿瘤细胞的凋亡,重组可溶性TRAIL也较早地进入了肿瘤治疗的实验研究中[133]。但鉴于其在血清中的半衰期短,这在较大程度上限制了重组可溶性TRAIL临床抗肿瘤的疗效。为克服上述固有缺陷,多个研究组探索以MSCs作为TRAIL递送肿瘤靶向载体细胞的研究均证实了其潜在的临床应用价值[134-136]。Lee等[20]的研究也发现,通过TNF-α预处理的MSCs其TRAIL的表达显著增高,并可高效诱导TRAIL敏感肿瘤细胞的凋亡。除抗肿瘤活性因子外[137],MSCs作为递送化疗药物如紫杉醇和溶瘤病毒的载体细胞也显示出较好的抗肿瘤效果[138-139]。有趣的是,Munoz等[140]的一项研究揭示,替莫唑胺耐药多形性胶质母细胞瘤细胞(GBM)中miR-9呈高表达,而通过构建anti-miR-9高表达MSCs并与GBM共培养则可有效向其递送anti-miR-9以拮抗miR-9的功能,进而逆转GMB细胞对替莫唑胺的耐药性。已如前述,MSCs与乳腺癌细胞共培养后可释放含有miR-222/223的外泌体而致化疗耐药性,相反地,能特异过表达miR-222/223拮抗剂的MSCs则可显著增强乳腺癌细胞对卡铂的敏感性[111],这些研究表明基因工程修饰MSCs在靶向逆转化疗耐药性中具有良好的临床应用前景。推而广之,尽管迄今MSCs的临床应用尚存在一定的安全隐患,但特异修饰的MSCs是否也具有增强肿瘤放疗和免疫治疗的临床疗效仍然值得深入研究。
十、结语与展望
自其分离鉴定至今,在过去近半个世纪的时间里,MSCs在肿瘤细胞生长增殖、凋亡调控、侵袭性生长和转移、血管新生、能量代谢、肿瘤免疫以及治疗抗性等诸多恶性生物学特性中的作用及其分子机制逐步被揭示,基于这些发现的基因工程修饰和物理/化学预处理的MSCs在特定肿瘤综合治疗中可能的临床应用研究也正方兴未艾(图1)。随着相关研究的深入,更多未知领域必将随之凸显。比如MSCs是否在肿瘤干细胞的调控中也起某种作用,甚或MSCs亦可转分化为肿瘤干细胞,若是其分子机制又如何。此外,是否可基于基因工程修饰MSCs而开发肿瘤发生及早期转移的预防手段也将极富吸引力。可以预见的是,在不久的将来,有关MSCs在恶性肿瘤生物学中作用的全景图将展现在科研共同体眼前,基于其的恶性肿瘤预防和治疗措施也将不断得以丰富和完善。
1 Hanahan D, Weinberg RA. Hallmarks of cancer: the next Generation[J].Cell, 2011, 144(5):646-674.
2 Shi Y, Du L, Lin L, et al. Tumour-associated mesenchymal stem/stromal cells: emerging therapeutic targets[J]. Nat Rev Drug Discov,2017, 16(1):35-52.
3 陈强星, 张剑. 间充质干细胞免疫调节作用的研究进展[J]. 器官移植, 2016, 7(6):484-489.
4 Friedenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells[J]. Cell Tissue kinet, 1970, 3(4):393-403.
5 Caplan AI. Mesenchymal stem cells[J]. J Orthop Res, 1991, 9(5):641-650.
6 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8(4): 315-317.
7 Caplan AI. Mesenchymal stem cells:time to change the Name![J]. Stem Cells Transl Med, 2017, 6(6):1445-1451.
8 陈津. 间充质(干)细胞的定义变迁[J/CD]. 中华细胞与干细胞杂志:电子版, 2017, 7(4):247-250.
9 De Boeck A, Pauwels P, Hensen K, et al. Bone marrow-derived mesenchymal stem cells promote colorectal cancer progression through paracrine neuregulin 1/HER3 signalling[J]. Gut, 2013, 62(4): 550-560.
10 左伟敏, 祝玲, 林婷婷, 等. 间充质干细胞促进Luminal B型乳腺癌细胞生长增殖及其分子机理初探[J/CD]. 中华细胞与干细胞杂志:电子版, 2016, 6(4):228-235.
11 Roccaro AM, Sacco A, Maiso P, et al. BM mesenchymal stromal cellderived exosomes facilitate multiple myeloma progression[J]. J Clin Invest, 2013, 123(4):1542-1555.
12 Abdul-Aziz AM, Shafat MS, Mehta TK, et al. MIF-Induced stromal PKCβ/IL8 is essential in human acute myeloid leukemia[J]. Cancer Res, 2017, 77(2): 303-311.
13 Ren G, Zhao X, Wang Y, et al. CCR2-dependent recruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα[J]. Cell Stem Cell,2012, 11(6):812-824.
14 Borriello L, Nakata R, Sheard MA, et al. Cancer-Associated fibroblasts share characteristics and pro-tumorigenic activity with mesenchymal stromal cells[J]. Cancer Res 2017, 77(18): 5142-5157.
15 Barcellos-De-Souza P, Comito G, Pons-Segura C, et al. Mesenchymal stem cells are recruited and activated into Carcinoma-Associated fibroblasts by prostate cancer Microenvironment-Derived TGF-1[J].Stem Cells, 2016, 34(10):2536-2547.
16 Liu T, Zhu K, Ke C, et al. Mesenchymal stem cells inhibited development of lung cancer induced by chemical carcinogens in a rat model[J]. Am J Transl Res, 2017, 9(6):2891.
17 Malumbres M, Barbacid M. Cell cycle, CDKs and cancer: a changing paradigm[J]. Nat Rev Cancer, 2009, 9(3):153-166.
18 Cotter TG. Apoptosis and cancer: the Genesis of a research field[J]. Nat Rev Cancer, 2009, 9(7):501-507.
19 Jackson SP, Bartek J. The DNA-damage response in human biology and disease[J]. Nature, 2009, 461(7267):1071-1078.
20 Lee RH, Yoon N, Reneau JC, et al. Preactivation of human MSCs with TNF-α enhances tumor-suppressive activity[J]. Cell Stem Cell, 2012,11(6): 825-835.
21 Reza AM, Choi YJ, Yasuda H, et al. Human adipose mesenchymal stem cell-derived exosomal-miRNAs are critical factors for inducing antiproliferation signalling to A2780 and SKOV-3 ovarian cancer cells[J].Sci Rep, 2016,6: 38498.
22 Bruna F, Arango-Rodriguez M, Plaza AA, et al. The administration of multipotent stromal cells at precancerous stage precludes tumor growth and epithelial dedifferentiation of oral squamous cell carcinoma[J].Stem Cell Res, 2017, 18: 5-13.
23 Rankin EB, Giaccia AJ. Hypoxic control of metastasis[J]. Science,2016, 352(6282):175-180.
24 Turajlic S, Swanton C. Metastasis as an evolutionary process[J].Science, 2016, 352(6282): 169-175.
25 Joyce JA, Pollard JW. Microenvironmental regulation of metastasis[J].Nat Revs Cancer, 2009, 9(4): 239-252.
26 Karnoub AE, Dash AB, Vo AP, et al. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature, 2007,449(7162): 557-563.
27 Mcandrews KM, Mcgrail DJ, Ravikumar NA. Mesenchymal stem cells induce directional migration of invasive breast cancer cells through TGF-β[J]. Sci Rep, 2015, 5: 16941.
28 Yu PF, Huang Y, Xu CL, et al. Downregulation of CXCL12 in mesenchymal stromal cells by TGFβ promotes breast cancer metastasis[J]. Oncogene, 2017, 36(6): 840-849.
29 Conklin MW, Eickhoff JC, Riching KM, et al. Aligned collagen is a prognostic signature for survival in human breast carcinoma[J]. Am J Pathol, 2011, 178(3): 1221-1232.
30 Corsa CA, Brenot A, Grither WR, et al. The action of discoidin domain receptor 2 in basal tumor cells and stromal Cancer-Associated fibroblasts is critical for breast cancer metastasis[J]. Cell Rep, 2016,15(11): 2510-2523.
31 Gonzalez ME, Martin EE, Anwar TA, et al. Mesenchymal stem Cell-Induced DDR2 mediates Stromal-Breast cancer interactions and metastasis growth[J]. Cell Rep, 2017, 18(5): 1215-1228.
32 Wu YL, Li HY, Zhao XP, et al. Mesenchymal stem cell-derived CCN2 promotes the proliferation, migration and invasion of human tongue squamous cell carcinoma cells[J]. Cancer Sci, 2017, 108(5): 897-909.
33 Jiang CM, Zhang QZ, Shanti RM, et al. Mesenchymal stromal Cell-Derived interleukin-6 promotes Epithelial-Mesenchymal transition and acquisition of epithelial Stem-Like cell properties in ameloblastoma epithelial cells[J]. Stem Cells, 2017, 35(9): 2083-2094.
34 Sohara Y, Shimada H, Declerck YA. Mechanisms of bone invasion and metastasis in human neuroblastoma[J]. Cancer Lett, 2005, 228(1-2):203-209.
35 Ara T, Song L, Shimada H, et al. Interleukin-6 in the bone marrow microenvironment promotes the growth and survival of neuroblastoma cells[J]. Cancer Res, 2009, 69(1): 329-337.
36 Nguyen DX, Bos PD, Massagué J. Metastasis: from dissemination to organ-specific colonization[J]. Nat Rev Cancer, 2009, 9(4): 274-284.
37 Bussard KM, Gay CV, Mastro AM. The bone microenvironment in metastasis;what is special about bone[J]. Cancer Metastasis Rev, 2008,27(1): 41-55.
38 Hosseini H, Obradovic MM, Hoffmann M, et al. Early dissemination seeds metastasis in breast cancer[J]. Nature, 2016, 540(7634): 552.
39 Harper KL, Sosa MS, Entenberg DA, et al. Mechanism of early dissemination and metastasis in Her2(+) mammary cancer[J]. Nature,2016, 540(7634): 588-592.
40 Gazdic M, Markovic BS, Jovicic NA, et al. Mesenchymal stem cells promote metastasis of lung cancer cells by downregulating systemic antitumor immune response[J]. Stem cells Int, 2017:1-11.
41 Yu PF, Huang Y, Han YY, et al. TNF activated mesenchymal stromal cells promote breast cancer metastasis by recruiting CXCR2(+)neutrophils[J]. Oncogene, 2017, 36(4): 482-490.
42 Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic Switch during tumorigenesis[J]. Cell, 1996, 86(3): 353-364.43 Bergers G, Benjamin LE. Tumorigenesis and the angiogenic Switch[J].Nat Rev Cancer, 2003, 3(6): 401-410.
44 Fraisl P, Mazzone M, Schmidt TA. Regulation of angiogenesis by Oxygen and metabolism[J]. Dev Cell, 2009, 16(2): 167-179.
45 Dewhirst MW, Cao Y, Moeller B. Cycling hypoxia and free radicals regulate angiogenesis and radiotherapy response[J]. Nat Rev Cancer,2008, 8(6): 425-437.
46 Cabrita MA, Christofori G. Sprouty proteins, masterminds of receptor tyrosine kinase signaling[J]. Angiogenesis, 2008, 11(1): 53-62.
47 Ciria M, Garcia NA, Ontoria-Oviedo I, et al. Mesenchymal stem cell migration and proliferation are mediated by Hypoxia-Inducible factor-1 upstream of Notch and SUMO pathways[J]. Stem Cells and Dev, 2017,26(13): 973-985.
48 Gonzalez-King H, Garcia NA, Ontoria-Oviedo I, et al. Hypoxia inducible factor-1 potentiates Jagged 1-Mediated angiogenesis by mesenchymal stem Cell-Derived exosomes[J]. Stem Cells, 2017, 35(7):1747-1759.
49 Gong M, Yu B, Wang JC, et al. Mesenchymal stem cells release exosomes that transfer miRNAs to endothelial cells and promote angiogenesis[J]. Oncotarget, 2017, 8(28): 45200-45212.
50 Lee JK, Park SR, Jung BK, et al. Exosomes derived from mesenchymal stem cells suppress angiogenesis by down-regulating VEGF expression in breast cancer cells[J]. PLOS One, 2013, 8(12): e84256.
51 Pakravan K, Babashah S, Sadeghizadeh M, et al. MicroRNA-100 shuttled by mesenchymal stem cell-derived exosomes suppresses in vitro angiogenesis through modulating the mTOR/HIF-1 alpha/VEGF signaling axis in breast cancer cells[J]. Cellular Oncol, 2017, 40(5):457-470.
52 Motegi SI, Ishikawa O. Mesenchymal stem cells: The roles and functions in cutaneous wound healing and tumor growth[J]. J Dermatol Sci, 2017, 86(2): 83-89.
53 Yamada K, Uchiyama A, Uehara A, et al. MFG-E8 drives melanoma growth by stimulating mesenchymal stromal Cell-Induced angiogenesis and M2 polarization of Tumor-Associated macrophages[J]. Cancer Res,2016, 76(14): 4283-4292.
54 韩昌敏, 张雷, 吴启龙, 等. 间充质干细胞对肿瘤血管生成的影响[J/CD]. 中华细胞与干细胞杂志:电子版, 2016, 6(4):252-257.
55 Koppenol WH, Bounds PL, Dang CV. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer, 2011, 11(5):325-337.
56 Cairns RA, Harris IS, Mak TW. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11(2): 85-95.
57 Kennedy KM, Dewhirst MW. Tumor metabolism of lactate:the influence and therapeutic potential for MCT and CD147 regulation[J].Future Oncol, 2010, 6(1):127-148.
58 Ward PS, Thompson CB. Metabolic reprogramming: a cancer hallmark even Warburg did not anticipate[J]. Cancer Cell, 2012, 21(3): 297-308.
59 Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme[J]. Science, 2008, 321(5897): 1807-1812.
60 Figueroa ME, Abdel-Wahab O, Lu C, et al. Leukemic IDH1 and IDH2 mutations result in a hypermethylation phenotype, disrupt TET2 function, and impair hematopoietic differentiation[J]. Cancer Cell,2010, 18(6): 553-567.
61 Denko NC. Hypoxia, HIF1 and glucose metabolism in the solid tumour[J]. NatRev Cancer, 2008, 8(9):705-713.
62 Krstic J, Trivanovic D, Jaukovic A, et al. Metabolic plasticity of stem cells and macrophages in cancer[J]. Front Immunol, 2017, 8: 939.
63 Fiaschi T, Marini A, Giannoni E, et al. Reciprocal metabolic reprogramming through lactate shuttle coordinately influences tumorstroma interplay[J]. Cancer Res, 2012, 72(19): 5130-5140.
64 Pavlides S, Whitaker-Menezes D, Castello-Cros R, et al. The reverse Warburg effect: aerobic glycolysis in cancer associated fibroblasts and the tumor stroma[J]. Cell cycle, 2009, 8(23): 3984-4001.
65 Chiarugi P, Cirri P. Metabolic exchanges within tumor microenvironment[J]. Cancer Lett, 2016, 380(1): 272-280.
66 Bonuccelli G, Avnet S, Grisendi G, et al. Role of mesenchymal stem cells in osteosarcoma and metabolic repro-gramming of tumor cells[J].Oncotarget, 2014, 5(17): 7575-7588.
67 Samudio I, Fiegl M, Mcqueen T, et al. The warburg effect in leukemiastroma cocultures is mediated by mitochondrial uncoupling associated with uncoupling protein 2 activation[J]. Cancer Res, 2008, 68(13):5198-5205.
68 Ohkouchi S, Block GJ, Katsha AM, et al. Mesenchymal stromal cells protect cancer cells from ROS-induced apoptosis and enhance the warburg effect by secreting STC1[J]. Mol Ther, 2012, 20(2): 417-423.
69 Fridman WH, Pagès F, Sautès-Fridman C, et al. The immune contexture in human tumours: impact on clinical outcome[J]. Nat Rev Cancer,2012, 12(4): 298-306.
70 Casey SC, Tong L, Li YL, et al. MYC regulates the antitumor immune response through CD47 and PD-L1[J]. Science, 2016, 352(6282): 227-231.
71 Taube JM, Anders RA, Young GD, et al. Colocalization of inflammatory response with B7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape[J]. Sci Transl Med, 2012, 4(127):127ra37.
72 Wang Y, Chen XD, Cao W, et al. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications[J].Nat Immunol, 2014, 15(11): 1009-1016.
73 Klemm F, Joyce JA. Microenvironmental regulation of therapeutic response in cancer[J]. Trends Cell Bio, 2015, 25(4): 198-213.
74 Le Blanc K, Davies LC. Mesenchymal stromal cells and the innate immune response[J]. Immunol Lett, 2015, 168(2): 140-146.
75 Glenn JD, Whartenby KA. Mesenchymal stem cells:Emerging mechanisms of immunomodulation and therapy[J]. World J stem cells,2014, 6(5): 526-539.
76 Tan J, Wu W, Xu X, et al. Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants: a randomized controlled trial[J]. JAMA, 2012, 307(11): 1169-1177.
77 Nauta AJ, Fibbe WE. Immunomodulatory properties of mesenchymal stromal cells[J]. Blood, 2007, 110(10): 3499-3506.
78 Ren G, Zhang L, Zhao X, et al. Mesenchymal stem cell-mediated immunosuppression occurs via concerted action of chemokines and nitric oxide[J]. Cell Stem Cell, 2008, 2(2): 141-150.
79 Patel S, Meyer JR, Greco SJ, et al. Mesenchymal stem cells protect breast cancer cells through regulatory T cells:role of mesenchymal stem cell-derived TGF-beta[J]. J Immunol, 2010, 184(10): 5885-5894.
80 Ling W, Zhang J, Yuan Z, et al. Mesenchymal stem cells use IDO to regulate immunity in tumor microenvironment[J]. Cancer Res, 2014,74(5): 1576-1587.
81 Fechter K, Dorronsoro A, Jakobsson E, et al. IFNγ regulates activated Vδ2+T cells through a feedback mechanism mediated by mesenchymal stem cells[J]. PLoS One, 2017, 12(1): e0169362.
82 Ghosh T, Barik S, Bhuniya A, et al. Tumor-associated mesenchymal stem cells inhibit naive T cell expansion by blocking cysteine export from dendritic cells[J]. Int J Cancer, 2016, 139(9): 2068-2081.
83 Bruzzese L, Fromonot J, By Y, et al. NFκB enhances hypoxiadriven T-cell immunosuppression via upregulation of adenosine A(2A)receptors[J]. Cellular Signal, 2014, 26(5):1060-1067.
84 Stagg J, Smyth MJ. Extracellular adenosine triphosphate and adenosine in cancer[J]. Oncogene, 2010, 29(39):5346-5358.
85 De LM, Garcíarocha R, Moralesramírez O, et al. Mesenchymal stromal cells derived from cervical cancer produce high amounts of adenosine to suppress cytotoxic T lymphocyte functions[J]. J Transl Med, 2016,14(1):302.
86 Schuler PJ, Westerkamp AM, Kansy BA, et al. Adenosine metabolism of human mesenchymal stromal cells isolated from patients with head and neck squamous cell carcinoma[J]. Immunobiology, 2017, 222(1):66-74.
87 Lin R, Ma H, Ding Z, et al. Bone marrow-derived mesenchymal stem cells favor the immunosuppressive T cells skewing in a Helicobacter pylori model of gastric cancer[J]. Stem Cells Dev, 2013, 22(21): 2836-2848.
88 Hsu WT, Lin CH, Chian BL, et al. Prostaglandin E2 potentiates mesenchymal stem cell-induced IL-10+IFN-γ+CD4+regulatory T cells to control transplant arteriosclerosis[J]. J Immunol, 2013, 190(5):2372-2380.
89 Rashedi I, Gómez-Aristizábal A, Wang XH, et al. TLR3 or TLR4 activation enhances mesenchymal stromal Cell-Mediated Treg induction via Notch signaling[J]. Stem Cells, 2017, 35(1): 265-275.
90 Chiossone L, Conte R, Spaggiari GM, et al. Mesenchymal stromal cells induce peculiar alternatively activated macrophages capable of dampening both innate and adaptive immune responses[J]. Stem Cells,2016, 34(7): 1909-1921.
91 Shou P, Chen Q, Jiang J, et al. Type I interferons exert anti-tumor effect via reversing immunosuppression mediated by mesenchymal stromal cells[J]. Oncogene, 2016, 35(46): 5953-5962.
92 Choi SH, Stuckey DW, Pignatta S, et al. Tumor resection boosts therapeutic efficacy of encapsulated stem cells expressing a highly secretable variant of interferon-β in glioblastomas[J]. Clinical Cancer Res, 201723(22): 7047-7058.
93 Li W, Ren G, Huang Y, et al. Mesenchymal stem cells: a double-edged sword in regulating immune responses[J]. Cell Death and Differ, 2012,19(9):1505-1513.
94 Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age[J]. Nature, 2011, 480(7378): 480-489.
95 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].CA Cancer J Clin, 2016, 66(2):115-132.
96 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2): 87-108.
97 Holohan C, Van Schaeybroeck S, Longley DB, et al. Cancer drug resistance: an evolving paradigm[J]. Nat Rev Cancer, 2013, 13(10):714-726.
98 Housman G, Byler S, Heerboth S, et al. Drug resistance in cancer: an overview[J]. Cancers, 2014, 6(3): 1769-1792.
99 Kartal-Yandim M, Adan-Gokbulut A, Baran Y. Molecular mechanisms of drug resistance and its reversal in cancer[J]. Crit Rev Biotechnol,2016, 36(4): 716-726.
100 Mcmillin DW, Negri JM, Mitsiades CS. The role of tumourstromal interactions in modifying drug response: challenges and opportunities[J]. Nat Rev Drug Discov, 2013, 12(3): 217-228.
101 Maj M, Bajek A, Nalejska E, et al. Influence of mesenchymal stem cells conditioned media on proliferation of urinary tract cancer cell lines and their sensitivity to ciprofloxacin[J]. J Cell Biochem, 2017,118(6): 1361-1368.
102 Tian C, Zheng G, Zhuang H, et al. Microrna-494 activation suppresses bone marrow stromal Cell-Mediated drug resistance in acute myeloid leukemia cells[J]. J Cell Physiol, 2017, 232(6): 1387-1395.
103 Chen DR, Lu DY, Lin HY, et al. Mesenchymal stem Cell-Induced doxorubicin resistance in triple negative breast cancer[J]. BioMed Red Int, 2014(13): 532161.
104 Han Z, Jing Y, Xia Y, et al. Mesenchymal stem cells contribute to the chemoresistance of hepatocellular carcinoma cells in inflammatory environment by inducing autophagy[J]. Cell Biosci, 2014, 4(1): 22.
105 Yang H, Zheng Y, Zhang Y, et al. Mesenchymal stem cells derived from multiple myeloma patients protect against chemotherapy through autophagy-dependent activation of NF-κB signaling[J]. Leuk Res,2017, 60: 82-88.
106 Piya S, Andreeff M, Borthakur G. Targeting autophagy to overcome chemoresistance in acute myleogenous leukemia[J]. Autophagy, 2017,13(1): 214-215.
107 Kamga PT, Bassi G, Cassaro A, et al. Notch signalling drives bone marrow stromal cell-mediated chemoresistance in acute myeloid leukemia[J]. Oncotarget, 2016, 7(16): 21713-21727.
108 Ji RB, Zhang B, Zhang X, et al. Exosomes derived from human mesenchymal stem cells confer drug resistance in gastric cancer[J].Cell Cycle, 2015, 14(15): 2473-2483.
109 Wang S, Huang X, Lee CK, et al. Elevated expression of erbB3 confers paclitaxel resistance in erbB2-overexpressing breast cancer cells via upregulation of Survivin[J]. Oncogene, 2010, 29(29): 4225-4236.
110 Zhu L, Wang J, Zuo WM, et al. Mesenchymal stem cells drive paclitaxel-resistance in erbB2-overexpressing breast cancer cells via paracrine of NRG-1[J]. Cancer Research, 2016, 76(14 Supplemrnt):4091.
111 Bliss SA, Sinha G, Sandiford OA, et al. Mesenchymal stem Cell-Derived exosomes stimulate cycling quiescence and early breast cancer dormancy in bone marrow[J]. Cancer Res, 2016, 76(19): 5832-5844.
112 Cheteh EH, Augsten M, Rundqvist H, et al. Human cancer-associated fibroblasts enhance glutathione levels and antagonize drug-induced prostate cancer cell death[J]. Cell Death Dis, 2017,8(6): e2848.
113 Cai J, Wang J, Huang Y, et al. ERK/Drp1-dependent mitochondrial fission is involved in the MSC-induced drug resistance of T-cell acute lymphoblastic leukemia cells[J]. Cell Death Dis, 2016, 7(11): e2459.
114 Tebbutt N, Pedersen MW, Johns TG. Targeting the ERBB family in cancer: couples therapy[J]. Nat Rev Cancer, 2013, 13(9): 663-673.
115 Khamisipour G, Jadidi-Niaragh F, Jahromi AS, et al. Mechanisms of tumor cell resistance to the current targeted-therapy agents[J]. Tumor Biology, 2016, 37(8): 10021-10039.
116 Groenendijk FH, Bernards R. Drug resistance to targeted therapies:déjà vu all over again[J]. Mol Oncol, 2014, 8(6):1067-1083.
117 Wilson TR, Fridlyand J, Yan Y, et al. Widespread potential for growth factor-driven resistance to anticancer kinase inhibitors[J]. Nature, 2012,487: 505-509.
118 Straussman R, Morikawa T, Shee K, et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion[J].Nature, 2012, 487(748): 500-504.
119 Crawford Y, Kasman I, Yu LL, et al. PDGF-C mediates the angiogenic and tumorigenic properties of fibroblasts associated with tumors refractory to Anti-VEGF treatment[J]. Cancer Cell, 2009, 15(1): 21-34.
120 Mallampati S, Leng XH, Ma HQ, et al. Tyrosine kinase inhibitors induce mesenchymal stem cell-mediated resistance in BCR-ABL(+)acute lymphoblastic leukemia[J]. Blood, 2015, 125(19): 2968-2973.
121 Karjalainen R, Pemovska T, Popa M, et al. JAK1/2 and BCL2 inhibitors synergize to counteract bone marrow stromal cell-induced protection of AML[J]. Blood, 2017, 130(6): 789-802.
122 Harrington KJ, Billingham LJ, Brunner TB, et al. Guidelines for preclinical and early phase clinical assessment of novel radiosensitisers[J]. Br J Cancer, 2011, 105(5): 628-639.
123 Barker HE, Paget JT, Khan AA. The tumour microenvironment after radiotherapy: mechanisms of resistance and recurrence[J]. Nat Rev Cancer, 2015, 15(7): 409-425.
124 Kalluri R. The biology and function of fibroblasts in cancer[J]. Nat Rev Cancer, 2016, 16(9): 582-598.
125 Nicolay NH, Lopez Perez R, Saffrich R, et al. Radio-resistant mesenchymal stem cells:mechanisms of resistance and potential implications for the clinic[J]. Oncotarget, 2015, 6(23): 19366-19380.
126 Hellevik T, Pettersen I, Berg V, et al. Changes in the secretory profile of NSCLC-Associated fibroblasts after ablative radiotherapy: potential impact on angiogenesis and tumor growth[J]. Transl oncol, 2013, 6(1):66-74.
127 Grinde MT, Vik J, Camilio KA, et al. Ionizing radiation abrogates the pro-tumorigenic capacity of cancer-associated fbroblasts co-implanted in xenografs[J]. Sci Rep, 2017,7: 46714.
128 Wang HH, Cui YL, Zaorsky NG, et al. Mesenchymal stem cells generate pericytes to promote tumor recurrence via vasculogenesis after stereotactic body radiation therapy[J]. Cancer Lett, 2016,375(2):349-359.
129 Alessio N, Capasso S, Di Bernardo GA, et al. Mesenchymal stromal cells having inactivated RB1 survive following low irradiation and accumulate damaged DNA: Hints for side effects following radiotherapy[J]. Cell Cycle, 2017, 16(3): 251-258.
130 De Araujo Farias V, O'valle F, Alonso Lerma BA, et al. Human mesenchymal stem cells enhance the systemic effects of radiotherapy[J]. Oncotarget, 2015, 6(31):31164-31180.
131 Li Z, Fan D, Xiong D. Mesenchymal stem cells as delivery vectors for antitumor therapy[J]. Stem Cell Investig, 2015, 2: 6.
132 Sage EK, Thakrar RM, Janes SM, et al. Genetically modified mesenchymal stromal cells in cancer therapy[J]. Cytotherapy, 2016,18(11): 1435-1445.
133 Johnstone RW, Frew AJ, Smyth MJ. The TRAIL apoptotic pathway in cancer onset, progression and therapy[J]. Nat Rev Cancer, 2008, 8(10):782-798.
134 林榕, 左伟敏, 祝玲, 等. 人肿瘤坏死因子相关凋亡诱导配体稳定过表达基因工程修饰人脐带间充质干细胞亚细胞系的建立[J/CD]. 中华细胞与干细胞杂志:电子版, 2015, 5(4):12-17.
135 Grisendi G, Bussolari R, Cafarelli L, et al. Adipose-Derived mesenchymal stem cells as stable source of tumor necrosis Factor-Related Apoptosis-Inducing ligand delivery for cancer therapy[J].Cancer Res, 2010, 70(9): 3718-3729.
136 Xia L, Peng R, Leng W, et al. TRAIL-Expressing Gingival-Derived mesenchymal stem cells inhibit tumorigenesis of tongue squamous cell carcinoma[J]. J Dent Res, 2015, 94(1): 219-228.
137 Yan F, Li X, Li N, et al. Immunoproapoptotic molecule scFv-Fdt-tBid modified mesenchymal stem cells for prostate cancer dual-targeted therapy[J]. Cancer Lett, 2017, 402: 32-42.
138 Pacioni S, Alessandris QG, Giannetti S, et al. Mesenchymal stromal cells loaded with paclitaxel induce cytotoxic damage in glioblastoma brain xenografts[J]. Stem Cell Res Ther, 2015,6: 194.
139 Rincon E, Cejalvo T, Kanojia D, et al. Mesenchymal stem cell carriers enhance antitumor efficacy of oncolytic adenoviruses in an immunocompetent mouse model[J]. Oncotarget, 2017, 8(28): 45415-45431.
140 Munoz JL, Bliss SA, Greco SJ, et al. Delivery of functional AntimiR-9 by mesenchymal stem cell-derived exosomes to glioblastoma multiforme cells conferred chemosensitivity[J]. Mol Ther Nucleic Acids, 2013, 2: e126.

