神经祖细胞与纤维蛋白支撑物移植对老年痴呆模型鼠的记忆认知功能改善及其机理探究
,
阿尔茨海默病(Alzheimer's disease,AD)是一种老年中枢神经退行性疾病,其特征在于记忆、语言和认知功能逐渐丧失。据估计,在美国超过3﹪ ~5﹪65岁以上的人患有AD,人数多达500 多万,全世界AD患者超过4 000万人[1-2]。在我国,已有大约900万人不同程度地患有AD。AD发生的主要病理改变是大脑海马区域神经细胞内出现Aβ和Tau组成的变性蛋白聚集体,从而引起神经细胞的退行性改变[3]。目前没有根治AD的药物[4-6],细胞治疗为AD治疗提供极大的临床治疗希望。
干细胞研究表明,发育中的大脑存在神经发生,成人中枢神经系统中也存在神经祖细胞(neural progenitor cells,NPCs)[7-8]。因此,干细胞移植可修复受损的中枢神经系统,进而治疗神经系统相关疾病,特别是神经变性疾病,比如AD[9]。移植的干细胞来源主要包括胚胎干细胞[10-11],神经干细胞[12-14],成体骨髓间充质干细胞,成体脐带间充质干细胞[15-18]和诱导多能干细胞[19-24]等。在本实验中,用到的是免疫排斥小,效果好,易获得的胎脑中的NPCs,通过加入提高细胞存活和加强细胞神经分化的细胞因子,以研究其对老年痴呆模型鼠记忆认知功能的改善及其机理的探究。Lu等[25]将多种生长因子创新性的组合在一起加入到神经干细胞中用于治疗脊髓损伤模型大鼠,并取得了突破性研究。在本实验中,首次将多种生长因子及纤维蛋白复合物组合在一起,并与NPCs移植入AD模型鼠中,以期观察移植的NPCs在AD模型鼠脑内的存活并向特定神经元分化。
材料与方法
一、主要材料及试剂
1.实验动物:实验性SPF级C57BL/6J雄鼠20 只,孕鼠10只,购自济南朋悦公司。SPF级APP/ PS1双转基因鼠50只,6到7月龄,购自北京华阜康公司。
2.实验试剂:DMEM/F12基础培养基、L-谷氨酰胺(L-Glutamine)、非必需氨基酸(non-essential amino acid、NEAA)、青霉素-链霉素(penicillin streptomycin,PS)、成纤维细胞生长因子(fibroblast growth factor,bFGF)、表皮细胞生长因子(epidermal growth factor,EGF)购自 美 国 Invitrogen公 司;脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)、神经营养因子-3(neurotrophin-3,NT-3)、血小板衍生生长因子(platelet derived growth factor,PDGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、肝细胞生长因子(hepatocyte growth factor,HGF)、类胰岛素样生长因子(insulin-like growth factors-1,IGF-1)购自美国Peprotech公司;MDL28170、纤维蛋白原(Fibrinogen)、凝血酶(Thrombin)购自美国Sigma公司;一抗:抗MAP2抗体,抗Tuj1抗体,抗ChAT抗体及抗GFAP抗体;二抗:抗兔lgG Cy-3抗体及抗鼠lgG 488抗体均购自美国Jackson ImmunoResearch公 司;Hoechst 33342购自美国Sigma公司;培养瓶、离心管、刻度吸管购自美国Corning公司。
二、实验方法
1. NPCs分离与培养:所有涉及到动物模型的研究都经聊城市人民医院医学伦理委员会批准(2014010)。取胎龄10 d的C57BL/6J孕鼠,断颈处死,将鼠脑置于预冷PBS中,剥离脑膜,分离海马区,机械法剪碎组织,然后加入脱氧核糖核酸酶Ⅰ工作液,用滴管吹打至单细胞悬液,400目滤网过滤,离心弃上清液,加入DMEM/F12洗涤1次,最后加入含 1 ﹪ PS、2 ﹪ B27、20 µg/L EGF 和 20 µg/ L bFGF的DMEM/F12完全培养基,将细胞接种于10 cm培养皿,于37 ℃,5 ﹪ CO2培养箱中培养。
原代培养的NPCs在无血清的培养基中生长在前2 ~ 4 d时大部分死亡,到第7天左右,可发现由2 ~ 3个细胞组成的细胞团,培养至第14天左右时,在每个培养皿中均可发现数十至上百个呈悬浮生长的神经球。将包装好的GFP慢病毒液(滴度1.0×108cfu/ml)加入到神经球培养皿中,获得带有GFP荧光标记的NPCs。
传代的方法:用吸管将培养皿中的细胞悬液收集到15 ml的离心管中,400×g离心5 min,弃除上清,加入新鲜的NPCs培养液,用吸管轻轻吹打至大神经球分散为小的神经球或单个神经细胞,按照1:3的比例传代后继续培养。
2. NPCs体外分化与免疫荧光染色:将细胞悬液400×g离心5 min弃上清,加入Accutase 37 ℃,消化10 min,然后用吸管轻轻吹打神经球至单个细胞,将其接种到涂有poly-L-ornithine/Liminin的24 孔板中,细胞密度为5×104个/孔。NPCs体外分化培养基为含有1﹪双抗、2﹪B27的DMEM/ F12培养基。
细胞分化3 d后,用4﹪多聚甲醛固定,磷酸盐缓冲盐水(PBS)洗涤,然后用含有10﹪正常山羊血清和0.1﹪Triton-X的PBS在室温下孵育1 h,后将细胞与一抗 [MAP2,1:500 ;Tuj1,1:500 ;胆碱乙酰基转位酶(choline acetyltransferase,ChAT),1:250和GFAP,1:250,均在4 ℃封闭溶液过夜。抗兔lgG Cy-3与抗鼠lgG 488分别用作二抗,在室温孵育2 h。细胞核用DNA特异性荧光染料Hoechst 33342。
3.脑立体定位仪移植分离的NPCs:采用P4 ~P5代细胞,将细胞混悬液浓度调整为2.5×105个/µl,分为A、B两管,各加入10种细胞因子(BDNF、VEGF、PDGF、HGF、EGF、bFGF、NT-3、GDNF、IGF-1及MDL28170),分别向A管中加入纤维蛋白原,B管中加入凝血酶(纤维蛋白原在凝血酶的作用下转变为纤维蛋白,将移植的细胞固定在注射部位)。随机将AD模型鼠分为3组,每组10只,分为NPCs+因子组、因子组及PBS组,利用脑立体定位仪向AD模型鼠两侧海马位置(AP : 2.06,ML : 1.75,DV : 1.75)定向移植NPCs,一侧孔分别注射管A 2 µl,管B 2 µl。其余各组相同方法处理。术后3 d密切注意小鼠饮食,健康状况。
4. Morris水迷宫记忆行为检测:Morris水迷宫实验装置由圆形水池、平台、摄像系统以及动物行为轨迹分析系统smart 3.0组成。水池直径为120 cm,高50 cm。池壁上有N,E,S,W 4个等距离点,将水池分为NE,SE,SW,NW 4个区域。水迷宫实验过程分为连续5 d的定位巡航实验和第6天的空间探索实验两部分。每天训练4次,每次使小鼠在不同区域下水,平台即第5 区域,位于第4 区域内。每次游泳时间60 s,每次训练间隔1 h左右。小鼠没有找到平台按60 s计算潜伏期。定位巡航实验检测小鼠学习获得能力,空间探索实验检测小鼠空间记忆能力。用此方法对3个实验组的AD模型鼠进行行为检测,对照组为未做任何处理的同月龄C57BL/6J小鼠。移植细胞1个月后,进行行为测试,随后每隔1个月进行1次检测,持续6个月。
5.新物体识别实验:训练时将2个相同的物体置于同一测试盒内,让被测试动物在测试盒内探求10 min。1 h后换掉其中1个物体(新物体在测试盒内的位置保持不变),然后将被测试动物再次置于测试盒内,考察其能否识别出其中一个物体是新物体。如果动物对已接触过的物体有记忆,在测试的过程中它闻嗅新物体的时间占总闻嗅时间的百分比会明显高于旧物体。50﹪代表小鼠对新旧物体的探究时间相同。
6.免疫组化:行为检测结束后,将AD模型鼠麻醉灌流,取脑组织,在4﹪多聚甲醛中浸泡并固定24 h后,30﹪蔗糖溶液脱水24 ~ 48 h,然后包埋在Tissue-Tek OTC中并用低温切片机切成20 µm的薄片。切片分别用NPCs增殖标志分子BrdU抗体、神经胶质细胞标志分子GFAP抗体,胆碱能神经元标志分子ChAT抗体,4 ℃过夜孵育。PBS冲洗后,用荧光标记的二抗Alexa Fluor 488或Cy3室温孵育3 ~ 4 h,然后用细胞核抗体Hoechest33258孵育5 min。用荧光显微镜或激光扫描共聚焦显微镜观察结果。
7. Western blot:AD模型鼠麻醉生理盐水灌流,取脑组织,分离海马及皮层,移入EP管中,加入适量RIPA裂解液冰上裂解10 min;超声破碎组织(50 Hz,1 min),500×g,4 ℃离心 15 min,吸取上清液;用BCA法定量测定蛋白浓度;将配制好的蛋白样本于100 ℃恒温加热器上变性10 min 后冰上放置,进行SDS-PAGE 蛋白电泳,半干转将蛋白转移至硝酸纤维素膜,室温封闭1 h,TBST 洗膜2 ~ 3次,每次 5 ~ 10 min;室温孵育一抗 2 ~ 3 h 或者 4 ℃孵育过夜,回收抗体后,TBST洗3次,每次5 min;室温孵育二抗1.5 ~ 2 h或者4 ℃孵育过夜,回收抗体后,TBST洗3次,每次5 ~ 10 min;ECL法显色,拍照,保存数据。
三、统计学分析方法
采用GraphPad Pad 7.0软件进行统计学处理。各组实验动物水迷宫逃避潜伏期、跨平台次数结果采用±s表示,组间比较采用F检验进行统计学分析,以P < 0.05为差异有统计学意义。
结 果
一、NPCs原代培养
胚胎来源呈悬浮生长的神经球,胞体体积较大,胞浆颜色较深,胞核(胞浆)比例比较大,组成神经球的细胞胞体大小基本一致,且每个神经球的大小基本也一致,形态规则,无突起生长,为典型的神经球形态(图1)。
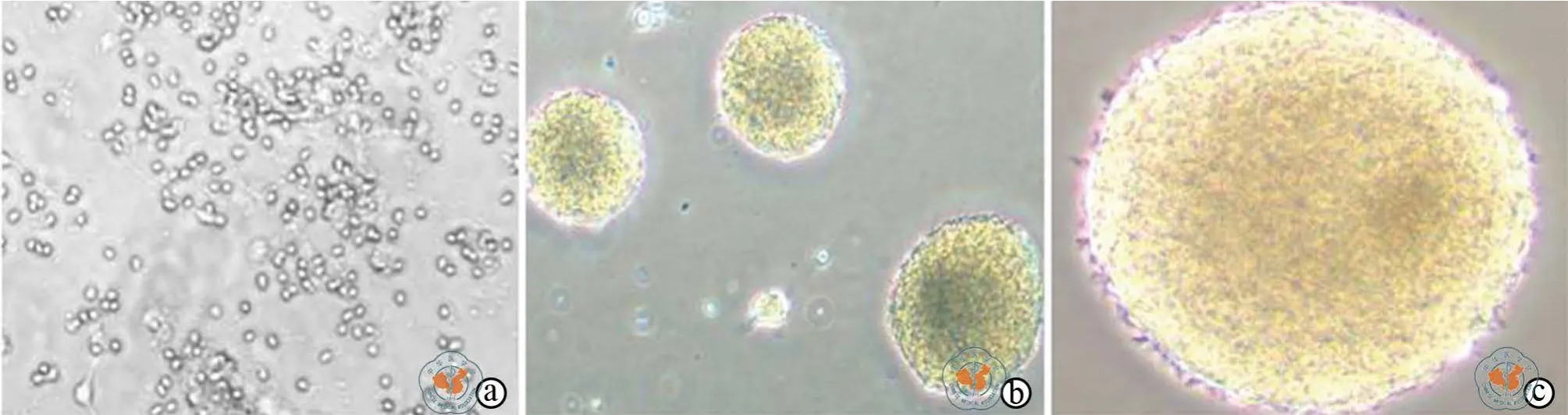
图1 倒置显微镜观察原代培养的胎脑神经祖细胞形成神经球的过程(×100)
二、NPCs体外分化与免疫荧光染色
将神经球取出,Accutase消化,用吸管轻轻吹打神经球至其分散为单个细胞,将其接种到涂有poly-L-ornithine/Liminin的24孔板中。分化3 d后,细胞表达神经元细胞特异生物标志物TUJ1与MAP2,及胆碱能神经元细胞特异生物标志物ChAT,部分细胞还表达星形胶质细胞特异生物标志物GFAP(图2)。
三、记忆认知功能检测情况
1.水迷宫实验测试结果:随着连续5 d的训练,所有小鼠寻找平台所需时间均有降低。于第5天,对实验组各组进行定位巡航实验,得出各组逃避潜伏期结果(表1),结果显示NPCs+因子组,以及因子组与PBS组比较,逃避潜伏期均有下降,表明两组的AD模型鼠学习记忆能力均有改善(P < 0.05)。24 h后,撤掉平台,进行空间探索实验,得出各组跨平台次数,NPCs+因子组、因子组与PBS组比较,都有升高,表明两组实验鼠记忆保持能力也有提高(图3)。
表1 AD模型鼠各组与WT组定位巡航实验逃避潜伏期(s,±s)

表1 AD模型鼠各组与WT组定位巡航实验逃避潜伏期(s,±s)
注:与 NPCs+因子组比较,aP < 0.05;与因子组比较,bP < 0.05;与对照组比较,cP < 0.05

图3 各实验组空间探索实验逃避潜伏期及跨平台次数
连续进行6个月水迷宫行为测试,得出各实验组逃避潜伏期时间变化曲线(图4)。实验结果表明,随着时间延长,因子组实验鼠的记忆能力逐渐减弱,移植细胞组的记忆改善能力仍维持移植初水平,表明移植入的NPCs细胞在AD模型鼠脑内存活,并对其记忆的改善能力发挥持续性效果。
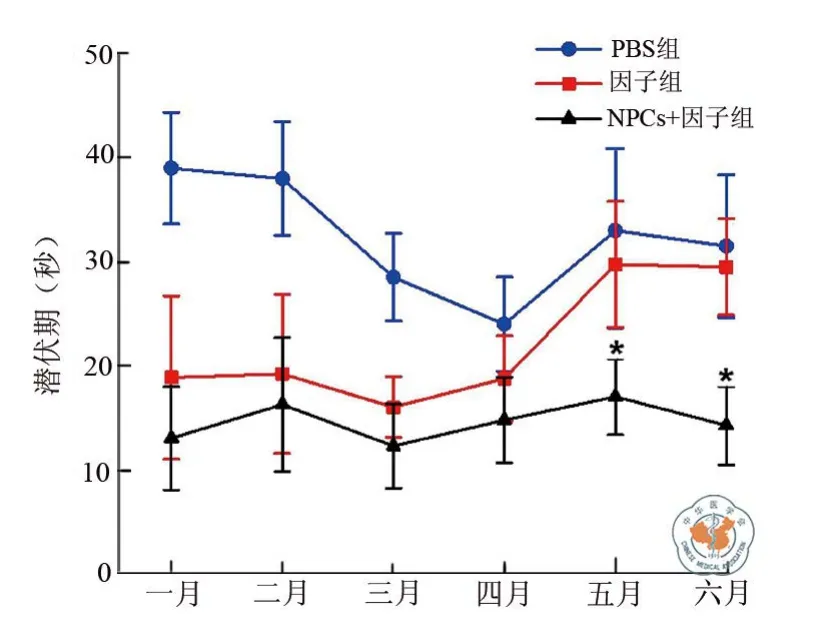
图4 不同时间各实验组逃避潜伏期变化
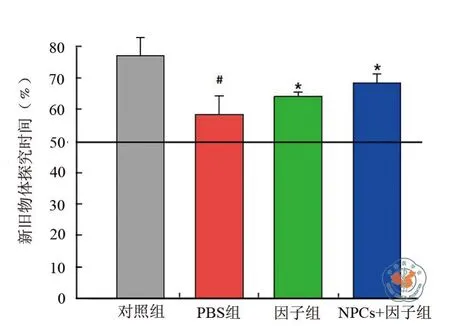
图5 各实验组新物体识别实验结果
2.新物体识别实验测试结果:各实验组对新物体探究时间占总探究时间百分比结果中(图5),NPCs+ 因子组为(68.46 ± 2.40)﹪,因子组为(65.20±1.03)﹪,PBS 组为(54.47 ± 4.79)﹪,野生对照组为(77.10 ± 4.02)﹪,其中NPCs+因子组高于PBS组(F = 3.983,P = 0.018),因子组同样高于PBS组(F = 21.63,P = 0.042)。表明两组小鼠对新物体识别记忆能力均得到改善。
四、免疫组化结果
将分离的NPCs与GFP荧光标记共染后,注射到AD模型鼠海马位置,行为检测结束后处死取脑,得HE结果和免疫荧光结果(图6)。ChAT荧光染色检测各实验组与对照组小鼠脑内胆碱能神经元分化情况(图7)。
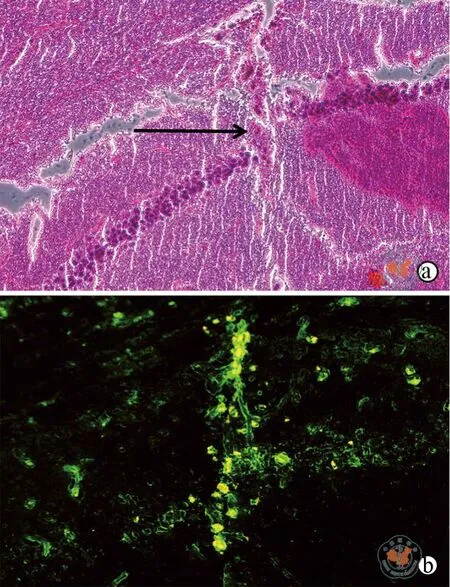
图6 倒置荧光显微镜下观察NPCs在AD模型鼠脑内海马部位存活情况(×200)

图7 倒置荧光显微镜下观察各实验组脑内胆碱乙酰基转位酶染色情况(×200)
五、Western blot结果
提取各实验组AD模型鼠及对照组老鼠脑内海马部位,进行Western blot检测,得出各实验组ChAT表达情况对比(图8)。
讨 论
在过去十年中,几乎所有以针对β-淀粉样蛋白(β-Amyloid)斑块的药物治疗AD在临床试验中都失败了,表明需要采取新的方法来改善AD患者的学习和认知功能。NPCs是能够分化为神经元和胶质细胞从而来代替损伤的神经细胞,并分泌神经营养分子调节恢复AD患者的记忆和认知功能。
分离了小鼠胎脑NPCs并联合细胞因子共同移植到AD模型鼠中,发现能够明显改善AD小鼠的记忆认知功能。免疫荧光及Western blot结果显示,在移植NPCs的区域,即AD模型鼠海马区,移植的NPCs不仅能够长时间存活,而且通过分化成了功能性的胆碱能神经元来改善AD模型鼠的记忆认知功能。表明NPCs能够作为治疗老年痴呆的潜在细胞来源。
此外,创新性的使用纤维蛋白支架(联合使用纤维蛋白原与凝血酶)的方法保证了移植入AD模型鼠脑内的NPCs和营养因子成分能够被固定在移植的海马区域内,发挥其特定功能。动物行为检测的结果也证明了AD模型鼠的认知记忆功能得到明显改善,而且这种改善能力可以持续4到6个月甚至更长的时间。说明了这种纤维蛋白支架对于NPCs的生长分化存活有明显支持作用,而且对AD模型鼠记忆功能改善的长时间维持也有着十分明显的效果。
NPCs与纤维蛋白支撑物联合多种营养因子移植明显改善老年痴呆模型鼠的记忆认知功能,该实验揭示了治疗老年痴呆另一条更有效,更可行的治疗途径。而对于其改善记忆认知功能的原理仍需进一步实验探究。
1 Holtzman DM, Morris JC, Goate AM. Alzheimer's disease:the challenge of the second century[J]. SciTransl Med, 2011, 3(77):77sr1.
2 Barnes DE, Yaffe K. The projected effect of risk factor reduction on Alzheimer's disease prevalence[J]. Lancet Neurol, 2011, 10(9):819-828.
3 Goldstein LS. Axonal transport and neurodegenerative disease:can we see the elephant?[J]. ProgNeurobiol, 2012, 99(3):186-190.
4 Gilman S, Koller M, Black RS, et al. Clinical effects of A beta immunization (AN1792) in patients with AD in an interrupted trial[J].Neurology, 2005, 64(9):1553-1562.
5 Rinne JO, Brooks DJ, Rossor MN, et al. 11C-PiB PET assessment ofchange in fbrillar amyloid-beta load in patients with Alzheimer's diseasetreated with bapineuzumab:a phase 2,double-blind,placebocontrolled,ascending-dose study[J]. Lancet Neurol, 2010, 9(4):363-372.
6 Mullane K, Williams M. Alzheimer's therapeutics:continuedclinic alfailures question the validity of the amyloid hypothesis-but what liesbeyond?[J]. Bio chem Pharmacol, 2013, 85(3):289-305.
7 Taupin P. The therapeutic potential of adult neural stem cells[J]. Curr Opin Mol Ther, 2006, 8(3):225-231.
8 Yamasaki TR, Blurton-Jones M, Morrissette D, et al. Neural stem cells improve memory in an inducible mousemodel of neuronal loss[J]. J Neurosci, 2007, 27(44):11925-11933.
9 张青, 周翠冰, 戴一凡, 等. 神经细胞异种移植的研究进展[J]. 器官移植, 2017, 8(4):83-87.
10 Tang J, Xu H, Fan X, et al. Embryonic stem cell-derived neural precursor cells improve memory dysfunction in Abeta(1-40)injured rats[J]. Neurosci Res, 2008, 62(2):86-96.
11 Moghadam FH, Alaie H, Karbalaie K, et al. Transplantation of primed or unprimed mouse embryonicstem cell-derived neural precursor cells improves cognitive function in Alzheimerian rats[J]. Differentiation,2009, 78(2-3):59-68.
12 Blurton-Jones M, Kitazawa M, Martinez-Coria H, et al. Neural stem cells improve cognition via BDNF in a transgenic model of Alzheimer disease[J]. Proc Natl Acad Sci U S A, 2009, 106(32):13594-13599.
13 Njiee G, Kantorovich S, Astary GW, et al. A preclinical assessmentof neural stem cells as delivery vehicles for anti-amyloid therapeutics[J].PLoS One, 2012, 7(4):e34097.
14 Zhang W, Wang PJ, Sha HY, et al. Neural stem cell transplants improve cognitive function without altering amyloid pathology in an APP/PS1 double transgenic model of Alzheimer's disease[J]. Mol Neurobiol,2014, 50(2):423-437.
15 Bae JS, Jin HK, Lee JK, et al. Bone marrow-derivedmesenchymal stem cells contribute to the reduction of amyloid-betadeposits and the improvement of synaptic transmission in a mousemodel of predementia Alzheimer's disease[J]. Curr Alzheimer Res, 2013, 10(5):524-531.
16 Lee JK, Jin HK, Bae JS. Bone marrow-derived mesenchymal stem cellsreduce brain amyloid-beta deposition and accelerate the activation ofmicroglia in an acutely induced Alzheimer's disease mouse model[J].NeurosciLett, 2009, 450(2):136-141.
17 Lee JK, Jin HK, Endo S, et al. Intracerebral transplantation of bone marrow-derived mesenchymal stem cells reduces amyloid-beta deposition and rescues memory deficits in Alzheimer's disease mice by modulation of immune responses[J]. Stem Cells, 2010, 28(2):329-343.
18 Malm TM, Koistinaho M, Parepalo M, et al. Bone-marrow-derivedcells contribute to the recruitment of microglial cells in response tobetaamyloid deposition in APP/PS1 double transgenic Alzheimermice[J].Neurobiol Dis, 2005, 18(1):134-142.
19 Duff K, Suleman F. Transgenic mouse models of Alzheimer's disease:how useful have they been for therapeutic development?[J].Brief Funct Genomic Proteomic, 2004, 3(1):47-59.
20 Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stemcells from adult human fibroblasts by defined factors[J]. Cell,2007, 131(5):861-872.
21 Yu JY, Hu KJ, Smuga-Otto K, et al. Human induced pluripotent stem cells free of vector and transgene sequences[J]. Science, 2009,324(5928):797-801.
22 Park IH, Arora N, Huo H, et al. Disease-specific induced pluripotent stem cells[J]. Cell, 2008, 134(5):877-886.
23 Zhou T, Benda C, Dunzinger S, et al. Generation of human induced pluripotent stem cells from urine samples[J]. Nat Protoc, 2012,7(12):2080-2089.
24 Fabin Han, Wei Wang, et al. Human induced pluripotent stem cell-derived neurons improve motorasymmetry in a 6-hydroxydopamineeinduced rat model of Parkinson's disease[J].Cytotherapy, 2015, 17(5):665-679.
25 Lu P, Graham L, Wang Y, et al. Promotion of survival and differentiation of neural stem cells with fibrin and growth factor cocktails after severe spinal cord injury[J]. J Vis Exp, 2014, 89:e50641.

