丁苯酞对七氟醚诱导神经细胞损伤的保护作用
鲁瑞涛
七氟醚是临床麻醉中较为常用的一种吸入性全身麻醉药物,近年来,有学者研究显示,七氟醚吸入麻醉可能引起患者机体中枢神经系统神经细胞的损伤,尤其对于儿童而言,由于中枢神经系统属于发育期,可导致神经细胞凋亡而造成其学习、记忆等认知功能异常[1-3]。丁苯酞(BNP)是一种从芹菜籽中提取后经人工合成的消旋体,是我国心脑血管领域中第一个拥有自主知识产权的新药[4-5]。国内外大量研究结果显示,BNP在神经细胞以及中枢神经系统保护方面具有着积极的作用,能够有效改善慢性痴呆大鼠学习记忆成绩[6-7]。而关于BNP对改善七氟醚麻醉后神经细胞损伤的作用,目前尚无研究报道。本研究探讨分析BNP对七氟醚诱导神经细胞损伤的影响 ,现报道如下。
材料与方法
一、主要仪器及试剂
丁苯酞氯化钠注射液(石药集团恩必普药业有限公司,H20100041);七氟醚(中国Baxter公司,纯度 > 98﹪);噻唑蓝 MTT(美国 Sigma公司);Annexin V-FITC试剂盒(南京凯基生物科技发展有限公司);anti-GAPDH(美国 Abcam 公司);anti-Bcl-2(美国 Abcam公司);anti-Bax(美国 Abcam公司);anti-Caspase-3(美国Abcam公司);免疫印迹试剂(碧云天生物技术公司);细胞培养液(美国Gbico Invitrogen公司)。FACS Calibur流式细胞仪(美国BD公司);电泳仪(美国Bio-rad公司);电转仪(美国Bio-rad公司);倒置显微镜(日本Olympus公司)。
二、方法
(一)细胞培养
将孕18 d大鼠用乙醚麻醉后取其胎鼠,将胎鼠置于HBSS培养皿内将其海马组织取出。将取出的胎鼠海马组织置于0.125﹪胰酶内,并放于培养箱内消化10 min。在4 ℃条件下100×g离心8 min,弃去上清液,然后加入DMEM将其缓慢摇匀,接种细胞密度为4×105个/ml。置于培养箱内培养,每隔2 ~ 3 d进行半量换液,体外培养至7 d进行七氟醚分组处理。
(二)分组方法
将细胞分为5组,分别为对照组、七氟醚组、低剂量BNP组、中剂量BNP组以及高剂量BNP组。对照组为正常培养的神经细胞;七氟醚组接入3﹪七氟醚混合气体进行培养;低剂量BNP组在培养基中加入浓度1 μmol/L的BNP处理6 h,再接入3﹪七氟醚混合气体;中剂量BNP组在培养基中加入浓度5 μmol/L的BNP处理6 h,再接入3﹪七氟醚混合气体;高剂量BNP组在培养基中加入浓度101 μmol/L的BNP处理6 h,再接入3﹪七氟醚混合气体。
(三)MTT法检测细胞生存率
分别于通气处理0、24、48以及72 h时采用MTT法检测细胞增殖率,加入MTT至终浓度为1 mg/ml,置于孵箱内继续培养4 h。小心弃去培养液,加入100 μl DMSO摇匀,在450 nm下检测各组细胞吸光度值,每组细胞均设置5个复孔。
(四)流式细胞技术检测细胞凋亡
各组细胞通气处理48 h,使用PBS洗涤3次,每次洗涤5 min,使用不含EDTA的0.25﹪胰酶消化液将细胞轻轻吹打至悬浮状态。然后加入100 μl缓冲液,5 μl Annexin V-FITC,5 μl碘化丙啶(PI),将其置于4 ℃环境下避光孵育15 min后,加入400 μl缓冲液,上机检测。每个实验重复3次。
(五)Western bolt检测蛋白表达
采用Western blot技术检测各组通气处理48 h后Bcl-2、Bax以及Caspase-3蛋白表达情况。使用SDS-PAGE胶电泳分离蛋白,然后使用电转仪法将蛋白转移至PDVF膜上,5 ﹪脱脂牛奶封闭2 h,4 ℃摇床孵育一抗过夜。使用PBST洗膜后孵育二抗,在室温下轻摇2 h。曝光后使用胶片进行显影分析,每个实验重复3次。
三、统计学分析方法
采用SPSS 22.0统计学软件进行数据处理分析,细胞生存率、细胞凋亡率采用±s表示,两组间比较采用t检验,两组以上比较采用方差分析,以P <0.05为差异具有统计学意义。
结 果
一、MTT法检测细胞生存率
24,48,72 h,七氟醚同期处理各组细胞生存率较对照组明显降低(P < 0.05),而BNP各处理组细胞生存率高于单纯七氟醚处理组(P < 0.05),且随着BNP 浓度的升高,细胞生存率升高(P < 0.05,表1)。
表1 通气处理后不同时间MTT法检测丁苯酞对神经细胞生存率的影响(﹪, ±s)

表1 通气处理后不同时间MTT法检测丁苯酞对神经细胞生存率的影响(﹪, ±s)
注 :与对照组比较,aP < 0.05;与七氟醚组比较,bP < 0.05;与低剂量 BNP 组比较,cP < 0.05;与中剂量 BNP 组比较,dP < 0.05
二、流式细胞技术检测细胞凋亡
采用流式细胞技术检测各组神经细胞凋亡情况,采用七氟醚通气处理的各组神经细胞凋亡率均高于对照组 [七氟醚组(67.49±7.92)﹪,低剂量BNP组(60.72±8.33)﹪,中剂量 BNP组(44.95±7.21)﹪,高 剂 量 BNP组(31.86±6.50),对照组(19.42±4.58)﹪,P < 0.05],而采用 BNP处理的各组神经系统凋亡率低于七氟醚组(P <0.05),且随着 BNP剂量的增加,凋亡率降低(P <0.05,图1)。

图1 各组细胞凋亡情况分析
三、Western blot技术检测蛋白表达
采用Western blot技术检测各组细胞蛋白表达情况,结果显示,七氟醚通气各组细胞Bcl-2表达较对照组降低,而BNP处理各组细胞Bcl-2表达较七氟醚组有所升高,且随着BNP剂量增加Bcl-2表达增加;七氟醚通气各组细胞Bax以及Caspase-3蛋白表达较对照组增加,而BNP处理各组细胞Bax以及Caspase-3蛋白表达较七氟醚组有所降低,且随着BNP浓度的升高Bax以及Caspase-3蛋白表达降低(图2)。
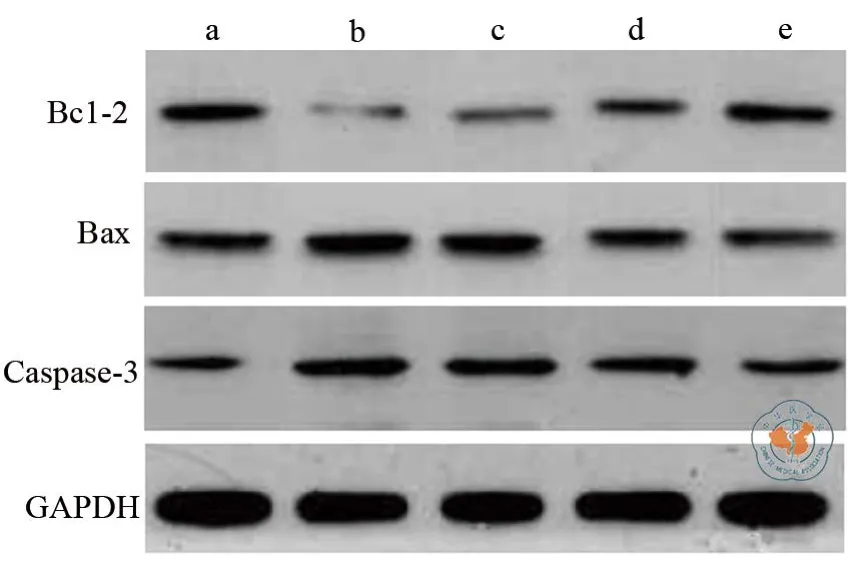
图2 Western blot技术检测各组细胞蛋白表达
讨 论
多项研究结果显示,常用的临床吸入性麻醉药物七氟醚可引起机体神经细胞凋亡以及与之相关的学习记忆等认知功能异常,因此对于临床麻醉药物产生的神经毒性已经成为了临床麻醉工作中亟待解决的难题[8-12]。BNP作为一种多功能的靶向治疗药物,多项研究结果均显示,BNP具有预防神经细胞凋亡的作用[13-15]。因此笔者推测,是否能够将BNP运用于缓解七氟醚所引起的神经细胞损伤。
本研究探讨分析BNP对七氟醚诱导神经细胞损伤的影响,研究分离胎鼠神经细胞,采用MTT法检测结果显示,采用七氟醚通气处理神经细胞后,神经细胞生存率明显降低,进一步表明七氟醚可诱导神经细胞的损伤。此外,采用BNP预处理的各组神经细胞,其生存率均较未处理的七氟醚组有明显改善,其中随着BNP浓度的增加,神经细胞生存率明显增高,提示BNP预处理能够对神经细胞起到一定的保护作用[16-17]。此外,采用流式细胞技术检测各组细胞凋亡情况,结果显示,使用七氟醚通气处理后的各组神经细胞凋亡率明显升高,而采用BNP预处理的各组细胞凋亡率较单纯七氟醚组有所降低,同时随着BNP剂量的升高凋亡率明显降低。表明七氟醚可诱导神经神经损伤,主要表现为诱导神经细胞凋亡,而BNP对神经细胞损伤的保护作用则体现为抑制七氟醚诱导的神经细胞凋亡。采用Western bolt技术检测各组细胞蛋白表达情况,结果显示,七氟醚可抑制神经细胞Bcl-2蛋白表达,增加Bax蛋白、Caspase-3蛋白表达。Caspase-3是多种凋亡途径的共同下游效应蛋白和重要的凋亡执行者;而Bcl-2蛋白的过表达能够有效抑制细胞的凋亡,Bax则通过抑制Bcl-2蛋白活性而促进细胞凋亡作用[18-20]。七氟醚对神经细胞Bcl-2的抑制以及Bax、Caspase-3的促进,从而诱导神经细胞发生凋亡。BNP处理后,与单纯七氟醚组比较,可促进Bcl-2表达,而抑制Bax、Caspase-3表达,从而减少七氟醚所诱导的细胞凋亡。
综上所述,七氟醚可诱导神经细胞凋亡,从而对神经系统造成损伤,而BNP则可有效抑制七氟醚诱导的神经细胞凋亡,对神经系统损伤具有保护作用,其可能的机制与促进Bcl-2蛋白表达,抑制Bax、Caspase-3蛋白表达有关。
1 王娟, 王李瑶, 颜贝, 等. 硒蛋白H减缓谷氨酸对神经细胞损伤的作用[J]. 临床与实验病理学杂志, 2016, 32(10):1130-1134.
2 刘嘉婧, 曹宁, 翟晶磊, 等. 骨髓间充质干细胞对冈田酸致神经细胞损伤的修复作用[J]. 解放军医学杂志, 2017, 42(5):377-382.
3 Hung HA, Sun GN, Keles S, et al. Dynamic regulation of schwann cell enhancers after peripheral nerve injury[J]. J Biol Chem, 2015,290(11):6937-6950.
4 何士科, 林莉, 蔡学礼. 单唾液酸神经节苷脂注射液联合依达拉奉注射液对抗脑缺血性神经细胞损伤的作用[J]. 中国临床药理学杂志,2017, 33(11):992-995.
5 Chen PW, Piao XH, Bonaldo P. Role of macrophages in Wallerian degeneration and axonal regeneration after peripheral nerve injury[J].Acta Neuropathol, 2015, 130(5):605-618.
6 沈蓓, 袁冬平, 伍城颖, 等. 芡实提取物对SH-SY5Y神经细胞损伤的保护作用及体外抗氧化活性研究[J]. 南京中医药大学学报, 2013,29(1):39-43.
7 Wang Y, Zhang P, Yin X, et al.Characteristics of peripheral nerve regeneration following a second nerve injury and repair[J]. Artif Cells Blood Substit Immobil Biotechnol, 2012, 40(4): 296-302.
8 Wang B, He L, Cu B, et al. Protection of ginsenoside Rg1 on central nerve cell damage and the influence on neuron apoptosis[J]. Pak J Pharm Sci, 2014, 27(6 Suppl):2035-2040.
9 刘展, 刘彦锋. 白藜芦醇对七氟醚诱导神经细胞损伤的影响[J]. 临床麻醉学杂志, 2016, 32(6):598-601.
10 Kobayashi M, Konishi H, Takai TA. A DAP12-Dependent signal promotes Pro-Inflammatory polarization in microglia following nerve injury and exacerbates degeneration of injured neurons[J]. Glia, 2015,63(6):1073-1082.
11 Li S, Wang X, Gu Y, et al. Let-7 microRNAs regenerate peripheral nerve regeneration by targeting nerve growth factor[J]. Mol Ther, 2015,23(3):423-433.
12 Zhang H, Zhang H, Dougherty PM. Dynamic effects of TNF-α on synaptic transmission in mice over time following sciatic nerve chronic constriction injury[J]. J Neurophysiol, 2013, 110(7): 1663-1671.
13 崔晓燕, 甄晓兰, 刘雪莉. 黄芩苷对β-淀粉样蛋白25-35引起新生大鼠原代海马神经细胞损伤的保护作用[J]. 中国临床药理学杂志,2016, 32(21):1985-1988.
14 Miki A, Kanamori A, Nakamura M, et al. The expression of syntaphilin is down-regulated in the optic nerve after axonal injury[J]. Exp Eye Res, 2014, 129(8):38-47.
15 宋文婷, 徐立, 刘建勋. 脑缺血后谷氨酸及其受体介导的神经细胞损伤及相关药物研究进展[J]. 中国药理学通报, 2012, 28(6):747-750.
16 Murali SS, Napier IA, Mohammadi SA, et al. High-voltageactivated Calcium current subtypes in mouse DRG neurons adapt in a subpopulation-specific manner after nerve injury[J]. J Neurophysiol,2015, 113(5):1511-1519.
17 柏平, 吴修建, 闫东. 右美托咪啶与咪达唑仑对幼鼠神经细胞损伤及学习记忆功能的影响[J]. 重庆医学, 2013 (25):2966-2968.
18 覃威, 叶水芬, 范雯, 等. 苁蓉精对MPP+诱导多巴胺能神经细胞损伤后GSK-3β表达的影响[J]. 中国神经免疫学和神经病学杂志, 2016,23(6):415-420.
19 Wang YH, Zhang PX, Yin XF, et al. Characteristics of peripheral nerve regeneration following a second nerve injury and repair[J]. Artif Cells Blood Substit Immobil Biotechnol, 2012, 40(4):296-302.
20 Ying ZX, Misra V, Verge VM. Sensing nerve injury at the axonal ER:Activated Luman/CREB3 serves as a novel axonally synthesized retrograde regeneration signal[J]. Proc Natl Acad Sci U S A, 2014,111(45):16142-16147.

