miR-29b与Mcl-1蛋白表达的关系及其对肺癌细胞增殖和凋亡的影响
杨 雁,刘行仁,蒋才玉,吴 池,邹 俊
随着新药和靶向治疗的进展,肺癌的治疗方式也趋于多元化,使其5年生存率得到显著的提高[1-2]。尽管如此,由于缺乏对肺癌早期筛查的有效手段,以及缺少预测肺癌危险因素的分子标记物,其治疗效果始终没有达到预期的标准[3]。近期的研究发现,miR-29家族在调节肿瘤细胞增殖、凋亡、迁移、侵袭等生物学行为中发挥作用[4]。miR-29的家族成员的在白血病、黑色素瘤、肝癌、结肠癌、宫颈癌和肺癌中都表现出低表达[5-10]。Fabbri等[11]研究发现,miR-29的家族成员能靶向调控DNA甲基转移酶3A和3B,这两种酶在DNA甲基化的过程中起到至关重要的作用,而且与肺癌患者的生存也有一定联系。miR-29的重新表达能使肺癌细胞恢复正常的DNA甲基化模式,也使得再沉默甲基化的肿瘤抑制基因(如FHIT和WWOX)重新表达,最终达到抑制肿瘤生成的目的。Rothschild等[12]证实了miR-29b参与Src-ID1信号传导通路,起到减弱肺癌细胞迁移和侵袭能力的目的。因此,基于miRNA的靶向治疗模式,miR-29b成为了一位极具竞争力的候选者。髓细胞白血病因子-1(myeloid cell leukemia-1, Mcl-1)蛋白是一种多区的抗凋亡蛋白,属于B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)蛋白家族的一员,在肺癌中起到了重要的促癌效应,但其上游的调控因子却无法明确[13]。本研究的目的在于探究miR-29b在非小细胞肺癌中的表达情况以及与Mcl-1相互作用关系,并分析其对肺癌细胞生物学行为的影响。
1 材料与方法
1.1组织样本收集2016年10月—2017年3月在四川省人民医院进行肺癌切除术患者的肿瘤组织和癌旁正常组织18例,病理类型均为非小细胞肺癌。所有患者术前均未接受其他治疗。其中男14例,女4例;年龄51~72岁,中位年龄61岁。本研究通过医院医学伦理委员会的批准同意。取出的肿瘤组织和癌旁正常组织样本立即经液氮冷冻并储存在-80℃冰箱待测。
1.2细胞株和实验试剂人非小细胞肺癌株SPC-A1由武汉细胞生物研究所提供。RPMI-1640培养液、10%小牛血清、100 μg/ml青霉素和100 μg/ml链霉素、0.25%胰酶溶液购自Gibco公司,二甲基亚砜购自Sigma公司。细胞培养于含有10% FBS、100 μg/ml青霉素和100 μg/ml链霉素的培养基,37℃的5% CO2培养箱中,生长至80%左右浓度时进行传代和冻存,用于后续的实验。细胞培养瓶和24、96孔板购自杭州四季庆生物工程材料有限公司。Trizol购自美国Ambion公司,Mcl-1抗体购买于美国abcam公司。逆反转录试剂盒购自日本TOYOBO公司,PCR试剂盒购自美国Kapa公司。荧光素酶活性检测试剂盒购自Promega公司。荧光素酶报告载体由Promega公司合成。miR-29b mimics和inhibitor购自GenePharma(中国上海)。
1.3SPC-A1细胞分组将200 μl含有100 pmol miR-29b mimics的无血清、无抗生素培养基与含5 μl Lipofectamine 2000(Invitrogen)的200 μl相同培养基混合,并静置20 min。然后将所得的400 μl转染溶液加入含有1.6 ml培养基的每个孔中。6 h后,用补充有10%FBS和青霉素及链霉素的2 ml新鲜培养基代替培养物。同样方法处理miR-29b inhibitor和miR-29b control。将分别转染miR-29b mimics、miR-29b inhibitor和miR-29b control的SPC-A1细胞,分为miR-29b mimics组、miR-29b inhibitor组和对照组。
1.4定量聚合酶链反应(PCR)使用Trizol试剂提取非小细胞肺癌细胞株以及肺癌组织和癌旁正常组织的总RNA,并使用TM miRNA分离试剂盒(Ambion, Austin, TX, USA)进一步纯化miRNA部分。通过超微量分光光度计测定RNA样品的浓度和纯度。使用实时PCR系统进行实时逆转录PCR。miR-29b前引物:5'-GGTACCGGTTGTCTTGGGTTTATTG-3',后引物:5'-GAATTCAAATACTTCAGAGCTG-3';Mcl-1克隆的前引物:5'-CGGGGTACCGAGTCATACTTGTGAAG-3',后引物:3'-GCACTCGAGCCTGTTTTTGTTTGATG-5'。U6管家基因作为对照。以100 ng总RNA为模版,逆转录cDNA,反应条件:95℃ 10 min,45个循环;95℃变性10 s,60℃退火和延伸60 s。使用RQ=2-ΔΔCt方法计算非小细胞肺癌细胞株以及肺癌组织和癌旁正常组织的miRNA相对表达量。实验重复3次。
1.5Western blotting实验检测Mcl-1蛋白SPC-A1细胞用冰PBS洗涤,然后用蛋白质裂解物(Pierce, Rockford, IL, USA)裂解。在4℃下以5000×g离心15 min,用二亚铬酸蛋白测定试剂盒测定蛋白质浓度。按照说明书配制10% SDS-PAGE分离胶,每孔加入20 μg蛋白样品。使用湿转法将蛋白转至PVDF膜上,使用5%脱脂奶粉室温下封闭2 h,TBST充分冲洗后,使用1∶1000稀释一抗孵育(兔单克隆Mcl-1抗体),4℃过夜;加入辣根过氧化物酶标记羊抗兔IgG(1∶2500)稀释,室温孵育2 h;ECL发光。实验重复3次。
1.6双荧光素酶实验使用双荧光素酶实验验证miR-29b和Mcl-1的关系。将SPC-A1细胞接种与24孔板中,与0.4 mg萤火虫荧光素酶报告载体和0.1 mg含有海肾萤光素酶的pRL-TK对照载体共转染,根据siPORTneoFX使用方法操作,在转染后48 h制备裂解物。转染24 h后使用双荧光素酶报告基因测定系统测定荧光素酶活性。实验重复3次。
1.7MTT增殖实验将对数期SPC-A1细胞使用胰蛋白酶消化后,制成单细胞悬浮液并以1×103个细胞/孔的密度接种到96孔板中。在细胞培养7 d后,加入MTT测定液20 μl,每孔充分混合均匀,并在37℃下孵育4~6 h。然后使用无菌吸管吸出上清液,每孔加入二甲基亚砜150 μl,在室温下搅拌10 min保证晶体充分溶解。然后在细胞培养24、48、72和96 h进行MTT测定波长为490 nm时的吸光度(OD),计算SPC-A1细胞的增殖情况。实验重复3次。
1.8细胞凋亡实验使用Annexin V-Fluos染色试剂盒(Roche-Boehringer)检测SPC-A1细胞的凋亡情况。SPC-A1细胞应用PBS洗涤,并根据试剂盒说明书进行染色。将载玻片与Permafluor介质一起安装,并在荧光显微镜(Axiophot; Olympus, Tokyo, Japan)下观察。
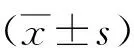
2 结果
2.1肺癌组织和癌旁正常组织miR-29b的表达肺癌组织和癌旁正常组织miR-29b表达水平分别为0.56±0.13和1.68±0.24。肺癌组织miR-29b表达水平明显低于癌旁正常组织(P<0.05)。
2.2SPC-A1细胞miR-29b的表达miR-29b mimics组SPC-A1细胞miR-29b的表达水平为6.15±0.76,miR-29b inhibitor组为0.52±0.24,对照组为1.10±0.19。miR-29b mimics组SPC-A1细胞miR-29b的表达水平高于对照组(P<0.05),miR-29b inhibitor组低于对照组(P<0.05)。
2.3miR-29b对SPC-A1细胞增殖的影响在培养72 h和96 h时,miR-29b mimics组的OD值分别为0.56±0.02和0.65±0.07,对照组分别为0.64±0.03和0.78±0.05。miR-29b inhibitor组培养96 h时的OD值为0.86±0.01。培养72 h和96 h时,miR-29b mimics组的增殖活性显著低于对照组(P<0.05)。培养96 h时,miR-29b inhibitor组的增殖活性明显高于对照组(P<0.05)。见图1。
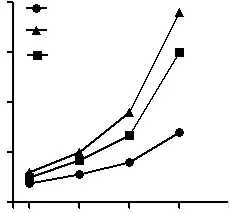

图1 miR-29b对SPC-A1细胞增殖的影响 与对照组比较,aP<0.05
2.4miR-29b对SPC-A1细胞凋亡的影响miR-29b mimics组、miR-29b inhibitor组和对照组SPC-A1细胞凋亡率分别为(37.28±5.11)%、(9.25±1.26)%和(21.69±7.38)%。miR-29b mimics组SPC-A1细胞凋亡率高于对照组(P<0.05),miR-29b inhibitor组低于对照组(P<0.05)。
2.5miR-29b靶向调控Mcl-1的表达生物信息学软件预测结果显示,miR-29b与Mcl-1有类似的3'-UTR结合序列。双荧光素酶实验结果显示,转染miR-29b mimics后可以明显抑制Mcl-1的荧光素酶活性。Western blotting实验结果显示,miR-29b mimics组、miR-29b inhibitor组和对照组Mcl-1蛋白表达水平分别为0.42±0.12、1.89±0.07和1.02 ±0.02。miR-29b mimics组Mcl-1蛋白表达水平低于对照组(P<0.05),miR-29b inhibitor组高于对照组(P<0.05)。见图2。
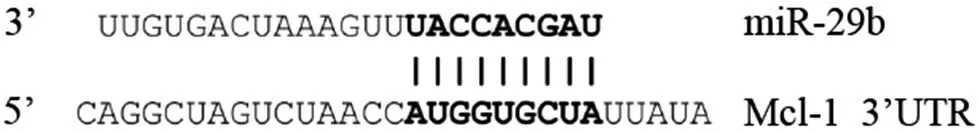
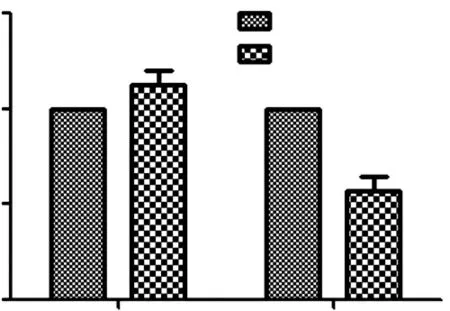
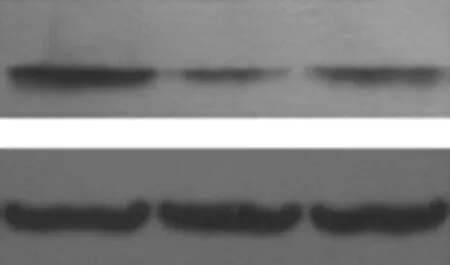
图2miR-29b和Mcl-1之间的关系以及miR-29b对Mcl-1蛋白表达的影响
A.miR-29b和Mcl-1的结合位点;B.双荧光素酶检测miR-29b和Mcl-1之间的关系;C.miR-29b对Mcl-1蛋白表达的影响;Mcl-1为髓细胞白血病因子-1
3 讨论
miRNA是一类内源性的小RNA,长度通常少于22个核苷酸[14]。miRNA作为一种非编码RNA,在转录后能调控靶RNA的表达[15]。miRNA参与了许多生物学进程,在多种疾病的发生和发展过程中起到关键的作用,其中也包括肿瘤,而且在肿瘤中存在明显的表达差异[16-17]。在一些肿瘤发病过程中,miRNA通过靶向作用某些生物学信号途径来改变肿瘤细胞的表型,成为肿瘤形成过程中的重要一环,而且还能作为诊断和预测生存预后的分子标记物[18]。基于miRNA治疗的发展代表了肿瘤治疗的新策略。通过同时调节多种生物信息途径,miRNA可以作为肿瘤抑制因子或致癌基因,调节肿瘤的发展过程,包括增殖,侵袭,凋亡和转移等[16]。miR-29b能靶向致癌基因和抗凋亡基因,在多种癌症发病过程中通常被沉默或下调[19]。在急性骨髓性白血病中,CDK6已被证实为miR-29b直接作用靶点[20]。miR-29b的过表达可预防人乳头状瘤病毒介导的宫颈癌细胞的恶性转化[21]。而在非小细胞肺癌中,miR-29b作用的靶基因为DNA甲基转移酶3A和3B,且其表达与DNA甲基转移酶3A和3B表达呈负相关[16]。本实验结果表明,miR-29b表现出与肺癌较高的相关性,其表达的降低与肿瘤的形成负相关,同时还影响了肺癌细胞的增殖和凋亡,所以能起到了一定的抑癌作用。
Mcl-1是一种抗凋亡蛋白,其表达不足易导致细胞在不适当时机凋亡,而过度表达易引起细胞转化风险的增加[22]。通常在肿瘤组织中Mcl-1表现为过表达。如Mcl-1的过度表达导致胆管癌细胞对肿瘤坏死因子相关凋亡诱导配体诱导的细胞凋亡产生抗性,而其抑制剂使细胞对凋亡敏感[23]。Mcl-1蛋白水平的调节是复杂的,在转录层面,Mcl-1 mRNA是由细胞因子白介素-3(IL-3)、IL-5、IL-6、IL-15、IL-22、干扰素-α、粒细胞-巨噬细胞集落刺激因子和表皮生长因子受体所调控[24]。鉴于Mcl-1调节的复杂性,可能还存在其他的调控机制。最近的研究已经表明,microRNAs能对蛋白质的表达进行调节[25]。miRNA作为内源性序列特异性抑制靶基因翻译,从而可以降低靶蛋白表达[26]。如miR-15和miR-16有与Bcl-2 mRNA互补性的碱基序列,过表达miR-15和miR-16可导致Bcl-2蛋白减少和细胞凋亡增加[27]。在急性骨髓性白血病、胆管癌和肝细胞癌中,miR-29b已被证明靶向Mcl-1蛋白的表达,影响肿瘤细胞生存[28-30]。本研究结果表明,miR-29b具有和Mcl-1相似的3'-UTR结合序列。双荧光素酶实验结果表明,miR-29b能与Mcl-1的3'-UTR特异性结合,并抑制Mcl-1蛋白的表达活性。
综上所述,肺癌组织中miR-29b的表达水平明显低于癌旁正常组织,同时miR-29b能抑制肺癌细胞增殖并诱导其凋亡,miR-29b能与Mcl-1的3'-UTR特异性结合,并抑制Mcl-1蛋白的表达活性。miR-29b可以成为肺癌治疗的新靶点。
[参考文献]
[1]石远凯,孙燕,于金明,等.中国晚期原发性肺癌诊治专家共识(2016年版)[J].中国肺癌杂志,2016,19(1):1-15.
[2]De Angelis R, Sant M, Coleman M P,etal. Cancer survival in Europe 1999-2007 by country and age: results of EUROCARE-5-a population-based study[J].Lancet Oncol, 2014,15(1):23-34.
[3]Trusolino L. Oncogenic MET as an effective therapeutic target in non-small cell lung cancer resistant to EGFR inhibitors: the rise of the phoenix[J].Cancer Discov, 2016,6(12):1306-1308.
[4]Hilz S, Fogarty E A, Modzelewski A J,etal. Transcriptome profiling of the developing male germ line identifies the miR-29 family as a global regulator during meiosis[J].RNA Biol, 2017,14(2):219-235.
[5]Zaidi S K, Perez A W, White E S,etal. An AML1-ETO/miR-29b-1 regulatory circuit modulates phenotypic properties of acute myeloid leukemia cells[J].Oncotarget, 2017,8(25):39994-40005.
[6]Andrews M C, Cursons J, Hurley D G,etal. Systems analysis identifies miR-29b regulation of invasiveness in melanoma[J].Mol Cancer, 2016,15(1):72.
[7]Mahati S, Xiao L, Yang Y,etal. miR-29a suppresses growth and migration of hepatocellular carcinoma by regulating CLDN1[J].Biochem Biophys Res Commun, 2017,486(3):732-737.
[8]Basati G, Razavi A E, Pakzad I,etal. Circulating levels of the miRNAs, miR-194, and miR-29b, as clinically useful biomarkers for colorectal cancer[J].Tumor Biol, 2016,37(2):1781-1788.
[9]Li Y, Zhang Z, Xiao Z,etal. Chemotherapy-mediated miR-29b expression inhibits the invasion and angiogenesis of cervical cancer[J].Oncotarget, 2017,8(9):14655-14665.
[10] Dinh T K, Fendler W, Chalubinska-Fendler J,etal. Circulating miR-29a and miR-150 correlate with delivered dose during thoracic radiation therapy for non-small cell lung cancer[J].Radiat Oncol, 2016,11:61.
[11] Fabbri M, Garzon R, Cimmino A,etal. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B[J].Proc Natl Acad Sci U S A, 2007,104(40):15805-15810.
[12] Rothschild S I, Tschan M P, Federzoni E A,etal. MicroRNA-29b is involved in the Src-ID1 signaling pathway and is dysregulated in human lung adenocarcinoma[J].Oncogene, 2012,31(38):4221-4232.
[13] Belmar J, Fesik S W. Small molecule Mcl-1 inhibitors for the treatment of cancer[J].Pharmacol Ther, 2015,145:76-84.
[14] Ha M, Kim V N. Regulation of microRNA biogenesis[J].Nat Rev Mol Cell Biol, 2014,15(8):509-524.
[15] Hansen T B, Jensen T I, Clausen B H,etal. Natural RNA circles function as efficient microRNA sponges[J].Nature, 2013,495(7441):384-388.
[16] Iorio M V, Croce C M. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. a comprehensive review[J].EMBO Mol Med, 2017,9(6):852.
[17] Xie B, Ding Q, Han H,etal. miRCancer: a microRNA-cancer association database constructed by text mining on literature[J].Bioinformatics, 2013,29(5):638-644.
[18] Cheng C J, Bahal R, Babar I A,etal. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment[J].Nature, 2015,518(7537):107-110.
[19] Yan B, Guo Q, Fu F J,etal. The role of miR-29b in cancer: regulation, function, and signaling[J].Onco Targets Ther, 2015,8:539-548.
[20] Zhu K, Liu L, Zhang J,etal. MiR-29b suppresses the proliferation and migration of osteosarcoma cells by targeting CDK6[J].Protein Cell, 2016,7(6):434-444.
[21] Lajer C B, Garnaes E, Friis-Hansen L,etal. The role of miRNAs in human papilloma virus (HPV)-associated cancers: bridging between HPV-related head and neck cancer and cervical cancer[J].Br J Cancer, 2017,117(5):e2.
[22] Xiao Y, Nimmer P, Sheppard G S,etal. MCL-1 is a key determinant of breast cancer cell survival: validation of MCL-1 dependency utilizing a highly selective small molecule inhibitor[J].Mol Cancer Ther, 2015,14(8):1837-1847.
[23] Morton S D, Cadamuro M, Brivio S,etal. Leukemia inhibitory factor protects cholangiocarcinoma cells from drug-induced apoptosis via a PI3K/AKT-dependent Mcl-1 activation[J].Oncotarget, 2015,6(28):26052-26064.
[24] Mojsa B, Lassot I, Desagher S. Mcl-1 ubiquitination: unique regulation of an essential survival protein[J].Cells, 2014,3(2):418-437.
[25] Schmiedel J M, Klemm S L, Zheng Y,etal. Gene expression. MicroRNA control of protein expression noise[J].Science, 2015,348(6230):128-132.
[26] Mork S, Pletscher-Frankild S, Palleja Caro A,etal. Protein-driven inference of miRNA-disease associations[J].Bioinformatics, 2014,30(3):392-397.
[27] Liu J, Chen G, Feng L,etal. Loss of p53 and altered miR15-a/16-1, MCL-1 pathway in CLL: Insights from TCL1-Tg: p53-/-mouse model and primary human leukemia cells[J].Leukemia, 2014,28(1):118-128.
[28] Xu L, Xu Y, Jing Z,etal. Altered expression pattern of miR-29a, miR-29b and the target genes in myeloid leukemia[J].Exp Hematol Oncol, 2014,3:17.
[29] Mott J L, Kobayashi S, Bronk S F,etal. Mir-29 regulates Mcl-1 protein expression and apoptosis[J].Oncogene, 2007,26(42):6133-6140.
[30] Xiong Y, Fang J H, Yun J P,etal. Effects of MicroRNA-29 on apoptosis, tumorigenicity, and prognosis of hepatocellular carcinoma[J].Hepatology, 2010,51(3):836-845.

