黄芩苷对前列腺癌细胞生物学行为的影响
高培廷,宋 华
前列腺癌病因复杂,是发展中国家老年男性常见的恶性肿瘤,目前普遍认为遗传因素和长期的环境暴露是导致前列腺癌发生的主要原因[1-2]。尤其在发展中国家,吸烟和环境污染是前列腺癌发病的高危因素[3-4]。随着科学技术的发展,对前列腺癌发病分子机制的认识越来越深入,探讨更多前列腺癌的诊断和治疗方式也是目前的研究热点。黄芩苷含多种黄酮类化合物,在植物中广泛存在,人体平日通过摄入不同类型的饮食,对黄酮类化合物的日均摄入量高达1 g,远远超过其他维生素类的摄入量,且对人体没有不良反应[5]。很多学者研究指出类黄酮化合物在人体内具有广泛的生物活性,包括抗氧化、抗炎、抗血栓形成和抗血管生成等作用[6-7]。而具有生物活性的黄酮类化合物也具有一定的抗肿瘤作用,但是目前研究只专注于少数几类,主要是异黄酮类。有相关研究表明,异黄酮可以抑制小鼠胃癌细胞的增殖能力,还可以诱导胶质瘤细胞凋亡过程[8]。目前关于黄芩苷对肿瘤细胞的作用研究甚少,且对其在生物体内的活性效应了解也不多。目前,黄芩苷对前列腺癌细胞的生物学行为的影响,以及能否对前列腺癌进行有效治疗的研究报道极少。本文通过研究黄芩苷对前列腺癌细胞生物学行为的影响,探讨黄芩苷对人前列腺癌细胞增殖和凋亡的作用。
1 材料与方法
1.1细胞株和实验试剂前列腺癌细胞株PC3购于上海细胞生物研究所,细胞培养于含10%胎牛血清以及100 U/ml青霉素和50 g/L链霉素的RPMI1640培养基,置于37℃,5% CO2孵箱内。四甲基偶氮唑盐(MTT)、Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购于上海美季生物技术有限公司。黄芩苷粉剂购于南京制药厂有限公司。
1.2CCK-8细胞活性实验细胞活性实验使用CCK-8试剂盒测定。将前列腺癌PC3细胞接种在96孔板中,每孔1×104个细胞。将细胞用不同浓度的黄芩苷(5、10、20、25和50 mg/L)与PC3细胞孵育48 h。孵育过后,用PBS冲洗细胞两次。向每个孔中加入新鲜培养基200 μl,然后加入20 μl的CCK-8溶液,并在37℃下孵育4 h。使用酶标仪板在490 nm波长下测量不同组的吸光度,计算不同浓度黄芩苷对前列腺癌细胞的抑制率。
1.3MTT法检测细胞增殖活性将前列腺癌PC3细胞分为黄芩苷组和对照组,黄芩苷组用25 mg/L黄芩苷处理,对照组用等量的PBS处理。在两组细胞对数期使用胰蛋白酶消化后,制成单细胞悬浮液并以每孔1×103个细胞的密度接种到96孔板中。培养7 d后,每孔加入MTT测定液20 μl,充分混合,并在37℃下孵育4~6 h。然后使用无菌吸管吸出上清液,每孔加入二甲基亚砜150 μl,在室温下搅拌10 min保证晶体充分溶解。然后在24、48、72和96 h测定波长为490 nm时的吸光度,计算前列腺癌PC3细胞的增殖情况。实验重复3次。
1.4流式细胞术检测细胞凋亡情况和活性氧(ROS)水平将前列腺癌PC3细胞接种于6孔板内,2 ml/孔,实验分为黄芩苷组和对照组,黄芩苷组使用25 mg/L黄芩苷处理,对照组则使用等量的PBS处理。每组均设3个复孔,处理48 h后消化细胞,装于1.5 ml的EP管内,在4℃下以2000 r/min离心15 min,弃上清液,使用PBS轻柔混匀后等速离心,重复洗涤3次。检测细胞凋亡使用400 μl Bidding Buffer悬浮细胞,加入5 μl Annexin V-FITC轻轻混匀后于2~8℃避光条件下孵育15 min,然后加入10 μl PI同等条件下孵育5 min,1 h内上流式细胞仪检测。并通过荧光显微镜评估两组细胞内ROS的水平。
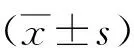
2 结果
2.1黄芩苷对前列腺癌细胞的最适有效浓度通过CCK-8细胞活性实验检测黄芩苷对前列腺癌PC3细胞的抑制率情况,确定黄芩苷药物的最适有效浓度。实验结果显示,黄芩苷浓度为5、10、20、25和50 mg/L时对前列腺癌PC3细胞抑制率分别为(11.68±1.18)%、(17.92±2.39)%、(31.95±3.09)%、(57.46±5.31)%和(34.62±2.39)%。黄芩苷浓度为25 mg/L时对前列腺癌PC3细胞抑制率最高(P<0.05)。故以25 mg/L浓度的黄芩苷作为后续实验浓度。
2.2黄芩苷对前列腺癌细胞增殖能力的影响MTT细胞增殖实验检测黄芩苷对前列腺癌PC3细胞增殖能力的影响。实验结果显示,对照组在24、48、72和96 h时的前列腺癌PC3细胞增殖率分别为(25.27±7.10)%、(51.06±9.74)%、(78.36±8.32)%和(95.36±11.21)%;黄芩苷组分别为(8.84±3.25)%、(11.26±4.97)%、(15.62±5.09)%和(23.76±5.59)%。在24和48 h时,两组的前列腺癌PC3细胞增殖率比较差异无统计学意义(P>0.05)。而在72和96 h时,黄芩苷组的前列腺癌PC3细胞增殖率低于对照组(P<0.05)。结果表明,适量浓度的黄芩苷对前列腺癌PC3细胞的增殖能力有明显的抑制作用。
2.3黄芩苷对前列腺癌细胞凋亡行为的影响细胞凋亡实验检测25 mg/L的黄芩苷对前列腺癌PC3细胞凋亡行为的影响。实验结果显示,对照组前列腺癌PC3细胞凋亡率为(4.20±0.86)%,黄芩苷组为(26.90±2.48)%。黄芩苷组的前列腺癌PC3细胞凋亡率高于对照组(P<0.05)。见图1。结果表明,适量浓度的黄芩苷对前列腺癌PC3细胞的凋亡行为有明显的增强作用。
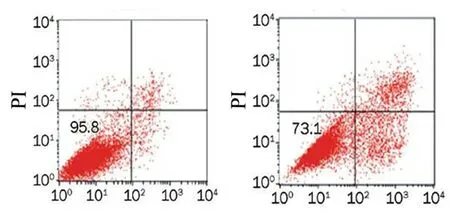
图1流式细胞术检测前列腺癌PC3细胞的凋亡行为变化
2.4黄芩苷对前列腺癌细胞内ROS水平的影响流式细胞术检测使用25 mg/L浓度的黄芩苷对前列腺癌PC3细胞内ROS水平的变化情况的影响,间接检测前列腺癌PC3细胞的凋亡水平。实验结果显示,对照组前列腺癌PC3细胞中的ROS表达水平为(5.9±1.25)%,黄芩苷组为(38.2±4.12)%。黄芩苷组前列腺癌PC3细胞中ROS表达水平显著高于对照组(P<0.05)。见图2。结果表明,黄芩苷可以加速前列腺癌PC3细胞的凋亡进程。
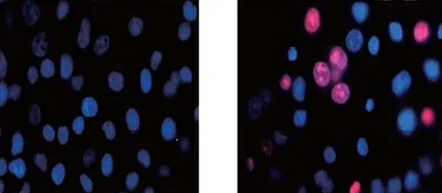
图2两组前列腺癌PC3细胞内活性氧的水平(×400)
3 讨论
有研究结果显示,黄芩苷对部分肿瘤细胞有一定的抑制作用,包括乳腺癌、肝癌及结肠癌[9-10]。但是,某些剂量的黄芩苷对肿瘤细胞的杀伤作用不明显,而且有明显的细胞毒性,干扰正常细胞的生长[11]。有研究报道,黄芩苷可有效改善胶质瘤细胞的增殖活力,有效保护原代培养的胶质瘤细胞,减缓外界及体内微环境的诱导损伤,表现出明显的保护作用[12]。而且Wei等[13]学者研究指出,黄芩苷具有显著的抗氧化特性和抗炎活性,不仅对肿瘤细胞有抑制作用,对部分炎症也有缓解效果。本实验结果显示,黄芩苷浓度为25 mg/L时,对前列腺癌PC3细胞增殖能力的抑制效果最佳。在一定的浓度范围,随着黄芩苷的浓度增加,对前列腺癌PC3细胞增殖能力抑制效果呈正相关关系。在以往的研究中,已经证实黄芩苷可以引起部分细胞的细胞周期发生变化。适量浓度的黄芩苷对细胞的生长过程有一定的干扰作用[14]。而且类黄酮类物质已被证明会改变参与细胞生长和分化关键蛋白质的调控过程,包括诱导细胞周期蛋白依赖性激酶和抑制视网膜母细胞瘤磷酸化蛋白的表达[15-16]。
目前,黄芩苷对人前列腺癌的抗肿瘤作用机制尚不完全清楚。有研究通过寡核苷酸微阵列分析表明,黄芩苷可以通过上调多达23个基因蛋白,从而参与各种细胞的生物学活性,包括调节细胞周期和细胞增殖基因(HERG、ras和hst)、细胞凋亡基因(CDKN1A)、信号转导相关调节因子(ETS2和MAP2)和细胞外基质/黏附分子(MMP73、MMP9)[17-19]。在上述调控因子中,HERG的表达情况与乳腺癌细胞的增殖凋亡相关,MMP9的活化与诱导口腔鳞状细胞癌的转移相关[20]。而有相关研究指出,中、高浓度的ROS可以通过细胞氧化应激反应诱导细胞凋亡,并发现自由基与细胞信号转导间存在一定的内在关联[21]。本研究结果发现,黄芩苷作用于前列腺癌细胞后,细胞内ROS水平明显上调。表明黄芩苷可以促进前列腺细胞的凋亡,抑制其增殖行为,达到有效的抗肿瘤效果。Won等[22]学者研究显示,在体外肝转移癌小鼠的饮食中添加适量的类黄酮类物质具有抑制肝转移的效果。而且其他研究相继证明类黄酮类化合物在使用过程中对荷瘤小鼠没有严重的细胞毒性[23]。所以,含有丰富类黄酮的黄芩苷是一种非常理想的有效的抗肿瘤药物,对肿瘤细胞有明显的抑制杀伤作用,可以和其他药物联用增强治疗效果。
综上所述,合适浓度(25 mg/L)的黄芩苷对前列腺癌细胞具有抑制增殖和促进凋亡的作用,而且暂未发现任何相关不良反应。表明黄芩苷可能对前列腺癌具有一定潜在的抗肿瘤活性,后续实验应深入探讨其在细胞层面的相关机制,为黄芩苷在临床治疗的应用提供理论支持。
[参考文献]
[1]Rebbeck T R, Devesa S S, Chang B L,etal. Global patterns of prostate cancer incidence, aggressiveness, and mortality in men of african descent[J].Prostate Cancer, 2013,2013:560857.
[2]Crawford E D, Stone N N, Evan Y Y,etal. Challenges and recommendations for early identification of metastatic disease in prostate cancer[J].Urology, 2014,83(3):664-669.
[3]韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[4]瞿旻,高旭,侯建国,等.前列腺癌患者根治术后生化复发危险因素的单中心研究[J].中华泌尿外科杂志,2015,36(8):573-577.
[5]Liao Z J, Liang R S, Shi S S,etal. Effect of baicalin on hippocampal damage in kainic acid-induced epileptic mice[J].Exp Ther Med, 2016,12(3):1405-1411.
[6]Zhang S, Wang J, Pan J. Baicalin-loaded PEGylated lipid nanoparticles: characterization, pharmacokinetics, and protective effects on acute myocardial ischemia in rats[J].Drug Deliv, 2016,23(9):3696-3703.
[7]申云富,范小青.汉黄芩苷的药理活性研究进展[J].上海中医药大学学报,2016,30(4):98-101.
[8]Sareddy G R, Vadlamudi R K. Cancer therapy using natural ligands that target estrogen receptor beta[J].Chin J Nat Med, 2015,13(11):801-807.
[9]Yang X, Belosay A, Hartman J A,etal. Dietary soy isoflavones increase metastasis to lungs in an experimental model of breast cancer with bone micro-tumors[J].Clin Exp Metastasis, 2015,32(4):323-333.
[10]吴汪泽,王卉,卢忠心.黄芩苷对结肠癌细胞迁移与侵袭能力的抑制作用及其机制研究[J].现代预防医学,2016,43(4):708-710,726.
[11] Li D, Lin B, Yusuf N,etal. Proteomic analysis and functional studies of baicalin on proteins associated with skin cancer[J].Am J Chin Med, 2017,45(3):599-614.
[12] 赵树蕃,崔颖秋.黄芩苷对氧化应激诱导牙龈上皮细胞凋亡的保护作用研究[J].口腔疾病防治,2016,24(12):701-705.
[13] Wei Y, Liang J, Zheng X,etal. Lung-targeting drug delivery system of baicalin-loaded nanoliposomes: development, biodistribution in rabbits, and pharmacodynamics in nude mice bearing orthotopic human lung cancer[J].Int J Nanomedicine, 2017,12:251-261.
[14] Chen J, Li Z, Chen A Y,etal. Inhibitory effect of baicalin and baicalein on ovarian cancer cells[J].Int J Mol Sci, 2013,14(3):6012-6025.
[15] Wang J, Masika J, Zhou J,etal. Traditional Chinese medicine baicalin suppresses mESCs proliferation through inhibition of miR-294 expression[J].Cell Physiol Biochem, 2015,35(5):1868-1876.
[16] 蒋寅,刘军楼,朱磊,等.黄芩苷对HT-29细胞炎症模型PI3K/NF-κB信号通路的影响及机制探讨[J].中国实验方剂学杂志,2016,22(12):118-122.
[17] Sucher N J, Carles M C. A pharmacological basis of herbal medicines for epilepsy[J].Epilepsy Behav, 2015,52(Pt B):308-318.
[18] Fernando W, Rupasinghe H P, Hoskin D W. Regulation of hypoxia-inducible factor-1α and vascular endothelial growth factor signaling by plant flavonoids[J].Mini Rev Med Chem, 2015,15(6):479-489.
[19] Chen H, Shen J. Baicalin reduces hemorrhagic transformation of rat ischemic stroke with delayed T-PA treatment[J].Free Radic Biol Med, 2016,100:S159.
[20] 韩春耀,张斌,马雪,等.沉默α-catulin基因的人舌鳞状细胞癌TSCCA细胞模型的建立[J].吉林大学学报:医学版,2016,42(3):481-485,插2.
[21] Zorov D B, Juhaszova M, Sollott S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J].Physiol Rev, 2014,94(3):909-950.
[22] Won S B, Han A, Kwon Y H. Maternal consumption of low-isoflavone soy protein isolate alters hepatic gene expression and liver development in rat offspring[J].J Nutr Biochem, 2017,42:51-61.
[23] Yanagihara K, Takigahira M, Mihara K,etal. Inhibitory effects of isoflavones on tumor growth and cachexia in newly established cachectic mouse models carrying human stomach cancers[J].Nutr Cancer, 2013,65(4):578-589.

