褪黑素及其受体激动剂对Mfn2介导的T2DM大鼠肝糖代谢基因的调节作用
岳 颖,周 珺,贾正平,李茂星,张汝学
2型糖尿病(type 2 diabetes mellitus, T2DM)作为一种的慢性代谢疾病,发病机制复杂。糖代谢异常是其主要发病特点,其中以肝脏过度生成葡萄糖和糖原储存减少致使血糖升高为主要病因。肝脏胰岛素抵抗(insulin resistance, IR)表现为肝糖代谢平衡紊乱,涉及糖酵解、糖异生以及肝糖原的合成和分解等多个途径的异常,而肝糖代谢的关键酶葡萄糖激酶(glucokinase, GK)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxylase kinase, PEPCK)、葡糖糖-6-磷酸酶(glucose-6-phosphatase, G-6-P)、糖原合成激酶-3β(glycogen synthase kinase-3, GSK-3β)均参与其中并发挥重要作用[1]。近年来研究认为,T2DM的IR、糖脂代谢异常等都与线粒体功能障碍具有重要关系[2-3]。线粒体融合蛋白2(mitofusin2, Mfn2)参与线粒体的融合,与线粒体的结构形态及功能调节变化有着不可分割的联系,可以介导机体细胞能量代谢、信号传导等。T2DM状态下,肝脏内Mfn2的缺失及表达下降使得肝细胞线粒体结构形态和功能异常,发生肝脏IR,导致肝糖代谢失衡[4-5]。因此,基于Mfn2介导的肝脏糖代谢变化可作为新型的糖尿病治疗靶点。褪黑素对线粒体功能和机体葡萄糖稳态的维持以及T2DM导致的IR等都具有调节作用[6]。Neu-p11是一种新型褪黑素受体激动剂,相较褪黑素具有半衰期更长,选择性更高,不良反应少,易合成的优势[7]。本实验通过建立T2DM大鼠模型,研究褪黑素及Neu-p11不同给药剂量对Mfn2介导的T2DM大鼠血糖、胰岛素、IR和肝糖代谢酶mRNA表达的调节作用以及对肝脏的保护作用。
1 材料与方法
1.1实验动物SPF级雌性Wistar大鼠50只,体重160~180 g,由兰州大学提供,动物合格证号:62000800000144,许可证号:SCXK(甘)2013-0002。饲养于兰州总医院动物实验科,定量摄食进水,室温18~25℃。
1.2主要药品与试剂柠檬酸(20100304,天津市大茂化学试剂厂);柠檬酸三钠(20090826,莱阳市双双化工有限公司);血糖测定试剂盒(163561,中生北控生物科技股份有限公司);50%葡萄糖注射液(C1506145,湖南科伦制药有限公司);4%多聚甲醛(Cat#P1110,Solarbio公司);胰岛素放射免疫分析药盒(S10950186,天津九鼎医学生物工程有限公司);Primescript RT Master Mix、TaKaRa MiniBEST Universal RNA Extraction Kit、TaKaRa SYBR Premix Ex Taq(RR036A、9767、RR802A,TakaRa公司);高脂饲料(基础饲料40%、鸡蛋34%、猪油20%、白砂糖5.1%、热量为22.1 kJ/g、糖类热量25%、脂肪热量60.17%,兰州军区兰州总医院动物实验科)。
1.3实验仪器BP210S电子天平购自赛多利斯有限公司;PHS-3B型pH计购自雷磁仪器公司;HP-8453紫外分光光度计购自美国惠普公司;SpectraMax i3全自动荧光酶标仪购自美国Molecular公司;Vitalab ISP-21半自动生化分析仪购自荷兰Vital Scientific公司;Sigma 3K15低温离心机购自德国Sigma公司;IEC-Micromax离心机购自美国ThermoElectron公司;MG96G Long Gene PCR仪购自杭州朗基科学仪器有限公司;AB ViiA7 Realtime PCR购自美国Applied Biosystems公司。
1.4T2DM大鼠模型的建立、分组及给药雌性Wistar大鼠50只在实验环境中适应10 d后,随机抽取10只作为正常对照组,剩余40只进行造模。正常对照组给予常规饲料饲养,造模大鼠均给予高脂饲料饲养,期间自由饮水。2个月后,造模大鼠空腹16 h,按体重腹腔注射链脲佐菌素(STZ)30 mg/kg,7 d后测定空腹血糖,根据大鼠血糖状态未达标者再次注射STZ 15 mg/kg,7 d后测定空腹血糖,血糖>13.0 mmol/L的大鼠为造模成功,按照血糖和体重均分为糖尿病模型组,褪黑素组,Neu-p11低、高剂量组,每组9只。正常对照组与模型组给予等量水,褪黑素组给予褪黑素10 mg/kg,Neu-p11低、高剂量组分别给予Neu-p11 5 mg/kg、10 mg/kg;灌胃体积为1 ml/200 g,每天8:30给药,连续给药4周。
1.5相关指标测定①空腹血糖(FBG):给药前、给药1、2、3、4周,各组大鼠禁食不禁水6 h后,用乙醚麻醉,眼球后静脉丛取血,6000 r/min离心4 min,取血清,用葡萄糖氧化酶法测定FBG。②腹腔葡萄糖耐量试验(IPGTT):给药21 d,大鼠禁食不禁水6 h后,根据大鼠体重按1 ml/200 g腹腔注射50%葡萄糖溶液,分别在注射前、注射后30、60和120 min,乙醚麻醉大鼠,取眼球后静脉丛血,置于含抗凝剂肝素钠(50 U/ml)的EP管中,6000 r/min离心4 min;用葡萄糖氧化酶法测定4个时间点的血糖值。③空腹胰岛素(INS)、IR指数(HOMA-IR)和胰岛素敏感指数(ISI):给药4周,采用放射免疫法测定血清INS,具体步骤按照试剂盒说明书进行操作;并计算HOME-IR和ISI,具体公式如下:HOMA-IR=FBG(mmol/L)×INS(mU/L)/22.5、ISI=Ln1/[FBG(mmol/L)×INS(mU/L)]。
1.6大鼠肝脏组织相关基因表达的测定大鼠处死后,剖取大鼠肝脏组织,称取约20 mg,加Buffer RL试剂600 ml研磨匀浆,提取肝脏组织中的总RNA。将提取的总RNA逆转录为cDNA,反应条件:37℃,15 min;85℃,5 s;-20℃保存。根据Mfn2、GK、PEPCK、G-6-P、GSK-3的基因序列设计引物,见表1。RT-PCR反应条件:95℃,30 s;95℃,5 s;60℃,31 s;共40个循环;-20℃保存。每批模板均同时进行内参β-actin和目的基因的扩增反应。获得数据以RQ=2-ΔΔCT计算mRNA表达量。
1.7大鼠肝脏病理切片的制作及观察将大鼠用水合氯醛麻醉后固定在取材板上,打开胸腔,将心脏露出,灌注后取出大鼠肝脏,应用4%多聚甲醛固定;而后将肝脏切成厚度为2 mm的组织块,梯度乙醇和二甲苯脱水,再浸于60℃的固体石蜡中,重复2次。然后石蜡包埋、切片,再将切片置于60℃烤箱中4 h,保存于切片盒中;最后进行HE染色观察。
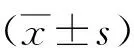
2 结果
2.1大鼠FBG水平比较4组T2DM大鼠不同时间点FBG水平均显著高于正常对照组(P<0.01)。与模型组比较,褪黑素组不同时间点FBG水平差异不显著,Neu-p11低、高剂量组给药1、2、3周FBG水平具有降低趋势,但差异均无统计学意义(P>0.05)。给药4周后,Neu-p11低剂量组FBG水平低于模型组(P<0.05)。见表2。
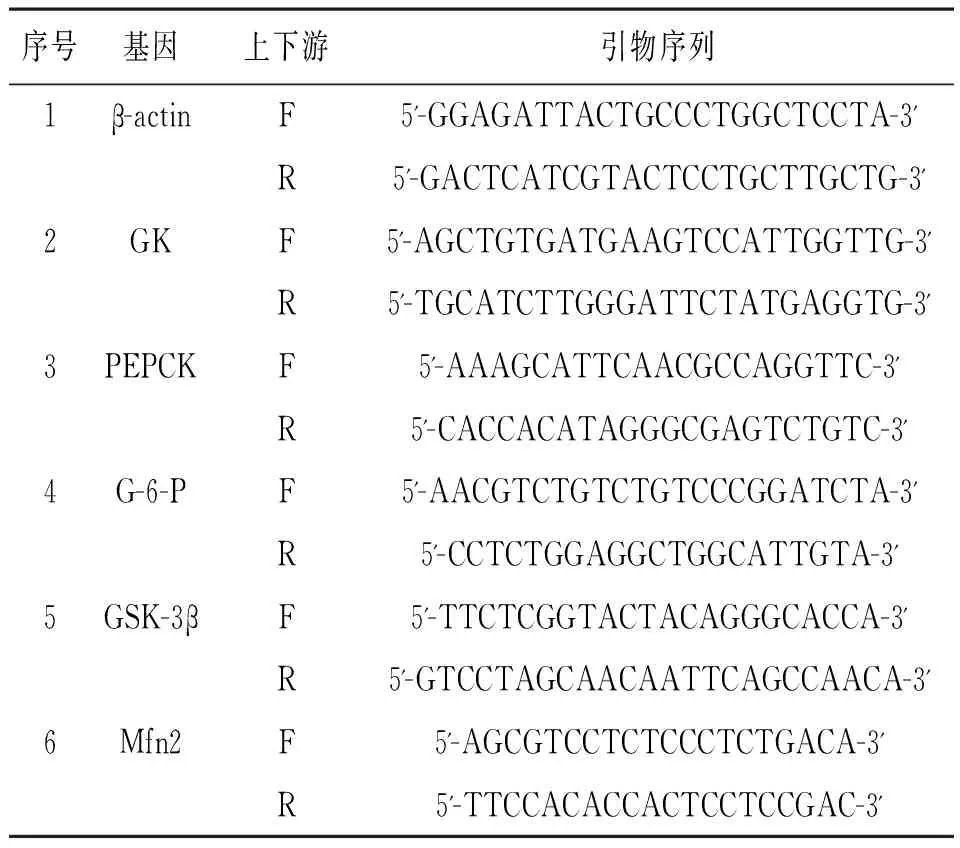
表1 大鼠肝脏组织相关基因的引物序列
注:GK为葡萄糖激酶,PEPCK为磷酸烯醇式丙酮酸羧激酶,G-6-P为葡糖糖-6-磷酸酶,GSK-3β为糖原合成激酶-3β,Mfn2为线粒体融合蛋白2
2.2大鼠IPGTT结果比较腹腔注射葡萄糖30 min后,各组血糖水平达到峰值。4组T2DM大鼠不同时间点血糖水平显著高于正常对照组(P<0.01)。给药组血糖值上升幅度相较其他组较小,其中褪黑素最优;注射后60和120 min,Neu-p11低剂量组较模型组血糖水平有明显下降趋势,Neu-p11高剂量与褪黑素组较模型组血糖水平变化不明显,但差异均无统计学意义(P>0.05)。见表3。

表2 5组大鼠空腹血糖水平比较
注:与正常对照组比较,bP<0.01;与模型组比较,aP<0.05

表3 5组大鼠腹腔葡萄糖耐量试验结果比较
注:与正常对照组比较,bP<0.01
2.3大鼠INS、HOMA-IR和ISI水平比较4组T2DM大鼠INS和HOMA-IR水平高于正常对照组,ISI水平低于正常对照组(P<0.01)。Neu-p11低剂量组INS和HOMA-IR水平低于模型组(P<0.05),但褪黑素组、Neu-p11低、高剂量组ISI水平改善效果不明显(P>0.05)。见表4。
2.4大鼠肝脏Mfn2和糖代谢关键酶mRNA表达情况4组T2DM大鼠PEPCK、G-6-P、GK、GSK-3β和Mfn2 mRNA表达水平与正常对照组比较差异均有统计学意义(P<0.01)。褪黑素组、Neu-p11低、高剂量组Mfn2 mRNA表达水平以及Neu-p11低剂量组GK mRNA表达水平均高于模型组(P<0.05,P<0.01)。褪黑素组、Neu-p11低、高剂量组G-6-P mRNA表达水平以及Neu-p11低、高剂量组PEPCK mRNA表达水平均低于模型组(P<0.05,P<0.01)。见表5。
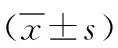
表4 5组大鼠INS、HOMA-IR和ISI水平比较
注:INS为空腹胰岛素,HOMA-IR为胰岛素抵抗指数,ISI为胰岛素敏感指数;与正常对照组比较,bP<0.01;与模型组比较,aP<0.05
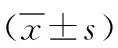
表5 5组大鼠肝脏Mfn2和糖代谢关键酶mRNA表达情况
注:GK为葡萄糖激酶,PEPCK为磷酸烯醇式丙酮酸羧激酶,G-6-P为葡糖糖-6-磷酸酶,GSK-3β为糖原合成激酶-3β,Mfn2为线粒体融合蛋白2;与正常对照组比较,bP<0.01;与模型组比较,aP<0.05,dP<0.01
2.5大鼠肝脏组织形态学变化正常对照组肝小叶结构清晰,细胞成多边形,细胞核大而圆,核仁清晰,核周边间隙均匀,细胞索排列规律整齐。模型组的肝组织结构紊乱,细胞核排列不规律,大部分肝细胞呈现大泡状,胞浆透明且疏松。褪黑素组、Neu-p11低、高剂量组相较于模型组细胞索排列紧密整齐,肝小叶结构清晰,其中Neu-p11低量组对肝组织形态改善明显,细胞核色深,核仁清晰,基本无大泡状细胞,褪黑素组和Neu-p11高剂量组出现少量大泡状细胞,肝组织整体形态良好。见图1。
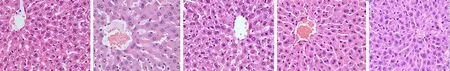

图1 5组大鼠肝脏组织HE染色病理切片(HE ×200) A.正常对照组;B.模型组;C.褪黑素组;D.Neu-p11低剂量组;E.Neu-p11高剂量组
3 讨论
近年研究发现,线粒体功能障碍是T2DM发生IR和代谢失衡的重要原因[7]。线粒体作为一个独立、自主的动态细胞器,其形态、数量与功能有着紧密联系,线粒体通过不断融合和断裂以维持其在细胞内数量和形态的变化。Mfn2是诱导线粒体融合的主要蛋白,在线粒体融合时起到外膜融合内膜停靠的作用,对线粒体结构形态和功能调节维持有重要意义[8-9]。研究发现,T2DM可造成Mfn2的表达低下,线粒体融合分裂失衡,数量与形态异常,线粒体功能障碍,形成IR[8]。肝脏作为胰岛素和血糖调节的敏感器官,在糖代谢调节中占有重要地位。本实验研究发现,胰岛组织受损导致的高血糖,促使肝脏内Mfn2表达低下,线粒体形态和数量变化紊乱影响糖酵解、糖异生和肝糖原的合成分解等途径,导致肝脏IR,诱发肝糖代谢关键酶表达异常。
褪黑素作为一种具有昼夜节律的调节激素,对机体内环境稳态、线粒体形态和功能的改善有较好效果[10]。褪黑素影响碳水化合物代谢的平衡,可通过减少糖异生和促进糖酵解来维持糖代谢的稳态[11]。内源性褪黑素失衡可导致大鼠糖耐量异常和IR,同时也导致动物体内肝脏和骨骼肌糖原合成的减少[12]。褪黑素半衰期短、容易快速代谢、药效短、不稳定,Neu-p11作为新合成的褪黑素受体激动剂具有半衰期长、选择性高、易合成等特点,有望成为治疗糖尿病的药物[13]。本实验采用高脂饲料长期喂养大鼠加小剂量注射STZ成功诱发T2DM模型,呈现空腹血糖显著上升,葡萄糖耐量下降及IR等特点[14]。给予褪黑素和Neu-p11治疗后,褪黑素组和Neu-p11低剂量组可显著改善T2DM大鼠的IR,且Neu-p11低剂量组对T2DM大鼠具有长效降糖作用,对葡萄糖耐受能力也有较好改善。
T2DM状态下,大鼠肝脏内过度产生葡萄糖,减少肝糖原储存,其原因为IR导致肝脏代谢基因的表达紊乱。其中GK表达降低,致使肝脏糖酵解减弱,糖原合成减少;而PEPCK、G-6-P、GSK-3β表达被激活,糖异生增强,血液中葡萄糖含量升高[1,15]。同时研究发现,高血糖及IR患者肝脏的线粒体结构紊乱肿胀,基质密度降低,线粒体融合分裂蛋白基因表达异常,尤其是Mfn2基因表达显著降低[16-18]。本实验结果显示,长期给予T2DM大鼠Neu-p11,可激活Mfn2的基因表达,改善Mfn2 mRNA在T2DM大鼠肝脏内的低表达状态,维持肝脏线粒体的正常形态和功能,改善IR,增强肝脏胰岛素的敏感性[19];调节肝糖代谢糖异生、糖酵解等重要途径关键酶mRNA的表达,上调GK mRNA的表达,增强糖酵解,加速肝糖原的生成,减少血液中的葡萄糖;下调PEPCK、G-6-P mRNA的表达,抑制糖异生和糖原分解,对肝糖代谢紊乱起到缓解和治疗的效果。
高脂饮食诱发的T2DM大鼠,肝细胞会呈现肿胀状态,细胞体积增大,易发生脂肪变性和炎性细胞浸润。肝脏HE染色显示,褪黑素组、Neu-p11低、高剂量组明显改善了T2DM大鼠肝脏的组织形态,肝脏细胞内脂滴沉积少,细胞索排列紧密,空泡减少,Neu-p11低剂量组改善效果显著。
综上所述,褪黑素与Neu-p11可通过介导T2DM大鼠肝脏Mfn2 mRNA表达来参与改善IR,影响肝糖代谢关键酶mRNA的表达,改善T2DM大鼠肝脏的组织形态,调节T2DM大鼠的糖代谢异常。这对后期褪黑素及其受体激动剂基于线粒体功能平衡治疗T2DM及IR的机制研究具有指导意义。
[参考文献]
[1]王利军,张汝学,贾正平.肝脏中糖代谢关键酶作为糖尿病药物靶点的研究进展[J].国际内分泌代谢杂志,2009,29(5):351-353.
[2]Warren B E, Lou P H, Lucchinetti E,etal. Early mitochondrial dysfunction in glycolytic muscle,but not oxidative muscle, of the fructose-fed insulin-resistant rat[J].Am J Physiol Endocrinol Metab, 2014,306(6):E658-667.
[3]Phielix E, Szendroedi J, Roden M. Mitochondrial function and insulin resistance during aging: a mini-review[J].Gerontology, 2011,57(5):387-396.
[4]Robb E L, Moradi F, Maddalena L A,etal. Resveratrol stimulates mitochondrial fusion by a mechanism requiring mitofusin-2[J].Biochem Biophys Res Commun, 2017,485(2):249-254.
[5]甘可欣.Mfn2表达对高脂诱导的胰岛素抵抗大鼠肝脏糖、脂代谢的影响及机制研究[D].石家庄:河北医科大学,2012.
[6]Lardone P J, Alvarez-Sanchez S N, Guerrero J M,etal. Melatonin and glucosemetabolism: clinical relevance[J].Curr Pharm Des, 2014,20(30):4841-4853.
[7]陈娜,邓倩,谭秋荣,等.线粒体功能障碍与2型糖尿病[J].中南药学,2014,12(9):885-889.
[8]Ishihara N, Eura Y, Mihara K. Mitofusin 1 and 2 play distinct roles in mitochondrial fusion reactions via GTPase activity[J].J Cell Sci, 2004,117(Pt 26):6535-6546
[9]Tubbs E, Axelsson A S, Vial G,etal. Sulforaphane improves disrupted ER-mitochondria interactions and suppresses exaggerated hepatic glucose production[J].MolCellEndocrinol,2018,461:205-214.
[10] 丁琪,赫长胜,薛峰,等.褪黑素对急性重症胰腺炎肝损伤的保护作用[J].中国现代医生,2011,49(5):12-13.
[11] Chen C, Fichna J, Laudon M,etal. Antinociceptive effects of novel melatonin receptor agonists in mouse models of abdominal pain[J].World J Gastroenterol, 2014,20(5):1298-1304.
[12] 刘文洁,张汝学,贾正平.褪黑素防治2型糖尿病的研究进展[J].中国药房,2013,24(41):3928-3930.
[13] Faria J A, Kinote A, Ignacio-Souza L M,etal. Melatonin acts through MT1/MT2 receptors to activate hypothalamic Akt and suppress hepatic gluconeogenesis in rats[J].Am J Physiol Endocrinol Metab, 2013,305(2):E230-242.
[14] 陈咨苗,陈肖俊,王美荣,等.酮替芬对链脲佐菌素诱导的糖尿病模型大鼠胰岛功能的影响[J].中国临床药理学与治疗学,2013,18(6):627-632.
[15] 卢晶,沈涵,程呈,等.hERG钾通道通过降低氧化应激改善肝细胞糖代谢[J].首都医科大学学报,2017,38(2):156-160.
[16] Kelley D E, He J, Menshikova E V,etal. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes[J].Diabetes, 2002,51(10):2944-2950.
[17] Vanhorebeek I, De Vos R, Mesotten D,etal. Protection of hepatocyte mitochondrial ultrastructure and function by strict blood glucose control with insulin in critically ill patients[J].Lancet, 2005,365(9453):53-59.
[18] Bach D, Pich S, Soriano F X,etal. Mitofusin-2 determines mitochondrial network architecture and mitochondrial metabolism. A novel regulatory mechanism altered in obesity[J].J Biol Chem, 2003,278(19):17190-17197.
[19] Li X, Cai S, Yin W,etal. Neu-p11 reduces clock/apelin expression in insulin-resistant mouse adipocyte model[J].Acta Biochim Biophys Sin, 2013,45(9):798-800.

