体外受精-胚胎移植超促排卵周期中金属蛋白酶3、肿瘤坏死因子、血管内皮生长因子的表达与卵巢反应性的研究*
金锐,包俊华,赵亚琼,刘芳,唐大伟,白刚,刘丽丽,赵静
(宁夏银川市妇幼保健院,宁夏 银川 750001)
随着人类辅助生殖技术的广泛开展和超促排卵药物的普遍使用,卵巢的不同反应所致的各种并发症日益引起临床医师的重视,评估在超促排卵过程中的卵巢微环境对卵巢反应性的影响[1],了解卵巢微环境的变化,帮助临床医师合理使用超促排卵药物,改善促排周期的妊娠情况。本文着重分析探讨在控制性超排卵治疗周期中,在使用大剂量的促排卵药物后,不孕妇女的血清及卵泡液中金属蛋白酶3(matrix metalloproteinase-3,MMP-3)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、肿瘤坏死因子(tumor necrosis factor,TNF)的表达差异,分析MMP-3、VEGF及TNF与卵巢反应性的关系。
1 资料与方法
1.1 一般资料
选择2013年3月-2015年10月在银川市妇幼保健院生殖中心行体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET) 治 疗, 年 龄22~38岁,月经规律,排卵正常,排除子宫内膜异位症及反复流产病史,且配偶精液检验正常(世界卫生组织第五版分析标准),均采用黄体期长方案的413例周期不孕妇女。收集这部分患者在使用促性腺激素(Gonadotrophin,Gn)启动日和绒毛膜促性腺激素(human chorionic gonadotropin,hCG)注射日的血清标本,并在患者取卵时收集其卵泡液。根据患者获卵数分为3个组:获卵数≥20个的为高反应组,获卵数在6~19个的为正常反应组,获卵数≤5个的为低反应组。
1.2 方法
1.2.1控制性超排卵方案 采用黄体期长方案。治疗前1周期的黄体中期肌内注射(肌注)长效GnRHa(曲普瑞林,1.0 mg/支,德国辉凌制药有限公司),达到垂体降调节标准(FSG、LH均<5 IU/L,E2<50 ng/L,子宫内膜厚度<5 mm,双侧卵巢无囊肿)后,在月经3~5 d 时肌内注射(肌注)Gn。经阴道B超监测卵泡的生长,待双侧卵巢中有2个卵泡平均直径>19 mm时,患者停止使用Gn,改为肌注hCG,将此日设定为hCG日;在使用hCG 34~36 h后患者在阴道B超的引导下抽取卵泡液,将卵泡液送至实验室并在显微镜下捡拾卵子。
1.2.2卵子的受精及胚胎培养将抽吸卵泡液获得的卵子移入浓度为6%二氧化碳CO2培养箱中培养2~4 h,与优化的精子结合,形成受精卵后将其移入胚胎培养试剂中继续在体外培养3~5 d,并对形成的胚胎进行评估打分。胚胎形态学评分标准为:1分:胚胎卵裂球大小如碎片一般,不一致,不对称,无核碎片>50%,胞浆颗粒粗糙;2分:胚胎胞浆浓缩,质地粗糙,无核碎片占20%~50%,卵裂球大小明显不均一;3分:胚胎胞浆饱满,质地略有不均,无核碎片10%~20%,卵裂球大小轻度不对称,不一致;4分:胚胎胞浆饱满,质地均匀,无核碎片≤5%,卵裂球大小均一,对称。在取卵后第3天对具有移植指针的患者选择评分在3~4分的优质胚胎1~3个进行子宫腔内移植。
1.2.3患者的黄体支持及妊娠确认移植术后对患者采用肌注或口服黄体酮进行黄体支持,14 d后检测患者血清及尿液hCG,确认是否妊娠。14 d后患者行B超检查,如子宫内见妊娠囊、胎芽及胎心搏动可确诊为临床妊娠。
患者的卵子受精及胚胎培养用瑞典Vitrolife 公司生产的G5系列培养液进行。所用的培养皿为美国FLCON公司生产的型号为3037、3003及3066培养皿。
VEGF、TNF及MMP-3的检测采用定量酶联免疫法。采用双抗体夹心酶联米易吸附测定方法测定卵泡液和血清中的VEGF、TNF及MMP-3水平。试剂盒购自美国R&D公司。实验操作按试剂盒说明书进行。批次和批间差异<10%。
1.2.5仪器与设备培养患者卵子和胚胎的培养箱为日本三洋CO2培养箱。采用美国热点Thermo MK3系列酶标仪进行测量血清及卵泡液中的MMP-3、VEGF及TNF。
1.3 统计学方法
采用SPSS 13.5统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组间采用方差分析,在方差分析有意义的基础上,行LSD-t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 患者基本资料
共纳入413例周期的患者,高反应周期有119例,正常反应周期有218例,低反应周期有76例。这些患者的年龄、BMI、不孕年限组间比较差异无统计学意义(P>0.05)。见表 1。
2.2 患者促排卵过程血清中VEGE、TNF、MMP-3的水平变化
413个周期的患者,在超促排卵过程中,随卵泡发育,各组患者血清中MMP-3和VEGF的水平呈上升趋势。注射hCG日血清中MMP-3和VEGF的水平与肌注Gn日比较,差异有统计学意义(P<0.05)。注射hCG日血清中MMP-3和VEGF水平高于肌注Gn日血清的MMP-3和VEGF水平。在超促排卵过程中,随着卵泡的发育,各组患者血清中TNF水平比较,差异有统计学意义(P<0.05),Gn启动日高于肌注hCG日。见表2。
表1 患者基本资料 (±s)
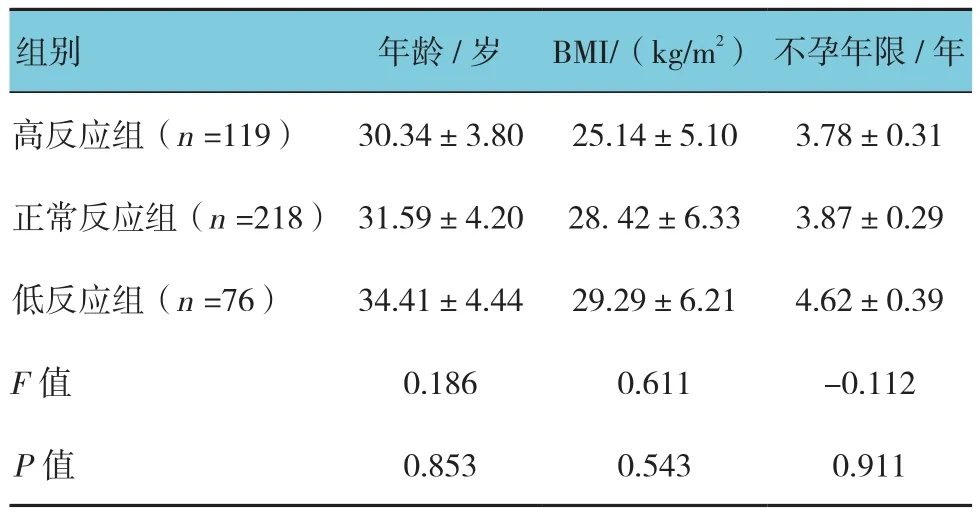
表1 患者基本资料 (±s)
高反应组(n =119) 30.34±3.80 25.14±5.10 3.78±0.31正常反应组(n =218) 31.59±4.20 28. 42±6.33 3.87±0.29低反应组(n =76) 34.41±4.44 29.29±6.21 4.62±0.39 F值 0.186 0.611 -0.112
2.3 患者卵巢反应性与卵泡液中MMP-3、VEGF及TNF水平的关系
3组患者卵泡液中MMP-3、VEGF及TNF水平比较,组间差异有统计学意义(P<0.05)。高反应患者卵泡液中MMP-3水平高于正常反应组和低反应组患者。而卵泡液中VEGF和TNF的水平恰恰相反,高反应组患者的水平低于正常反应组和低反应患者的水平。见表3。
①建设项目节水管理需要建立建设项目实施全过程的管理制度。一是规划阶段,发展改革主管部门组织对建设项目设计任务书进行审查时,同时审查节水设施可行性情况;二是设计阶段,建设单位需要提交节水评估报告,节水管理机构需要对建设项目施工图设计节水设施的情况同步审查;三是施工阶段,施工单位需要按照施工图设计文件,进行节水设施施工;四是竣工验收阶段,节水管理机构应对节水设施进行同步竣工验收,验收合格后通知水行政主管部门,允许建设项目取水或在管网范围内向建设项目供水;五是运行管理阶段,建设单位必须确保已经建成节水设施的正常运行,节水管理机构或水行政主管部门对节水设施运行维护情况进行监管、处罚。
表2 各组患者血清MMP-3、TNF、VEGF注射Gn及注射hCG日血清水平比较 (±s)
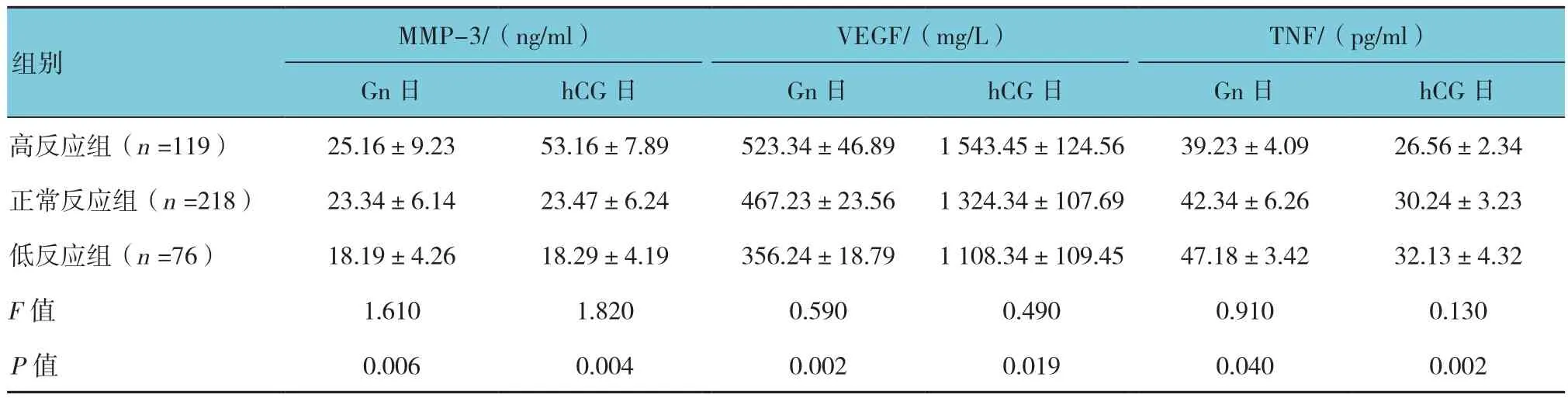
表2 各组患者血清MMP-3、TNF、VEGF注射Gn及注射hCG日血清水平比较 (±s)
MMP-3/(ng/ml) VEGF/(mg/L) TNF/(pg/ml)Gn日 hCG日 Gn日 hCG日 Gn日 hCG日高反应组(n =119) 25.16±9.23 53.16±7.89 523.34±46.89 1 543.45±124.56 39.23±4.09 26.56±2.34正常反应组(n =218) 23.34±6.14 23.47±6.24 467.23±23.56 1 324.34±107.69 42.34±6.26 30.24±3.23低反应组(n =76) 18.19±4.26 18.29±4.19 356.24±18.79 1 108.34±109.45 47.18±3.42 32.13±4.32 F值 1.610 1.820 0.590 0.490 0.910 0.130 P值 0.006 0.004 0.002 0.019 0.040 0.002组别
表3 患者卵泡液中VEGF、TNF及MMP-3水平比较 (±s)
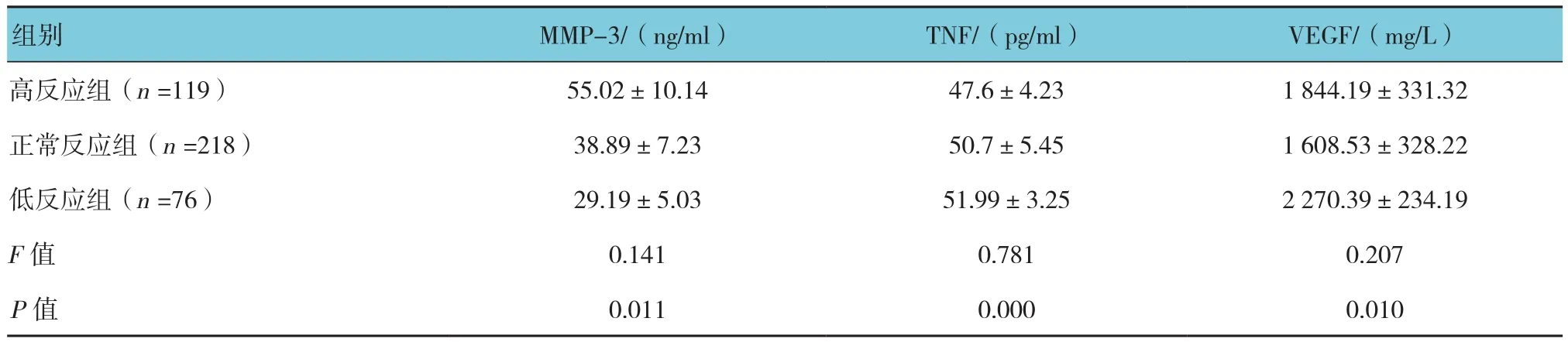
表3 患者卵泡液中VEGF、TNF及MMP-3水平比较 (±s)
组别 MMP-3/(ng/ml) TNF/(pg/ml) VEGF/(mg/L)高反应组(n =119) 55.02±10.14 47.6±4.23 1 844.19±331.32正常反应组(n =218) 38.89±7.23 50.7±5.45 1 608.53±328.22低反应组(n =76) 29.19±5.03 51.99±3.25 2 270.39±234.19 F值 0.141 0.781 0.207 P值 0.011 0.000 0.010
3 讨论
卵泡液是卵巢中卵子及颗粒细胞生长发育的微环境。卵泡液是由卵巢局部分泌物和血浆的渗出物共同组成的,在卵子的生长、发育、排出、闭锁中起至关重要的调控作用[2]。在IVF-ET的超促排卵过程中,在外源性促性腺激素的作用下,卵泡内的细胞分泌不同的细胞因子形成复杂的网络体系,协同发挥生物活性功能[3],直接或间接地影响着卵母细胞的发育、分裂、生存及以后的受精、胚胎形成及着床[4]。
MMPs家族是1个大家族,目前已分离鉴别出20个成员,编号分别为MMP 1~20,它们是一组锌离子依赖性肽链内切酶,大小各异,底物不尽相同,能裂解维系蛋白结构的肽链,主要参与结缔组织的降解[5]。MMPs在卵泡生长发育中的作用主要是可以精确调控在卵泡生长发育中卵巢内细胞外基质(extracellular matrix,ECM)成分的降解和重塑,MMPs通过调节卵巢结构成分的动态周期性变化,对卵泡和黄体功能发挥作用。在排卵过程中,包括卵泡生长和卵泡破裂释放出成熟的卵母细胞以及颗粒细胞的黄素化,这些都涉及到广泛的血管发生和卵巢组织重建[6]。迄今为止,已经发现有多种MMPs参与了卵泡生长和排卵的过程。本研究测定分析了在控制性排卵过程中,卵巢高反应的患者、正常反应患者以及卵巢低反应患者血清及卵泡液中的MMP-3的表达,可以看到血清中MMP-3的表达随着获卵数目地增加而有所增加,卵巢高反映的患者有较高的MMP-3水平,与此同时妊娠的患者中MMP-3的表达较未妊娠的患者高[7],所以,血清中MMP-3可以作为预测卵巢反应性和成功妊娠的早期指标,从而有利于临床早期干预。
TNF是肌肉细胞源性具有多向性作用的细胞因子,主要由活化的巨噬细胞、NK细胞及T淋巴细胞产生。参与细胞的增殖和凋亡等过程与慢性乙肝、自身免疫性疾病、胰岛素抵抗、肿瘤等多种疾病的易感性相关[8]。TNF在卵巢上主要由颗粒细胞和巨噬细胞产生,TNF参与排卵,但当其水平较高时可抑制颗粒细胞上胰岛素样生长因子1诱导的E2的合成和卵泡膜上LH诱导的雄烯二酮的合成,从而影响卵泡的发育[9]。在超排卵过程中,TNF水平随着卵泡生长成熟逐渐降低,通过抑止颗粒细胞对雌二醇及孕酮的合成对促性腺激素的反应下降。与此同时TNF可以促进MMP-3的活性,促使排卵发生,同时导致排卵后的卵泡黄素化、血管化,所以当接近排卵时,在TNF的作用下卵泡液中的MMP-3和VEGF水平均呈现上升的趋势[10]。
VEGF在维持卵巢正常功能上起重要作用,对卵泡生长、黄体分化、卵母细胞的成熟及受精是十分重要的[11]。在卵泡生长的过程中,卵泡液中的VEGF诱导卵泡周围的微血管形成,促进血液中的FSH和LH更好地作用于卵母细胞,从而促进了卵母细胞的生长和成熟[12]。同时卵巢中的颗粒细胞中VEGF的表达受促性腺激素和TNF等因子的调节,在卵泡期增加其通透性,促进卵泡液聚集,利用前体物质如脂质的运输[13],为激素的合成提供条件。在控制性超促排卵过程中,颗粒细胞、卵泡膜细胞分泌的VEGF促使卵泡周围的微血管生成,从而使得卵泡有机会获得更多的激素或营养物质,进而促进卵泡的发育[14]。
血清中的MMP-3、TNF及VEGF等只是众多卵巢卵泡发育微循环中的一员,对于各个因子的相互调节,互相平衡[15],需要更进一步地研究。分析卵泡液中的细胞因子的变化可以作为IVF-ET过程中一个辅助检查部分,帮助临床医师更好地指导临床用药,改善IVF-ET中超促排卵中卵子发育的情况,提高获得卵母细胞质量,进而提高IVF-ET的妊娠结局。
参 考 文 献:
[1]李斌, 杜兴贵, 姚俊霞, 等. MMP-9和TIMO-1在不明原因不孕者子宫内膜的表达[J]. 中国热带医学, 2008, 8(10): 1701-1703.
[2]尚定昆, 郑晓群, 颜卫华, 等. TH1/TH2细胞因子与习惯性流产的关系研究[J]. 中国优生与遗传杂志, 2008(4): 30-32.
[3]姜晓媛, 孙振高, 连方, 等. 卵泡液代谢组学研究进展[J]. 生殖医学杂志, 2013(11): 888-892.
[4]于康, 王海涛, 张鹏, 等. 卵泡液微环境对卵母细胞发育的影响[J]. 齐鲁医学杂志, 2011(1): 90-92.
[5]王秀霞, 王天任 , 易晓芳, 等. 卵泡液中 TNF-α和IFN-γ与颗粒细胞调亡关系的探讨[J]. 生殖与避孕, 2010(8): 519-522.
[6]张玲, 熊承良. 颗粒细胞核卵泡液因子在评估卵母细胞质量中的价值[J]. 生殖与避孕, 2010(12): 827-831.
[7]BAKA S, ZOULA K, MALAMITSI-PUCHNER A, et al.Intrafollicular levels of matrix metalloproteinase-2 and -9 in patients with polycystic ovaries are not associated with pregnancy rate during IVF cycle[J]. In Vivo, 2009, 23(1): 89.
[8]RODRIGUEZ D, MORRISON C J, OVERALL C M. Matrix metalloproteinases: What do they not do? New substrates and biological roles indenti fi ed by murine models and proteomics[J].Biochimica et Biophysica Acta(BBA)-Molecular Cell Research,2010, 1803 (1): 39-54.
[9]LAHAV-BARATZ S, KRAIEM Z, SHILOH H, et al. Decreased espression of tissue inhibitor of matrix matalloproteinasees in follicular fl uid from women with polycystic ovaries compared with normally ovulating patients undergoing in vitro fertilization[J].Fertility and Sterility, 2003. 56(2): 223-228
[10]DOMINGUEZ M A, PETRE M A, NEAL M S, et al. Bisphenol a concentra-tion-dependently increases huma granulosa-lutein cell matrix metalloproteinase-9 (MMP-9) enzyme output[J].Reprodcutive Toxicology, 2008(25): 420-425.
[11]QIAO J, FENG H L. Extra-and intra-ovarian factors in polycystic ovary syndrome: impact on oocyte maturation and embryo developmental competence[J]. Human Reproduction Update,2011, 17(1): 17-33.
[12]BREW K, NAGASE H, The tissue inhibitors of metalloproteinases(TIMPs): An ancient family with structural and functional diversity[J]. Biochimica et Biophsica Acta, 1803(2010), 55-71.
[13]KIM K H, OH D S, JEONG J H, 梅林琳. 卵泡血流量是1个比卵泡液血管内皮生长因子和一氧化碳浓度更好的预测体外受精胚胎移植结局的指标[J]. 世界核心医学期刊文摘: 妇产科学分册. 2005(5): 21-22.
[14]夏兰, 赵晓明, 孙赟, 等. 反复IVF失败患者卵泡液代谢组学的检测分析[J]. 生殖与避孕, 2012(4): 248-253.
[15]张娜, 甄秀丽, 张轶, 等. 卵泡液中活性氧对体外受精-胚胎移植结局的影响[J]. 中国优生与遗传杂志, 2013(9): 111-112.

