苏尼替尼对雌二醇诱发的去卵巢大鼠子宫内膜渗出和血管通透性的干预作用研究*
李长兴,莫晨玲,李建华,孔德霞,李娟,代冬芳,永胜
(1.青海大学医学院,青海 西宁 810001;2.青海省第四人民医院,青海 西宁 810007;3.青海省西宁市第二人民医院,青海 西宁 810001)
苏尼替尼(Sutveratrol,Sut)为一种小分子多靶点酪氨酸激酶抑制剂,对血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)—VEGFR-1、VEGFR-2、VEGFR-3的酪氨酸激酶具有抑制作用,选择性阻断VEGFR信号通路,使血管内皮生长因子和血管内皮生长因子受体表达减少,从而抑制肿瘤血管的生成,达到抑制肿瘤生长和转移的目的。虽然对此相应的毒理机制进行了大量的研究,但对外源性雌二醇诱发去卵巢大鼠的子宫内膜渗出和血清血管内皮细胞生长因子(VEGF)浓度的干预作用的研究较为少见。本实验以去卵巢大鼠为动物模型,研究Sut对雌二醇诱发的去卵巢大鼠子宫内膜渗出和VEGF浓度的干预作用。
1 材料与方法
1.1 动物的选择和分组
动物分组、模型复制参照兰州大学基础医学院生理研究所课题组的方法[1-2]。选用健康雌性SD大鼠,体重(180±20)g,由兰州大学动物实验中心提供,二级动物室饲养。随机分为假手术组(Sham组)、卵巢切除组(Ovx组)、卵巢切除+17β-雌二醇组(17β-estradiol,Est)组(Ovx+Est组)、卵巢切除+17-β雌二醇+苏尼替尼组(Ovx+Est+Sut组)4组,每组6只。大鼠经氯胺酮(100 mg/kg)腹腔注射麻醉后,脊柱两侧肋弓2 cm下切口开腹,暴露卵巢,结扎切除双侧卵巢后关腹,均为无菌操作;Sham组仅打开腹腔后暴露卵巢,只切除卵巢周围5 mm×5 mm脂肪组织后关腹。术后1周开始连续皮下注射给药3周。Ovx+Est组给予1.0 mg/kg雌二醇注射液(溶媒为芝麻油),Ovx+Est+Sut组给予1.0 mg/kg 17β-雌二醇和1 mg/kg Sut(溶媒为芝麻油),Sham组、Ovx组每天给予等量的芝麻油。
1.2 试剂及仪器
1.2.1试剂17β-雌二醇(美国Sigma公司),Sut(广州爱纯医药科技有限公司),大鼠VEGF酶联免疫分析试剂(上海川翔生物制品有限公司)。
1.2.2仪器分光光度计(上海精密科学仪器有限公司),光学显微镜及照相系统(重庆广电仪器有限公司 XSN-HS7),全自动酶标仪(Bio-Tek ELX808IU),低温高速离心机(长沙湘仪离心机仪器有限公司TGL-16),电子天平(上海精密科学仪器有限公司)。
1.3 观察指标及方法
1.3.1大鼠子宫系数的测定末期给药称重,12 h后氯胺酮腹腔注射麻醉后,结扎子宫周围血管后摘取子宫,称重记录,算出子宫系数。子宫系数=子宫重量/大鼠体重。
1.3.2VEGF的测定从左心室抽取血样,离心后取血清,放入冷冻管。根据酶联免疫分析(ELISA)试剂盒说明书中提供的方法测出血清中VEGF的吸光值,根据标准曲线,算出VEGF的浓度,比较各组之间的差异。
1.3.3子宫内膜形态学的观察所取子宫组织用4 mol/L的多聚甲醛进行固定,常规脱水后石蜡包埋,切片,进行HE染色。光学显微镜低倍和高倍镜下观察各组子宫内膜形态变化。
1.4 统计学方法
采用SPSS17.0软件进行数据分析,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,方差分析有意义的基础上,两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠子宫湿重及子宫系数测定结果
4组大鼠子宫湿重及子宫系数比较,差异有统计学意义(P<0.05);与Ovx组比较,Ovx+Est组的子宫湿重和子宫系数均增加;与Ovx+Est组比较,Ovx+Est+Sut组大鼠体重、子宫湿重及子宫系数下降。见表1。
2.2 子宫内膜形态
Sham组:属正常分泌期大鼠子宫内膜,结构清楚。腺体分布均匀,呈柱状,排列规则。在内膜和肌层中可见嗜酸性粒细胞的渗出(见图1)。Ovx组:子宫明显萎缩,内膜变薄,上皮细胞萎缩呈低柱状,细胞排列紧密,细胞质减小,未能在内膜和肌层中发现嗜酸性粒细胞的渗出(见图2)。Ovx+Est组:子宫内膜明显增厚,腺上皮细胞水肿,腺体数量增加,腺腔扩大。在内膜和肌层中发现大量嗜酸性粒细胞的渗出(见图3)。Ovx+Est+Sut组:子宫内膜上皮层变薄,上皮细胞体积稍大,细胞质疏松,在内膜和肌层中只发现少量的嗜酸性粒细胞的渗出(见图4)。
表1 各组大鼠子宫湿重及子宫系数比较 (±s)
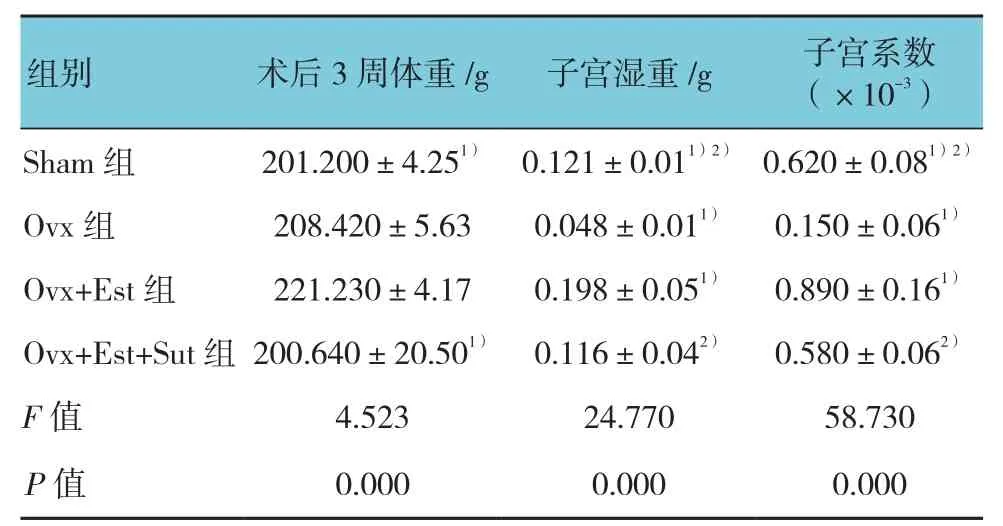
表1 各组大鼠子宫湿重及子宫系数比较 (±s)
注:1)与Ovx+Est组比较,P <0.05;2)与Ovx组比较,P <0.05
组别 术后3周体重/g 子宫湿重/g 子宫系数(×10-3)Sham 组 201.200±4.251) 0.121±0.011)2) 0.620±0.081)2)Ovx 组 208.420±5.63 0.048±0.011) 0.150±0.061)Ovx+Est组 221.230±4.17 0.198±0.051) 0.890±0.161)Ovx+Est+Sut组 200.640±20.501) 0.116±0.042) 0.580±0.062)F值 4.523 24.770 58.730 P值 0.000 0.000 0.000
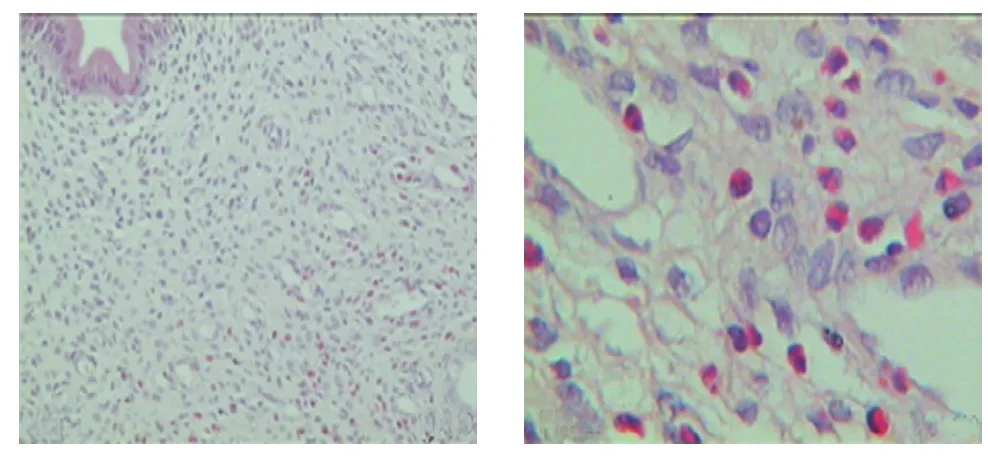
图1 Sham组子宫内膜形态 (左:×100,右:×400)

图2 Ovx组子宫内膜形态 (左:×100,右:×400)

图3 Ovx+Est组子宫内膜形态(左:×100,右:×400)
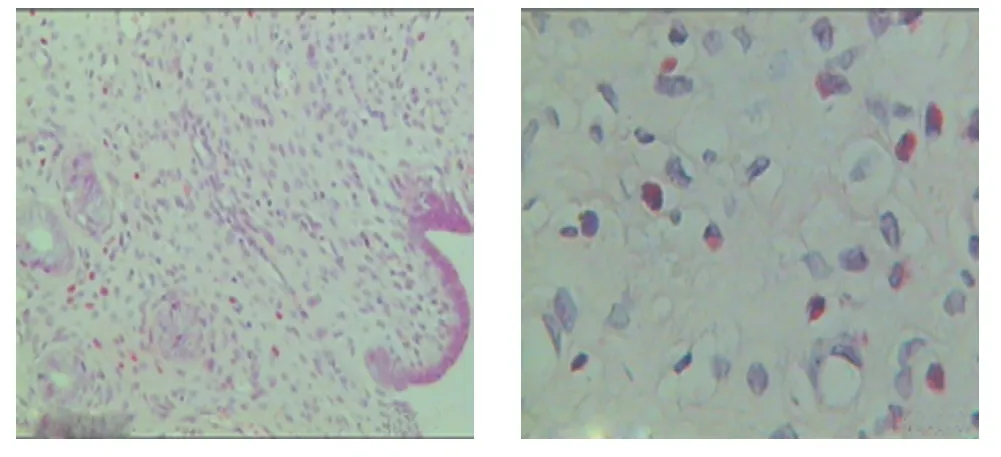
图4 Ovx+Est+Sut子宫内膜形态(左:×100,右:×400)
2.3 VEGF浓度比较
4组VEGF浓度比较,差异有统计学意义(P<0.05);与Ovx组相比,给予外源性的17β-雌激素后,Ovx+Est组血清VEGF的浓度上升;给予Sut后,Sut可使Ovx+Est+Sut组血清VEGF浓度低于Ovx+Est组。见表2。
表2 各组VEGF浓度比较 (n =6,pg/ml,±s)
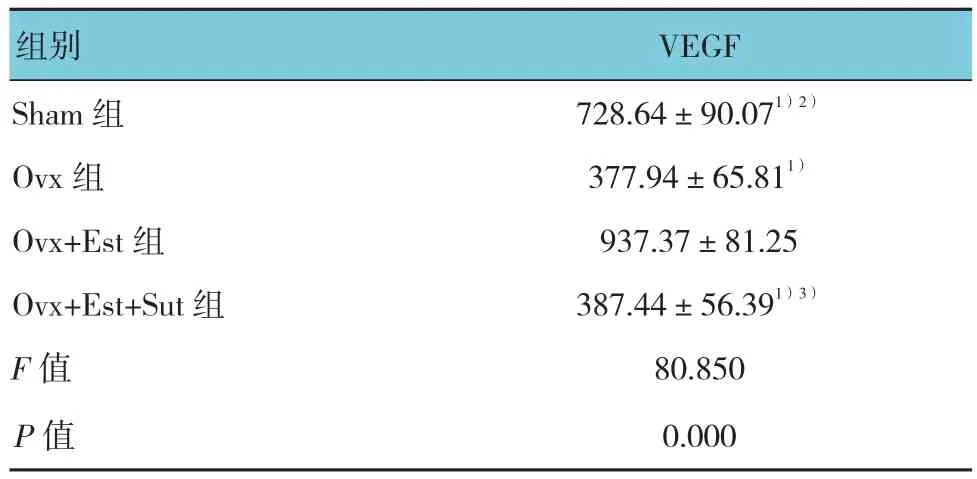
表2 各组VEGF浓度比较 (n =6,pg/ml,±s)
注:1)与Ovx+Est组比较,P <0.05;2)与Ovx组比较,P <0.05;3)与 Sham 组比较,P <0.05
组别 VEGF Sham 组 728.64±90.071)2)Ovx 组 377.94±65.811)Ovx+Est组 937.37±81.25 Ovx+Est+Sut组 387.44±56.391)3)F值 80.850 P值 0.000
3 讨论
本实验研究用去卵巢大鼠为动物模型,研究Sut对外源性雌激素诱发去卵巢大鼠子宫内膜渗出的干预作用。实验发现,子宫内膜是雌激素作用的主要靶器官,其组织形态学的改变是随着雌激素水平的不同而产生变化的,去卵巢大鼠给予外源性雌激素后,可使子宫重量及系数增加,子宫内膜增生,嗜酸性粒细胞渗出明显,血清VEGF的浓度升高;给予Sut干预后,大鼠子宫湿重及子宫系数降低,子宫内膜中嗜酸性粒细胞数减少,血清VEGF浓度也降低。研究[3-4]证明了Sut可抑制外源性雌激素对子宫内膜的渗出,抑制VEGF的生成。
VEGF蛋白是一种具有高度保守性的糖蛋白,是目前发现的作用最强、特异性最高的促血管生成因子,在促进内皮细胞增生、迁移,促进萌芽过程中起重要调节作用,并在多种恶性肿瘤中过度表达,与肿瘤的生长、转移、预后密切相关[5]。VEGF接受雌孕激素的调节,雌激素可促进VEGF mRNA的生成,其生成量依赖于雌激素的浓度和作用时间[6]。VEGF有VEGFR-1、VEGFR-2、VEGFR-3 3种受体,属于受体酪氨酸激酶超家族膜蛋白,其中膜内是酪氨酸激酶区,通过内化作用发挥上述作用。VEGFR-1表达于单核细胞、滋养层细胞、内皮细胞等,是第1个被确定为血管内皮生长因子受体RTKs,在成血管细胞组合为成血管的过程中发挥重要作用;VEGFR-2是VEGF的主要功能受体,在成血管细胞的早期发育中发挥重要作用;VEGFR-3可直接影响微血管分支的发生及血管网的构成,主要接受Snail的调控[7-10]。
Sut为吲哚酮类衍生物,为小分子多靶点酪氨酸激酶抑制剂,对VEGFR-2有特异性抑制作用,可选择性阻断VEGFR信号通路,可抑制肿瘤血管的生成,从而抑制肿瘤活性和血管形成[11]。同时Sut对血小板衍生生长因子受体β(PDGFRβ)、干细胞因子受体(c2Kit)和胎肝激酶3(Flt3)受体具有抑制作用[12]。抑制VEGFR-2已成为阻断VEGF通路发挥促血管生成作用的有效方法。给予Sut后,Sut可抑制VEGF的表达,阻止VEGF与VEGFR的胞外部分结合,进而抑制胞内区的激酶区磷酸化和活化,抑制与血管生成密切相关PI3K-AKT-mTOR、Ras-Raf-MEK-ERK等信号通路,使血清VEGF浓度下降,从而使血管通透性下降, 抑制血管表皮细胞的生长、迁移进而导致血管的增生,使渗出减少[13-14]。
总之,Sut作为小分子多靶点酪氨酸激酶抑制剂,对雌二醇诱发的子宫内膜和血清VEGF浓度的影响,可以为妇产科肿瘤的防治和治疗提供新的思路。
参 考 文 献:
[1]展瑞岩, 杨红, 张元新, 等. 苏尼替尼对HeLa细胞增殖及3-磷酸甘油醛脱氢酶表达和活性的影响[J]. 中国生物制品学杂志,2013, 26(3): 385-387.
[2]李长兴, 李红芳, 张立雪, 等. 白藜芦醇对雌二醇诱发的去卵巢大鼠子宫内膜渗出和血清VEGF的影响[J]. 中国现代医学杂志,2013, 23(2): 23-26.
[3]CAIN R J, RIDLEY A J. Phosphoinositide 3-kinases in cell migration[J]. Biol Cell, 2009, 101(1): 13-29.
[4]SNUDERL M, BATISTA A, KIRKPATRICK N D, et al. Targeting placental growth factor/neuropilin 1 pathway inhibits growth and spread of medulloblastoma[J]. Cell, 2013, 152(5): 1065-1076.
[5]李骏, 刘旭东. 浅谈VEGF的相关研究进展[J]. 中国继续医学教育, 2016, 8(9): 201-203.
[6]杨小秋, 谈顺. 血管内皮生长因子研究进展及其与胰腺癌的相关研究[J]. 海南医学, 2014, 25(8): 1157-1160.
[7]和珂莉, 曾慧, 方程, 等. 中国乳腺癌患者VEGF-C表达与临床意义关系的Meta分析[J]. 国际检验医学杂志, 2015, 3(6): 723-725.
[8]PARK J A, KIM D Y, KIM Y M, et al. Endothelial snail regulates capillary branching morphogenesis via vascular endothelial growth factor[J]. Plos Genet, 2015, 11(7): e1005324.
[9]HARTMANN J T, KANZ L. Sunitinib and periodic hair depigmentation due to temporary c-KIT inhibition[J]. Arch Dermatol, 2008, 144(11): 1525-1526.
[10]BABA T, KOBAYASHI H, KAWASAKI H, et al. Glyceraldehyde-3-phosphate dehydrogenase interacts with phosphorylated Akt resulting from increased blood glucose in rat cardiac muscle[J].FEBS Lett, 2010, 584(13): 2796-2800.
[11]YU Y F, ZHANG Y, SHEN N A, et al. Effect of VEGF, P53 and telomerase on angiogenesis of gastric carcinoma tissue[J]. Asian Paci fi c Journal of Tropical Medicine, 2014, 7(4): 293-296.
[12]钟毅, 李志裕, 尤启冬. 血管内皮细胞生长因子受体酪氨酸激酶抑制剂的研究进展[J]. 中国新药杂志, 2006, 15(3): 181-185.
[13]EILKEN H M, ADAMS R H. Dynamics of endothelial cell behavior in sprouting angiogenesis[J]. Curr Opin Cell Biol, 2010,22(5): 617-625.
[14]梁雯, 赵桂森. 血管内皮生长因子受体酪氨酸激酶小分子抑制剂[J]. 生命的化学, 2012, 32(6): 519-525.

