叶酸联合降压药物治疗H型高血压效果分析
冯立春
(三门峡市中心医院全科医学科,河南 三门峡 472000)
原发性高血压是导致脑卒中发生的首要危险因素[1],其中以血浆同型半胱氨酸(homocysteine,Hcy)≥10 μmol·L-1的H型高血压危险度最高。Hcy是一种含硫基的氨基酸,是蛋氨酸循环的重要中间产物[2],通过诱导产生过氧化氢,增加自由基活性,对血管内皮造成损伤[3]。研究显示,Hcy是心血管疾病的独立危险因子[4-5]。高Hcy可直接或通过氧自由基介导血管内皮损伤,导致内皮细胞、平滑肌细胞功能障碍,使缩血管物质生成增加,促进血管平滑肌细胞的增殖和胶原合成,引起体循环血管阻力增加,血压升高[6]。H型高血压诱发脑卒中主要与血浆高Hcy水平损害血管内皮功能,造成血管弹性失衡和功能紊乱,诱发血管重构有关,进而加速动脉粥样硬化进展和血压升高,增加脑卒中发病风险[7]。体内缺乏叶酸或者编码叶酸代谢的酶发生基因突变,均将导致机体内Hcy代谢障碍,造成血Hcy蓄积。因此,针对H型高血压,降低血压和Hcy水平是预防脑卒中的重要治疗策略[8]。本研究采用叶酸联合降压药物治疗H型高血压,旨在探讨其预防脑卒中、心血管疾病的效果,现报道如下。
1 资料与方法
1.1一般资料选择2015年8月至2016年8月三门峡市中心医院收治的300例H型高血压患者为研究对象,纳入标准:(1)符合《中国高血压防治指南(2010年修订版)》中高血压诊断标准[9];(2)为防止重度高血压患者在历时1周的药物洗脱期因血压波动较大而导致发生急性并发症的风险,仅选取轻、中度高血压患者,坐位舒张压(diastolic blood pressure,DBP)90~110 mmHg(1 mmHg=0.133 kPa),收缩压(systolic blood pressure,SBP)140~180 mmHg;(3)血浆Hcy水平≥10 μmol·L-1;(4)了解本研究,并签订知情同意书。排除标准:(1)继发性高血压患者;(2)患有急性冠状动脉综合征、心脏瓣膜病等严重心脏疾病者;(3)患有无症状性脑梗死者;(4)慢性肾病≥3期者;(5)患有严重肝、肾等器质性病变者;(6)合并糖尿病、高脂血症等慢性病者;(7)合并恶性肿瘤者;(8)近6个月内有心肌梗死病史者;(9)近3个月内服用抗癫痫药物、维生素、甲氨蝶呤等影响血浆Hcy水平的药物者;(10)精神异常,有意识障碍者。300例患者入院后编号,采用密封信封法随机分为对照组和观察组,每组150例。对照组和观察组患者因未按疗程服药者或中途失访分别剔除18、26例,最终对照组132例、观察组124例纳入研究,有效随访率为85.33%。对照组:男90例,女42例,年龄35~65(54.24±6.84)岁;DBP为(96.87±9.24)mmHg,SBP为(154.84±17.24)mmHg;血浆Hcy水平为(16.24±3.86)μmol·L-1。观察组:男83例,女41例,年龄 36~65(54.84±7.05)岁;DBP为(97.45±10.05)mmHg,SBP为(153.91±18.35)mmHg;血浆Hcy水平为(15.98±4.06)μmol·L-1。2组患者的性别、年龄、血压、血浆Hcy水平等比较差异均无统计学意义(P>0.05),具有可比性。
1.2治疗方法对照组患者遵照《中国高血压防治指南(2010年修订版)》[9]进行常规降压治疗,依那普利片(湖南千金湘江药业股份有限公司,国药准字H20066383)10 mg,口服,每日1~2次;和(或)苯磺酸左旋氨氯地平片(浙江昂利康制药有限公司,国药准字H20083460)5 mg,口服,每日1~2次。观察组患者在常规降压基础上给予叶酸片(江西制药有限责任公司,国药准字H36020872)2 mg,口服,每日1次。2组患者均治疗1 a,治疗期间严禁服用维生素B12等影响血Hcy水平的药物。
1.3随访观察(1)血压:治疗期间,每月1次于上午8~9点,患者静坐5~10 min后检测SBP和DBP水平,连续测量2次,取平均值;(2)血浆Hcy水平:分别于治疗前及治疗3、6、9、12个月,抽取患者清晨空腹肘静脉血5 mL,3 000 r·min-1离心10 min,取血浆,采用荧光偏振免疫分析法经Architect i2000SR型全自动免疫分析仪(美国雅培公司)检测血浆Hcy水平;(3)颈动脉粥样硬化情况:于治疗前、治疗12个月后,使用迈瑞DC-7型彩色多普勒超声仪(深圳迈瑞生物医疗电子股份有限公司)检测2组患者颈总动脉后壁内-中膜厚度(intima-media thicknes,IMT)、血流阻力指数(resistance index,RI)及颈动脉斑块数目、斑块面积、斑块类型(包括硬斑、软斑、扁平斑和溃疡斑),并计算斑块稳定性,斑块稳定性=(硬斑+扁平斑)/斑块总数×100%;(4)随访:入选者均建立随访调查表,由专人定期门诊或电话访问,随访截止时间为2017年8月,记录患者缺血性脑卒中、心血管事件以及病死发生情况;(5)不良反应:记录2组患者治疗期间的不良反应情况。
2 结果
2.12组患者治疗期间血压比较结果见表1。对照组患者治疗6、9、12个月时与治疗3个月时比较SBP均显著降低,差异有统计学意义(P<0.05);治疗12个月时与治疗6个月时比较SBP显著降低,差异有统计学意义(P<0.05),而治疗9个月时与治疗6、12个月时SBP比较差异均无统计学意义(P>0.05)。对照组患者治疗3、6、9个月时DBP两两比较差异无统计学意义(P>0.05);治疗12个月时DBP与治疗3个月时比较显著降低,差异有统计学意义(P<0.05),与治疗6、9个月时比较差异均无统计意义(P>0.05)。观察组患者SBP在治疗6、9、12个月时显著低于治疗3个月时,治疗9、12个月时显著低于治疗6个月时,治疗12个月时显著低于治疗9个月时,差异均有统计学意义(P<0.05);观察组患者DBP在治疗6、9、12个月时显著低于治疗3个月时,差异均有统计学意义(P<0.05);而治疗6、9、12个月时DBP两两比较差异均无统计学意义(P>0.05)。观察组患者治疗3、6、9、12个月时SBP和DBP与对照组比较均显著降低,差异有统计学意义(P<0.05)。
表12组患者治疗期间血压水平变化比较
Tab.1Comparisonofthechangesofbloodpressurebetweenthetwogroupsduringtreatment
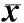
(±s)
注:与治疗3个月比较aP<0.05;与治疗6个月比较bP<0.05;与治疗9个月比较cP<0.05;与对照组同时间点比较dP<0.05;1 mmHg=0.133 kPa。
2.22组患者治疗后血浆Hcy水平比较对照组患者治疗3、6、9、12个月时血浆Hcy水平分别为(15.67±4.11)、(15.18±3.16)、(15.35±3.61)、(15.18±3.52)μmol·L-1,观察组患者治疗3、6、9、12个月时血浆Hcy水平分别为(11.16±3.13)、(10.03±2.98)、(8.15±2.42)、(7.02±2.31)μmol·L-1。治疗3、6、9、12个月时,对照组患者血浆Hcy水平两两比较差异均无统计学意义(P>0.05)。治疗3、6、9、12个月时,观察组患者血浆Hcy水平与对照组比较均显著降低(P<0.05),且观察组患者治疗3、6、9、12个月时血浆Hcy水平逐渐降低,不同时间点之间两两比较差异均有统计学意义(P<0.05)。
2.32组患者治疗前后颈动脉斑块情况比较对照组患者治疗前检出颈动脉斑块79例,颈动脉斑块检出率为59.85%(79/132);检出斑块总数为220个,其中硬斑22个,扁平斑99个,软斑53个,溃疡斑46个,斑块稳定性为 55.00 %(121/220)。观察组患者治疗前检出颈动脉斑块70例,颈动脉斑块检出率为56.45%(70/124),检出斑块总数为196个,其中硬斑19个,扁平斑95个,软斑43个,溃疡斑39个,斑块稳定性为58.16%(114/196)。对照组患者治疗12个月后检出颈动脉斑块48例,颈动脉斑块检出率为36.36%(48/132);检出斑块总数为141个,其中硬斑20个,扁平斑84个,软斑26个,溃疡斑11个,斑块稳定性为73.76 %(104/141)。观察组患者治疗12个月后检出颈动脉斑块26例,颈动脉斑块检出率为20.97%(26/124);检出斑块总数为99个,其中硬斑21个,扁平斑70个,软斑6个,溃疡斑2个,斑块稳定性为91.92%(91/99)。治疗前2组患者颈动脉斑块检出率比较差异均无统计学意义(χ2=0.303,P>0.05)。治疗12个月后,2组患者颈动脉斑块检出率与治疗前比较均显著降低(χ2=14.582、32.904,P<0.05),且观察组患者颈动脉斑块检出率显著低于对照组,差异均有统计学意义(χ2=7.375,P<0.05)。治疗前,2组患者斑块稳定性比较差异无统计学意义(χ2=0.422,P>0.05)。治疗12个月后,2组患者斑块稳定性与治疗前比较均显著增高(χ2=35.352、12.878,P<0.05),且观察组患者斑块稳定性显著高于对照组,差异有统计学意义(χ2=12.427,P<0.05)。
2.42组患者治疗前后颈总动脉后壁IMT、RI和斑块面积比较结果见表2。治疗前2组患者颈总动脉后壁IMT、RI和斑块面积比较差异均无统计学意义(P>0.05)。治疗12个月后,2组患者颈总动脉后壁IMT、RI和斑块面积与治疗前比较均显著降低,且观察组患者颈总动脉后壁IMT、RI和斑块面积均显著低于对照组,差异均有统计学意义(P<0.05)。
表22组患者治疗前后颈总动脉后壁IMT、RI和斑块面积比较
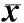
注:与治疗前比较aP<0.05;与对照组治疗后比较bP<0.05。
2.52组患者治疗1a后终点事件比较治疗1 a后,对照组患者发生脑卒中17例(12.88%)、心血管事件7例(5.30%)、病死15例(11.36%),观察组患者发生脑卒中4例(3.23%)、心血管事件4例(3.23%)、病死2例(1.61%),观察组患者脑卒中发生率和病死率显著低于对照组(χ2=7.912、9.805,P<0.05),2组患者心血管事件发生率比较差异无统计学意义(χ2=0.671,P>0.05)。
2.62组患者治疗期间不良反应比较治疗期间,2组患者均未发生明显不良反应。
3 讨论
据文献报道,我国75%的高血压患者属于H型,具有高血压、高Hcy水平表现,一方面可损伤血管内皮功能,增加血液黏度,促进血栓形成,并增加血管痉挛、硬化、收缩风险,另一方面可促进动脉粥样硬化进展,增加脑卒中发病风险,血浆高Hcy水平被视为血管性疾病的一个危险因素[5,10]。
Hcy由体内的蛋氨酸转化而来,在其转化过程中需要叶酸的参与,最终合成蛋氨酸和四氢叶酸,叶酸水平将影响血浆Hcy水平[11]。当人体缺乏叶酸或者编码叶酸代谢的酶发生基因突变时,将导致机体内Hcy的代谢障碍,造成Hcy蓄积,发生高Hcy血症。而文献报道,高Hcy血症是颈动脉粥样硬化的独立危险因素[12-13]。WANG等[14]的meta分析显示,补充叶酸可将脑卒中发生风险降低18%。
本研究采用随机对照研究方法,分析叶酸联合降压药物与单纯降压药物治疗H型高血压的效果,发现2组患者治疗后血压、血浆Hcy水平均显著降低,且观察组改善更加明显,说明补充叶酸可提高H型高血压治疗效果。补充叶酸是我国防治脑卒中的重要策略,叶酸与Hcy代谢密切相关,其可通过加速Hcy甲基化而促进Hcy代谢,形成甲硫氨酸,进而降低血浆Hcy水平,达到控制高Hcy血症的目的。血浆高Hcy水平可影响血管前列环素、硫化氢、一氧化氮等内皮舒张因子表达,造成内皮细胞损伤和脂代谢异常,血管平滑肌增厚和caspase-12、GRP 94蛋白表达上调,是引起患者血压居高不下另一方面原因[15-16],而补充叶酸,一方面可降低Hcy水平,另一方面可达到控制血压的目的[17]。故本研究中观察组患者在补充叶酸治疗后,其SBP、DBP改善效果优于对照组,与卫聪颖等[18]、李蕾等[19]报道结果一致。
颈动脉粥样硬化是诱发脑卒中的独立危险因素,不稳定斑块破裂、微栓子脱落、出血均可诱发心脑血管事件[20]。H型高血压患者因高Hcy水平,血管内皮细胞更易损伤,影响血管平滑肌细胞增殖、迁移,促进动脉血小板活化、血栓形成,增加动脉局部巨噬细胞聚集、动脉壁沉积脂质和促进斑块钙化,促进颈动脉粥样硬化进展[21-22]。本研究中,2组患者治疗前颈总动脉后壁IMT、RI、颈动脉斑块检出率和斑块面积均较高,斑块稳定性差,说明患者动脉粥样硬化较为严重,发生心脑血管事件风险高。有研究显示,针对H型高血压患者,补充叶酸可发挥脑卒中二级预防作用[23]。本研究中,观察组患者补充叶酸治疗后颈总动脉后壁IMT、RI及斑块检出率、斑块面积和斑块稳定性均较对照组明显改善,说明叶酸可通过降低血浆Hcy水平来抑制H型高血压患者颈动脉粥样硬化进展。此外,观察组患者1 a后脑卒中事件发生率、病死率均显著低于对照组,说明补充叶酸可通过改善患者颈动脉粥样硬化进展,进而降低患者发生心脑血管事件的风险。并且,补充叶酸治疗不会增加患者用药的不良反应,安全可靠。
综上所述,H型高血压患者在降血压治疗基础上补充叶酸可明显降低血压、血浆Hcy水平,改善颈动脉粥样硬化情况,降低患者并发脑卒中和病死的风险。
[1] THOMOPOULOS C,PARATI G,ZANCHETTI A.Effects of blood pressure lowering on outcome incidence in hypertension.1.Overview,meta-analyses,and meta-regression analyses of randomized trials[J].JHypertens,2017,32(12):2285-2295.
[2] 董彦博,李红英,李军朋.高同型半胱氨酸血症与先天性心脏病并肺动脉高压的关系[J].中华实用儿科临床杂志,2015,30(10):784-785.
[3] 黄漓莉,于健,周素娴,等.同型半胱氨酸和视黄醇结合蛋白4与糖尿病视网膜病变的相关性研究[J].眼科新进展,2016,36(3):244-246.
[4] 孙佳鹏,肖慧捷,丁洁.同型半胱氨酸:心肾损伤的共同标志之一[J].中华实用儿科临床杂志,2015,30(17):1355-1357.
[5] 马晓敏,刘丹.视网膜静脉阻塞患者血小板参数及同型半胱氨酸水平的临床分析[J].眼科新进展,2017,37(10):973-975.
[6] 孟群,蒋也平,樊剑锋,等.儿童甲基丙二酸血症肾脏损害28例临床分析与随访[J].中华实用儿科临床杂志,2015,30(17):1313-1316.
[7] PANG H,HAN B,FU Q,etal.Association of high homocysteine levels with the risk stratification in hypertensive patients at risk of stroke[J].ClinTher,2016,38(5):1184-1192.
[8] 朱静.马来酸依那普利叶酸片治疗H型高血压的疗效探讨[J].蚌埠医学院学报,2017,42(6):740-742.
[9] 中国高血压防治指南修订委员会.中国高血压防治指南(2010年修订版)[J].中国实用乡村医生杂志,2012,19(12):1-15.
[10] RUHUI L,JINFA J,JIAHONG X,etal.Influence of hyperhomocysteinemia on left ventricular diastolic function in Chinese patients with hypertension[J].Herz,2015,40(4):679-684.
[11] 董宁,汤欣,肖林,等.视网膜分支静脉阻塞患者急性期和恢复期血浆同型半胱氨酸水平的变化[J].眼科新进展,2015,35(4):368-370,373.
[12] MAO X,XING X,RONG X,etal.Folic acid and vitamins D and B12correlate with homocysteine in Chinese patients with type-2 diabetes mellitus,hypertension,or cardiovascular disease[J].Medicine,2016,95(6):e2652.
[13] 梅百强,杨希立,许兆延,等.H型高血压患者斑块特征与同型半胱氨酸相关性研究[J].介入放射学杂志,2016,25(1):70-73.
[14] WANG X,QIN X,DEMIRTAS H,etal.Efficacy of folic acid supplementation in stroke prevention:a meta-analysis[J].Lancet,2007,369(9576):1876-1882.
[15] ALBERT C M,COOK N R,GAZIANO J M,etal.Effect of folic acid and B vitamins on risk of cardiovascular events and total mortality among women at high risk for cardiovascular disease:a randomized trial[J].JAMA,2008,299(17):2027-2036.
[16] 卢凡,赵连友,张志敏,等.马来酸依那普利叶酸对H型高血压大鼠血管平滑肌细胞GRP 94和caspase-12的表达影响[J].解放军医药杂志,2014,26(3):85-88.
[17] 张医虎,寿松涛,刘艳存,等.依那普利叶酸片治疗H型高血压效果的meta分析[J].山东医药,2015,55(17):54-56.
[18] 卫聪颖,赵连友,李雪,等.马来酸依那普利叶酸片治疗H型高血压疗效及其与同型半胱氨酸关系研究[J].中国实用内科杂志,2015,35(7):606-609.
[19] 李蕾,韩红彦,潘云红.叶酸对H型高血压患者颈动脉粥样硬化与左心室肥厚的影响[J].临床心血管病杂志,2016,32(9):927-929.
[20] 宋云方.不同剂量阿托伐他汀联合苯磺酸氨氯地平对原发性高血压合并动脉粥样硬化患者动态血压水平的影响[J].新乡医学院学报,2017,34(7):607-611.
[21] 徐雄鹰,周蓉靖,白春峰,等.H型高血压合并急性脑梗死患者血浆同型半胱氨酸水平与颈动脉内膜中层厚度的关系[J].中华高血压杂志,2015,23(4):383-386.
[22] WANG M,KIM S H,MONTICONE R E,etal.Matrix metalloproteinases promote arterial remodeling in aging,hypertension,and atherosclerosis[J].Hypertension,2015,65(4):698-703.
[23] 刘子君,肖传实,史宏涛,等.依那普利叶酸片对山西地区H型高血压人群干预后疗效观察[J].中华高血压杂志,2016,24(4):359-364.

