黄芪甲甙对急性心肌梗死大鼠早期心功能、炎性相关因子及内皮型一氧化氮合酶信号通路的影响
王 皓,王少学,李素敏,韩东明
(1.新乡医学院第一临床学院,河南 新乡 453003;2.原阳县人民医院超声科,河南 原阳 453500)
急性心肌梗死(acute myocardial infarction,AMI)是常见的疾病,近年来发病率呈上升趋势[1]。AMI不仅给患者带来极大的痛苦,同时也给家庭和社会带来很大的负担。因此,对心血管疾病的防治是刻不容缓的重大课题。研究表明,炎性因子参与了AMI的发展过程[2]。持续的炎症反应会诱导多个细胞死亡途径激活,引起心肌细胞进行性凋亡,心肌组织损伤进一步加重,甚至导致心室重构[3-4]。路妍等[5]研究发现,AMI患者外周血单个核细胞中Toll 样受体(toll-like receptor,TLR)4表达显著升高,且与冠状动脉病变严重程度密切相关。另有研究证实,AMI患者尤其是合并不良心血管事件的患者血清中和不稳定斑块中TLR4、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)等促炎因子水平明显升高,并且这种升高通常预示患者预后不良[6-7]。因此,推测阻断或者抑制TLR信号途径可减轻AMI后心肌损伤,并抑制心室重构,对心脏起到保护作用,这也是目前心血管领域研究的热点。黄芪甲甙是黄芪的主要活性成分。梁荣寿等[8]研究发现,黄芪注射液可通过抑制TLR-4/核转录因子-κB (nuclear factor-κB,NF-κB)信号通路减轻脂多糖所致的炎症反应。李青等[9]研究发现,黄芪甲甙可能通过抑制单核细胞TLR-4表达,抑制炎性因子产生,从而阻断肾脏纤维化。另有研究报道,黄芪甲甙能减轻心肌梗死后心肌缺血[10]。但是,黄芪甲甙对心肌梗死后心肌的保护作用的具体机制尚不清楚,尤其黄芪甲甙对心脏的保护作用与TLR之间的关系还有待阐明。本研究通过结扎大鼠心脏左冠状动脉前降支制备AMI模型,观察黄芪甲甙对AMI大鼠心脏的保护作用,并对其作用机制进行探讨。
1 材料与方法
1.1实验动物健康Wistar大鼠45只,体质量200~250 g,雌雄各半,均由河南省实验动物中心提供[合格证号:SYXK(豫) 2011-001]。
1.2主要试剂与仪器黄芪甲甙(纯度 > 98%)由中国药品生物制品鉴定所提供,大鼠NF-κB、TNF-α、IL-1β和IL-6酶联免疫吸附试验测定(enzyme linked immunosorbent assay,ELISA)试剂盒、大鼠心肌肌钙蛋白(cardiac troponin,cTn)免疫试剂盒均购自南京森贝伽生物科技有限公司,一氧化氮(nitric oxide,NO)检测试剂盒、TRIzol试剂、BeyoRT cDNA第1链合成试剂盒购自上海碧云天生物技术有限公司,SYBR Green实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自北京索莱宝科技有限公司;ABI 7300 实时荧光定量PCR仪购自美国ABI公司,BL-420F生物机能实验系统、HX-100动物呼吸机购自成都泰盟科技有限公司,小动物超声仪购自北京森西科技有限公司,AU 2700全自动生物化学分析仪购自日本奥林巴斯公司。
1.3动物分组及模型制备将45只大鼠随机分为假手术组、模型组和黄芪甲甙组,每组15只。所有大鼠适应性饲养1周。模型组和黄芪甲甙组大鼠采用左冠状动脉前降支结扎法制备AMI模型[11]:大鼠用30 g·L-1水合氯醛(10 mL·kg-1)腹腔注射麻醉,将大鼠四肢固定在自制泡沫手术板上;经口气管插管,接小动物呼吸机;四肢皮下插入针电极,使用BL-420F生物机能实验系统描记肢体Ⅱ导联心电图(electrocardiogram,ECG);手术野脱毛膏脱毛,消毒,铺无菌巾,沿左胸骨第3~4肋间开胸,放置开胸器(眼科开睑器),小心用镊子在心脏收缩期提起心包膜并剪开,充分暴露心脏;于左心耳与肺动脉圆锥间以左冠状静脉为标志,左心耳根部下 2~3 mm 用5-0无创伤缝线穿过并结扎冠状动脉左前降支;肉眼观察前降支供血区变苍白,收缩力降低,然后挤压胸腔排出空气并逐层关闭胸腔。假手术组大鼠只穿线不结扎,其余操作同模型组。各组大鼠术后经腹腔注射青霉素80万U,连用3 d 以预防感染。
造模24 h后,黄芪甲甙组大鼠腹腔注射黄芪甲甙20 mg·kg-1·d-1(以10 g·L-1羧甲基纤维素钠溶解),假手术组、模型组大鼠腹腔注射相同体积的羧甲基纤维素钠,每日1次,连续2周。
1.4心电图监测使用BL-420F生物机能实验系统描记造模前、造模后即刻及给药1、3、7、14 d肢体Ⅱ导联ECG,观察ST段变化,并记录ST段值。
1.5超声心动图检测各组大鼠心功能给药2 h后,各组大鼠用30 g·L-1水合氯醛(10 mL·kg-1)腹腔注射麻醉,随后仰卧位固定于恒温加热板上,脱毛膏脱毛后,用小动物超声仪(频率17.5 MHz)进行心脏超声检查[12]。分别检测大鼠左心室舒张末期内径(left ventricular internal diameter at end-diastole,LVDD)、左心室收缩末期内径(the left ventricular internal diameter at end-systole,LVDS)、左心室舒张末期容积(left ventricular end diastolic volume,LVEDV)、左心室收缩末期容积(left ventricular end systolic volume,LVESV)、左心室短轴的缩短率(left ventricular fractional shortening,LVFS) 和左心室射血分数(left ventricular ejection fraction,LVEF)。
1.6血清TNF-α、IL-1β、IL-6和NF-κB水平检测末次给药后4 h,大鼠麻醉,取各组大鼠下腔静脉血4 mL,1 000×g离心25 min,取上清液,保存于-20 ℃待测。应用ELISA法检测各组大鼠血清TNF-α、IL-1β、IL-6和NF-κB水平,严格按试剂盒说明书操作。
1.7血浆NO水平检测末次给药后4 h,大鼠麻醉,取下腔静脉血2 mL置于无菌抗凝管中,1 000×g离心25 min,取上清液。应用NO检测试剂盒,采用Griess反应测定血浆亚硝酸盐水平。按说明书要求依次加入待测样品、Griess反应试剂 I和II,每孔50 μL。在540 nm波长处记录吸光度值,并使用亚硝酸钠标准曲线对亚硝酸盐进行定量,以血浆亚硝酸盐含量来反映NO水平。
1.8实时荧光定量PCR检测心肌组织中TLR2、TLR4、核苷酸结合寡聚化结构域(nucleotidebindingoligomerizationdomain,NOD)1、NOD2、内皮型一氧化氮合酶(endothelialnitricoxidesynthase,eNOS)mRNA表达末次给药后4 h,大鼠取静脉血后开胸,取左心室心肌组织。采用TRIzol试剂提取心肌组织总RNA。将1 μg心肌组织总RNA反转录生成cDNA第1链。然后使用SYBR Green 荧光定量PCR试剂盒,以反转录产生的cDNA为模板,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,对基因进行荧光定量PCR扩增。TLR2上游引物为5′-TCTCCCATTTCCGTCTTTTT-3′,下游引物为5′-GGTCTTGGTGTTCATTATCTTC-3′;TLR4上游引物为5′-GAAGCTGGTGGCTGTGGA-3′,下游引物为5′-TGATGTAGAACCCGCAAG-3′;NOD1上游引物为5′-GTCACTGAGGTCCATCTGAAC-3′,下游引物为5′-CATCCACTCCTGGAAGAACCT-3′;NOD2上游引物为5′-CATGTGCTGCTACGTGTTCTC -3′,下游引物为5′-CCTGCCACAATTGAAGAGGTG-3′;eNOS上游引物为5′-TTCCGGCTGCCACCTGATCCTAA-3′,下游引物为5′-AACATGTGTCCTTGCTCGAGGCA-3′;GAPDH上游引物为5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物为5′-TTTGAGGGTGCAGCGAACTT-3′。反应条件:95 ℃预变性10 min,1个循环;95 ℃变性30 s,58 ℃ 退火45 s,70 ℃延伸30 s,共35个循环。实验重复3次,各基因相对表达量采用2-ΔΔCt法计算。
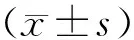
2 结果
2.13组大鼠造模情况造模过程中,假手术组无大鼠死亡,模型组大鼠死亡4只,黄芪甲甙组大鼠死亡2只。
2.23组大鼠心电图ST段值变化结果见表1。造模前各组大鼠ST段值比较差异无统计学意义(P>0.05)。造模后即刻模型组和黄芪甲甙组大鼠心电图ST段较假手术组显著抬高(P<0.01),表明AMI模型制作成功。模型组和黄芪甲甙组大鼠给药1、3、7、14 d后ST段值均显著高于假手术组(P<0.01)。黄芪甲甙组大鼠给药3、7、14 d后ST段值均显著低于模型组(P<0.05)。
表13组大鼠心电图ST段值的变化
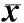
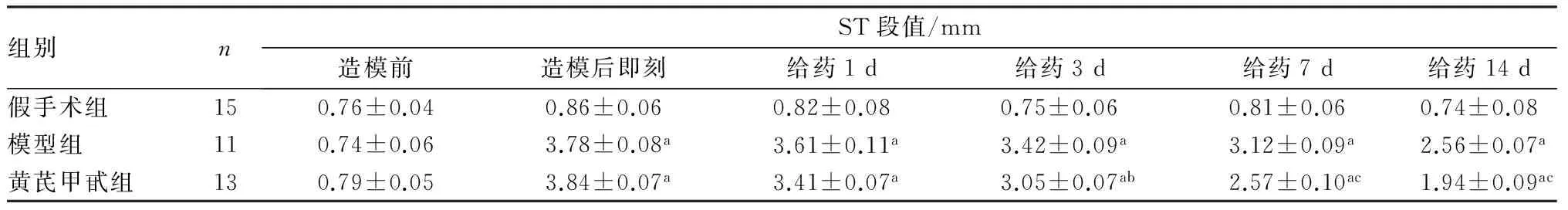
注:与假手术组比较aP<0.01;与模型组比较bP<0.05,cP<0.01。
2.33组大鼠超声心动图各指标比较结果见表2。与假手术组比较,模型组和黄芪甲甙组大鼠LVDD、LVDS显著扩大(P<0.01)、LVEDV、LVESV显著增加(P<0.01),LVFS、LVEF显著下降(P<0.01)。与模型组比较,黄芪甲甙组大鼠LVDD、LVDS显著缩小(P<0.05),LVEDV、LVESV显著下降(P<0.05),LVFS、LVEF显著增加(P<0.05)。
表23组大鼠超声心动图指标比较
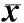

注:与假手术组比较aP<0.01,bP<0.05;与模型组比较cP<0.05,dP<0.01。
2.43组大鼠血清IL-1β、IL-6、TNF-α和NF-κB水平比较结果见表3。与假手术组比较,模型组和黄芪甲甙组大鼠IL-1β、IL-6、TNF-α水平显著增高(P<0.05);模型组大鼠血清NF-κB水平显著高于假手术组(P<0.01),但黄芪甲甙组与假手术组大鼠NF-κB水平比较差异无统计学意义(P>0.05)。与模型组比较,黄芪甲甙组大鼠血清IL-1β、IL-6、TNF-α和NF-κB水平显著降低(P<0.05)。
表33组大鼠血清IL-1β、IL-6、TNF-α和NF-κB水平比较

注:与假手术组比较aP<0.01,bP<0.05;与模型组比较cP<0.01,dP<0.05。
2.53组大鼠心肌组织中TLR2、TLR4、NOD1、NOD2mRNA表达比较结果见表4。与假手术组比较,模型组和黄芪甲甙组大鼠心肌组织中TLR2、TLR4、NOD1、NOD2 mRNA表达显著增加(P<0.05);与模型组比较,黄芪甲甙组大鼠心肌组织中TLR2、TLR4、NOD1、NOD2 mRNA表达显著降低(P<0.05)。
表43组大鼠心肌组织中TLR2、TLR4、NOD1、NOD2mRNA表达比较
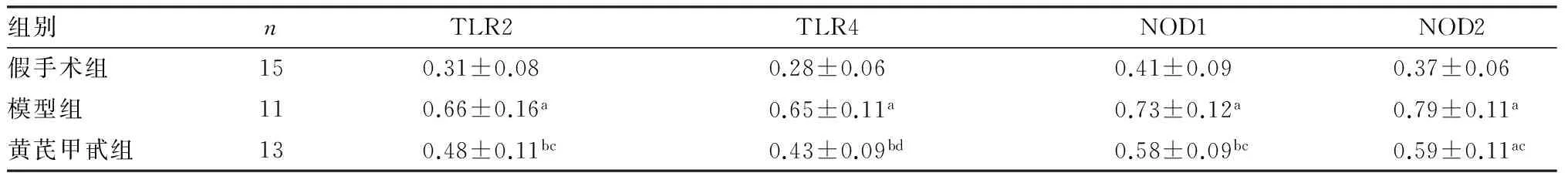
注:与假手术组比较aP<0.01,bP<0.05;与模型组比较cP<0.05,dP<0.01。
2.63组大鼠血浆NO水平和心肌组织中eNOSmRNA表达比较与假手术组比较,模型组大鼠血浆NO水平和心肌组织中eNOS mRNA表达显著降低 (P<0.05)。黄芪甲甙组大鼠血浆NO水平低于假手术组(P<0.05),但2组大鼠心肌组织中eNOS mRNA表达比较差异无统计学意义(P>0.05)。与模型组比较,黄芪甲甙组大鼠血浆NO水平和心肌组织中eNOS mRNA表达显著升高(P<0.01)。
表53组大鼠血浆NO水平和心肌组织中eNOSmRNA表达比较
Tab.5ComparisonofthelevelofNOinplasmaandtheexpressionofeNOSmRNAincardiacmuscletissueamongthethreegroups
(±s)
注:与假手术组比较aP<0.05;与模型组比较bP<0.01。
3 讨论
本研究发现,与模型组比较,黄芪甲甙组大鼠给药3、7、14 d后ST段值均显著下降,并且给药14 d后,黄芪甲甙组大鼠LVDD、LVDS明显缩小,LVEDV、LVESV明显下降,LVFS、LVEF明显增加;说明黄芪甲甙对AMI大鼠心肌损伤和心功能有明显改善作用。TLRs在损伤引起的局部炎性反应中起重要作用。TLR2和TLR4被认为是AMI时最常见和最具有特征性的炎性因子,它们通过激活细胞信号传导系统,释放炎性介质。TLR2参与AMI时炎性反应的识别,并在免疫系统中起重要作用。TLR4是最早在哺乳动物体内发现的Toll受体,在调节炎性反应中起着重要作用[13-14]。研究发现,在心肌梗死时,TLR4基因和蛋白表达均增高[15]。NOD是一类含有核苷酸结合寡聚域的蛋白质家族。TLR2和TLR4的肽多糖亚基可以被NOD家族蛋白识别,尤其是NOD1和NOD2。NOD1和NOD2是胞内蛋白,参与先天性免疫,并与人类慢性炎性疾病密切相关。NOD信号途径可活化NF-κB,还可以上调丝裂原活化蛋白激酶家族,激活促炎性反应基因[16-17]。本研究发现,模型组大鼠心肌组织中TLR2、TLR4、NOD1和NOD2 mRNA表达均较假手术组显著增加,黄芪甲甙组大鼠心肌组织中TLR2、TLR4、NOD1和NOD2 mRNA表达均较模型组显著降低;说明黄芪甲甙可通过降低TLR2、TLR4、NOD1和NOD2 mRNA的表达发挥对心脏的保护作用。
TLR介导的信号通路可激活NF-κB,诱导下游分子如炎性细胞因子(TNF-α、IL-1β等)、黏附分子和凋亡蛋白等靶基因的转录与表达[18-20]。TNF-α、IL-1β 和 IL-6表达增高,可启动和调节局部的急性应激炎性反应[21],从而加重心肌的损伤[22]。临床研究证实,心力衰竭患者循环系统组织和心肌组织中TNF-α、IL-1β 和 IL-6水平显著升高,且其水平与患者疾病的严重程度密切相关[23]。TURNER等[24]研究发现,动脉粥样硬化时,激活的NF-κB主要存在于平滑肌、巨噬细胞和内皮细胞,并参与心室重构。本研究结果发现,模型组大鼠血清IL-1β、IL-6、TNF-α和NF-κB的表达均较假手术组显著升高,黄芪甲甙组大鼠血清IL-1β、IL-6、TNF-α和NF-κB的表达较模型组显著降低,这说明黄芪甲甙对AMI引起的心脏损伤有一定的保护作用。
另有研究表明,由 NOS经还原型辅酶Ⅱ依赖性催化反应催化底物L-精氨酸产生的NO具有心脏保护作用,可对抗AMI。NOS共有3种亚基,包括神经元NOS(nNOS或NOS1)、可诱导型NOS(iNOS或NOS2)和内皮细胞NOS(eNOS或NOS3)。eNOS不仅在心内膜和冠状动脉内皮表达,在心肌细胞和心脏传导系统如窦房结和房室组织中也存在[25]。有研究发现,eNOS-/-小鼠心肌缺血再灌注损伤后心肌损伤会加重,这说明由eNOS催化产生的NO具有心肌保护作用[26]。本研究结果显示,模型组大鼠血浆中NO水平和心肌组织中eNOS mRNA表达显著低于假手术组;黄芪甲甙组大鼠血浆中NO水平和心肌组织中eNOS mRNA表达显著高于模型组。黄芪甲甙组大鼠血浆NO水平低于假手术组,但2组大鼠心肌组织中eNOS mRNA表达比较差异无统计学意义;这说明黄芪甲甙能通过激活eNOS、增加NO的生成而发挥对AMI大鼠心脏的保护作用。
总之,本研究证实黄芪甲甙对AMI大鼠具有心脏保护作用,其心脏保护作用的发挥可能与激活eNOS信号系统和抑制炎性因子生成有关。黄芪甲甙是有前景的心脏保护药物,可用于预防和治疗AMI所致的心脏损伤。同时eNOS信号通路和TLR信号途径将来也可能成为缺血性心脏病的潜在治疗靶点。
[1] 何忠开,姚峰,梁政,等.白藜芦醇对急性心肌梗死大鼠核因子-κB 信号通路表达的影响[J].新乡医学院学报,2017,34(4):251-254.
[2] AKASAKA Y,MORIMOTO N,ISHIKAWA Y,etal.Maocardial apoptosis associated with the expression of proinflammatory cytokines during the course of myocardial infarction[J].ModPathol, 2006,19(4):588-598.
[3] HAUDEK S B,TAFFET G E,SCHNEIDER M D,etal.TNF provokes cardiomyocyte apoptosis and cardiac remodeling through activation of multiple cell death pathways[J].JClinInvest,2007,117 (9):2692-2701.
[4] KARPINSKI L,PNAKSEJ R,KOSMALA W,etal.Serum levels of interleukin-6,interleukin-10 and C-reactive protein in relation to left ventricular function in patients with myocardial infarction treated with primary angioplasty[J].KardiolPol,2008,66(12): 1279-1285.
[5] 路妍,张建华.瑞舒伐他汀对急性心肌梗死患者行择期PCI术后外周血TLR4表达及炎性因子的影响[J].河北医药,2015,37(23):3544-3547.
[6] HU Z P,FANG X L,FANG N,etal.Melatonin ameliorates vascular endothelial dysfunction,inflammation,and atheroscelrosis by suppressing the TLR4 /NF-κB system in high-fat-fed rabbits[J].JPinealRes,2013,55(4):388-398.
[7] ISHIKAWA Y,SATOH M,ITOH T,etal.Local expression of Toll-like receptor 4 at the site of ruptured plaques in patients with acute myocardial infarction[J].ClinSci,2008,115(4):133-140.
[8] 梁荣寿,李健哲.黄芪注射液对脂多糖诱导的内皮细胞炎症因子产生的影响及其机制研究[J].中国临床药理学与治疗学,2011,16(6):611-616.
[9] 李青,许陵冬,江燕,等.黄芪甲苷对肾小管上皮细胞诱导单核细胞分化的影响[J].临床肾脏病杂志,2016,9(16):557-561.
[10] 于俊民,张小波,姜文,等.黄芪总皂苷对大鼠缺血心肌血管内皮生长因子蛋白表达的影响[J].中国急救医学,2014,34(11):1033-1035.
[11] TANG Y L,ZHAO Q,QIN X,etal.Paraerine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J].AnnThoracSurs,2005,80(1):229-236.
[12] 朱丹,郭艳红,米琳,等.大鼠心肌梗死模型心功能评价的方法学比较[J].中国微创外科杂志,2009,9(5):413-416.
[13] 孙园园,郭大东,陈美清,等.rno-miR-30b-5p在葡萄膜炎发病过程中对白细胞介素-10和Toll样受体4表达的调控作用[J].眼科新进展,2017,37(4):330-332.
[14] 刘晶,白浪,苏亚茹,等.不同浓度肽聚糖对角膜上皮细胞Toll样受体(TLR)2和TLR4表达的影响[J].眼科新进展,2017,37(8):705-708.
[15] ZHAO P,WANG J,HE L,etal.Deficiency in TLR4 signal transduction ameliorates cardiac injury and cardiomyocyte contractile dysfunction during ischemia[J].JCellMolMed,2009,13(8A):1513-1525.
[16] 马丽霞,袁青,刘佳佳.Nod样受体与Toll受体介导炎症的研究进展[J].国际免疫学杂志,2009,32(5):345-349.
[17] 陈琳琳,卢放根.固有免疫中TLR和NOD的研究现状[J].国际免疫学杂志,2008,31(6):461-465.
[18] 武宇辉,齐颖,马伟科,等.微小RNA-155和微小RNA-21对脓毒症患儿Toll样受体4表达的影响[J].中华实用儿科临床杂志,2017,32(6):420-424.
[19] 张静,禚志红,王怀立,等.脂多糖预处理对癫痫幼鼠Toll样受体4/高迁移率族蛋白1基因表达及海马硬化的影响[J].中华实用儿科临床杂志,2016,31(21):1658-1662.
[20] 宋亚辉,尤庆旺,王倩楠,等.Omega-3鱼油脂肪乳对缺氧缺血性脑损伤新生大鼠海马组织Toll样受体4和核因子κB的影响[J].中华实用儿科临床杂志,2016,31(12):923-926.
[21] 韩梦雨,金明,王志军.炎性细胞因子与新生血管性眼病[J].眼科新进展,2017,37(12):1088-1092.
[22] MOON M K,LEE Y J,KIM J S,etal.Effect of caffeic acid on tumor necrosis factor-alpha -induced vascular inflammation in human umbilical vein endothelial cells[J].BiolPhamBull,2009,32(8):1371-1377.
[23] TESTA M,YEH M,LEE P,etal.Circulating levels of cytokines and their endogenous modulators in patients with mild to severe congestive heart failure due to coronary artery disease or hypertension[J].JAmCollCardiol,1996,28(4):964-971.
[24] TURNER N A,DAS A,WARBURTON P,etal.Interleukin-lalpha stimulates proinflammatory cytokine expression in human cardiac myofibroblasts[J].AmJPhysiolHeartCircPhysiol,2009,297(3): H1117-H1127.
[25] BALLIGAND J L,CANNON P J.Nitric oxide synthases and cardiac muscle.Autocrine and paracrine influences[J].ArteriosclerThrombVascBiol,1997,17(10): 1846-1858.
[26] SUMERAY M S,REES D D,YELLON D M.Infarct size and nitric oxide synthase in murine myocardium[J].JMolCellCardiol,2000,32(1): 35-42.

