原发性肝细胞癌患者血清中微小RNA-21、微小RNA-122和微小RNA-145的表达及临床意义
尚 冰,陈 炜
(铜川矿务局中心医院外科,陕西 铜川 727000)
原发性肝癌主要指肝细胞癌、肝内胆管癌和肝血管肉瘤,其中,肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的85%~90%,在肿瘤相关死亡原因中居第3位[1]。HCC的发展和恶化是一个典型的多阶段过程,乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)感染是HCC的重要病因[2]。HCC的进展与许多调节细胞周期、细胞凋亡和细胞迁移等的基因有关。诸多研究聚焦于与HCC进展相关的基因和蛋白质,但是其敏感性和特异性尚不尽人意[3]。微小RNA(microRNA,miRNA)是一类由19~24个核苷酸组成的小型非编码RNA,通过与mRNA靶位点结合,在翻译水平调节基因表达[4-5]。研究表明,miRNA异常表达与多种癌症的发生和进展有关[6]。研究显示,肝胆管细胞癌组织中miR-21表达显著上调,miR-122和miR-145表达显著下调,这3种miR可能参与了肝癌的发生和发展[7]。本研究旨在探讨HCC患者血清中miR-21、miR-122和miR-145的表达及临床意义。
1 资料与方法
1.1一般资料选择2014年9月至2016年9月铜川矿务局中心医院收治的HCC患者,患者纳入标准:(1)经病理学检查确诊为HCC;(2)符合HCC诊断标准[8];(3)入组前均未接受任何治疗;(4)精神状况良好。排除标准:(1)伴有严重营养不良者;(2)不愿意参加本研究者。本研究共纳入HCC患者100例(HCC组),男53例,女47例,年龄41~65(50.45±8.26)岁。另外,选择同期体检健康者100例作为对照组,男50例,女50例,年龄40~65(50.35±9.12)岁。2组受试者的性别、年龄分布比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审查、同意后实施,受试者均签署知情同意书。
1.2主要试剂与仪器TaqMan®ABC miRNA Purification Kit(美国Thermo Fisher公司),反转录试剂盒、热启动Taq 酶(日本TAKARA公司);7500型荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(美国ABI公司)。
1.3血样采集HCC患者分别于入院时和手术后1周采集空腹肘静脉血5 mL,对照组受试者于体检当日采集空腹肘静脉血,将血样装于5 mL离心管中,室温下静置1 h,然后3 000 r·min-1离心5 min,取上清液,置于-70 ℃冰箱中保存。
1.42组受试者血清中miR-21、miR-122和miR-145表达检测采用实时定量荧光PCR法检测血清中miR-21、miR-122和miR-145的表达。首先,采用TaqMan®ABC miRNA Purification Kit试剂盒提取细胞总RNA。其次,根据目标基因的mRNA 序列,按照引物设计的原则,用设计软件Primer express 3.0设计并合成引物及探针。miR-21的上游引物序列为5′-GCTTCGCCTAGCTTATCAGACT-3′,下游引物序列为5′-CAGTGCTGGGTCCGAGTGA-3′;miR-122的上游引物序列为5′-CAAGCGTTGGAGTGTGACA-3′,下游引物序列为5′-CGTCCTACCATTCTCCAGC-3′;miR-145的上游引物序列为5′-GCTGGGGTCCA-GTTTTCCCAGGA-3′,下游引物序列为5′-GTCGGCAATTCAGTTGAGAGGGATTC-3′;内参基因U6的上游引物序列为5′-CTCGCTTCGGCAGCACATA-TACT-3′,下游引物序列为5′-ACGCTTCACGAA-TTTGCGTGTC-3′。进行RNA反转录后,以反转录产物为模板,在实时定量PCR仪上进行扩增,反应条件为:94 ℃ 3 min,94 ℃ 20 s,65 ℃ 40 s,循环35次。采用2-△△CT法计算miR-21、miR-122和miR-145的相对表达量。
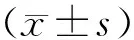
2 结果
2.12组受试者血清中miR-21、miR-122和miR-145表达水平比较结果见表1。HCC组患者血清中miR-21、miR-122表达水平显著高于对照组,miR-145表达水平显著低于对照组,差异均有统计学意义(P<0.05)。
表12组受试者血清中miR-21、miR-122和miR-145表达比较

2.2血清中miR-21、miR-122和miR-145表达水平与HCC患者临床特征的关系结果见表2。HCC患者血清中miR-21、miR-122和miR-145表达水平与组织分化程度、临床分期、肿瘤大小及肝硬化有关(P<0.05),与性别、年龄、HBV抗原、HCV抗体无关(P>0.05)。与高分化和中分化程度、临床分期低、肿瘤直径<5cm和无肝硬化的患者相比,低分化程度、临床分期高、肿瘤直径≥5 cm和有肝硬化的患者血清中miR-21和miR-122表达显著升高,miR-145表达显著降低,差异均有统计学意义(P<0.05)。
表2血清miR-21、miR-122和miR-145表达与HCC临床特征的关系

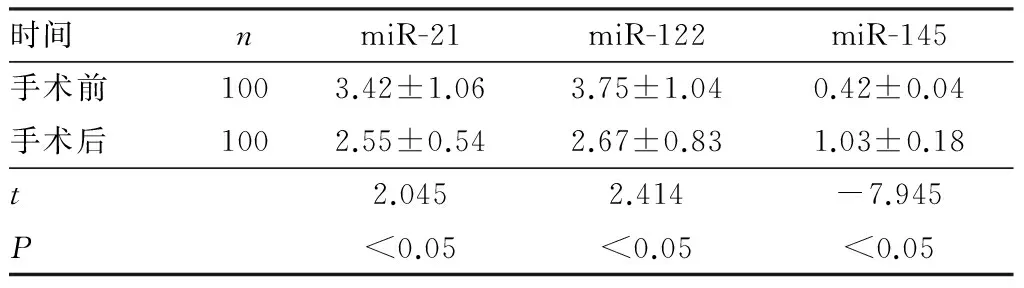
2.3HCC患者手术前后血清中miR-21、miR-122和miR-145表达水平比较结果见表3。手术后HCC患者血清中miR-21、miR-122表达水平显著低于手术前,miR-145表达水平显著高于手术前,差异均有统计学意义(P<0.05)。
表3肝癌患者手术前后血清中miR-21、miR-122和miR-145表达比较
3 讨论
miRNA在多种肿瘤中异常表达,且其表达水平与肿瘤的进展和预后高度相关[9]。原发性肝癌是常见的恶性肿瘤之一,我国每年有近50万人死于肝癌[10]。目前,甲胎蛋白作为肝癌患者筛查的手段,其敏感度较低,且区分肝癌与乙型肝炎或肝硬化的能力较差[11]。因此,研究miRNA在肝癌诊断及预后评估中的作用具有重要的临床意义。
miR-21首次在神经胶质瘤中被发现,是一种致癌miRNA,通过抑制细胞凋亡而促进肿瘤的发生和发展。miR-21在多种肿瘤中存在过表达现象,包括乳腺癌[12]、肺癌[13]、结直肠癌[14]、肾癌[15]等。本研究结果显示,HCC患者血清中miR-21表达水平显著高于健康者。研究表明,miR-21的表达水平与乳腺癌和宫颈癌的淋巴转移、临床分期等具有明显相关性,且随着临床分期的升高,miR-21表达水平逐渐升高[16]。miR-122是第1个被发现的肝脏特异性表达miRNA分子,且该miRNA约占肝脏所表达miRNA分子总量的70%[17]。miR-122表达水平与细胞周期蛋白G1呈负相关,并且G1是miR-122 的作用靶点,miR-122在肿瘤细胞中过表达,具有促进肿瘤细胞增殖的作用[18]。SHYU等[19]研究显示,肝癌组织中miR-122表达水平显著高于癌旁组织。本研究结果显示,HCC患者血清中miR-122表达水平显著高于健康者。与高分化和中分化程度、临床分期低、肿瘤直径<5cm和无肝硬化的患者相比,低分化程度、临床分期高、肿瘤直径≥5 cm和有肝硬化的患者血清中miR-21、miR-122表达显著升高,提示miR-21、miR-122可能成为HCC诊断、病情评估的指标。
miR-145具有高度的保守性、时序性和组织特异性,其通过调控下游的靶基因而参与肿瘤细胞的生长、增殖、分化、凋亡及转移扩散过程。何涛等[20]研究发现,miR-145在肝癌HepG2细胞系中的表达水平显著低于正常肝细胞。本研究结果显示,HCC患者血清中miR-145表达水平显著低于健康者。WANG等[21]研究发现,miR-145表达下调与非小细胞肺癌的淋巴结转移有关。本研究结果显示,miR-145的相对表达量在低分化程度、高临床分期、肿瘤直径<5 cm和并发肝硬化的患者中显著降低,提示miR-145的表达可能与肝癌的发生发展存在负相关关系。
综上所述,HCC患者血清中miR-21、miR-122高表达,miR-145低表达,且其表达水平与HCC患者的临床分期、分化程度、肿瘤大小和是否有肝硬化具有相关性。此3种miRNA可能参与了HCC的发生和发展,联合检测血清中miR-21、miR-122和miR-145表达水平有助于HCC的诊断和病情评估有重要意义。
[1] TORRE L A,BRAY F,SIEGEL R L,etal.Global cancer statistics,2012[J].CACancerJClin,2015,65(2):87-108.
[2] ARZUMANYAN A,REIS H M,FEITELSON M A.Pathogenic mechanisms in HBV-and HCV-associated hepatocellular carcinoma[J].NatRevCancer,2013,13(2):123-135.
[3] NORTON P,COMUNALE M A,HERRERA H,etal.Development and application of a novel recombinant Aleuria aurantia lectin with enhanced core fucose binding for identification of glycoprotein biomarkers of hepatocellular carcinoma[J].Proteomics,2016,16(24):3126-3136.
[4] 党晓洁,任梅,朱江,等.氧化应激条件下miR-21对人眼小梁网细胞胞外基质蛋白表达的影响[J].眼科新进展,2017,37(1):30-34.
[5] 符春艳.miR-93及miR-21在糖尿病视网膜病变患者中的表达及其临床价值[J].眼科新进展,2017,37(12):1161-1164.
[6] NARASIMHAN A,GHOSH S,STRETCH C,etal.Small RNAome profiling from human skeletal muscle:novel miRNAs and their targets associated with cancer cachexia[J].JCachexiaSarcopeniaMuscle,2017,8(3):405-416.
[7] KARAKATSANIS A,PAPACONSTANTINOU I,GAZOULI M,etal.Expression of microRNAs,miR-21,miR-31,miR-122,miR-145,miR-146a,miR-200c,miR-221,miR-222,and miR-223 in patients with hepatocellular carcinoma or intrahepatic cholangiocarcinoma and its prognostic significance[J].MolecularCarcinogenesis,2013,52(4):297.
[8] 中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等.原发性肝癌规范化病理诊断指南:2015年版[J].中华肝胆外科杂志,2015,21(3):145-151.
[9] RAWLINGS-GOSS R A,CAMPBELL M C,TISHKOFF S A.Global population-specific variation in miRNA associated with cancer risk and clinical biomarkers[J].BMCMedGenomics,2014,7(1):53.
[10] 任同良.微波消融与手术切除治疗原发性肝癌疗效比较[J].新乡医学院学报,2017,34(11):991-993,997.
[11] SHU H,LI W,SHANG S,etal.Diagnosis of AFP-negative early-stage hepatocellular carcinoma using Fuc-PON1[J].DiscovMed,2017,23(126):163-168.
[12] SORIA-VALLES C,GUTIéRREZ-FERNNDEZ A,GUIU M,etal.The anti-metastatic activity of collagenase-2 in breast cancer cells is mediated by a signaling pathway involving decorin and miR-21[J].Oncogene,2014,33(23):3054-3063.
[13] LI B,REN S,LI X,etal.miR-21 overexpression is associated with acquired resistance of EGFR-TKI in non-small cell lung cancer[J].LungCancer,2014,83(2):146-153.
[14] SHI C,YANG Y,YANG X,etal.Novel evidence for an oncogenic role of microRNA-21 in colitis-associated colorectal cancer[J].Gut,2016,65(9):1470-1481.
[15] VERGHO D,KNEITZ S,ROSENWALD A,etal.Combination of expression levels of miR-21 and miR-126 is associated with cancer-specific survival in clear-cell renal cell carcinoma[J].BMCCancer,2014,14:25.
[16] 祝敏捷,孙莲芳,杨静.血清miR-21和miR-10b在早期宫颈癌患者中的表达及临床意义[J].现代中西医结合杂志,2017,26(11):1167-1170.
[17] SONG K,HYUNJOO K,HAN C,etal.Active glycolytic metabolism in CD133+hepatocellular cancer stem cells:regulation by miR-122[J].Oncotarget,2015,6(38):40822-40835.
[18] XING T J,JIANG D F,HUANG J X,etal.Expression and clinical significance of miR-122 and miR-29 in hepatitis B virus-related liver disease[J].GenetMolRes,2014,13(3):7912-7918.
[19] SHYU Y C,LEE T L,LU M J,etal.miR-122-mediated translational repression of PEG10 and its suppression in human hepatocellular carcinoma[J].JTranslMed,2016,14(1):200.
[20] 何涛,李国庆,谢娟,等.miR-145对HepG2细胞中肿瘤干细胞增殖的影响[J].中国医药指南,2013,11(31):62-63.
[21] WANG M,WANG J,DENG J,etal.miR-145 acts as a metastasis suppressor by targeting metadherin in lung cancer[J].MedOncol,2015,32(1):344.

