MicroRNA-15b在子宫内膜癌组织中的表达及其对子宫内膜癌细胞增殖的影响
张 英,马瑞霞,杜艳云,史亚男
(1.新乡市中心医院妇瘤一科,河南 新乡 453000;2.河南省荣康医院妇产科,河南 新乡 453000;3.中山大学第一附属医院妇产科,广东 广州 510000)
子宫内膜癌是影响女性健康的常见恶性肿瘤,约占生殖系统恶性肿瘤的30%,近年来发病率呈升高趋势,且出现低龄化[1]。由于该肿瘤恶性程度高、侵袭力强、复发转移率高[2],已成为威胁女性健康的重要疾病。微小RNA(micro RNA,miRNA)作为机体内广泛存在的非编码短链RNA[3],在细胞增殖、分化、生长、凋亡、器官发育、代谢等多种生理过程中发挥重要作用[4-8]。研究表明,miRNA可发挥癌基因或抑癌基因的作用而参与多种恶性肿瘤发生、进展[9-12]。miR-15b是miR-15家族的重要成员,在调节细胞凋亡中发挥重要作用[13]。本研究对子宫内膜癌组织中miR-15b表达进行分析,探讨其与子宫内膜癌患者临床病理特征的关系,并通过上调子宫内膜癌HEC-1A细胞中miR-15b表达,观察其对细胞增殖的影响,以期为子宫内膜癌发病机制研究提供基础资料。
1 材料与方法
1.1一般资料选取2013年2月至2017年2月在新乡市中心医院行子宫内膜癌分期手术治疗的87例患者为研究对象,年龄31~75(55.7±11.5)岁,均经病理学检查确诊为子宫内膜癌,且术前均未接受放射、化学治疗。国际妇产科联盟(federation international of gynecology and obstetrics,FIGO)分期[14]:Ⅰ~Ⅱ期71例,Ⅲ~Ⅳ期16例;组织学类型:Ⅰ型67例,Ⅱ型20例;组织分化程度:低分化31例,中高分化56例;肌层浸润深度:≥1/2 肌层25例,<1/2肌层62例;发生淋巴结转移15例,其中累及淋巴管13例。患者均留取新鲜子宫内膜癌组织,置于液氮中保存于-80 ℃冰箱备用。同时,选取45例因子宫肌瘤行子宫全切术患者的正常子宫内膜组织作为对照,年龄33~74(56.2±11.9)岁。2组患者年龄比较差异无统计学意义(P>0.05)。本研究通过医院伦理委员会批准,研究对象均知情同意。
1.2细胞、试剂与仪器人子宫内膜癌HEA-1A细胞购自中国科学院上海细胞学研究所;TRIzol总RNA提取试剂盒、Lipfectamine 2000转染试剂盒购自美国Invitrogen公司,达尔伯克改良伊格尔培养基/F12培养基(Dulbecco′s modified Eagle medium: nutrient mixture F-12,DMEM/F12)、胎牛血清、胰蛋白酶购自美国HyClone公司,miR-15b及内参引物均由上海生工生物公司设计合成,miR-15b模拟物及对照序列均由福州迈新生物技术开发有限公司设计合成,反转录聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自日本TaKaRa公司,四甲基偶氮唑蓝(tetramethylazolazole blue,MTT)细胞增殖试剂盒购自南京建成生物工程研究所,Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙锭(propidium iodide,PI)细胞凋亡检测试剂盒购自北京百奥莱博科技有限公司,PI购自美国Sigma公司;实时荧光定量PCR仪购自美国ABI公司,流式细胞仪购自美国Bio-Rad公司。
1.3实时荧光定量PCR检测子宫内膜癌和正常子宫内膜组织中miR-15b表达取子宫内膜癌和正常子宫内膜组织,研磨后,加入细胞裂解液,用 TRIzol 总RNA提取试剂盒提取细胞中总RNA并检测纯度和浓度。取总RNA 2 μg,以miR-15b茎环结构:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCA-ATTGCACTGGATACGACTGTAAAC-3′进行反转录,以cDNA为模板进行PCR。miR-15b上游引物序列为5′-ATGAACTTTCTCTGTCTTGG-3′,下游引物序列为5′-TCACCGCCTCGGCTTGTCACA-3′;U6上游引物序列为5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物序列为5′-CGCTTCACGAATTTGCGTGTCAT-3′。PCR反应条件:92 ℃ 5 min,92 ℃ 30 s,60 ℃ 30 s,76 ℃ 30 s,连续36个循环;每个样本均设3个平行反应复孔。采用2-△△Ct法计算子宫内膜癌和正常子宫内膜组织中miR-15b相对表达量。
1.4细胞培养与处理
1.4.1细胞培养和分组将人子宫内膜癌HEC-1A细胞置于含体积分数10%胎牛血清的DMEM/F12培养基中,于含体积分数5% CO2、37 ℃培养箱中恒温培养。待细胞融合度在80%以上时,胰蛋白酶消化,传代培养,取对数生长期细胞,利用Lipfectamine 2000转染试剂盒进行转染,根据转染物不同分为miR-15b模拟物组、对照序列组和空白对照组。miR-15b模拟物组细胞转染miR-15b模拟序列为5′-TGTAAACCATGATGTGCTGCTA-3′;对照序列组细胞转染对照序列为5′-GTGTAACACGTCTATACGCCCA-3′;空白对照组细胞不作任何处理。转染后继续恒温培养。
1.4.2实时荧光定量PCR检测各组人子宫内膜癌细胞中miR-15b表达取各组转染后培养48 h细胞,加入细胞裂解液,其余操作步骤与“1.3项”相同。
1.4.3MTT法检测各组人子宫内膜癌细胞增殖能力取各组细胞,胰蛋白酶消化后,重悬成单细胞悬液,调整细胞密度为2×108L-1,按每孔100 μL细胞悬液接种于96孔板,继续恒温培养。分别于培养12、24、48、72、96 h时,将20 μL MTT(5 g·L-1)加入各孔,孵育4 h,将孔内上清液弃去,各孔加入 150 μL 二甲基亚砜,振荡15 min,待结晶物完全溶解后,用酶标仪于570 nm波长处检测吸光度值,并根据吸光度值判定细胞增殖能力。重复实验3次。
1.4.4流式细胞术检测各组人子宫内膜癌细胞凋亡率取各组细胞,胰蛋白酶消化后,调整细胞浓度为2×108L-1,将细胞接种于6孔板,继续培养 48 h,以1 500 r·min-1离心10 min,收集细胞,磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次,用 1×结合缓冲液100 μL重悬细胞,分别加入Annexin V-FITC和PI各5 μL,室温下避光孵育20 min,于 60 min 内上机检测细胞凋亡情况。
1.4.5流式细胞术检测各组细胞周期取各组细胞,胰蛋白酶消化后,调整细胞浓度为2×108L-1,将细胞接种于6孔板,继续培养48 h,以1 500 r·min-1离心10 min,室温下用体积分数70%乙醇固定60 min,以500 r·min-1离心5 min,加入PI和RNA酶,孵育60 min,于60 min内上机检测各组细胞周期。
2 结果
2.1子宫内膜癌和正常子宫内膜组织中miR-15b表达比较子宫内膜癌组织和正常子宫内膜组织中miR-15b相对表达量分别为1.32±0.13,2.49±0.16,子宫内膜癌组织中miR-15b相对表达量低于正常子宫内膜组织,差异有统计学意义(t=46.184,P<0.05)。
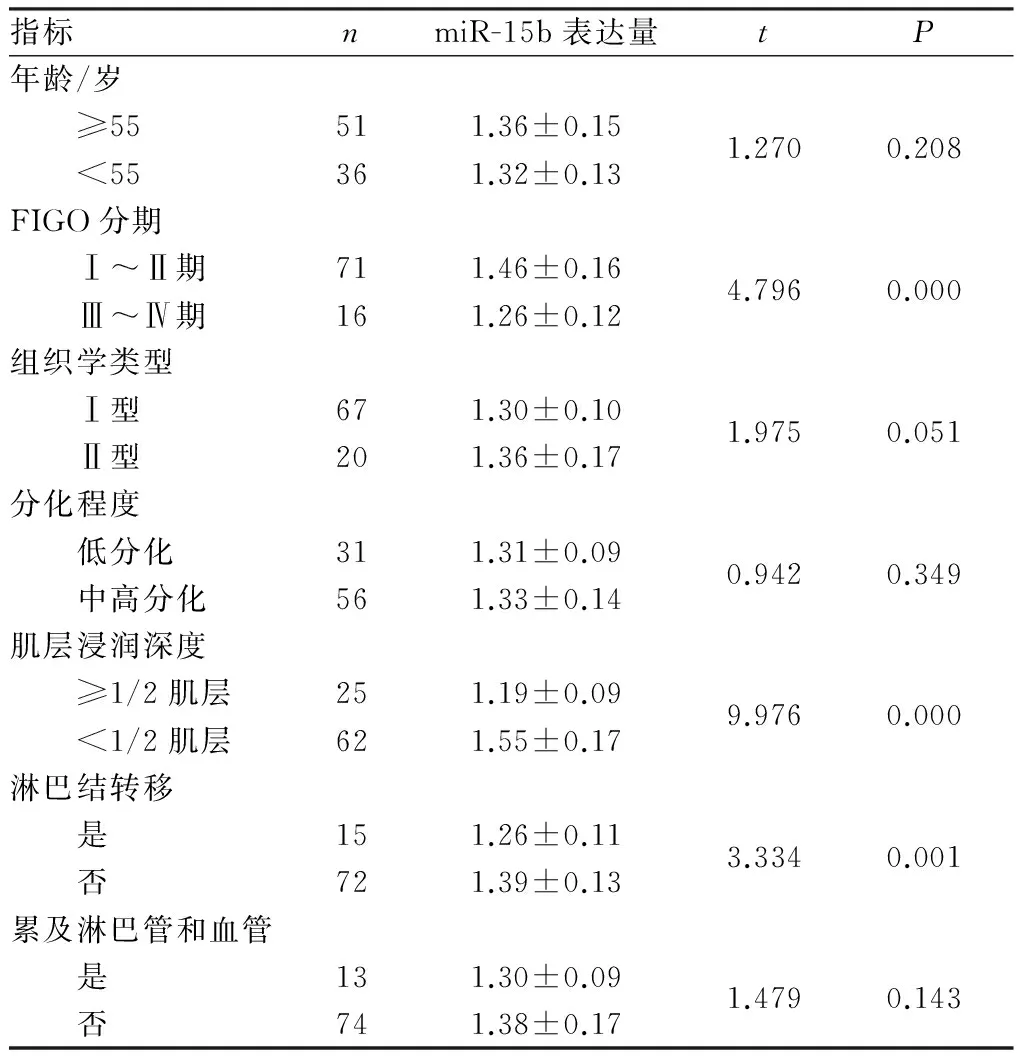
2.2子宫内膜癌组织中miR-15b表达与患者临床病理特征的关系结果见表1。子宫内膜癌组织中miR-15b相对表达量与患者的年龄、组织学类型、分化程度、是否累及淋巴管和血管无关(P>0.05),与FIGO分期、肌层浸润深度和淋巴结转移有关(P<0.05)。
表1子宫内膜癌组织中miR-15b相对表达量与患者临床病理特征的关系
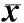
2.3各组人子宫内膜癌细胞中miR-15b表达比较miR-15b模拟物组、对照序列组和空白对照组人子宫内膜癌细胞中miR-15b相对表达量分别为2.73±0.28、1.29±0.10和1.31±0.16,空白对照组与对照序列组miR-15b相对表达量比较差异无统计学意义(P>0.05);miR-15b模拟物组人子宫内膜癌细胞中miR-15b相对表达量高于空白对照组和对照序列组,差异有统计学意义(P<0.05)。
2.4各组人子宫内膜癌细胞增殖能力比较结果见表2。空白对照组、对照序列组和miR-15b模拟物组细胞培养24、48、72、96 h时的增殖能力两两比较差异均有统计学意义(P<0.05)。miR-15b模拟物组人子宫内膜癌细胞培养12 h时细胞增殖能力与空白对照组和对照序列组比较差异无统计学意义(P>0.05)。miR-15b模拟物组人子宫内膜癌细胞培养24、48、72、96 h时细胞增殖能力低于空白对照组和对照序列组,差异均有统计学意义(P<0.05);空白对照组与对照序列组细胞培养12、24、48、72、96 h时细胞增殖能力比较差异均无统计学意义(P>0.05)。
表2不同培养时间3组人子宫内膜癌细胞增殖能力比较
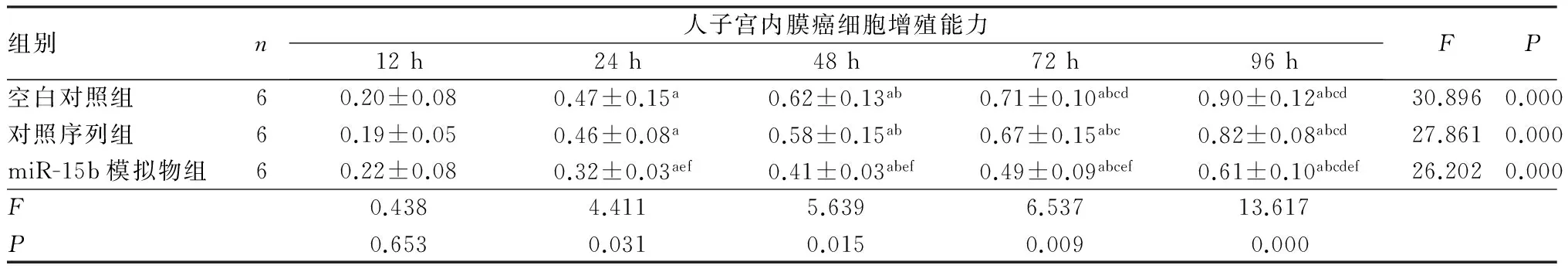
注:与培养12 h时比较aP<0.05;与培养24 h比较bP<0.05;与培养48 h比较cP<0.05; 与培养72 h比较dP<0.05;与空白对照组比较eP<0.05;与对照序列组比较fP<0.05。
2.5各组人子宫内膜癌细胞凋亡率比较结果见图1。miR-15b模拟物组、对照序列组和空白对照组人子宫内膜癌细胞凋亡率分别为(15.5±3.0)%、(6.5±1.6)%和(8.1±2.6)%,3组人子宫内膜癌细胞凋亡率比较差异有统计学意义(F=22.090,P=0.000)。与空白对照组和对照序列组比较,miR-15b模拟物组人子宫内膜癌细胞凋亡率升高,差异有统计学意义(P<0.05)。空白对照组与对照序列组人子宫内膜癌细胞凋亡率比较差异无统计学意义(P>0.05),
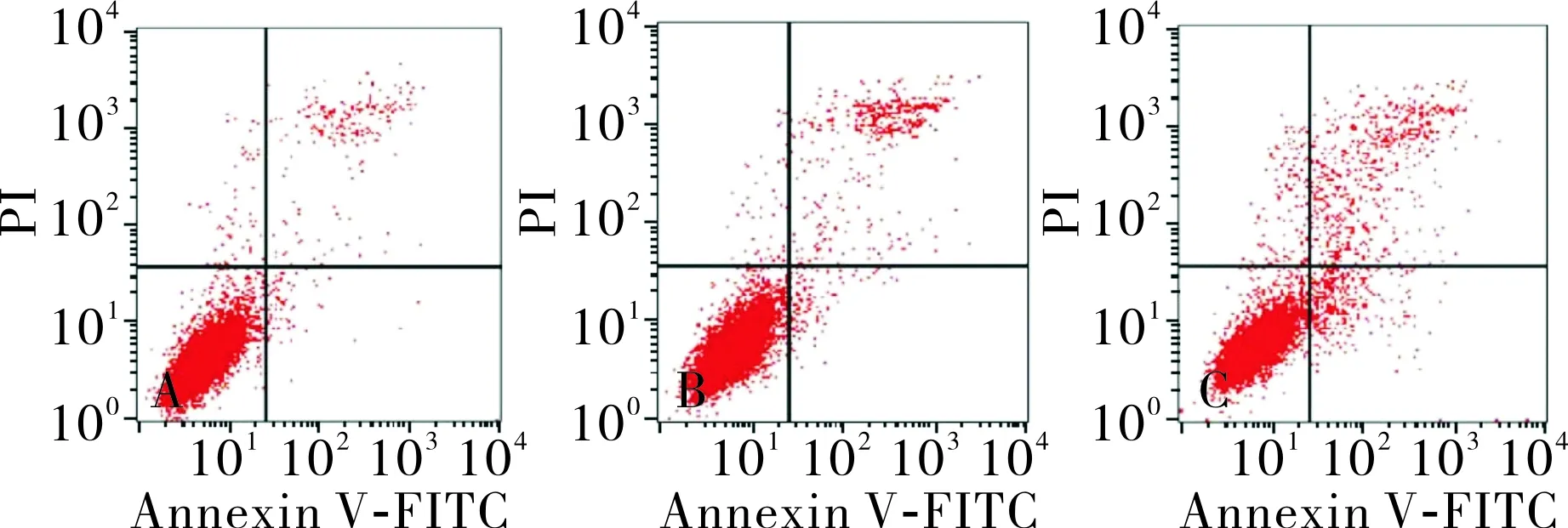
A:空白对照组;B:对照序列组;C:miR-15b模拟物组。
图1流式细胞术检测各组细胞凋亡情况
Fig.1Cellapoptosiswasdetectedbyflowcytometry
2.6各组人子宫内膜癌细胞周期变化比较结果见表3和图2。miR-15b模拟物组、对照序列组和空白对照组G0+G1、G2+M期细胞比例比较差异均有统计学意义(P<0.05),而S期细胞比例比较差异无统计学意义(P>0.05);空白对照组G0+G1、G2+M期细胞比例与对照序列组比较差异无统计学意义(P>0.05);与空白对照组和对照序列组比较,miR-15b模拟物组G0+G1期细胞比例显著增加,而G2+M期细胞比例显著减少,差异均有统计学意义(P<0.05)。
表3各组人子宫内膜癌细胞周期变化比较
Tab.3Comparisonofcellcyclechangesofendometrialcarcinomacellsineachgroup
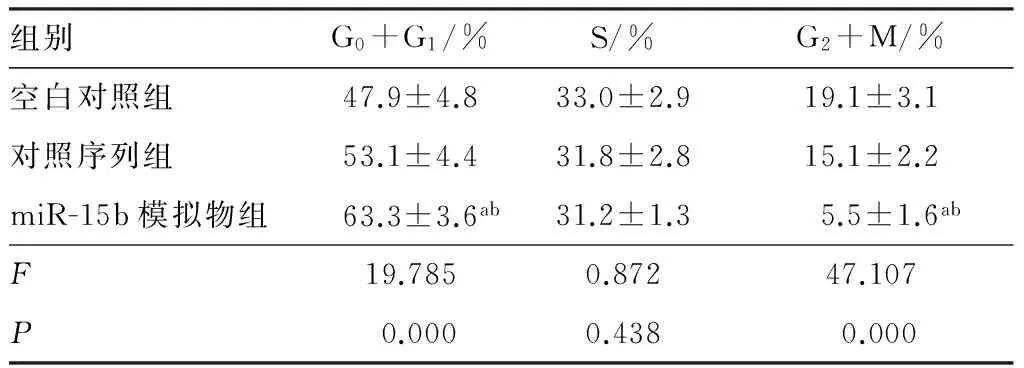
组别G0+G1/%S/%G2+M/%空白对照组47.9±4.833.0±2.919.1±3.1对照序列组53.1±4.431.8±2.815.1±2.2miR-15b模拟物组63.3±3.6ab31.2±1.35.5±1.6abF19.7850.87247.107P0.0000.4380.000
注:与空白对照组比较aP<0.05;与对照序列组比较bP<0.05。
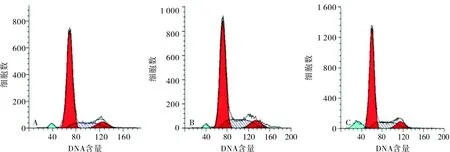
A:空白对照组;B:对照序列组;C:miR-15b模拟物组。
图2流式细胞术检测各组细胞周期变化
Fig.2Cellcyclechangeswasdetectedbyflowcytometryineachgroup
3 讨论
子宫内膜癌作为好发于绝经后女性的常见恶性肿瘤,发病因素较为复杂,且近年来出现发病率升高、发病年龄年轻化趋势[15],同时,由于该肿瘤恶性程度高、侵袭力强,肿瘤复发、转移率高,多数患者预后不良[16]。研究表明,子宫内膜癌组织中miRNA表达谱发生改变,可能在子宫内膜癌的发病机制中发挥潜在作用[17]。miR-15b作为miRNA重要类型,参与了多种恶性肿瘤的发生、发展,miR-15b既可以发挥抑癌基因功能参与胰腺癌[18]、口腔癌[19]等恶性肿瘤的发生,又可以作为癌基因参与胃癌、结直肠癌等恶性肿瘤的发生,提示miR-15b可能通过不同的调控机制而参与不同恶性肿瘤的发生。同时,miR-15b又可以作为判定肿瘤患者预后的标志物[20]。本研究结果显示,子宫内膜癌组织中miR-15b相对表达量低于正常子宫内膜组织,说明miR-15b在子宫内膜癌组织中呈低表达,提示miR-15b可能在子宫内膜癌发生中发挥抑癌基因的功能。
本研究结果显示,子宫内膜癌组织中miR-15b相对表达量与FIGO分期、肌层浸润深度和淋巴结转移有关,在FIGO分期Ⅲ~Ⅳ期、肌层浸润深度≥1/2肌层和发生淋巴结转移的子宫内膜癌组织中呈低表达,说明miR-15b参与了子宫内膜癌病程进展,随着子宫内膜癌病情进展,miR-15b表达逐渐减少,进一步提示miR-15b可能在子宫内膜癌发生中发挥抑癌基因的功能。本研究为进一步探讨miR-15b在子宫内膜癌进程中的作用,采用转染miR-15b模拟物的方式提高子宫内膜癌细胞中miR-15b的表达,结果显示,miR-15b模拟物组子宫内膜癌细胞中miR-15b相对表达量显著增加,提示构建的细胞模型成功。MTT实验结果显示,与空白对照组和对照序列组比较,miR-15b模拟物组子宫内膜癌细胞培养24、48、72、96 h时细胞增殖能力降低,说明上调子宫内膜癌细胞中miR-15b表达可有效降低细胞增殖能力。本研究结果显示,miR-15b模拟物组子宫内膜癌细胞凋亡率显著高于空白对照组和对照序列组,说明上调子宫内膜癌细胞中miR-15b表达可促进细胞凋亡。进一步对细胞周期进行检测显示,miR-15b模拟物组子宫内膜癌细胞G0+G1期细胞比例显著增加,说明上调miR-15b可能通过细胞周期阻滞而最终促进细胞凋亡的发生。
综上所述,miR-15b在子宫内膜癌组织中呈低表达,且参与了子宫内膜癌病程进展,上调子宫内膜癌细胞中miR-15b表达可抑制细胞增殖,其机制可能与阻滞细胞周期及促进细胞凋亡有关。
[1] SIMONY A,HANSEN E J,CHRISTENSEN S B,etal.Incidence of cancer in adolescent idiopathic scoliosis patients treated 25 years previously[J].EurSpineJ,2016,25(10):3366-3370.
[2] ZANFAGNIN V,FERRERO A,BIGLIA N,etal.The role of surgery in recurrent endometrial cancer[J].ExpertRevAnticancerTher,2016,16(7):741-750.
[3] 郝义,孙笑,刘玉秋,等.miRNA146a 在视网膜色素上皮细胞老化及老年性黄斑变性中的功能研究[J].眼科新进展,2017,37(2):117-121.
[4] 黄芳延,杨蕾,尤梁慧,等.miR-1908过表达的人脂源性多能干细胞基因表达谱分析[J].中华实用儿科临床杂志,2016,31(7):496-498.
[5] 季青山,俞茜,孙思勤,等.miR-34a/SIRT1在H2O2诱导人晶状体上皮细胞氧化应激中的表达[J].眼科新进展,2017,37(8):728-731.
[6] 汤有才,李恩耀,魏明,等.MicroRNA-146a对寻常型银屑病患儿血CD4+T淋巴细胞的调控作用[J].中华实用儿科临床杂志,2016,31(17):1332-1335.
[7] LIU X,LIU X,WU Y,etal.MicroRNAs in biofluids are novel tools for bladder cancer screening[J].Oncotarget,2017,8(19):32370-32379.
[8] 符春艳.miR-93及miR-21在糖尿病视网膜病变患者中的表达及其临床价值[J].眼科新进展,2017,37(12):1161-1164.
[9] VARAMO C,OCCELLI M,VIVENZA D,etal.miRNAs and their role in the correlation between schizophrenia and cancer (review)[J].MolMedRep,2016,14(6):4942-4946.
[10] 丁肖媛,蔡红,王嵩,等.玉屏风散对支气管哮喘小鼠微小 RNA 表达的影响[J].中华实用儿科临床杂志,2016,31(4):284-287.
[11] 李娜,曹娟,郁继国,等.miR26a对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的影响及机制研究[J].眼科新进展,2017,37(7) :619-622.
[12] 马岳,伍俊,廖旺,等.miRNA-100通过抑制羧基末端区域小磷酸化酶样蛋白表达促进人白血病细胞 HL-60增殖[J].中华实用儿科临床杂志,2016,31(3):185-189.
[13] ZHAO C,WANG G,ZHU Y,etal.Aberrant regulation of miR-15b in human malignant tumors and its effects on the hallmarks of cancer[J].TumourBiol,2016,37(1):177-183.
[14] 刘薇,马静茹,张春雨.低频脉冲电刺激干预对宫颈癌根治术后尿潴留的影响[J].新乡医学院学报,2017,34(4):327-329.
[15] SURI V,ARORA A.Management of endometrial cancer:a review[J].RevRecentClinTrials,2015,10(4):309-316.
[16] BOGANI G,DOWDY S C,CLIBY W A,etal.Incisional recurrences after endometrial cancer surgery[J].AnticancerRes,2015,35(11):6097-6104.
[17] 周胤健,杜英,梅丽娜,等.子宫内膜癌microRNA表达谱的初步研究[J].中华实验和临床病毒学杂志,2014,28(4):280-282.
[18] ZHANG W L,ZHANG J H,WU X Z,etal.miR-15b promotes epithelial-mesenchymal transition by inhibiting SMURF2 in pancreatic cancer[J].IntJOncol,2015,47(3):1043-1053.
[19] WANG X,GUO H,YAO B,etal.miR-15b inhibits cancer-initiating cell phenotypes and chemoresistance of cisplatin by targeting TRIM14 in oral tongue squamous cell cancer[J].OncolRep,2017,37(5):2720-2726.
[20] JI W B,LIU X,LUO Y,etal.High expression of miR-15b predicts poor prognosis for hepatocellular carcinoma after curative hepatectomy[J].OncolRep,2016,36(4):1901-1908.

