两株根际促生细菌对TMV的生防作用研究
刘笑玮,秦元霞,2,袁莲莲,何青云,杨金广,申莉莉
1 中国农业科学院烟草研究所,烟草行业病虫害监测与综合治理重点开放实验室,山东省青岛市崂山区科苑经四路11号 266101;2 沈阳农业大学,植物保护学院,辽宁省沈阳市沈河区东陵路120号 110866
烟草花叶病毒(Tobacco mosaic virus,TMV)是一种正义、单链的RNA病毒,寄主范围广泛,能侵染番茄、辣椒、黄瓜等重要作物。前人调查发现,TMV是最具有科学和经济意义的病毒[1],其为害烟草造成叶片花叶、植株矮化、生长缓慢等症状,严重影响烟叶的质量和产量,给生产带来巨大的经济损失。在生产中通常采用化学农药防治病毒,但化学农药的大量使用也伴随着许多不良影响,如“3R1P”问题,即农药残留(residue)、有害生物抗性(resistance)及再猖獗(resurgence)和环境污染(pollution),如今,“3R1P”效应已成为全世界公认的、亟待解决的难题。与化学防治相比,生物防治具有生产成本低、环境友好、对人畜无害等优点,成为植物病害绿色防控的研究热点和发展方向[2]。其中,筛选根际促生细菌,利用其对病毒的抑制作用、对寄主的促生作用进行病毒病早期控制,是病毒病生物防治的重要策略之一[3]。
植物根际促生菌(plant growth promoting rhizobacteria,PGPR) 是指一类附生于植物根际中能够促进有益微生物的根际定殖,抑制有害微生物的生防微生物[4]。根据定殖于根际的位置,可将PGPR分为胞外促生菌(ePGPR)和胞内促生菌(iPGPR)[5]。研究发现,PGPR主要有促进植物营养吸收、分泌代谢产物间接调节植物生长、抑制土传病原菌的功能[6]。一方面,PGPR具有固氮[7]、溶磷[8]、释放钾[9]、提供铁元素[10]等活性,直接为植物提供N、P、K、Fe,促进植物营养吸收;另一方面,PGPR能产生生长素、赤霉素、细胞分裂素等激素间接调节植物生长[11]。此外,PGPR对土传病害具有生物防治功能:(1)PGPR能产生吩嗪、藤黄绿脓菌素、土壤杆菌素等抗生素来抑制病原物的生长[12-13];(2)PGPR能合成木聚糖、壳聚糖等几丁质酶[14],诱导植物产生系统抗性(Induced Systemic Resistance,ISR),提高植物抗病力;(3)PGPR能产生溶菌酶,溶解真菌细胞壁,促进病原真菌的细胞裂解[15-16];(4)PGPR在植物根际定殖,占据病原物侵染位点,可减少病原物的侵入机会[17],也可与病原物进行营养竞争,从而抑制病原物的扩展[18]。
本研究以实验室筛选到的两株根际促生菌Sa、Sk为材料,从促进烟草生长、体外钝化病毒、室内抗病毒防治效果等方面探究其对TMV的抑制作用。试验结果表明二者均有良好的生防潜力,该研究为TMV的预防提供了新的方法,并为其实际应用奠定理论基础。
1 材料与方法
1.1 材料
供试菌株:Sa、Sk;供试毒源:TMV和TMV30B侵染性克隆(带有GFP标记);供试烟草品种:三生NN烟、本氏烟、普通烟K326;供试培养基:LB液体培养基、LA固体培养基、霍格兰氏营养液。
1.2 方法
1.2.1 病毒接种液制备
取TMV病叶1 g,于液氮中充分研磨,加少量0.01 mol/L PBS缓冲液(pH 7.0)后,用双层纱布过滤除去残渣,加PBS缓冲液定容至40 mL,即为TMV接种液。
将实验室贮存的含有TMV30B侵染性克隆的农杆菌活化、离心,以MMA缓冲液(10 mmol/L MES,10 mmol/L MgCl2,50 μmol/L AS)将菌体重悬,利用紫外分光光度计调节OD600值为0.8,以此重悬液浸润本氏烟叶片[19]。待植株发病后,取1 g病叶研磨,用PBS缓冲液定容至20 mL,即为TMV30B接种液。
1.2.2 发酵液、发酵上清、粗蛋白及去蛋白上清的制备
将Sa、Sk菌株于LB液体培养基中过夜培养作为种子液,吸取1 mL种子液接种于200 mL的LB中,28 ℃,200 rpm培养48 h为发酵液,10000 rpm离心10 min去菌体作为发酵上清。4 ℃条件下,向发酵上清中缓慢加入硫酸铵至最终度为80%,并不断轻轻搅拌,待硫酸铵全部溶解后4 ℃静置过夜。10000 rpm离心20 min,沉淀用10 mL PBS缓冲液溶解后,放入孔径为500 Da的透析袋中进行透析除去硫酸铵[20],将透析后的粗蛋白溶液冷冻干燥,最终溶解于20 mL PBS缓冲液中作为粗蛋白溶液。取50 mL离心后的上清液,用孔径为500 Da的透析袋透析,冻干后用 mL PBS缓冲液溶解作为去蛋白上清。
1.2.3 根际促生细菌Sa、Sk的鉴定
菌落形态观察:蘸取Sa、Sk菌液于LA平板上划线,28 ℃倒置培养24 h后,观察记录菌落形态,参照《伯杰细菌鉴定手册》进行生理生化鉴定[21],同时结合Biolog微生物自动鉴定系统对Sa、Sk菌株进行分类鉴定[22]。
基因组测序:挑取Sa、Sk单菌落于15 mL的LB中28 ℃过夜培养,提取细菌基因组DNA(Bacteria Genomic DNA Kit,Trans)。采用细菌基因组16S rDNA通用引物27F/1492R,以细菌DNA为模板,配置20 μL反应体系进行PCR扩增。将扩增产物送上海生工生物工程技术服务有限公司进行纯化和测序,将测序结果与GenBank数据库中已报道的16S rDNA核苷酸序列进行Blastn比对。
1.2.4 促生效果测定
平皿滤纸法萌芽试验:向9 cm的平皿中加入发酵上清(预先过0.22 µm的过滤器除菌)与去离子水比例为1∶10的混合液3 mL,以去离子水代替发酵上清为对照。铺一层滤纸,每皿点播约100粒本氏烟种子,每处理设置4皿重复,用封口膜封口后,26 ℃培养6~9 d,统计发芽率并称量百芽鲜重。
水培法促生试验:向盛有550 mL霍格兰氏营养液的培养盒中加入20 mL发酵上清,分别以加入霍格兰培养液、LB培养基代替发酵上清为对照。取长势一致的四叶期K326幼苗,以清水洗去根土,插入培养孔中进行培养,每组处理8株幼苗,3次重复。每日添加去离子水10 mL,26 ℃培养14 d后观察植株根冠生长状况并称量单株鲜重。
1.2.5 抑制TMV活性测定
在TMV的枯斑寄主三生NN烟(N. tobacumvar.Sumsun(NN))上,采用半叶法测定对TMV的抑制活性:将细菌发酵液、发酵上清、粗蛋白溶液、去蛋白上清分别与等体积TMV接种液混合,将LB与TMV接种液等量混合液作为发酵液、发酵上清、去蛋白上清的对照处理,PBS缓冲液与TMV接种液等量混合液作为粗蛋白溶液的对照处理。静置15~20 min后,在三生NN烟叶片的左、右两侧分别摩擦接种对照与实验组。每株接种3~4片展开叶,每处理4株重复。接种后喷清水去除石英砂、保湿,26 ℃培养,3~4 d后调查枯斑数,按以下公式计算抑制效果。

1.2.6 发酵上清对TMV30B的体外钝化
采用TMV30B摩擦接种本氏烟的模式观察体系:取TMV30B接种液与发酵上清等量混合,静置15~20 min后,摩擦接种本氏烟叶片;以等体积的LB与TMV30B接种液混合为对照。每处理设置4株重复,每株接种5片展开叶。26 ℃培养5~6 d,于紫外灯下观察记录初侵染造成的绿色荧光斑点数目。
1.2.7 发酵上清对TMV的室内防效
在TMV的系统侵染寄主栽培烟草K326上进行室内防效实验。使用Sa、Sk发酵上清喷雾处理5~6叶期K326,间隔24 h,共喷施3次,以喷施清水为阴性对照,喷施6%寡糖·链蛋白可湿性粉剂1000倍液为阳性对照,末次喷施6 h后摩擦接种TMV。每处理设置25株重复,每株接种上部2片展开叶。接种后14 d调查各处理的发病级别,按下式统计病情指数,计算防治效果。

1.3 数据分析
试验数据采用SPSS 19.0软件进行统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 根际促生细菌Sa、Sk的鉴定
在LA平板上,Sa菌落圆形、突起、表面光滑、半透明、有光泽,培养36~48 h后菌落膨胀而破裂坍塌(图1a),革兰氏染色试验显示Sa为革兰氏阳性菌。Sk菌落近圆形、突起、半透明,表面光滑且有光泽(图1b),革兰氏染色结果为阴性。Sa、Sk菌株的生理生化特征及Biolog鉴定结果分别见表1、表2。

图1 Sa、Sk单菌落形态Fig.1 Single colony morphology of Sa and Sk

表1 Sa、Sk菌株生理生化特征Tab.1 Physiological and biochemical characteristics of Sa and Sk
根据上述生理生化特征结果,对照《伯杰细菌鉴定手册》中关于芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)的描述,Sa符合芽孢杆菌属的特征,Sk 符合假单胞菌属的特征。
按照Biolog 操作手册,用GNⅢ板对两种菌株进行鉴定,结果表明Sa菌株与巨大芽孢杆菌(B.megaterium)相似度最高,而Sk菌株与针绿假单胞菌(P. chlororaphis ss aurantiaca)的相似度最高。

表2 Biolog 系统对Sa、Sk菌株鉴定结果(48 h)Tab.2 Identification of Sa and Sk by Biolog (48 h)
利用细菌基因组16S rDNA通用引物27F/1492R扩增后,Sa的扩增核苷酸序列大小为1437 bp,Sk的扩增核苷酸序列大小为1394 bp。将测序结果进行Blastn比对后,发现Sa与巨大芽孢杆菌(B.megaterium)的同源性为99%,Sk与假单胞菌(P.protegens)的同源性为99%。16S rDNA序列已上传至GeneBank,Sa登录号为MH012178,Sk登录号为MH012179。
综合Sa、Sk菌株的菌落形态、生理生化特性、Biolog鉴定结果及16S rDNA的鉴定和比对结果,将Sa和Sk分别暂定为芽孢杆菌属(Bacillussp.)和假单胞菌属(Pseudomonassp.)。
2.2 萌芽促生效果
由平皿滤纸法萌芽试验可以看出,3种处理的种子发芽率均为100%,但与对照相比Sa、Sk两个处理中种子萌发快,且芽更壮(图2a)。第9 d统计百芽鲜重发现Sa为0.137 g,Sk为0.138 g,两处理的百芽鲜重均显著高于对照处理的0.109 g(图2b),说明Sa、Sk有促进种子萌发的作用。另外,若按照1∶5比例添加Sa、Sk的发酵上清,则萌芽结果与对照无显著差异,若按照1∶1比例添加Sa、Sk的发酵上清,则种子不萌发(结果未展示),说明高浓度的发酵上清抑制种子萌发,只有适当浓度的发酵上清才会促进种子萌发。

图2不同浓度Sa、Sk发酵上清的催芽促生效果Fig.2 Germination and growth promoting effect of different concentrations of Sa and Sk fermentation supernatant
K326幼苗水培14 d,发现经Sa、Sk发酵上清处理的幼苗其茎叶生长和根系发育均优于经LB液体培养基处理及对照的幼苗。Sa处理平均单株鲜重为1.740 g,Sk处理平均单株鲜重为1.767 g,均显著高于LB处理的平均单株鲜重1.125 g及对照单株平均鲜重0.853 g(图2c);且Sa、Sk处理的幼苗根系发育粗壮、侧根较多,说明Sa、Sk均有促进幼苗生长的作用。
2.3 抑制TMV活性测定

图3 Sa、Sk不同成分对TMV的抑制活性Fig.3 Inhibition activity of different components of Sa and Sk on TMV
利用半叶法测定Sa、Sk对TMV的抑制作用,可以看出Sa(图3a)、Sk(图3b)不同成分对TMV的抑制效果不同。如表3所示,Sa的发酵液、发酵上清、粗蛋白溶液、去蛋白上清抑制TMV的效果分别为92.5%、88.4%、85.2%、83.1%;Sk的发酵液、发酵上清、粗蛋白溶液、去蛋白上清抑制TMV的效果分别为89.5%、86.9%、88.0%、0%,表明Sa、Sk的发酵产物对TMV均有良好的抑制效果。此外,Sk的去蛋白上清无防效,仅粗蛋白溶液产生良好防效,说明其生防活性物质主要为蛋白类。但是,Sa的粗蛋白溶液和去蛋白上清对TMV均具有良好的抑制作用,为了进一步确定Sa的粗蛋白是否具有抗病毒活性,将其水浴加热灭活后与TMV接种液混合接种三生NN烟,发现蛋白失活后的粗蛋白溶液抑制TMV的效果降低至36.2±2.3%,说明其蛋白成分也具有抑制TMV的活性,表明Sa的生防活性物质主要包括蛋白和非蛋白两类。

表3 Sa、Sk不同成分对TMV的抑制效果Tab.3 Inhibition effect of different components of Sa and Sk on TMV
2.4 发酵上清对TMV30B的体外钝化

图4 Sa、Sk发酵上清体外钝化TMV30B的能力Fig.4 Passivated ability of Sa and Sk fermentation supernatant on TMV30B in vitro
用TMV30B接种液与发酵上清的混合液摩擦处理本氏烟叶片,5 d后用紫外灯照射叶片统计接种叶上绿色荧光斑点数量(图4)。其中LB对照的接种叶上绿色荧光斑点平均数量为8.93,而Sa发酵上清处理为2.20,Sk发酵上清处理为4.07,均显著低于对照。该试验结果表明:Sa和Sk均有钝化TMV30B的作用,且Sa的钝化效果高于Sk,可以明显抑制TMV30B的初侵染。
2.5 发酵上清对TMV的室内防效
5~6叶期普通烟K326经3次喷施Sa、Sk发酵上清,寡糖·链蛋白1000倍液及清水对照后,接种TMV。结果显示:接种后7 d,清水对照植株的接种叶均开始表现轻微花叶,发病率为100%;接种后10 d,Sa、Sk发酵上清,寡糖·链蛋白处理植株的接种叶开始表现轻微花叶,发病率100%。第14 d,对照植株的所有新叶出现花叶绿岛症状,经Sa、Sk发酵上清和寡糖·链蛋白处理的植株其症状较轻,发病级别和病情指数显著低于清水对照。统计显示Sa发酵上清对TMV的预防效果为27.71%,与寡糖·链蛋白的防效25.54%无显著差异,但略好于防效为18.55%的Sk发酵上清(表4)。
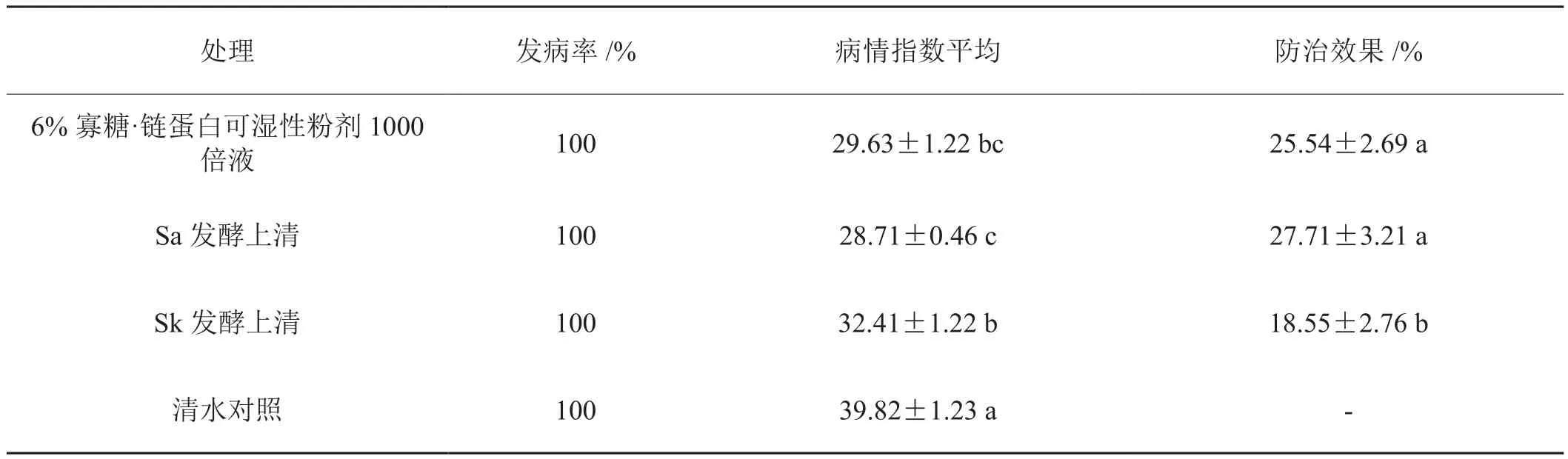
表4 各处理病情指数及对TMV的防治效果Tab.4 Disease index and control effect on TMV
3 讨论与结论
目前已鉴定的PGPR菌株涵盖芽孢杆菌属、假单胞菌属、欧文氏菌属、黄单胞菌属、黄杆菌属、肠杆菌属、克雷伯氏菌属等多个属种,其中以芽孢杆菌属和假单胞菌属为主[23]。同时,作为根际促生菌,芽孢杆菌属和假单胞菌属也是目前研究最为广泛的两个属。研究发现,芽孢杆菌能够克服镍(Ni)胁迫[24]、增加根干重、促进植物生长[25]、提高植物抗氧化酶活性[24]和耐盐性[26]、增强植物抗病性[27]。假单孢菌能够克服盐胁迫[28]、维持植物营养[29]、产生激素和抗菌化合物、提高植物产量[30]、激活植物相关防御基因、增强植物抗病性[31]。目前研究多聚焦于根际促生菌产生的抗菌活性物质对土传病原真菌或细菌病害的抑制作用上,对病毒抑制作用的报道相对较少。本文中鉴定的菌株Sa、Sk分别属于芽孢杆菌属和假单胞菌属。对峙培养发现Sa、Sk均能抑制黑胫病菌生长,抑菌效率为67.5%、56.9%,对青枯病菌没有抑制作用(结果未展示)。促生和防病试验显示Sa和Sk能够促进烟草生长、钝化病毒,从而抑制病毒的初侵染。
已有研究表明,芽孢杆菌不仅具有解磷促钾能力,而且能够产生细菌素(bacteriocins)、活性蛋白酶类和脂肽类表面活性素(suifactins)、伊枯草菌素(iturins)、丰宁素(fengycins)等,对病原菌表现出抑制作用,目前已应用于微生物肥料和生物防治领域[32]。假单胞菌不仅能分泌藤黄绿菌素(Plt)、吩嗪酸(PCA)、2,4-二乙酰藤黄粉(Phl)、嗜铁素及几丁质酶和溶菌酶,抑制多种病原菌,还能够吸附、结合土壤重金属,已被商业应用于种子包衣抑菌和环境生物修复领域[33]。此外,粘质沙雷氏菌能分泌小分子物质抑制TMV,解淀粉芽胞杆菌和荧光假单胞菌能分泌胞外蛋白抑制TMV[3,20]。本文的芽孢杆菌Sa的抗病毒活性物质主要包括蛋白和非蛋白两类,假单胞菌Sk其活性物质主要为蛋白类,目前尚未对活性物质进行鉴定。
有研究表明,真菌与根系之间的互作能改变水稻的基因表达,促进侧根的生长并使水稻获得更丰富的营养。被真菌‘殖民’的植物通过真菌菌丝直接获得了70%~100%的磷酸盐,真菌生物肥可能会成为未来生物肥[34]。本文促生试验发现,适当浓度的Sa、Sk发酵上清能够促进种子萌发、根系发育和茎叶生长。细菌生物被膜与植物根系之间的互作也必将成为细菌生物肥研究的热点。开展菌株的根际定殖能力及植物根表细菌生物膜形成与作用机制的研究,有助于推进细菌生防菌肥的开发。
目前生防菌对病毒的抑制作用研究以体外钝化为主、以促生防病为辅,几乎没有治疗作用,这也是当前抗病毒剂的共同局限性,生产中应该从苗期开始喷施,以预防性为主。本文体外钝化试验表明,菌株发酵上清对TMV具有良好的体外钝化作用,且能有效抑制TMV30B的初侵染和系统扩展,延缓症状发生。可将Sa、Sk发展为生物消毒剂,用于土壤、育苗盘、剪叶机等工具的消毒,钝化残存的TMV,减少初侵染源。促生和温室防效试验显示,Sa、Sk均兼具促生和防病作用,也可将其发展为生物抗病毒剂,从苗期开始使用,用于培育壮苗和预防病毒。

