生物炭基肥对植烟土壤微生物功能多样性的影响
常栋,马文辉,张凯,王晓强,何晓冰,许跃奇,徐放达
河南省烟草公司平顶山市公司,河南 平顶山 467000
生物炭是指生物有机材料(农作物秸秆、杂草、粪便等生物质)在缺氧或低氧环境中通过高温裂解后的固体产物[1]。其含碳量极高,施入土壤后不仅能增加土壤中的有机质含量、提高肥力,而且耐降解,因而可以提高碳在土壤中的封存时间[2]。近年来,在全球气候变暖与能源、粮食危机日益蔓延的大背景下,有关生物炭的研究得到了学者的广泛重视,并取得了显著的研究进展[3-6]。
微生物是土壤生态系统的重要组成部分,其在土壤养分循环、有机碳的矿化-固定过程中起着关键作用[7]。由于微生物分布广泛、对环境敏感,且在生态系统中具有不可替代的作用,被越来越多地用于土壤肥力评价中[8-9]。现有研究表明,生物炭在调控土壤微生物群落结构和多样性方面发挥着重要作用[10-13]。
豫中烟区是我国浓香型烤烟的重要产区之一,由于耕地资源有限,烤烟连作种植年限较长,加上化学肥料使用不合理,造成植烟土壤结构变差、养分供应不均衡、微生物多样性和生物活性降低等问题,严重影响了优质烟叶生产的可持续发展,因此,烟田土壤改良十分必要。近些年,生物炭在烟田土壤改良中的研究广泛开展[14-18]。目前,生物炭主要来源于农业废弃物,其本身所含养分有限,单独施用并不能满足作物生长的需要[19]。而以生物炭为承载体,与其他类型肥料混合制成的生物炭基肥弥补了生物炭养分不足、消耗量大等问题,同时减少化肥用量、改善土壤微生态环境、提高养分利用率和作物品质[20-21]。生物炭基肥在河南、江西、陕西、湖南、贵州等产区的示范效果良好。目前,关于生物炭基肥对植烟土壤微生物生态的研究较少。本文以河南省郏县典型植烟土壤为研究对象,在大田环境下,分析添加不同用量生物炭基肥对土壤微生物功能多样性的影响,以期为合理的烤烟施肥措施提供科学依据。
1 材料与方法
1.1 研究区概况
试验地位于河南省郏县茨芭镇,东经113.08°,北纬34.07°,海拔224 m,主要种植作物为烟草,属暖温带大陆性季风气候,年平均气温14.6 ℃,≥ 10℃ 年活动积温4734.9 ℃,无霜期220 d左右,年平均日照时数2232 h,日照率50%。年平均降雨量680 mm,7 ~ 9月份降雨量占全年的70% 左右,属丘陵干热少雨区,高温期与多雨期同步,土壤类型为壤土。
1.2 试验设计
试验于2017年进行,采用随机区组设计,共设4个处理:施用化肥(B0);化肥 + 0.9 t·hm-2生物炭基肥(B60);化肥 + 1.5 t·hm-2生物炭基肥(B100);化肥 + 2.1 t·hm-2生物炭基肥(B140)。各个试验小区化肥氮素用量 52.5 kg·hm-2,N∶P2O5∶K2O 施用比例为 1∶1∶3.5,各处理重复 3 次,小区面积约 130 m2,生物炭基肥全部用作基肥条施。试验所用生物炭基肥为河南宝融生物科技有限公司生产,生物炭种类为秸秆炭,有机质含量60%,全氮含量2.5%,全磷含量0.56%,全钾含量3.4%,pH为7.7。大田管理按照平顶山市烟叶生产管理标准体系相关操作规程进行。烤烟供试品种为中烟100。
1.3 样品采集与预处理
在烟草旺长期(移栽后60 d)按5点采样法采集烟株根系附近0 ~ 20 cm土壤,剔除土壤样品中石块和植物残根等杂物,混匀过2 mm筛,放入4℃冰箱保存。对采集的土壤样品进行微生物碳源利用多样性、酶活性和化学指标的测定。
1.4 测定指标与方法
1.4.1 土壤养分指标测定
将土壤样品置于室内自然风干后过筛。有机碳(SOC)含量采用重铬酸钾外加热法测定,碱解氮(AN)含量采用碱解扩散法测定,速效磷(AP)含量的测定采用0.5mol/L NaHCO3浸提-钼锑抗比色法,pH测定采用电位法测定,固液比为1∶2.5[22];硝态氮和铵态氮采用连续流动分析仪测定,微生物量碳(MBC)采用熏蒸浸提-重铬酸钾容量法测定,土壤微生物量氮(MBN)采用熏蒸浸提法测定[23]。
1.4.2 土壤微生物群落功能多样性分析
土壤微生物碳源利用多样性采用Biolog Eco微平板测定。微平板中31种底物划分为6类[24]:碳水化合物(D-半乳糖酸-γ内脂,β-甲基-D-葡萄糖苷,D-纤维二糖,α-D-乳糖,i-赤藓糖醇,α-D-葡萄糖-1-磷酸,D-木糖,D-甘露醇,N-乙酰-D葡萄糖胺,D,L-α-磷酸甘油),氨基酸(L-天门冬酰胺,L-苯基丙氨酸,L-精氨酸,L-丝氨酸,L-苏氨酸,甘氨酰-L-谷氨酸),羧酸(γ-羟基丁酸,衣康酸,α-丁酮酸,D-苹果酸,丙酮酸甲酯,D-半乳糖醛酸,D-葡萄糖胺酸),多聚物(α-环式糊精,肝糖,吐温40,吐温80),酚酸(2-羟基苯甲酸,4-羟基苯甲酸),胺类(苯乙胺,腐胺)。称取相当于5 g烘干土重的新鲜土样,加入盛有45 mL已灭菌的0.85% NaCl溶液锥形瓶中,密封震荡30 min后,稀释至1∶1000。将Biolog Eco微平板从冰箱取出,预热至20℃,将稀释液接种到平板中,每孔接种量为150 μL。在28℃下连续培养7 d,每隔24 h用Biolog自动读数仪在590 nm下读数[25]。
1.4.3 土壤酶活性的测定
土壤酶活性的测定依照关松荫的方法[26]。
1.5 数据处理
每孔平均颜色变化率(average well colour development, AWCD),用以衡量微生物利用不同碳源的整体能力[27],是微生物群体活性的有效指标,值越大表示土壤微生物密度越大、活性越高。

式中,Ci为各反应孔在590 nm下的吸光值;R为对照孔A1(用水代替碳源)的吸光值;当Ci-R<0时,在计算中记为0。本研究采用Biolog Eco微平板培养96 h的数据计算群落丰富度指数(S),Shannon多样性指数(H),Simpson多样性指数(D),McIntosh多样性指数(U)和Shannon均一性指数(E),其中S是微生物可以利用的碳源数目(OD590>0.5)代表该孔碳源被利用,H反映群落物种及其个体数和分布均匀程度的综合指标,受群落物种丰富度影响较大。D较多反映了群落中最常见的物种优势度。U是群落物种均一性的度量。E反映了Shannon指数的均匀度,计算公式如下[28-29]:

其中,Pi=(Ci-R)/∑(Ci-R),ni=Ci-R,E=H/lnS。
试验数据利用Excel 2013进行初步处理,使用SPSS 20.0进行统计分析,采用单因素方差分析(one-way ANOVA)和Tukey HSD法多重比较检验各处理间的差异显著性(P<0.05),利用R语言进行主成分分析和热图制作。
2 结果与分析
2.1 生物炭基肥对土壤化学和生物化学性质的影响
各处理耕层土壤化学和生物化学性质如表1和表2所示。添加生物炭基肥后土壤pH均有所提高,B60和B140显著高于B0和B100。土壤AN和AP含量表现为B100显著高于其他各处理。B0处理的SOC含量显著低于添加生物炭基肥的处理。添加生物炭基肥后,MBC和MBN含量均有增加,其中B100和B140处理之间没有显著性差异,但均显著高于B0。土壤矿质氮含量在B100和B140之间没有显著性差异,但显著低于B0处理,B60处理的矿质氮含量显著低于其它处理。B0处理的土壤微生物熵(qmic)与添加生物炭基肥处理没有显著性差异,仅B60处理显著低于B140处理。

表1 不同施肥处理下的土壤性质Tab.1 Soil properties under different fertilization treatments

表2 不同施肥处理下的土壤酶活性Tab.2 Enzyme activities affected by fertilization treatments
添加生物炭基肥处理的土壤蔗糖酶和多酚氧化酶活性均比B0处理有所提高,但差异没有达到显著水平,脲酶活性表现为B140处理显著高于B0和B100。
2.2 生物炭基肥对土壤微生物功能多样性的影响
对不同处理每隔24 h测定OD值,计算平均颜色变化率(AWCD)。各处理烤烟根域土壤微生物对不同碳源的利用程度均随培养时间的增加而增大。在培养的前24 h里各处理间没有显著差异且接近于0,随后碳源被迅速利用,AWCD值急剧增加并表现为 B100>B140>B60>B0,而在 96 h 之后变幅逐渐降低。在培养至144 h时B0处理AWCD值最低为1.32,分别为B60、B100和B140处理的98%、81%和80%,表明施用生物炭基肥增加了微生物能源物质,提高了土壤微生物活性,尤其B100和B140处理最为显著。

图1 生物炭基肥对土壤微生物平均颜色变化率(AWCD)的影响Fig. 1 Variation in average well-colour development (AWCD) over time in Biolog Ecoplates
微生物的种类以及丰度是影响微生物活动的主要因素之一。为了进一步确定不同用量的生物炭基肥对土壤微生物多样性的影响,各施肥处理土壤培养96 h的微生物功能多样性指数见表3。研究结果表明,增施生物炭基肥能有效的改善土壤微生物群落功能多样性。B100和B140处理的Shannon多样性指数(H)和Simpson多样性指数(D)显著高于B0和B60处理;McIntosh多样性指数(U)表现为 B100>B140>B60>B0,其中 B0 显著低于 B100 和B140;Shannon均一性指数(E)为B140处理显著低于B0和B60处理。

表3 不同施肥处理下的土壤微生物群落功能多样性和均匀度指数Tab.3 Diversity and evenness indices of soil microbial communities of different treatments
2.3 生物炭基肥对土壤微生物碳源利用特征的影响
对各处理土壤微生物31种碳源的利用数据进行主成分分析,结果见图2。B0处理分布在第三象限,B60处理分布在第二象限,B100处理分布在第一象限,B140处理分布在第四象限。在主成分分析中,PC1和PC2分别解释了49.87%和26.91%的方差,累计达到76.78%。在PC1轴上,B100和B140处理主要分布在正轴方向上,且离散较小,B0和B60处理主要分布在负轴方向上;在PC2轴上,B0和B60处理主要分布在轴的中段位置,B100处理分布在正轴方向上,B140主要分布在负轴方向上。
进一步分析31种碳源在PC1、PC2上的载荷值(表4),载荷值越高表示对应碳源对主成分的影响越显著。从表4可知,以|r| > 0.5计,对PC1贡献较大的碳源有21种,主要包括碳水化合物6种,氨基酸5种,羧酸5种,多聚物2种,酚酸1种,胺类2种,其中18个呈正相关,3个呈负相关;对PC2贡献较大的有8种,主要包括碳水化合物1种,氨基酸2种,羧酸3种,多聚物1种,酚酸1种,其中5个呈正相关,3个呈负相关。
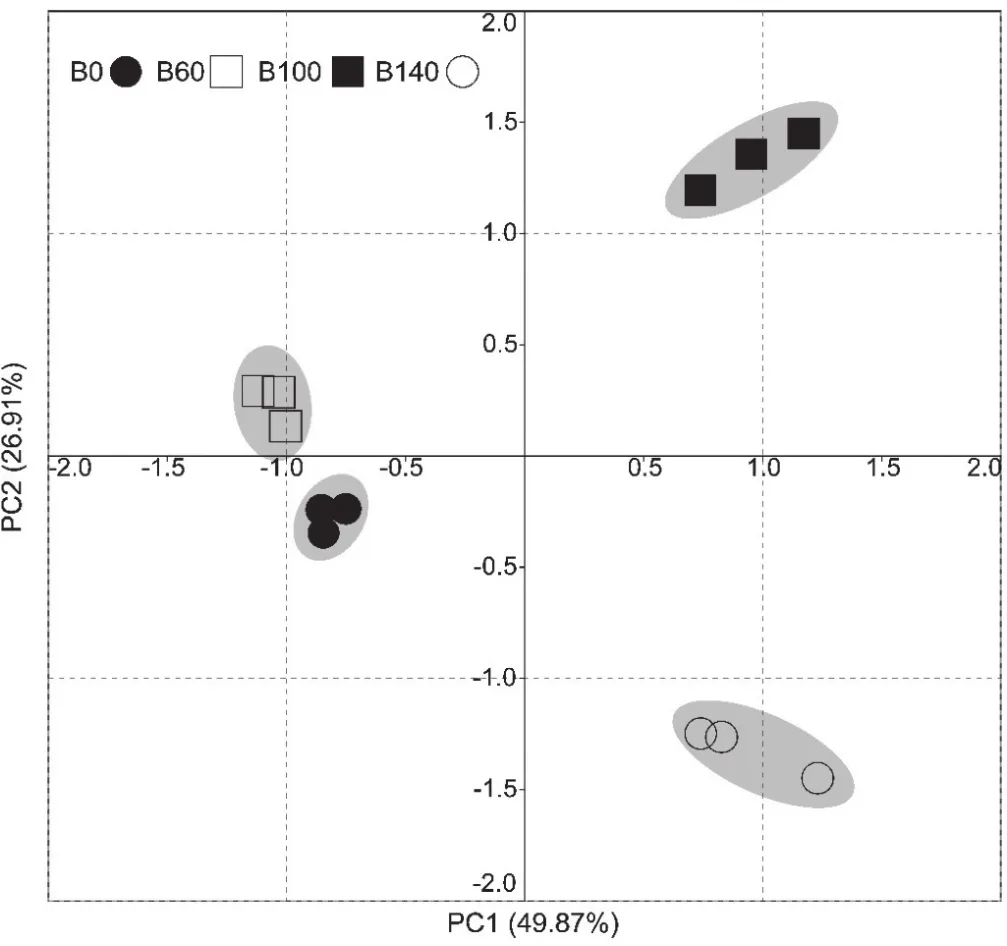
图2 不同施肥处理下微生物碳源利用的主成分分析Fig. 2 PCA for carbon source utilization of soil microorganisms under different treatments

表4 不同碳源在PC1和PC2上的载荷值(|r| < 0.4的值未显示)Tab.4 Correlation analysis of different carbon source utilization with PC1 and PC2 (the values of |r| < 0.4 are not shown)
不同施肥处理下,烟草根域土壤微生物对不同类别碳源的利用程度存在一定程度的差异。烟株根域土壤微生物群落对碳水化合物、多聚物和胺类3种碳源的利用强度均表现为B100和B140处理显著高于B0和B60处理;氨基酸类的利用强度 为 B100>B140>B0>B60, 其 中 B100 和 B140 处理显著高于B60处理,B0和B60处理间无显著性差异;羧酸类碳源的利用强度表现为B100处理最高,但各处理间无显著性差异;酚酸类碳源为B100>B60>B140>B0,其中 B100 处理显著高于其他处理。表明生物炭基肥的施用增加了土壤微生物对6类碳源的利用强度。
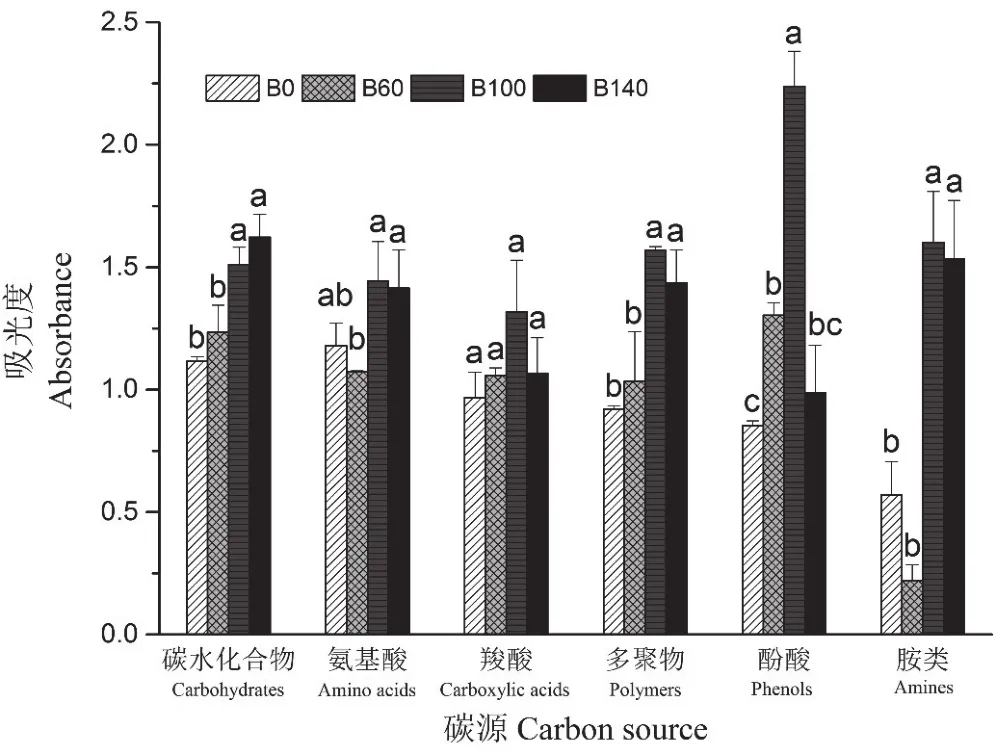
图3 不同施肥处理下土壤微生物对6类碳源的利用特征Fig. 3 Utilization characteristics of six substrate categories under different treatments
不同施肥处理对6类碳源共31种底物利用情况的热图分析结果表明(图4)。碳水化合物中,各处理土壤微生物对D-半乳糖酸-γ-内脂、N-乙酰-D-葡萄糖胺的利用程度差异较小,而增施生物炭基肥提高了碳水化合物的利用强度,主要是由于β-甲基-D-葡萄糖苷、D-纤维二糖、α-D-乳糖、i-赤藓糖醇、D-木糖、D-甘露醇和D,L-α-磷酸甘油的利用差异性造成的;氨基酸底物中,L-苯基丙氨酸、L-苏氨酸和甘氨酰-L-谷氨酸对施用生物炭基肥处理贡献较大;B60、B100和B140处理羧酸类的γ-羟基丁酸、丙酮酸甲酯和D-半乳糖醛酸高于不施用生物炭基肥处理B0,而B100处理的衣康酸利用强度大于其他各处理,B140处理的D-葡萄糖胺酸则小于其他处理;多聚物中,生物炭基肥的施用主要是增加了肝糖底物的利用;B100处理对酚酸类的利用较高,主要是由于2-羟基苯甲酸和4-羟基苯甲酸造成的;胺类中,B100和B140处理的苯乙胺和腐胺利用强度显著高于B0和B60处理。
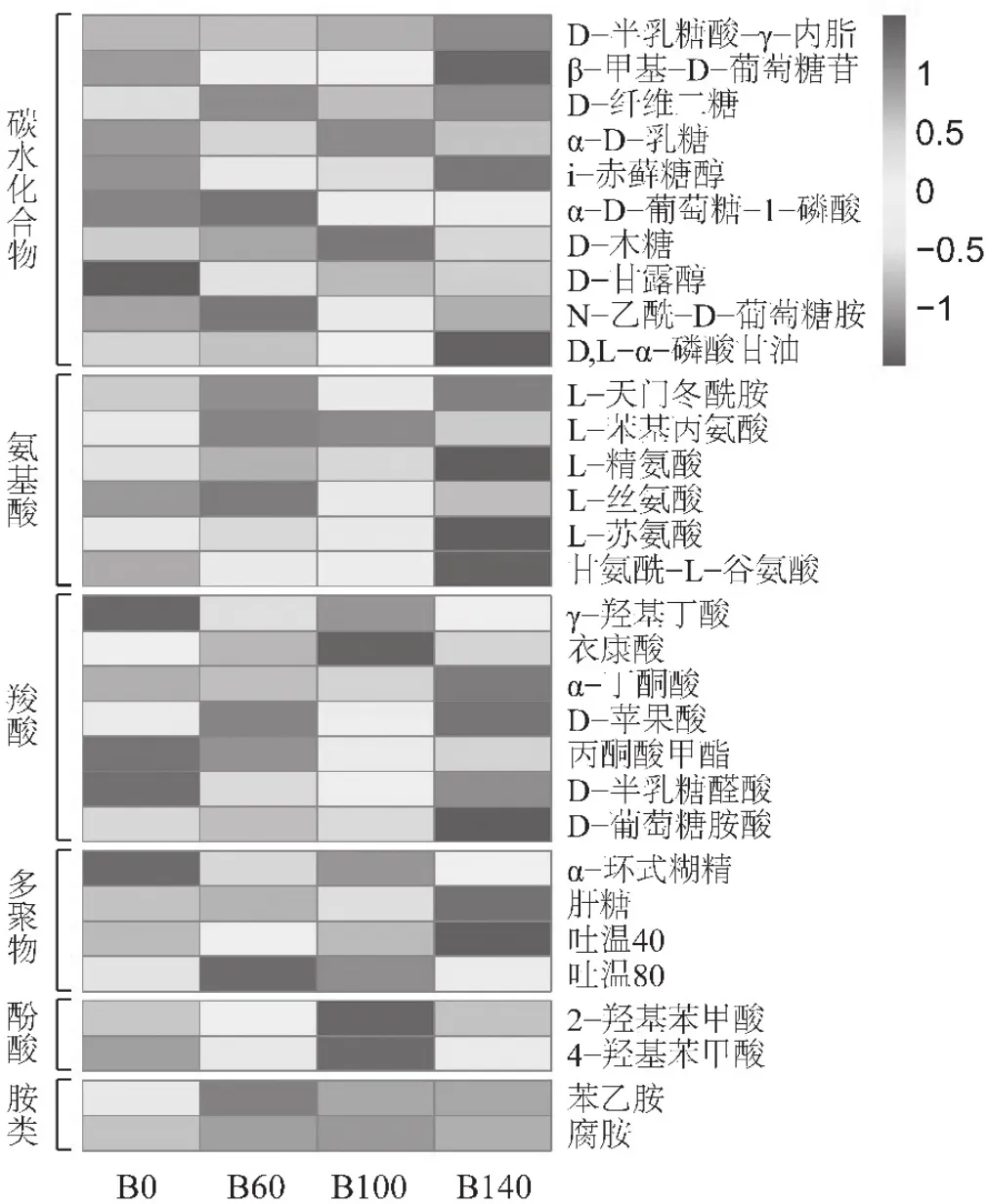
图4 不同施肥处理下土壤微生物对31种碳源的利用热图Fig. 4 Heatmap of 31 carbon substrate utilization under different treatments
3 讨论
3.1 生物炭基肥对植烟土壤养分的影响
直接向土壤中输入有机物是提高有机碳含量的主要途径之一[30]。生物炭富含碳素,能够显著增加土壤中有机碳含量。同时,生物炭中惰性碳所占比例较大,主要是高度浓缩的芳香化合物[1],在土壤中有很强的生物和非生物稳定性,施入土壤后较多的有机碳得以保存。而生物炭基肥兼具生物炭和有机肥的特点,既有养分缓释的作用,同时又可以增加土壤中的有效养分[31]。本研究结果显示,与对照处理相比,增施生物炭基肥显著提高了土壤有机碳含量,能够补偿土壤由于长期耕作所损失的有机物质,从而改善土壤特性,这与战秀梅等[32]的研究结论一致。Zhu等[25]研究显示,增施生物炭后微生物熵呈现降低趋势,认为是由于增添生物炭后的稀释效应引起的。本研究结果中,微生物熵仅B60处理显著低于B140处理,可能是由于生物炭基肥的添加对土壤有机碳和微生物群落组成的改变程度不同。添加生物炭基肥后,各处理土壤矿质氮含量显著低于对照。Prayogo等[33]研究也表明,生物炭的施用显著减少了土壤氮矿化量。生物炭对土壤矿化氮的抑制,一方面可能是由于生物炭的物理结构和表面官能团的吸附作用;另一方面生物炭可能改变参与氮循环微生物的生长,进而影响了土壤氮素动态过程。
土壤酶主要来源于微生物,其活性的高低在一定程度上反映了微生物的活性及其在养分循环中的作用。本研究中生物炭基肥不同添加量处理的土壤蔗糖酶和多酚氧化酶活性均有不同程度的提高,但差异没有达到显著水平,脲酶活性表现为B140处理显著高于B0和B100。有研究表明,添加生物炭对土壤脲酶、蔗糖酶和过氧化氢酶活性均有提高[34-35]。陈心想等[36]研究则显示,生物炭在短期内对蔗糖酶活性没有显著影响。生物炭对土壤酶的影响具有可变性,这可能是受生物炭种类、施用量、老化时间以及土壤类型等的影响。土壤微生物量碳是土壤有机碳中最活跃和最易变化的部分,也是土壤生物肥力的重要指标之一。生物炭基肥的结构及营养特性都有利于土壤微生物量的增加。本研究结果显示,随着生物炭基肥用量的增加,MBC和MBN呈现增长趋势,除了B60外的其他各处理均显著高于对照,与其他研究结果一致[37-38]。一方面,生物炭基肥中可利用组分能够直接为微生物生长提供所需的养分[39];另一方面,生物炭丰富的孔隙结构可以为微生物的栖息提供良好的环境[40]。
3.2 生物炭基肥对植烟土壤微生物功能多样性的影响
Biolog微平板法是一种广泛应用的微生物检验技术,其通过微生物对不同碳源底物利用的差异性来反映微生物群落代谢能力的不同。AWCD和功能多样性指数可以在一定程度上反映土壤微生物的活性及多样性[27]。Gomez等[41]研究表明,向土壤输入有机物料能够增加微生物数量和活性。本研究显示,添加生物炭基肥处理均使AWCD高于对照,表明外源碳的输入有利于维持土壤微生物的碳源底物利用能力,这与前人研究结果一致[42]。
微生物功能多样性分析显示,随着生物炭基肥施用量的增加,Shannon多样性指数、Simpson多样性指数和McIntosh多样性指数表现为增大趋势,Shannon均一性指数为减小趋势。表明生物炭基肥用量不同,微生物物种的数量、优势物种的优势度以及物种的多度均有明显差异。其中B100处理最有利于提高土壤微生物群落功能多样性。
主成分分析能够减少变量的数量又不损失太多的信息,准确体现微生物对碳源的利用能力。本研究结果显示,不同施肥处理土壤在31种碳源构建的主成分分析坐标体系中存在明显的空间分异,其中B0和B60处理间的差异较小,而B100、B140与B0处理差异显著,表明生物炭基肥的施用达到一定量时才能引起土壤微生物群落代谢功能的显著改变。Chan等[43]研究也表明,生物炭增加了土壤微生物群落数量和多样性。
4 结论
(1)施用生物炭基肥显著提高了烟田SOC、MBC、MBN的含量,减少了矿质氮含量,对微生物熵影响不大;对土壤脲酶、蔗糖酶和多酚氧化酶活性具有一定的提升作用。
(2)施用生物炭基肥显著增加了微生物功能多样性指数和碳源利用能力,降低了均一性指数,随着施用量的增大,处理间的差异加剧。
(3)综合考量生物炭基肥对植烟土壤的改良作用和施用成本,在研究区施用量1.5 t·hm-2即可有较好的效果。

