人脂肪干细胞膜片的构建及其生物学特性初探
杨 芳,陈书强,芦 洁,董 杰,孙惠君,郭雯娓,王晶晶,张建华,马 媛,王晓红
空军军医大学(第四军医大学)唐都医院 生殖医学中心,陕西西安 710038
组织工程技术的发展为组织器官的修复和再生开辟了新的治疗方法。虽然采用传统的细胞悬液或联合生物支架材料移植方法在修复受损组织取得一定的成功[1-2],但这两种技术仍存在一定缺陷,如单细胞悬液注射后细胞易发生吸收、扩散,难以留在治疗部位,且注射细胞量有限,修复效能较低[3];而支架材料常因移植部位炎症、自身免疫或者机械损伤等因素引起较高比例的细胞死亡或损失。自从Okano发明了不含支架材料的细胞膜片构建方法后,细胞膜片已作为细胞移植的一种新方法广泛应用于再生医学应用和研究。目前细胞膜片已应用于牙科、食管肿瘤术后、心肌缺血等领域[4-6]。而在生殖领域中的应用鲜有报道。人脂肪干细胞(adipose-derived stemcells,ADSCs)来源广泛,可自体取材,避免了免疫排斥问题;其具有一定的分泌、分化能力,且能提高修复组织的细胞活性,促进血管的再生[7];目前未见其移植后成瘤报道[8]。因此,本课题组选择了ADSCs作为种子细胞构建细胞膜片,在稳定构建人ADSCs膜片的基础上,对其基本生物学特性进行鉴定,并通过检测其分泌的促进组织再生的相关细胞因子探讨脂肪干细胞膜片应用于组织损伤修复的可行性。
材料和方法
1 采集样本 实验所用脂肪组织为唐都医院妇产科患者行腹部手术时获取,供者年龄25 ~ 35岁,排除乙肝和结核等传染病。所有样本均征得供者本人及家属同意并填写知情同意书后获取。
2 主要试剂和仪器 DMEM培养基(Gibco公司,美国);胎牛血清(四季青,中国);2.5 g/L胰酶(MP公司,美国);流式抗体(Biolegend公司,美国);Ⅰ型胶原酶、DMSO、地塞米松、β-甘油磷酸钠、茜素红、油红O(Sigma公司,美国);维生素C(Gibco公司,美国);成脂诱导液(Cyagen公司,美国);引物序列(上海生工生物工程股份有限公司);Elisa试剂盒(依科赛公司,中国);反转录试剂盒(Abcam公司,美国);酶标仪(MD,美国);流式细胞仪(BD公司,美国);PCR仪(Bio-Rad公司,美国);倒置显微镜(ZEISS公司,德国);细胞培养箱(Thermo公司,美国)。
3 分离培养人ADSCs 将取得的少量脂肪组织装入盛有PBS的无菌离心管中,用无菌PBS反复冲洗并剪去血污后,剪碎至1 mm3大小,加入0.25%的Ⅰ型胶原酶,37℃恒温摇床消化90 min,加等量含10% FBS以及1%双抗的DMEM/F12培养液终止消化,用100目和200目的筛网依次过滤,800 r/min 5 min离心2次,弃上清,加入DMEM/F12培养液制成细胞悬液,接种在25 cm2的培养瓶中,置于37℃、5%CO2的培养箱中培养,原代接种24 h后首次换液,洗去悬浮细胞碎片和杂质。之后隔日给细胞换液1次,每日观察细胞生长情况,待细胞贴壁生长至80% ~ 90%的融合度时,用0.25%的胰蛋白酶消化细胞并传代。
4 流式细胞术鉴定人ADSCs表面标记物 取第3代(P3)人脂肪干细胞,调整细胞浓度为5×105/ml,取6支流式管,向每支流式管中分别加入1 ml细胞悬液,800 r/min离心5 min,弃上清后,分别加入5μl相应流式抗体,抗体种类分别是CD29-PE、CD44-APC、CD45-percp-cy5.5、CD90-FITC、CD105-APC单克隆抗体,加入相应的同型抗体作为阴性对照,震荡混匀。4℃避光孵育30 min后,每管加入1 ml流式洗液清洗2次,800 r/min离心5 min弃上清,加入400 μl流式固定液,200目的筛网过滤去除杂质,用流式细胞仪检测人ADSCs相关的表面标记分子。
5 绘制ADSCs体外生长曲线 取P3 ADSCs,以2×103/孔的细胞密度分别接种于7块96孔板中,置入37℃、5% CO2的培养箱中培养,每24 h取出1块96孔培养板,按照CCK-8法检测试剂盒说明书加入10 μl的CCK-8,用酶标仪检测450 nm波长的吸光度值,并根据结果绘制细胞体外生长曲线。6 鉴定ADSCs多向分化能力 取P3 ADSCs,以2×104/孔的细胞密度接种于两块6孔板中,24 h细胞贴壁后,分别换成脂诱导培养液(含10%FBS,1%双抗,1 mol/L地塞米松,0.1 mmol/L吲哚美辛,10 mg/L胰岛素,0.5 mmol/L IBMX的DMEM/F12)和成骨诱导培养液(含10 nmol/L地塞米松、50μg/ml维生素C、10 mmol/Lβ-甘油磷酸钠、10% FBS、1%双抗的DMEM/F12)培养,之后隔日给细胞换液1次,进行成脂诱导的ADSCs连续培养7 d,油红O染色进行鉴定。进行成骨诱导的ADSCs连续培养21 d,茜素红染色鉴定。
7 构建ADSCs膜片 取P3 ADSCs,以1×106/孔的细胞密度接种于6孔板中,24 h细胞贴壁后,换添加维生素C和地塞米松的细胞膜片诱导培养液培养,之后隔日给细胞换液1次,连续培养10 ~ 14 d,观察细胞膜片形态。
8 扫描电镜观察ADSCs膜片结构 ADSCs被诱导成膜片后,弃诱导液,PBS冲洗两遍,用2.5%的戊二醛4℃固定24 h,标本送至第四军医大学口腔医院电镜中心扫描观察。
9 qRT-PCR检测细胞因子及干性基因mRNA表达 取P3 ADSCs和ADSCs膜片,用Trizol法提取细胞总RNA,检测RNA纯度及浓度合格后,反转录为cDNA,然后采用实时荧光定量PCR仪检测相关细胞因子及干性基因的mRNA的相对表达量,引物序列见表1。
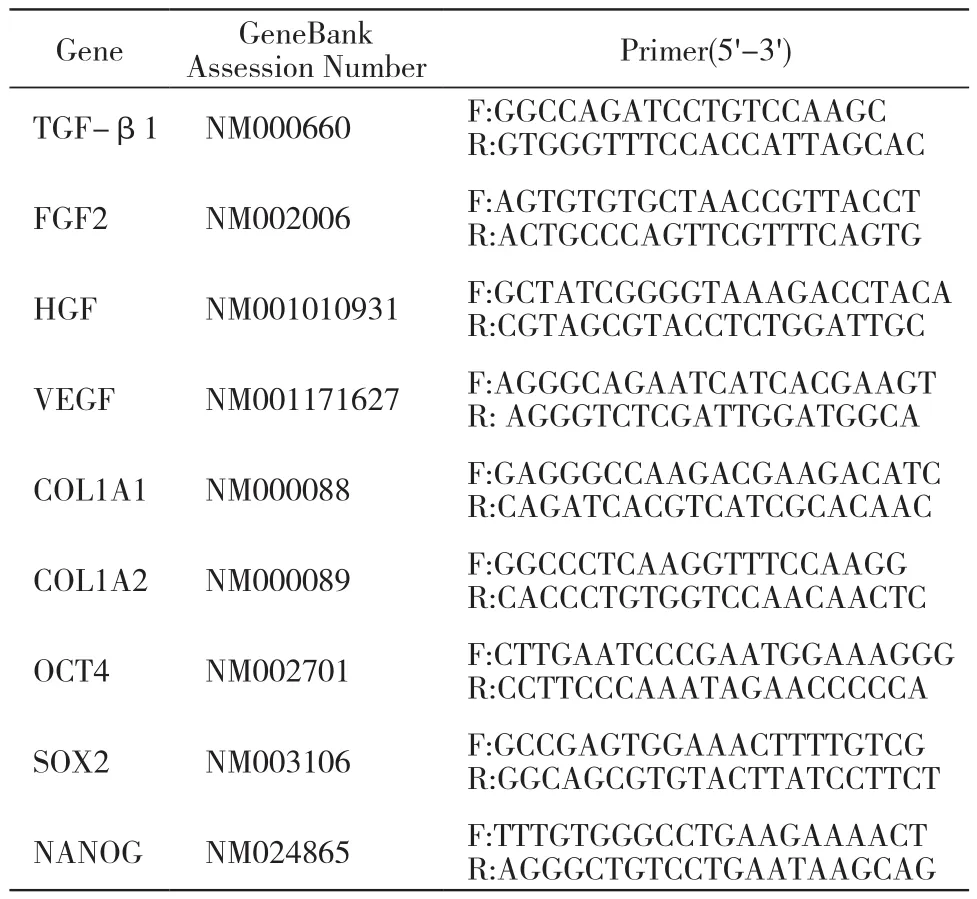
表1 实时荧光PCR引物Tab. 1 Primer for real-time PCR
10 ELISA法测定细胞因子浓度 取P3 ADSCs对数生长期的上清液和ADSCs成细胞膜片后上清液,用ELISA检测两种上清中细胞因子TGF-β1、FGF、HGF、VEGF的浓度。
11 统计学分析 采用SPSS 19.0软件进行统计分析,所有计量资料以-x±s表示,组间比较采用独立样本t检验进行分析。P<0.05为差异有统计学意义。
结 果
1 人ADSCs形态及生长曲线 ADSCs原代培养约4 h贴壁,24 h后细胞完全贴壁生长,体外分离培养的ADSCs生长状态良好,光学显微镜下可见原代ADSCs呈现短梭形、多角形(图1A)。P3代以后细胞大小形态基本均一,胞体狭长,呈成纤维细胞样(图1B)。ADSCs生长曲线成典型的S型,1 ~ 2 d为潜伏期,3 ~ 5 d进入对数生长期,继续培养至6 ~ 7 d进入平台期,随后进入衰退期(图1C)。
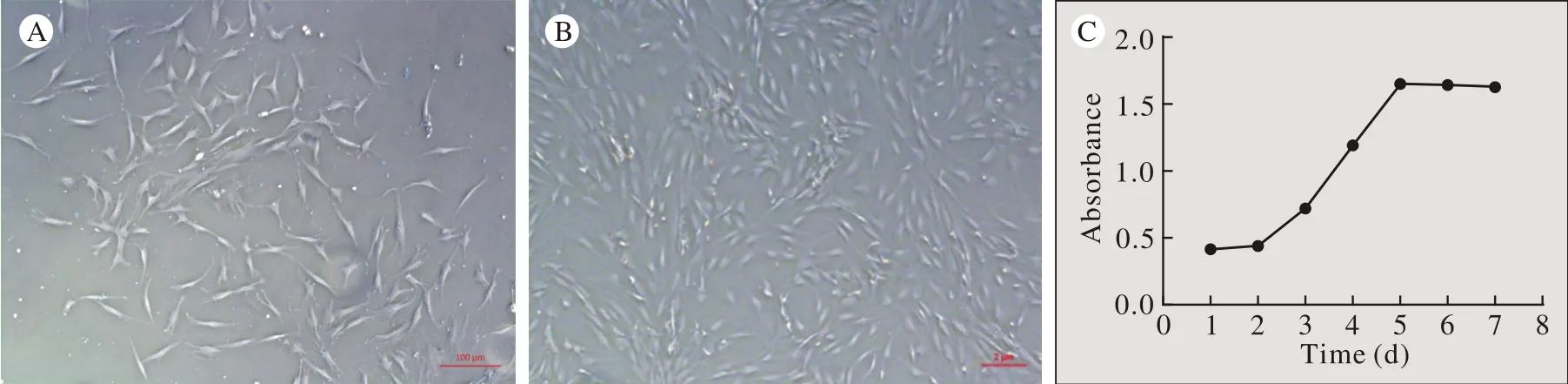
图1 人脂肪干细胞形态及生长曲线 A:原代脂肪干细胞(50ⅹ); B:第三代脂肪干细胞(50ⅹ); C: 脂肪干细胞生长曲线Fig. 1 Isolation and culture of ADSCs A: P0 ADSCs; B:P3 ADSCs; C: Growth curve of ADSCs
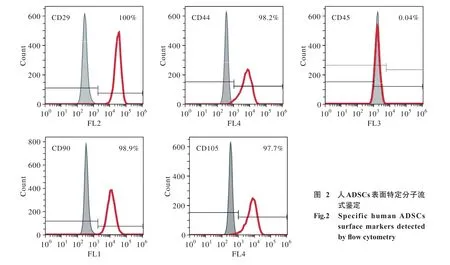
图2 人ADSCs表面特定分子流式鉴定Fig. 2 Specific human ADSCs surface markers detected by flow cytometry
2 人ADSCs表面特定分子检测结果 流式细胞仪检测显示人ADSCs的间充质干细胞表面标记分子CD29、CD44、CD90、CD105均为阳性;造血干细胞表面标记分子CD45表达阴性,结果符合人ADSCs表面特定分子的表达(图2)。
3 人ADSCs成脂诱导 人ADSCs经成脂诱导培养液连续培养7 d后,进行油红O染色,可见红色脂滴形成(图3A)。同样经过成骨诱导培养基连续培养21 d后,进行茜素红染色,细胞表面形成了红褐色矿化结节(图3B),结果提示人ADSCs具有多向分化能力。
4 构建人ADSCs膜片 对P3代ADSCs采用细胞膜片诱导培养液连续培养10 ~ 14 d,可获得白色膜状的细胞膜片,镜下观察可见膜片中的细胞呈长梭形重叠生长(图4A),成熟的细胞膜片可被轻轻刮下,且具有一定韧性和弹性(图4B)。

图3 脂肪干细胞体外分化能力鉴定A:成脂诱导7 d油红O染色(50ⅹ); B :成骨诱导21 d茜素红染色(100ⅹ)Fig. 3 Identification of differentiation potential ofADSCs in vitroA: Adipogenic differentiation of ADSCs was assessed by Oil Red staining (50ⅹ);B: Osteogenic differentiation of ADSCs was assessed by Alizarin Red Staining (100ⅹ)
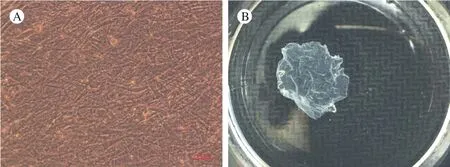
图4 人脂肪干细胞膜片A: 光镜下形态; B: 大体外观Fig. 4 Human ADSCs cell-sheetA: Microscopic image; B: Gross image
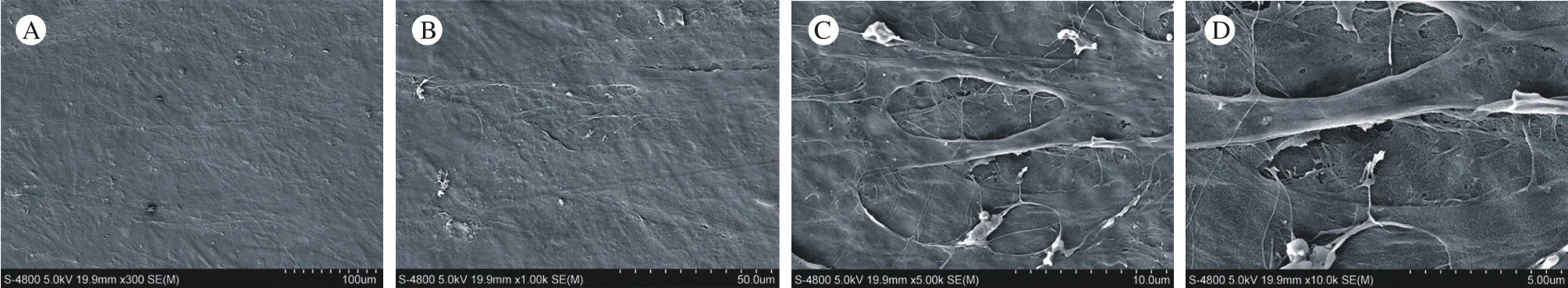
图5 人脂肪干细胞膜片扫描电镜下形态学观察A:300ⅹ; B:1 000ⅹ; C:5 000ⅹ; D:10 000ⅹFig. 5 Morphological observation of human ADSCs cell-sheet by scanning electron microscopeA:300ⅹ; B:1 000ⅹ; C:5 000ⅹ; D:10 000ⅹ
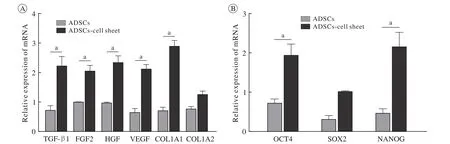
图6 比较人ADSCs和ADSCs膜片相关各细胞因子与干性基因mRNA表达量(aP<0.05)Fig. 6 Comparison of mRNA levels of cytokines and stem-related genes between human ADSCs and human ADSCs cell-sheet (aP<0.05)
5 人ADSCs膜片电镜下形态 细胞膜片表面光滑,膜片中的细胞呈网格样叠加生长,细胞之间相互连接紧密(图5),放大300倍和1 000倍都隐约可见细胞的轮廓(图5 A和图5 B),放大5 000倍和10 000倍能看到细胞与细胞之间连接成片的细胞外基质,以及膜片是由多层细胞叠加形成(图5 C和图5 D)。
6 比较人ADSCs和ADSCs膜片的相关细胞因子与干性基因mRNA相对表达情况 qRT-PCR检测结果显示,与人ADSCs相比,人ADSCs膜片的 TGF-β1、FGF2、HGF、VEGF、CoL1A1的mRNA表达水平显著升高(P均<0.05)(图6A)。同时人ADSCs膜片的干性基因OCT4及NANOG的mRNA水平也显著增高(P均<0.05)(图6B)。
7 比较ADSCs和ADSCs膜片的上清液细胞因子浓度 采用ELISA法检测两组的相关细胞因子浓度,结果显示人ADSCs膜片上清液中的促生长细胞因子TGF-β1、FGF、HGF、VEGF表达量显著高于ADSCs上清液(P<0.05)(图7)。
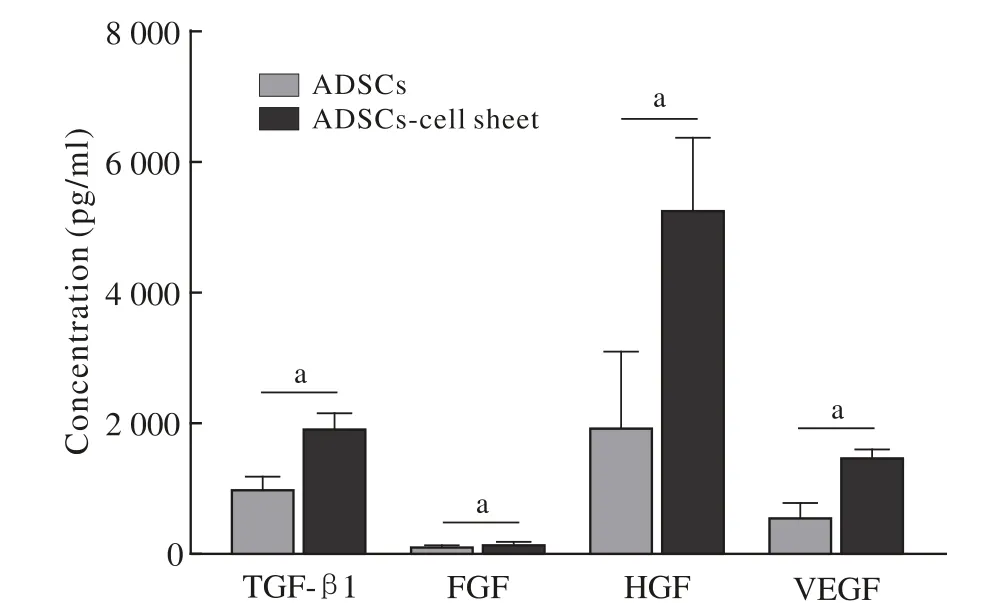
图7 比较人ADSCs和ADSCs膜片的上清液细胞因子浓度(aP<0.05)Fig. 7 Comparison of protein levels of cytokines concentrations in cell suspension between human ADSCs cell-sheet and human ADSCs (aP<0.05)
讨 论
细胞膜片技术的发明,为组织器官的修复和再生开辟了新的治疗前景。细胞膜片摒弃了传统的细胞支架材料载体模式,使细胞最大限度地发挥自身特性,提高细胞的生物活性,其自身形成的细胞外基质构建的内源性支架及特殊的微环境,对细胞的增殖、分化起着调节作用,从而促进组织的修复与再生[9-10]。有文献表明维生素C是细胞分泌胶原和其他所需要物质过程中的关键因子,能促进细胞外基质的合成和分泌,并且抑制细胞分化[11],维生素C联合地塞米松可使诱导培养的细胞膜片韧性和支持性更好[12]。因此本实验在完全培养基中加入活性因子维生素C和地塞米松,成功将人ADSCs诱导成细胞膜片,其具有较好的韧性和弹性。膜片经扫描电镜观察显示其表面光滑,由多层细胞构成,保留了细胞之间的紧密连接和细胞外基质的自然形态,此结果与以往文献报道一致[13]。虽然目前关于细胞膜片是否能够促进组织再生或修复及其作用机制尚未阐明[14],但根据其自分泌形式生成的能够刺激血管再生、减轻创面炎症反应、促进周围细胞增殖分化的细胞因子[15-16],我们推测细胞膜片能够有效促进受损组织的再生或修复。
TGF-β是目前公认的、最具代表性的促生长细胞因子,其在组织损伤的修复和更新中起重要作用,与伤口愈合过程密切[17-18]。伤口愈合是一个复杂的生物学活动,创伤发生初期,血小板释放富含TGF-β1和VEGF进入损伤部位,然后在TGF-β1的趋化作用下,成纤维细胞促进细胞外基质的合成。而胶原蛋白Ⅰ是参与创伤愈合过程的细胞外基质的主要成分之一,它既是细胞黏附、血管形成的主要支架和媒介,又是形成的细胞膜片的主要成分。因此,在伤口愈合的过程中,含有大量胶原蛋白Ⅰ的细胞膜片可以覆盖伤口,发挥促进伤口愈合的作用。VEGF和FGF2是目前已知最强的促细胞生成因子,FGF家族分子,如VEGF和FGF2,不仅能在伤口愈合中发挥重要作用,在诱导肉芽组织产生新生上皮组织和血管生成反应中也起着协同作用,可加速伤口愈合[19-20]。HGF能使所有组织和器官的细胞恢复再生能力,从而激发细胞活力。由此可见TGF-β1、FGF、HGF、VEGF在伤口的愈合过程中相互协同,共同促进伤口的愈合。我们的研究结果显示,TGF-β1、FGF2、HGF、VEGF在人ADSCs膜片中的表达显著上调,推测诱导产生的细胞膜片的修复功能强于单纯的人ADSCs。干细胞无限增殖和多向分化潜能也对伤口良好愈合有利。研究发现OCT4、SOX2、NANOG是3个重要的干细全能型基因,可维持干细胞自我更新、无限增殖和多向分化潜能,可作为干细胞的表面标记分子[21]。本实验qRTPCR研究结果中OCT4、NANOG在人ADSCs膜片的表达显著上调,可进一步推测诱导产生的细胞膜片具有较强的修复功能。
综上所述,本实验将分离纯化的人ADSCs成功诱导为ADSCs膜片,通过对ADSCs膜片形态和重要促生长细胞因子及干性基因的表达水平进行分析,我们推测诱导成的人ADSCs膜片具有较强的组织修复能力,为后续我们利用人ADSCs膜片进行组织工程修复工作奠定了实验基础,提供了理论依据。
1 Rodriguez J, Boucher F, Lequeux C, et al. Intradermal injection of human adipose-derived stem cells accelerates skin wound healing in nude mice[J]. Stem Cell Res Ther, 2015, 6 : 241.
2 Yoo JH, Shin JH, An MS, et al. Adipose-tissue-derived Stem Cells Enhance the Healing of Ischemic Colonic Anastomoses: An Experimental Study in Rats[J]. J Korean Soc Coloproctol, 2012,28(3): 132-139.
3 Haraguchi Y, Shimizu T, Sasagawa T, et al. Fabrication of functional three-dimensional tissues by stacking cell sheets in vitro[J]. Nat Protoc, 2012, 7(5): 850-858.
4 Zakharova L, Mastroeni D, Mutlu N, et al. Transplantation of cardiac progenitor cell sheet onto infarcted heart promotes cardiogenesis and improves function[J]. Cardiovasc Res, 2010, 87(1): 40-49.
5 Tsumanuma Y, Iwata T, Washio K, et al. Comparison of different tissue-derived stem cell sheets for periodontal regeneration in a canine 1-wall defect model[J]. Biomaterials, 2011, 32(25):5819-5825.
6 Ohki T, Yamato M, Ota M, et al. Application of regenerative medical technology using tissue-engineered cell sheets for endoscopic submucosal dissection of esophageal neoplasms[J]. Dig Endosc,2015, 27(2): 182-188.
7 Li Q, Zhang A, Tao C, et al. The role of SDF-1-CXCR4/CXCR7 axis in biological behaviors of adipose tissue-derived mesenchymal stem cells in vitro[J]. Biochem Biophys Res Commun, 2013, 441(3): 675-680.
8 MacIsaac ZM, Shang H, Agrawal H, et al. Long-term in-vivo tumorigenic assessment of human culture-expanded adipose stromal/stem cells[J]. Exp Cell Res, 2012, 318(4): 416-423.
9 Rozario T, DeSimone DW. The extracellular matrix in development and morphogenesis: a dynamic view[J]. Dev Biol, 2010, 341(1):126-140.
10 Kawanishi K, Nitta K. Cell sheet-based tissue engineering for mesothelial cell injury[J]. Contrib Nephrol, 2015, 185 : 66-75.
11 Ji AR, Ku SY, Cho MS, et al. Reactive oxygen species enhance differentiation of human embryonic stem cells into mesendodermal lineage[J]. Exp Mol Med, 2010, 42(3): 175-186.
12 Nakamura A, Akahane M, Shigematsu H, et al. Cell sheet transplantation of cultured mesenchymal stem cells enhances bone formation in a rat nonunion model[J]. Bone, 2010, 46(2): 418-424.
13 Deries M, Gonçalves AB, Vaz R, et al. Extracellular matrix remodeling accompanies axial muscle development and morphogenesis in the mouse[J]. Dev Dyn, 2012, 241(2): 350-364.
14 Intini G. Future approaches in periodontal regeneration: gene therapy, stem cells, and RNA interference[J]. Dent Clin North Am, 2010, 54(1): 141-155.
15 隆艳艳, 焦顺昌. mTOR抑制剂对炎症相关细胞因子分泌的影响[J]. 解放军医学院学报, 2015, 36(12): 1252-1254.
16 Paschos NK, Brown WE, Eswaramoorthy R, et al. Advances in tissue engineering through stem cell-based co-culture[J]. J Tissue Eng Regen Med, 2015, 9(5): 488-503.
17 宁江海, 刘洪臣, 潘和平, 等. 具有羟基磷灰石结合活性的拟TGF-β多肽分子的实验研究[J]. 军医进修学院学报, 2002,23(2): 101-103.
18 Pakyari M, Farrokhi A, Maharlooei MK, et al. Critical Role of Transforming Growth Factor Beta in Different Phases of Wound Healing[J]. Adv Wound Care (New Rochelle), 2013, 2(5):215-224.
19 梁春阳, 周定标. 颈动脉内膜切除术后再狭窄的相关细胞因子[J]. 军医进修学院学报, 2004, 25(6): 461-462.
20 刘镕, 赵琴平, 董惠芬, 等. TGF-β信号传导通路及其生物学功能[J]. 中国病原生物学杂志, 2014, 9(1): 77-83.
21 Pashaiasl M, Khodadadi K, Kayvanjoo AH, et al. Unravelling evolution of Nanog, the key transcription factor involved in selfrenewal of undifferentiated embryonic stem cells, by pattern recognition in nucleotide and tandem repeats characteristics[J].Gene, 2016, 578(2): 194-204.

