缺氧预处理对缺血性脑卒中大鼠的脑保护作用及H3R17me2表达的影响
杨 鹏, 吴世政, 侯 倩, 陈晓娟
在我国,脑卒中的年龄标准化患病率、发病率及死亡率分别为1114.8/10万人、246.8/10万人/年和114.8/10万人/年,其中缺血性脑卒中(ischemic stroke,IS)的发病者及患病者分别占69.6%和77.85%[1]。目前,IS的主要治疗措施是6 h以内的动静脉溶栓及血管内介入。尽管取得了明显的治疗效果,但是对于发病超过其治疗时间窗的患者,这些措施的治疗效果明显下降,出血风险明显增高。缺氧预处理(hypoxic precondition,HPC)是指低氧刺激后,机体对随后严重的缺氧/缺血性损伤耐受性增强的现象,但其具体机制尚未完全阐明。近些年来,自噬在脑缺血损伤中的作用得到越来越多关注,H3R17me2是AMPK-SKP2-CARM1自噬信号轴的关键蛋白,它表达量的多少提示着该信号通路的激活程度。本实验通过大鼠间歇性低压缺氧预处理及大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型的制备,观察大鼠的神经损伤及H3R17me2蛋白的表达变化,探讨缺氧预处理对缺血性脑卒中大鼠的脑保护作用及H3R17me2在其中扮演的角色。
1 材料与方法
1.1 实验相关试剂及仪器设备
1.1.1 实验主要试剂 大鼠用MCAO线栓(2432-5,北京西农科技有限公司);Nissol stain,焦油紫法(G1430,购自北京索莱宝科技有限公司);UltraSensitiveTM S-P超敏试剂盒(KIT-9710,福州迈新生物技术开发公司);DAB显色试剂盒(DAB-0031,福州迈新生物技术开发公司);高效RIPA组织/细胞裂解液(R0010,北京索莱宝科技有限公司);PierceTMBCA Protein Assay(货号:23225,Thermo Fisher scientific);Anti-Histone H3(asymmetric di methyl R17)抗体(ab194707,abcam);alpha tubulin Mouse Monoclonal 抗体(66031-1-Ig,Proteintech)。
1.1.2 实验仪器设备 青海大学高原医学研究中心低压氧舱;超速离心机(Eppendorf AG 22331Hamburg,德国);Bio-RAD xMark 10235(日本);Amersham Imager 600发光显像分析仪(日本)。
1.2 动物来源及分组 实验用纯系SPF级SD雄性大鼠,体重180~220 g,购自西安交通大学医学院实验动物中心,合格证号:No.61001700001958。随机分为正常对照(normal control,NC)组、假手术(sham operated control,SC)组、单纯缺氧预处理(hypoxic precondition,HPC)组、单纯梗死组(middle cerebral artery occlusion,M)组、缺氧预处理后梗死组(middle cerebral artery occlusion after hypoxic preconditioning,HM)组,每组12只大鼠。
1.3 缺氧预处理 将实验大鼠置于模拟海拔5000 m的低压氧舱,每天2 h,连续5 d。大鼠氧舱内放置期间不予饲料、饮水,出舱后正常饲养。
1.4 大鼠局灶缺血病理模型制备 参考Longa 法,加以改良。大鼠禁食12 h,10%水合氯醛氯化钠溶液(3 ml/kg)腹腔注射麻醉后,备皮、固定大鼠,碘伏消毒术野皮肤,手术剪颈部正中开一约1 cm小口,钝性分离皮下筋膜、肌肉等组织。暴露左侧颈总动脉以后,分离左颈总动脉及迷走神经,结扎左颈总动脉近心端,远心端留线备用。颈总动脉分叉处动脉夹夹闭该侧颈总动脉,在其稍近心端用显微剪剪一斜口,插入线栓,松开动脉夹,以适当角度将线栓插入该侧颈内动脉,从劲总动脉分叉处算起,进线栓深度16~18 mm时,可有轻微阻力感,提示插线栓成功,固定线栓,缝合皮肤及皮下组织,再次碘伏消毒。术后置于37 ℃恒温箱维持大鼠正常体温。
1.5 神经功能缺损评价 大鼠术后24 h行Longa 5级评分。0分:活动自如,无神经功能缺损症状功大鼠;4分:意识丧失,昏迷状态。剔除评分为0分、4分者,余者入组行后续操作。
1.6 脑组织形态学染色
1.6.1 冰冻切片 大鼠10%水合氯醛麻醉后,开胸,去除心包,暴露心脏,从心尖部进针,经左心室插入升主动脉,血管钳钳夹固定针头,打开输液器开关,待右心耳充盈后,剪开右心耳。0.9%氯化钠溶液内灌注, 直至左心耳开口处流出清亮液体后换成4%多聚甲醛PBS缓冲液(pH=7.4)灌注内固定。待大鼠尾部僵硬强直后,断头取脑,放置于4%多聚甲醛PBS缓冲液(pH=7.4)外固定。18 h后,序贯梯度蔗糖4%多聚甲醛脱水固定。常规冰冻切片,厚20 μm,4 ℃,保存于PBS缓冲液中。
1.6.2 尼氏染色 常规贴片,通风橱内晾片48 h,以蒸馏水体积/冰乙酸体积=1/1万的冰乙酸水溶液配成浓度0.001 g/ml的焦油紫染液,2000 r/min离心10 min,去除沉淀颗粒备用。切片在氯仿、无水乙醇、95%乙醇、70%乙醇各浸泡1 min,蒸馏水浸泡数秒,焦油紫37 ℃恒温、室温下各孵育15 min,蒸馏水洗涤2 min,95%酒精乙酸溶液分色,无水乙醇每次浸泡3 min,重复3次,二甲苯透明5 min,重复3次,中性树胶封片。晾干后,光镜下观察,梗死侧皮质、海马CA1区拍照。
1.6.3 免疫组织化学染色 采用冰冻切片漂片的SP法,具体步骤:(1)选取含有典型海马CA1区结构的脑片置于盛有PBS缓冲液(pH=7.4)的24孔板中洗涤3次,每次5 min;(2)吸净残余液体后,加入适量内源性过氧化物酶阻断剂室温下平摇30 min;(3)PBS缓冲液洗涤3次,每次5 min;(4)吸净残余液体,加入适量正常非免疫动物血清,室温平摇孵育1 h;(5)吸净残余液体,加入适量5% BSA稀释的一抗H3R17me2(1/300),4 ℃平遥50 r/min过夜;(6)室温复温2 h;(7)PBS缓冲液洗涤6次,每次5 min;(8)吸净残余液体,加入适量生物素标记的第二抗体室温平遥50 r/min孵育1 h;(9)PBS缓冲液150 r/min洗涤6次,每次5 min;(10)吸净残余液体,加入适量链霉菌抗生物素蛋白-过氧化酶,室温平遥50 r/min孵育30 min;(11)吸净残余液体,加入适量DAB显色液,显微镜下控制染色深度;(12)贴片,通风橱晾干;(13)梯度酒精脱水,二甲苯透明化,中性树胶封片;(14)光镜下观察,梗死侧皮质、海马CA1区拍照;(15)采用评分法半定量分析:按照染色深浅,将染色神经细胞分为弱阳性、中等阳性、强阳性,分别记弱阳性=1分、中等阳性=2分、强阳性=3分,每张照片评分=(弱阳性细胞数×1+中等阳性细胞数×2+强阳性细胞数×3)/该照片细胞总数。
1.7 大鼠脑组织蛋白提取 大鼠麻醉后断头取脑,取梗死侧皮质脑组织适量。剪碎后,以每10 mg组织加入100 μl 100/L浓度的高效 RIPA/PMSF 裂解缓冲液,超声破碎仪冰浴下打碎脑组织,直至样品中无粘稠状物悬浮。4 ℃下,12000 r/min离心10 min。BCA法蛋白定量,加入蛋白上样缓冲液煮沸10 min,分装、-80 ℃保存备用。
1.8 免疫印迹检测H3R17me2的表达 (1)每孔上样15 μg,行SDS-PAGE凝胶电泳,积层胶浓度5%,分离胶浓度10%;(2)电泳后切取目的条带胶段,恒流下200 mA转膜50 min,将目的蛋白H3R17me2、内参蛋白β-actin 转移到PVDF膜上;(3)新鲜配制的5% BSA封闭液室温封闭2 h后,加入封闭液稀释的目的蛋白H3R17me2(1/1000)、内参蛋白β-actin(1/8000)4 ℃,50 r/min平遥孵育过夜;(4)TBST(pH=7.4)洗涤PVDF膜7次,每次7 min后,分别加入相应二抗(山羊抗兔IgG 1/10000,山羊抗小鼠IgG 1/10000)室温50 r/min平遥孵育2 h;(5)TBST洗膜7次,每次10 min后,强效ECL发光液曝光,保存实验结果图片;(6)采用Image J软件对实验结果条带进行半定量分析。

2 实验结果
2.1 MCAO组与HM组大鼠Z-Longa神经功能缺失评分比较 MCAO造模手术后18 h行Z-Longa神经功能缺失评分。结果显示HM组大鼠评分明显小于MCAO组(P﹤0.05)。
2.2 各组大鼠皮质及海马CA1区尼氏染色 大脑皮质及海马CA1区尼氏染色结果显示:NC组、SC组、HP组神经元形态、数量及尼氏小体数量几无差别;与前者相比,HM组脑缺血区神经元数量明显减少,形态欠完整,可见少量细胞碎片,尼氏小体数量减少,染色变浅;与HM组相比,MCAO组几无完整神经元,神经元呈碎片化,尼氏小体明显减少,染色模糊不清(见图1)。
2.3 各组大鼠皮质及海马CA1区 H3R17me2免疫组化染色 免疫组化染色显示各组H3R17me2
评分数据统计发现差异有统计学意义(皮质:F=337.279,P<0.01;海马CA1区:F=256.159,P<0.01)。组间两两比较发现NC组与SC组染色评分未见明显差异(P>0.05),HP组、MCAO组、HM组与NC组相比,染色评分均增高(P<0.05),MCAO组较HM组染色评分高(P<0.05),HM组较HP组染色评分高(P<0.05)。提示缺氧预处理可以上调H3R17me2的表达,但是脑梗死处理上调效力要高于单纯缺氧预处理,而缺氧预处理后脑梗死的上调效力介于两者之间(见图2、见表1)。
2.4 各组大鼠左侧脑组织H3R17me2 的Western blot检测结果比较 Westernb blot 结果显示各组 H3R17me2灰度值与β-actin 灰度值比值数据统计发现有统计学意义(F=310.771,P<0.01)。组间两两比较发现NC组与SC组灰度值比值未见明显差异(P<0.05),HP组、MCPO组、HM组与NC组相比灰度值比值均增高(P<0.05),HP组较MCAO组增高更明显(P<0.05),HM组较HP组增高(P<0.05),HM组较MCAO组增高(P<0.05)。提示缺氧预处理可以上调 H3R17me2的表达,表现为缺氧预处理对H3R17me2上调效力大于脑梗死的上调效力。但是由于Western blot 结果未考虑存活细胞数量对蛋白定量结果的影响,导致与免疫组化结果的不同(见图3)。

表1 各组大鼠H3R17me2免疫组化染色评分
皮质评分:与NC组相比aP<0.05;与HP组相比bP<0.05;与M组相比cP<0.05;海马评分:与NC组相比dP<0.0;与HP组相比eP<0.05;与M组相比fP<0.05
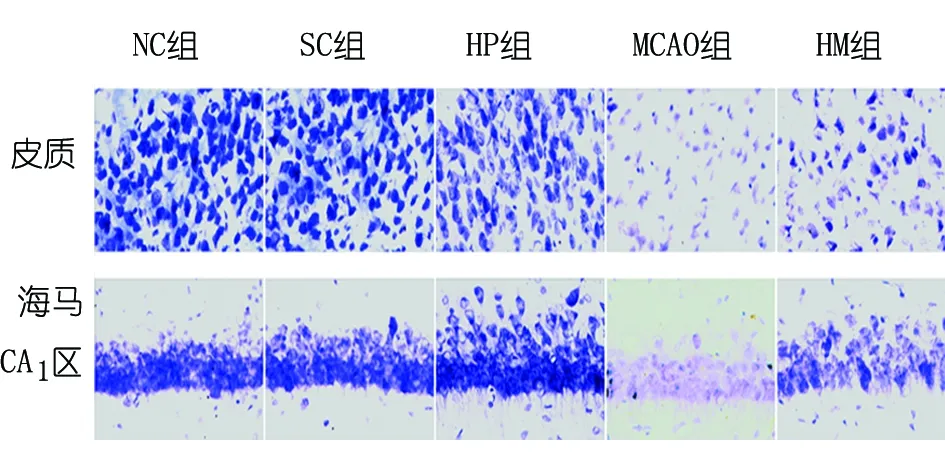
图1 各组大鼠尼氏染色
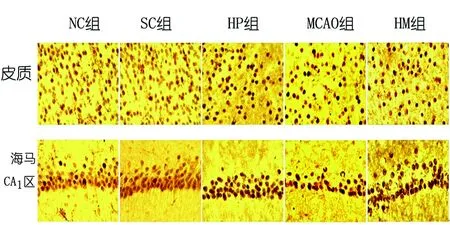
图2 各组大鼠H3R17me2免疫组化染色
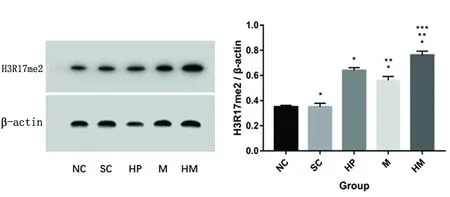
图3 各组大鼠脑组织Western blot的H3R17me2蛋白表达
3 讨 论
本研究运用低压氧舱模拟了海拔5000米高原地区间断的缺氧预处理,验证了HPC对成年大鼠局灶性脑缺血的神经保护作用及其可能作用机制。(1)HPC可逆转MCAO手术对大鼠皮质及海马CA1区的神经功能及组织形态上的损伤;(2)HPC可以下调MCAO手术后皮质及海马CA1区H3R17me2蛋白的表达。
HPC被认为是一种亚致死性的低氧暴露介导的可以减少随后的严重缺血带来的损伤的内源性脑保护作用。在细胞、组织、动物、临床层面都观察到了HPC的这种神经保护作用[2~4]。研究表明,脑缺血后自噬系统被激活[5~9]。有研究发现在短暂性全脑缺血(transient global cerebral ischemia,tGCI)后海马CA1区自噬体及增多和LC3-Ⅱ蛋白上调,但在缺氧预处理后这种趋势却被逆转[10]。AMPK-SKP2-CARM1信号轴能调节自噬相关基因的转录,同时CARM1依赖的精氨酸甲基化及H3R17me2蛋白的形成是自噬过程中的一个关键细胞核事件[11]。在营养饥饿的情况下,AMPK-SKP2-CARM1信号轴被激活,导致H3R17me2蛋白的表达上调,从而使一些自噬/溶酶体基因表达上调[11]。
我们通过在体的动物实验,从分子及组织细胞学层面,运用低压氧舱模拟高原低氧环境对MCAO手术后大鼠短期间断低压缺氧预处理,发现高原HPC对局灶性缺血大鼠确有神经保护作用。同时发现AMPK-SKP2-CARM1信号轴可能参与了HPC对MCAO手术后大鼠的神经保护作用,提示运用该通路的阻断剂如ellagic acid[12],可能模拟HPC对该通路的阻断作用,从而产生相似的神经保护作用。为临床药物的研发提供一些启发。
[1]Wang W,Jiang B,Sun H,et al.Prevalence,incidence and mortality of stroke in China:results from a nationwide population-based survey of 480,687 adults[J].Circulation,2017,135(8):759.
[2]Ruscher K,Isaev N,Trendelenburg G,et al.Induction of hypoxia inducible factor 1 by oxygen glucose deprivation is attenuated by hypoxic preconditioning in rat cultured neurons[J].Neuroscience Letters,1998,254(2):117-120.
[3]Peerez-Pinzan MA,Mumford PL,Rosenthal M,et al.Anoxic preconditioning in hippocampal slices:role of adenosine[J].Neuroscience,1996,75(3):687-694.
[4]Bernaudin M,Nedelec AS,Divoux D,et al.Normobaric hypoxia induces tolerance to focal permanent cerebral ischemia in association with an increased expression of hypoxia-inducible factor-1 and its target genes,erythropoietin and VEGF,in the adult mouse brain[J].Journal of Cerebral Blood Flow & Metabolism Official Journal of the International Society of Cerebral Blood Flow & Metabolism,2002,22(4):393.
[5]Gabryel B,Kost A,Kasprowska D.Neuronal autophagy in cerebral ischemia-a potential target for neuroprotective strategies[J].Pharmacological Reports Pr,2012,64(1):1.
[6]Uchiyama Y,Koike MM.Autophagic neuron death in neonatal brain ischemia/hypoxia[J].Autophagy,2008,4(4):404.
[7]Lei YC,Shi-Zheng WU,Zhang SK,et al.Research of the treatment on neural stem cells of bone marrow by hypoxia preconditioning joint with BDNF on cerebral infarction in rats[J].Chinese Journal of Stroke,2016,11(5):360-367.
[8]Chen J,Shi-Zheng WU,Zhang SK.Expression of ASPP1 and VEGF in rat brains at various altitudes and the correlation between cerebral reserve capacity and their expression[J].Practical Preventive Medicine,2011,18(4):720-723.
[9]胡潇方,吴世政,张淑坤,等.miR-181c对缺氧预处理大鼠卒中的脑保护作用机制[J].中华神经科杂志,2013,46(11):751-754.
[10]Zhan L,Chen S,Li K,et al.Autophagosome maturation mediated by Rab7 contributes to neuroprotection of hypoxic preconditioning against global cerebral ischemia in rats[J].Cell Death & Disease,2017,8(7):e2949.
[11]Shin HJR,Kim H,Oh S,et al.AMPK-SKP2-CARM1 signalling cascade in transcriptional regulation of autophagy[J].Nature,2016,534(7608):553.
[12]Selvi BR,Batta K,Kishore AH,et al.Identification of a novel Inhibitor of coactivator-associated arginine methyltransferase 1(CARM1)-mediated methylation of histone H3 Arg-17*[J].Journal of Biological Chemistry,2010,285(10):7143-7152.

