一种原代小胶质细胞培养与纯化方法的改良
徐蛟天, 边立功, 张 琰, 王 威, 陈孝祥, 陈鑫月, 李 庆, 邓兴力
小胶质细胞是中枢神经系统主要的胶质细胞之一,其数量约占总胶质细胞总数的10%~20%,是中枢神经系统的固有免疫细胞,具有吞噬细菌、抗原呈递、产生细胞因子和补体的能力[1],呈现与外周巨噬细胞最相似的结构和功能[2,3]。近年大量研究表明小胶质细胞在中枢神经系统的损伤和疾病中,如阿尔茨海默症、帕金森病等,起着非常重要的作用[4,5]。
通过以小胶质细胞为靶点研究神经退行性疾病,已成为病理机制研究潜在的突破方向[6]。目前,用于小胶质细胞培养的方法有震摇分离法[7]、营养剥夺法[8]、温和胰酶消化法[9]及用马血清进行培养得到富含小胶质细胞的原代培养方法[10]。原有的分离纯化方法产量低、周期长,难以满足实验需要。因此,如何获取高产量、高纯度的原代小胶质细胞,已成为以小胶质细胞为靶点的研究成败的关键和基础。为此本研究拟通过改良传统小胶质细胞培养与纯化方法,进一步优化小胶质细胞培养方案,以获取高产量以及纯度的小胶质细胞。
1 材 料
1.1 动物及主要设备 健康SPF级新生Spraque-Dawley(SD)大鼠,购自昆明医科大学动物实验中心,细胞培养箱(Thermo)、酶标仪(Bio-Tek)、正置、倒置荧光显微镜(Olympus)。
1.2 实验材料及试剂 细胞培养耗材(Corning)、LPS(sigma)、DMEM/High glucose(HyClone)、Alex-Fluor 594-conjugated Goat Anti-Rabbit IgG(Proteintech)、488-conjugated Donkey Anti-Mouse IgG(Proteintech)、青-链双抗(PS,Invitrogen)、CD11b/c polyclonal Antibody(Proteintech,Source:Mouse)、Iba1 polyclonal Antibody(Proteintech,Source:Rabbit)、 FBS(BI)、L-Glutamine(Gibco)。DAPI(Beyotime)、抗荧光淬灭封片剂(Beyotime)、D-Hanks液(HyClone)、0.25%胰酶(Solarbio)。
2 方 法
2.1 取材和培养 取新生(24~48 h)SD大鼠5只,冰冻麻醉后,75%酒精浸泡消毒,剪取头颅,置于冷D-Hanks液清洗并剪除颅骨取出脑组织,解剖显微镜下去除小脑、嗅球及脑干,分离海马及中脑并尽量剥除脑膜,细刷轻微扫除残余脑膜及出血点,仅留取大脑皮质。收集大脑皮质,D-Hanks液清洗后移至盛有3 ml D-Hanks液的培养皿,剪碎至≤1 mm3,平均移至3个15 ml规格离心管,等体积加入0.125%胰蛋白酶消化,37 ℃培养箱消化10 min(中间可吹打助消化),待消化液粘稠状消失,呈均匀乳白色,每个离心管等体积加入含10% FBS的小胶质细胞培养基终止消化,200目滤网过滤,去除未消化完全的组织,1000 r/min,离心5 min,弃上清,小胶质细胞完全培养基重悬,红细胞计数板计数,调整密度,以5×106密度接种于T25 cm2Flask,4 ml/瓶。37 ℃、5% CO2培养箱培养,待大部分悬浮细胞贴壁后(一般4~8 h),全量换液,更换含20% FBS小胶质细胞完全培养基,倒置显微镜每天观察细胞生长状态,根据细胞代谢情况2~3 d半量换液(第一次换液至第2次换液之间可间隔至5 d)。待细胞铺满瓶后可更换含10% FBS小胶质细胞完全培养基,培养至7~10 d可收获纯化。小胶质细胞完全培养基(DMEM/High glucose,10% FBS,1% PS,1% L-Glutamine,配制后4 ℃保存2 w)。
2.2 不同方法纯化并计算小胶质细胞纯度及产量
2.2.1 手拍法纯化小胶质细胞纯化 混合胶质细胞培养7~10 d,倒置显微镜下观察,可见细胞呈分层生长,小胶质细胞呈较强折光性,半贴壁或者悬浮生长,纯化前1 d,半量换液。手拍前,先轻柔吸除2 ml培养基,手拍法轻柔拍下上层小胶质细胞,见培养基出现大量悬浮细胞时,收集细胞悬液,计数,以8×105个/ml密度接种多聚赖氨酸包被的24孔板爬片,37 ℃、5%CO2培养箱培养,待细胞贴壁后,去除多余培养基,1~2 d后鉴定。根据后续实验细胞需要量,更换含(10%~20%)FBS培养基,3~4 d可再次收集纯化。
2.2.2 分别用温和胰酶法、摇床法纯化小胶质细胞,具体操作参考文献[3,7,9]。
2.3 细胞免疫荧光染色 分别取纯化后细胞,PBS清洗2次×1 min,含4%多聚甲醛的磷酸缓冲液(PB)固定20 min,PBS清洗2次×5 min,0.1%的PBST(Triton X100+PBS)透膜15 min,10%的山羊血清封闭2 h,加一抗CD11b/c(1∶300),Iba1(1∶300),4 ℃孵育过夜,弃一抗,PBS清洗3次×5 min。避光操作,二抗Alex-Fluor594(1∶100),Alex-Fluor488(1∶100)室温孵,1.5 h,DAPI(2.5 μg/ml)孵育5 min,捞取爬片,封片剂封片,晾干后正置显微镜下拍照。

3 结 果
3.1 小胶质细胞混合培养 小胶质细胞混合培养第3天可从形态上辨认出小胶质细胞,部分小胶质细胞伸出突触(见图1A箭头所指),但大部分小胶质细胞处于增殖期,形态上表现为圆形(见图1A)。细胞培养至第5天,细胞呈分层生长,下面以星形胶质细胞为主伴有其他类型的胶质细胞以及成纤维细胞,上层胞体较小,折光性较强,呈半悬浮或者悬浮生长,圆形或者少数有突触伸出的为小胶质细胞(见图1B箭头所指),细胞培养至第7天,细胞密度明显增加,可见小胶质细胞成簇聚集生长,表现出密度依赖性(见图1C)。细胞培养至第9~11天,细胞完全铺满瓶底可收集纯化。
3.2 小胶质细胞纯化 取混合培养第10天细胞,纯化接种1 d后,大部分细胞处于静息状态,形态表现为梭形、杆状等不规则形态,部分细胞可见1~2个较长突起(见图1D)。
3.3 小胶质细胞鉴定 细胞免疫荧光,小胶质细胞特异性抗体CD11b/c、Iba1双染鉴定为阳性,小胶质细胞阳性率>96%。绿色荧光为CD11b/c阳性细胞(见图2A);红色荧光为Iba1阳性细胞(见图2B);黄色荧光为CD11b/c、Iba1双阳性细胞(见图2C);蓝色荧光为DAPI阳性细胞核(见图2A~C)。
3.4 不同纯化方法小胶质细胞纯度及产量计数
3.4.1 不同纯化方法小胶质细胞鉴定 小胶质细胞混合培养第10天,分别用手拍法、温和胰酶消化法以及摇床法分别纯化小胶质细胞。细胞免疫荧光染色鉴定,3种纯化方法均可纯化产生CD11b/c阳性细胞(见图3A~C)。
3.4.2 不同方法纯化小胶质细胞细胞计数 细胞计数结果显示:(1)手拍法与温和胰酶法纯化小胶质细胞其细胞产量明显高于摇床法(见图4A);(2)手拍法纯化小胶质细胞纯度明显高于温和胰酶法,而与摇床法无显著差异(见图4B)。

图1 小胶质细胞混合培养。A:细胞培养第3天;B:细胞培养第5天;C:细胞培养第7天;D:细胞纯化后1 d。bar=20 μm
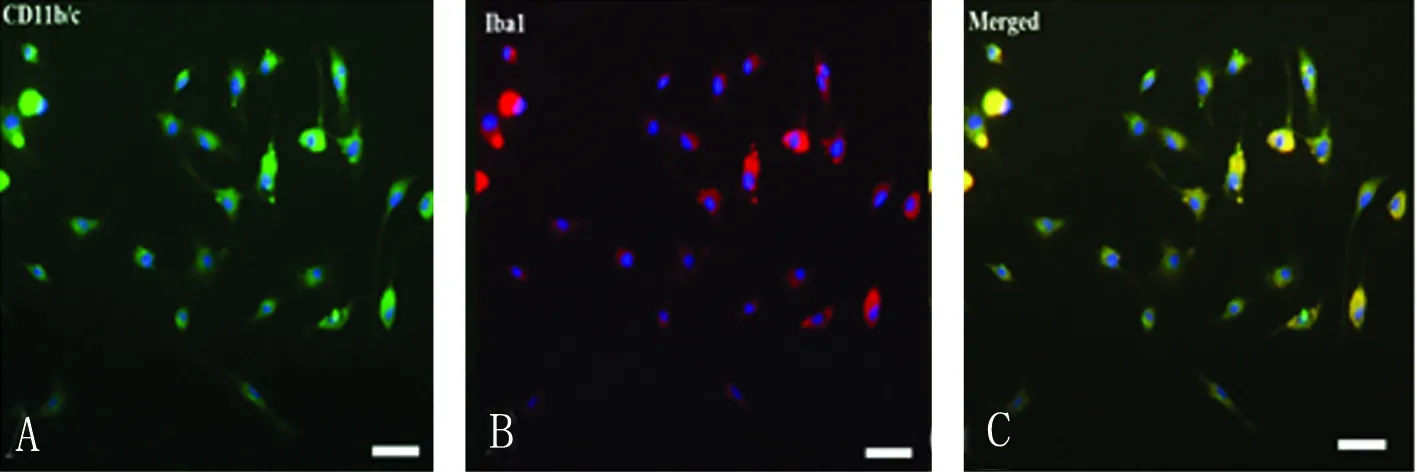
图2 小胶质细胞鉴定。A:CD11b/c阳性细胞;B:Iba1阳性细胞;C:CD11b/c、Iba1双阳性细胞。bar=50 μm
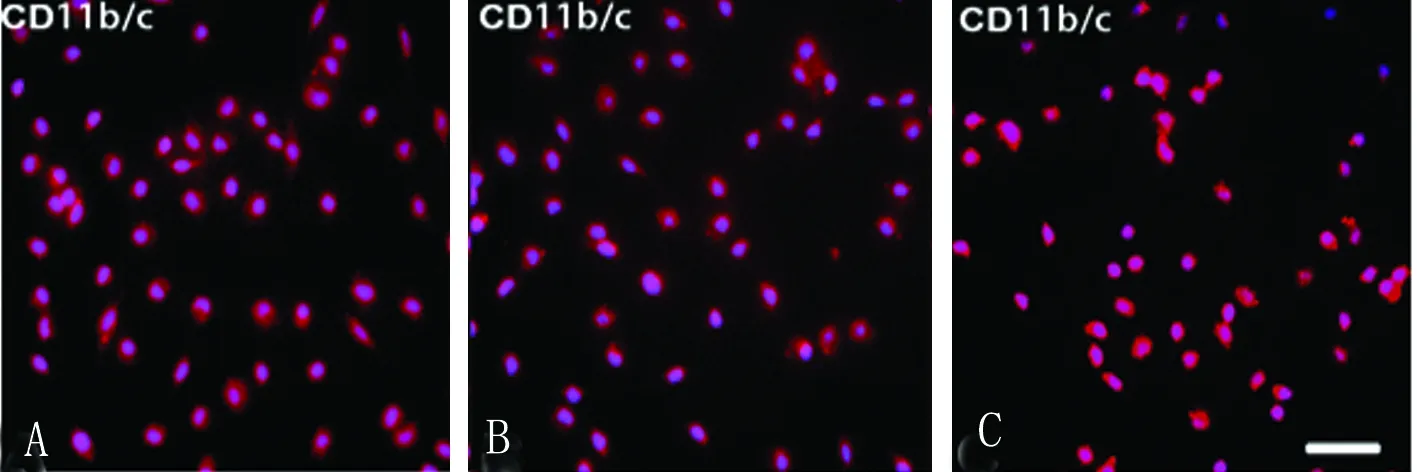
图3 不同方法纯化小胶质细胞免疫荧光鉴定。A:手拍法;B:温和胰酶法;C:摇床法。bar=50 μm
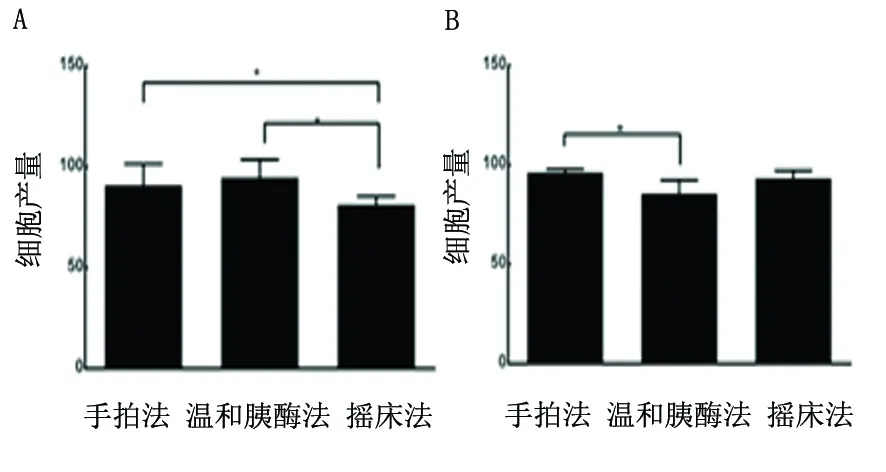
图4 不同方法纯化小胶质细胞细胞计数。A:细胞产量;B:细胞纯度*P<0.05
4 讨 论
小胶质细胞(microglia)是中枢神经系统(central nervous system,CNS)中内特有的具有免疫功能的细胞[11],从形态及生理学功能上将小胶质细胞归类为CNS的巨噬细胞,是脑从数量上小胶质细胞占中枢神经系统中整个胶质细胞数目的5%~20%[12]。有研究表明,小胶质细胞是最早对CNS损伤做出反应的细胞,静息状态下的小胶质细胞可以通过神经营养因子的分泌促进神经元的成熟发育[11],而过度激活的小胶质细胞则引发一系列炎症反应损伤神经元[13]。现代临床研究证明神经性炎症,特别是中枢神经系统长期存在的慢性炎症对帕金森为代表的一类神经退行性疾病的发生发展具有重要影响作用[2]。而此过程中,小胶质细胞的过度活化以及引起的一系列免疫反应在此类疾病病程进展中起到关键作用[14]。
因此,以小胶质细胞为靶点,通过抑制小胶质细胞活化,从而控制中枢神经系统炎症,已成为帕金森病等神经退行性疾病机制研究潜在的突破方向。而如何建立一种高效的小胶质细胞培养方法来获取高产量、高纯度以及活性稳定的小胶质细胞,已成为此项研究成败的关键和基础。
传统的原代小胶质细胞的方法多是参考McCarthy等方法,选取出生1~4 d内的新生鼠培养小胶质细胞,国内也有部分学者选用出生前胎鼠[15]。而我们认为用出生24 h新生鼠培养小胶质细胞效果最佳,此时的鼠大脑的脑膜及血管最易剥离,且脑皮质区出血点最少。通过大量实践我们在传统小胶质细胞培养方法的基础上做如下改进:(1)取材,去除脑干、中脑以及嗅球,只留取皮质部分;(2)消化过程中可通过增加胰酶用量减低胰酶浓度,与分多管消化相结合的方式缩短组织消化时间;(3)适当增加小胶质细胞的接种密度(1×106个/ml);(4)采用手拍法与加差速贴壁相结合的方式纯化小胶质细胞。在小胶质细胞整个培养过程中,我们认为脑组织的消化程度和第一次更换培养基时间点的把握是决定小胶质细胞纯度和产量的关键。一方面,脑组织消化时间不够,大量未消化完全的组织块被过滤而降低了混合悬浮细胞的产量;另一方面,胰酶的过度消化则影响小胶质细胞的贴壁能力不利于细胞的贴壁。我们的实践认为,把胰酶消化时间控制在10 min之内,第一次更换培养基时间在接种后3~4 h,培养可获取较高的小胶质细胞产量及纯度。混合胶质细胞培养细胞在培养第3天就可在形态上辨认出小胶质细胞(见图1A,箭头所指),细胞培养至第5天,可见折光性较强的小胶质细胞成簇生长,形态多为圆形(见图1B,箭头所指);细胞培养至第7天,可见折光性较强的小胶质细胞密度进一步增大,细胞呈半贴壁生长,部分细胞处悬浮状态,部分贴壁生长的小胶质细胞呈现出长梭形、分枝状等形态(见图1C,箭头所指)。细胞培养10~14 d,可见混合细胞铺满平底,且有大量折光性较强的细胞处于悬浮状态,此时可用于分离纯化,进行下一步实验。在改良培养方法的基础上,通过不同的纯化方法获取小胶质细胞,我们发现相同的培养条件下,手拍法与温和胰酶消化法均可获取较高的细胞产量,但前者获取的细胞纯度更高。而摇床法的细胞产量相比较前两者产量均较低(见图4)。实践表明,用手拍法与差速贴壁法相结合的方式,省去离心这一步操作可减少离心对细胞的损伤,同时可避免离心过程造成细胞数量上的损失。细胞在纯化后8~10 h可见细胞伸出突触,呈长梭形、分枝状等典型形态(见图1D)。小胶质细胞特异性抗体CD11b/c、Iba1双染鉴定为阳性,小胶质细胞阳性率>95%(见图3A~C)。
因此我们认为,在改良传统小胶质细胞培养的基础上,再通过优化纯化方法,用手拍法与差速离心相结合的方式可获取更高纯度以及产量的小胶质细胞。可有效满足于基于小胶质细胞为实验对象的各种实验,特别是以小胶质细胞为靶点,炎症相关以及神经保护方面与帕金森病相关的研究。但是,本研究发现,纯化后的小胶质细胞在随着培养时间延长以及传代后,细胞的质量出现明显降低,这可能与纯化后缺少其他胶质细胞分泌神经营养因子有关。如何在提高纯度和产量的同时进一步延长纯化后小胶质细胞的生存时间还需进一步的研究和探讨。
[1]孔惠敏,甘 娜,尹 飞,等.体外小胶质细胞活化及mrp8表达关系的研究[J].中风与神经疾病杂志,2013,12(30):1060-1063.
[2]Crotti A,Ransohoff RM.Microglial physiology and pathophysiology:Insights from genome-wide transcriptional profiling[J].Immunity,2016,44(3):505-515.
[3]Banati RB.Neuropathological imaging:In vivo detection of glial activation as a measure of disease and adaptive change in the brain[J].Br Med Bull,2003,65:121-131.
[4]Ransohoff RM,El Khoury J.Microglia in health and disease[J].Cold Spring Harb Perspect Biol,2015,8(1):a020560.
[5]Hong ZY,Shi XR,Zhu K,et al.Scm-198 inhibits microglial overactivation and attenuates abeta(1-40)-induced cognitive impairments in rats via jnk and nf-small ka,cyrillicb pathways[J].J Neuroinflammation,2014,11:147.
[6]Alam Q,Alam MZ,Mushtaq G,et al.Inflammatory process in Alzheimer’s and Parkinson’s diseases:Central role of cytokines[J].Curr Pharm Des,2016,22(5):541-548.
[7]Giulian D,Baker TJ.Characterization of ameboid microglia isolated from developing mammalian brain[J].J Neurosci,1986,6(8):2163-2178.
[8]Hao C,Richardson A,Fedoroff S.Macrophage-like cells originate from neuroepithelium in culture:Characterization and properties of the macrophage-like cells[J].Int J Dev Neurosci,1991,9(1):1-14.
[9]Saura J,Tusell JM,Serratosa J.High-yield isolation of murine microglia by mild trypsinization[J].Glia,2003,44(3):183-189.
[10]Colton CA,Yao J,Taffs RE,et al.Abnormal production of interleukin-1 by microglia from trisomy 16 mice[J].Neurosci Lett,1991,132(2):270-274.
[11]Chen Z,Trapp BD.Microglia and neuroprotection[J].J Neurochem,2016,136(Suppl 1):10-17.
[12]Hwang IK,Park JH,Lee TK,et al.Cd74-immunoreactive activated m1 microglia are shown late in the gerbil hippocampal ca1 region following transient cerebral ischemia[J].Mol Med Rep,2017,15(6):4148-4154.
[13]徐蛟天,陈孝祥,邓兴力,等.Nurr-1对小胶质细胞微环境的影响[J].神经解剖学杂志,2017,33(2):160-166.
[14]Solano FR,Mahesula S,Apple DM,et al.Neurogenic niche microglia undergo positional remodeling and progressive activation contributing to age-associated reductions in neurogenesis[J].Stem Cells Dev,2016,25(7):542-555.
[15]张 敏,魏桂荣,梅元武,等.三种小胶质细胞培养方法比较[J].脑与神经疾病杂志,2005,13(2):97-99.

