响应面法优化金针菇液体发酵培养基
陈 敏 ,洪家丽 ,雷雅婷 ,陈岚彬 ,陈永芳 ,万旭志 ,龚世禹 ,刘艺琳 ,余晓丹 ,曾 峰 , 刘 斌 ,3
(1.福建农林大学食品科学学院,福建福州 350002;2.国家菌草工程技术研究中心,福建福州 350002;3.福建农林大学生命科学学院,福建福州 350002)
真菌中含有丰富的生物活性物质,如真菌多糖、多肽、氨基酸、蛋白质、生物碱、萜类化合物、色素类化合物、甾醇,还有核苷类物质、酚、酯类、微量元素和维生素等[1],是保健产品研究和开发的主要原料之一,其中金针菇以超高的保健价值和营养价值吸引人们的眼球。液体深层发酵是获得食用菌菌丝体的主要方法,具有液体发酵周期短、工业化生产所需空间小、产量高等优点[2],比子实体的培植更适合工业化生产。研究发现,从液体发酵获得金针菇菌丝体中提取的多糖有抗氧化[3-7]、提高免疫力[8-10]、抗肿瘤[5,11]等作用。在临床试验中,食药用菌菌丝体多糖类活性物质无副作用[12]。菌丝体中的多糖含量也明显高于子实体[13],同时菌丝体多糖的抗氧化活性也大于子实体多糖[14]。目前,真菌液体发酵的研究主要集中于通过对培养基组成、培养条件的优化来提高菌丝得率及其他代谢产物。果蔬汁中富含维生素、氨基酸和矿物质等,添加到培养基中作为氮和碳的补充来源,不仅有利于促进菌丝体生长,提高营养价值和改善风味,还能极大地降低成本,扩大工业生产。为了进一步提高菌丝体得率,应用响应面分析法,以金针菇菌丝生物量作为优化响应值,通过葡萄糖、蛋白胨、KH2PO4和果蔬汁对液体发酵培养基进行优化,以期为食用菌液体发酵果蔬汁提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 菌种
金针菇菌株,福建农林大学国家菌草工程技术研究中心提供,每2个月传代1次,于4℃条件下保藏。
1.1.2 仪器与设备
SW-CJ-2D型超净工作台,苏州净化设备有限公司产品;AL204型电子天平,梅特勒-托利多仪器有限公司产品;YXQ-LS-50SⅡ型立式压力蒸汽灭菌器,上海博迅实业有限公司产品;101-3A型烘箱,广州科域新材料科技有限公司产品;SKY-2102C型立式双层低温摇床,上海苏坤实业有限公司产品;SHZ-D III型循环水真空泵,巩义市予化仪器有限责任公司产品。
1.1.3 培养基
果蔬汁:胡萝卜汁与梨汁比例为1∶1;金针菇液体发酵培养基:葡萄糖20 g/L,蛋白胨3 g/L,KH2PO43 g/L,MgSO4·7H2O 1 g/L,果蔬汁10%(V/V),pH值自然。
1.2 方法
1.2.1 液体菌种的制备
选取经过活化后的金针菇菌种制备液体菌种。在250 mL的三角瓶中装入100 mL的液体培养基,使用一次性接种针勾取0.5 cm2大小的菌种接种于瓶中,重复操作接种5~6次,最后用脱脂棉塞封住三角瓶口,调整旋转式摇床转速为200 r/min,在25℃的条件下振荡培养三角瓶7 d,备用。
1.2.2 培养基优化
取第1步中振荡培养完成的菌种作为一级菌种,使用一次性接种针接种于100 mL的液体培养基中,接种量10%,继续在200 r/min旋转式摇床上于25℃的条件下培养7 d,根据响应面分析法中Box-Behnken中心组合设计的原理,采用Design-Expert(Version 8.0.6.1)分析软件设计进行四因素三水平的响应面分析试验[15-16]。以菌丝体干质量为考查指标,确定各因素对菌丝体影响的显著性和液体发酵培养基最佳条件。
金针菇液体发酵试验因素水平及编码见表1。

表1 金针菇液体发酵试验因素水平及编码/%
1.2.3 测定方法
菌丝生物量:取发酵液在4℃条件下以转速10 000 r/min离心10min,收集沉淀物,去离子水洗涤3次,置于已称质量的干净培养皿上,于真空干燥箱中在60℃条件下烘干至恒质量,称质量2次差距不超过0.2mg即为菌丝生物量[17]。
2 结果与分析
采用响应面分析法中Box-Behnken设计法,以深层发酵得到的菌丝生物量为指标,对金针菇菌丝体生长过程中液体果蔬培养基的各组分进行优化研究。第4,8,9,11次试验为中心点试验,用于考查模型的误差。其中,第21组菌丝生物量最少,为8.175 mg/mL;第 24组菌丝生物量最多,为21.335mg/mL。
响应面中心组合设计金针菇发酵试验及结果见表2。

表2 响应面中心组合设计金针菇发酵试验及结果
2.1 金针菇菌丝生物量方差分析结果
采用 Design-Expert(Version 8.0.6.1) 分析软件对表2中金针菇菌丝生物量的各项数据进行多项式拟合回归,建立四元二次响应面回归模型:

金针菇发酵菌丝生物量方差分析结果见表3。
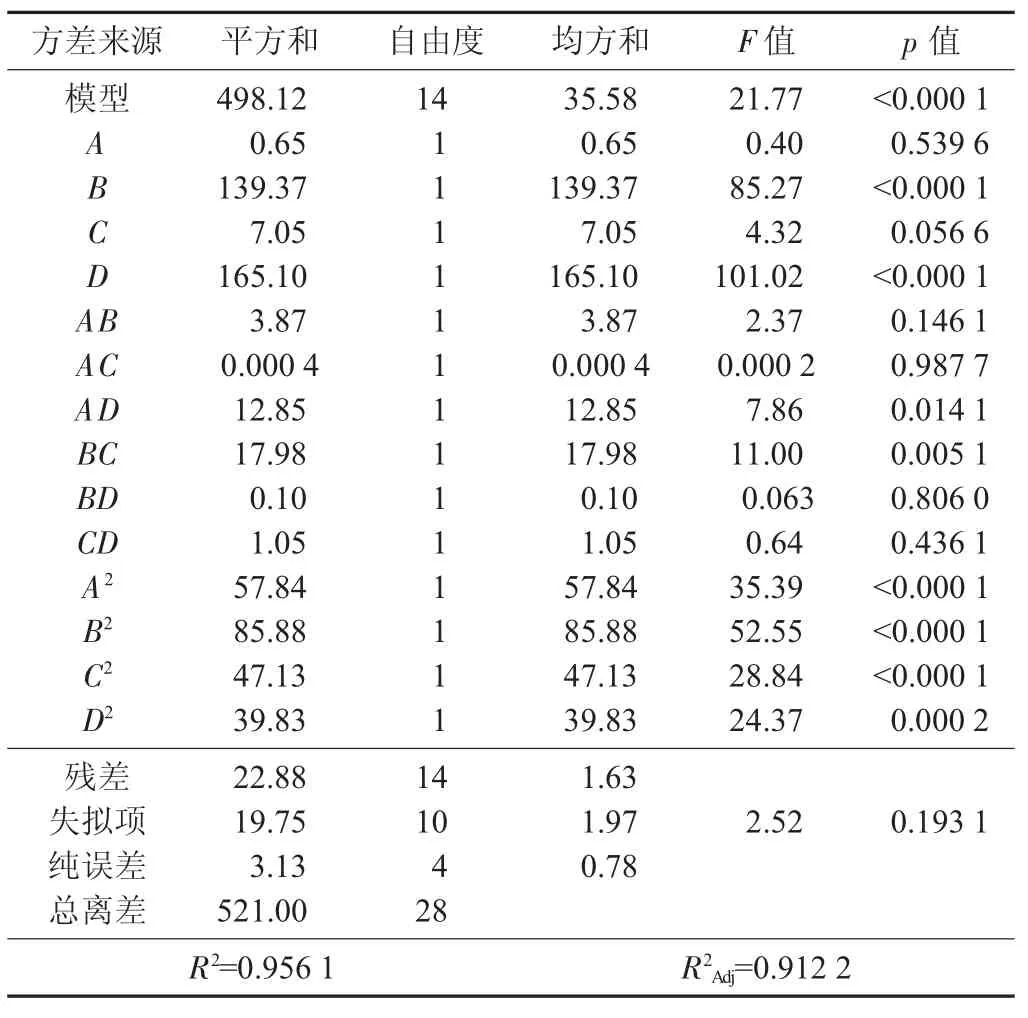
表3 金针菇发酵菌丝生物量方差分析结果
由表3可知,回归项中p<0.001,说明所选择模型非常显著。失拟项p=0.193 1>0.05,说明失拟项差异并不显著,表明该二次回归模型能够较显著拟合葡萄糖、蛋白胨、KH2PO4和果蔬汁质量分数对菌丝生物量的影响,该模型可替代试验真实点对试验结果进行分析。其中,模型一次项蛋白胨和果蔬汁质量分数对菌丝生物量影响十分显著,葡萄糖和KH2PO4质量分数对菌丝生物量影响显著;模型二次项葡萄糖、蛋白胨、KH2PO4质量分数对菌丝生物量影响十分显著,果蔬汁质量分数对菌丝生物量影响显著。
2.2 金针菇菌丝生物量响应面分析结果
对葡萄糖(A)、蛋白胨(B)、KH2PO4(C)、果蔬汁(D)4个因素进行交互作用分析。
各因素对金针菇菌丝生物量影响三维响应曲面见图1。
从图1可以非常直观地看出,各因素对响应值的影响,随着葡萄糖、蛋白胨和果蔬汁质量分数的增加,金针菇菌丝生物量也在增加。葡萄糖(A)、蛋白胨(B)、KH2PO4(C)、果蔬汁(D) 4个因素之间两两相互作用等高线均为椭圆,说明这4个因素两两之间交互作用明显。
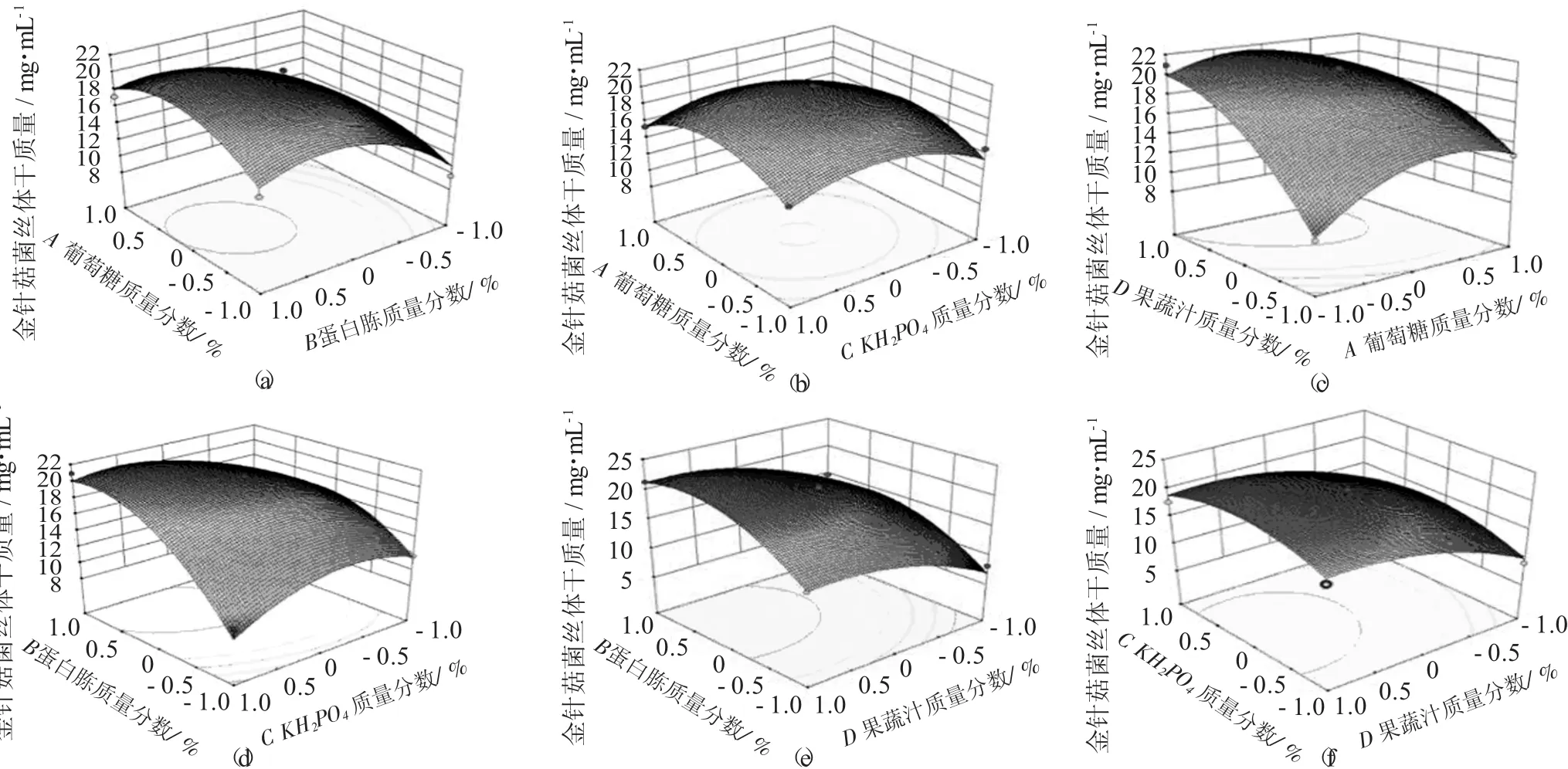
图1 各因素对金针菇菌丝生物量影响三维响应曲面
2.3 验证试验
金针菇深层液体发酵试验中,最优培养基质量分数为葡萄糖2.15%,蛋白胨0.38%,KH2PO40.27%,果蔬汁12.90%;在此条件下,优化后的培养基中菌丝体实际含量为21.46mg/mL,与预测值21.51mg/mL相近,说明预测值和实际值有较高的拟合性,工艺参数准确可靠。
3 结论
深层液体发酵是近年来生产食用菌菌丝体的主要方法之一,已经成为研究食用菌保健制品的重要手段,因此食用菌的开发利用已经由以往的大棚子实体栽培慢慢向深层发酵培养发展,为食药用菌的研发带来巨大利益和便利[18]。为了提高液体发酵金针菇菌丝体的得率,通常对液体发酵培养基进行优化,目前食药用菌液体深层发酵培养基提高菌丝体得率的优化主要集中在氮源、碳源、无机盐、温度、pH值等方面[19-20]。试验以葡萄糖作为碳源,蛋白胨作为氮源,对培养基进行优化,同时添加经济易得的果蔬汁来发酵食用菌,利用响应面优化培养基配方以研究对菌丝体得率的影响。通过分析,得出最优培养基配方为葡萄糖质量分数2.15%,蛋白胨质量分数0.38%,KH2PO4质量分数0.27%,果蔬汁质量分数12.9%。依据响应面分析调整培养基配方后实际测定值为21.46mg/mL,与预测值相近,说明预测值和实际值有较高的拟合性,工艺参数准确可靠。
通过对金针菇菌丝营养特性的研究可以明显发现,速效性和迟效性的碳源或氮源,以及无机盐和维生素等都会对菌丝生物量产生影响。国内在金针菇的液体发酵培养基中通常选择添加黄豆粉、可溶性淀粉[21]等直接补充基础的碳源和氮源。果蔬汁中富含单糖、矿物质和VC等均易被人体吸收[22],可以在保证金针菇生长所需的碳源和氮源的同时进一步提供各类其他营养素,促进菌丝体的生长。同时,深层液体发酵后的果蔬汁培养基中富含氨基酸、多糖、无机酸等多种活性成分,不仅风味独特,而且营养价值更高,可以后续开发利用,在批量化生产食用保健品中占有很大优势。
[1]WeiZhenhua,Duan Yingyi,Qian Yongqing,etal.Screening of Ganoderma strainswith high polysaccharides and ganoderic acid contents and optimization of the fermentation medium by statisticalmethods[J].Bioprocess and Biosystems Engineering,2014,37(9):1 789-1 797.
[2]王丽红,孔阳,马卫红,等.姬松茸菌丝体深层液体发酵条件的优化 [J].陕西科技大学学报,2013,31(3):97-101.
[3]黄琼,黄晓梅,张平,等.金针菇多糖的抗氧化活性 [J].食品研究与开发,2014(4):66-69.
[4]Lin L,Cui F,Zhang J,et al.Antioxidative and renoprotective effects of residue polysaccharides from Flammulina velutipes[J].Carbohydrate Polymers,2016 (6):388-396.
[5]YangW,Pei F,ShiY,etal.Purification,characterization and anti-proliferation activity of polysaccharides from Flammulina velutipes[J].Carbohydrate Polymers,2012 (2):474-480.
[6]Liu F,Ooi V E,Chang S T.Free radical scavenging activities ofmushroom polysaccharide extracts[J].Life Sciences,1997,60 (10):763-771.
[7]Lin G L,Xu X S,Lian W S.Antioxidant activity of edible mushroom polysaccharideextracts in vitro[J].JournalofEast China University of Science&Technology,2006,32(3):278-277.
[8]Ramamoorthy H,Abraham P,Isaac B,et al.Role for NF-κB inflammatory signalling pathway in tenofovir disoproxil fumarate(TDF) induced renal damage in rats[J].Food&Chemical Toxicology,2016 (3):103-107.
[9]Yu Q,Nie S P,Wang JQ,et al.Polysaccharide from Ganoderma atrum induces tumor necrosis factor-αsecretion via phosphoinositide 3-kinase/AKT,mitogen-activated protein kinase and nuclear factor-κB signaling pathways in RAW264.7 cells[J].International Immunopharmacology,2012,14 (4):362-368.
[10]Yu Q,Nie S P,Wang JQ,et al.Toll-like receptor 4-mediated ROS signaling pathway involved in Ganoderma atrum polysaccharide-induced tumor necrosis factor-α secretion duringmacrophage activation[J].Food&Chemical Toxicology,2014(2):14-18.
[11]Ouyang F,Wang G,GuoW,etal.AKT signalling andmitochondrial pathways are involved in mushroom polysaccharide-induced apoptosis and G1 or S phase arrest in human hepatoma cells[J].Food Chemistry,2013 (4):2 130-2 139.
[12]孙培龙,宣以巍,裘娟萍.灰树花菌丝体发酵及成分分析 [J].食用菌,2001(5):4-5.
[13]赵永勋.食药用菌液体发酵的现状和展望 [J].农业与技术,2004,24(3):111-114.
[14]冮洁,王赛男,季旭颖.食用菌子实体和菌丝体多糖抗氧化性的比较研究 [J].大连民族大学学报,2015,17(1):19-23.
[15]何轩辉,廖森泰,刘吉平,等.应用Box-Behnken组合设计优化灰树花粗多糖提取条件 [J].食用菌学报,2008,15 (3):64-67.
[16]Chehreghani S,Noaparast M,Rezai B,et al.Bondedparticlemodel calibration using response surfacemethodology[J].Particuology,2017(3):141-152.
[17]陈潇筱,杨焱,崔凤杰,等.添加氧化铝对灰树花菌丝体生长及多糖产量的影响 [J].食用菌学报,2016,23(1):42-46.
[18]韦朝阳,贺亮,邵双双,等.外源添加物对食药用菌液体发酵影响的研究进展 [J].食品科学,2015,36(7):245-250.
[19]Wu Zhongwei,Lu Junwen,Wang Xiaoqing,et al.Optimization for production of exopolysaccharideswith antitumor activity in vitro from Paecilomyces hepiali[J].Carbohydrate Polymers,2014 (1):226-234.
[20]Tang Jiapeng,Liu Yiting,Zhu Li.Optimization of fermentation conditions and puriication of cordycepin from Cordyceps militaris[J].Preparative Biochemistry and Biotechnology,2014,44 (1):90-106.
[21]姜宁,刘晓鹏,杨洪,等.金针菇液体培养基优化研究 [J].安徽农业科学,2007,35(21):6 429-6 430.
[22]黄勇.浅谈果蔬汁的营养生理意义 [J].普洱学院学报,1994 (2):88-91.◇

