响应面法优化超声辅助提取蓝靛果多糖的工艺研究
韩春然,张家成,王 鑫,那治国,2,王佳宁,谢静南,张 凯
(1.哈尔滨商业大学,高校食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.黑龙江东方学院,黑龙江哈尔滨 150066)
蓝靛果忍冬(Lonicera enulis Turcz) 简称蓝靛果,属被子植物门,忍冬科,忍冬属。蓝靛果原产于北半球温带地区,随后被引入世界各国种植培育,如今在中国、俄罗斯、日本及朝鲜等绝大多数亚欧地区都有蓝靛果的种植与开发。我国对蓝靛果的研究相对其他发达国家起步晚。起初,我国主要致力于研究关于野生蓝靛果的资源调查和人工栽培这2个方面;近年来,随着对野生蓝靛果开发利用的研究逐渐深入,在生态学特性、器官解剖、分类、地位等一系列研究上,我国学者取得了较大进展。蓝靛果果实不仅富含矿物质、各类氨基酸、维生素等营养物质,而且还含有大量的花色苷、黄酮、多酚等对人体有益的活性物质[1-5]。这些物质都对人体健康具有促进作用,使蓝靛果具有较高的药用功能和保健价值[6-8]。
张雁南等人[9]的研究发现微波辅助提取法中,体积分数为65%无水乙醇提取出的蓝靛果红色素可以清除自由基,从而起到抗氧化作用。王恩福等人[10]研究发现,通过注射高脂食物使大鼠患有试验型高血脂,发现乙酸乙酯所提取的蓝靛果提取物可以使大鼠体内密度脂蛋白和血清中超氧化物歧化酶的含量增加,而甘油三酯和血清中丙二醛的含量明显减少,表明该物质对高脂大鼠具有一定的降脂功效。刘奕琳等人[11]采用细胞凋亡的试验研究表明,蓝靛果花色苷在一定条件下对人体肺癌细胞、肝癌细胞和宫颈癌细胞均有很强的抑制作用,其安全无毒和极佳的生理功效,已经使多糖成为一类具有开发价值的新型药物资源[12]。一系列的研究表明,多糖具有提高机体免疫力、预防疲劳、降血糖、降血脂、抗癌、抑菌、防辐射等生理功效[13]。现阶段,大量的动植物多糖已经被成功开发利用,如大枣、南瓜多糖[14-15]、壳聚糖等。蓝靛果中含有较为丰富的多糖,是一种良好的提取原料。目前,对蓝靛果的研究集中在花色苷的提取、纯化及功能性研究,对蓝靛果多糖的研究还是空白。所以,优化蓝靛果多糖的提取工艺,对深入研究其功能性及系列产品的开发利用具有重要意义。
1 试验部分
1.1 原料与试剂
蓝靛果,黑龙江勃利县采摘;硫酸、苯酚、乙醇,分析纯,天津市富宇精细化工有限公司提供;快流速DEAE-琼脂糖凝胶,北京博奥拓达科技有限公司提供。
KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司产品;UV-9100型紫外可见分光光度计,北京瑞利分析仪器公司产品;HL-2B型数显恒流泵,上海精科实业有限公司产品。
1.2 试验方法
1.2.1 葡萄糖标准曲线的绘制
精密称取干燥至恒质量的葡萄糖标准品250 mg置于250 mL的容量瓶中,加水适量使其溶解、定容。精密吸取上述溶液25 mL,定容至250mL容量瓶中,即得100μg/mL的标准样品。用移液枪精密移取0.1,0.2,0.3,0.4,0.5 mL的葡萄糖标准溶液分别置于试管中,定容至1 mL,分别加1.0 mL的6%苯酚,摇匀迅速滴加浓硫酸5mL,摇匀,在室温下冷却30 min,以空白校正零点。
1.2.2 多糖含量的测定
吸取提取出的样品溶液,根据上述操作,测定样品溶液的吸光度,将其带入回归方程,以计算多糖的含量。公式如下:

式中:C——样液的浓度;
V——定容后的体积;
0.934——蓝靛果多糖/总糖转换系数;
m——所取蓝靛果粉末的质量;
n——稀释倍数。
1.2.3 超声辅助提取条件优化
挑选果实成熟、果肉饱满的蓝靛果,干燥、粉碎。称取2.00 g(准确称量至±0.01 g) 的粉碎后的蓝靛果粉末,按1∶15的料液比取蒸馏水溶解蓝靛果粉末于烧杯中,后置于一定温度(30,40,50,60,70℃)的超声清洗器水浴中浸提一定时间(20,40,60,80,100 min),并设置超声波清洗器功率(150,175,200,225,250W)。取1mL稀释后的提取液,加入1mL苯酚,5mL硫酸,冷却至室温,在波长490 nm下测定吸光度A。计算蓝靛果多糖浓度。
1.2.4 响应曲面分析
选取超声温度、超声时间、超声功率3个因素用Design-Expert 7.0.0进行Box-Behnken试验[16]。
Box-Behnken试验设计因素水平及编码见表1。

表1 Box-Behnken试验设计因素水平及编码
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线
如图1所示,以葡萄糖质量浓度(μg/mL) 为横坐标,于波长490 nm下吸光度(A) 为纵坐标,绘制标准曲线,得到标准曲线方程为:Y=0.014 6X+0.002 1(R2=0.998 4)。
2.2 超声辅助提取条件优化分析
2.2.1 超声时间对提取率的影响
在料液比1∶15,超声温度40℃,超声功率175 W的提取条件下分别提取20,40,60,80,100min,在490 nm下测定吸光度A,通过标准曲线定量并计算。
超声时间对提取率的影响见图2。
从图2可以看出,当超声时间在20~60 min时,吸光度随超声时间的延长而增加,即提取的蓝靛果含量随超声时间的延长而增加;继续随着超声时间的延长吸光度呈下降趋势,即蓝靛果多糖的提取量呈下降趋势。从图2可以看出,超声时间在60min时吸光度最高,即超声时间60min时蓝靛果多糖得率最大。由此可得,最佳的超声时间为60min。

图2 超声时间对提取率的影响
2.2.2 超声温度对提取量的影响
在超声时间60 min,超声功率175 W,料液比1∶15的提取条件下分别用30,40,50,60,70℃的超声温度进行提取;在490 nm下测定吸光度,通过标准曲线定量并计算。
超声温度对提取率的影响见图3。

图3 超声温度对提取率的影响
从图3可以看出,当超声温度在30~40℃时,吸光度随超声温度的升高而增加,即提取的蓝靛果多糖含量随超声温度的升高而增加。这是由于蓝靛果中的多糖能溶解到溶剂中,升高温度使溶剂对多糖的提取能力增大(分子扩散作用),加快了提取速率,进而增加单位时间的提取量[17]。在超声温度为40℃时,吸光度达到最大,即所提取的蓝靛果多糖含量最高。当超声温度高于40℃时,吸光度随超声温度的升高而降低并趋平,即所提取的蓝靛果多糖含量开始下降。由此可得,最优提取温度为40℃。
2.2.3 超声功率对提取量的影响结果
在超声时间60 min,超声温度40℃,料液比1∶15的提取条件下分别用 150,175,200,225,250W的功率进行提取;在490 nm下测定吸光度。
超声功率对提取率的影响见图4。
从图4可以看出,当超声功率在150~175W时,吸光度随超声功率的升高而而增加,即提取的蓝靛果多糖含量随超声功率的升高而增加。这是由于功率增大能加剧空气泡的运动,当超声功率增加时,多糖提取率有所上升。在超声功率为175W时,吸光度达到最大,即所提取的蓝靛果多糖含量最高。当超声功率高于175W时,吸光度随超声功率的升高而降低,即所提取的蓝靛果多糖含量开始下降。由此可得,最佳超声功率为175W。

图4 超声功率对提取率的影响
2.2.4 响应曲面分析结果
Box-Behnken试验设计与结果见表2。

表2 Box-Behnken试验设计与结果
表2中的数据通过Design Expert软件进行拟合分析,蓝靛果多糖提取率与3个变量之间的关系表述为以下二阶多项式方程。
利用Design Expert软件对表2数据进行多元回归拟合,获得超声辅助提取蓝靛果多糖对超声时间(X1)、超声温度(X2)和超声功率(X3)的二次多项回归模型方程为:

响应面模型方差分析见表3,回归方程系数显著性检验见表4。
从表3可见,试验所选用的模型高度显著(p<0.000 1),模型的校正决定系数R2adj=0.972 1,说明该模型能解释97.21%响应值的变化;相关系数R=0.993 9,说明该模型拟合程度良好,试验误差小,该模型是合适的,可以用此来分析超声辅助蓝靛果多糖的提取。从表4回归方程系数显著性检验可知,模型一次项X1,X2,交互项X1X2,X1X3显著;二次项 X12,v22,X32极显著;X3,X2X3不显著。
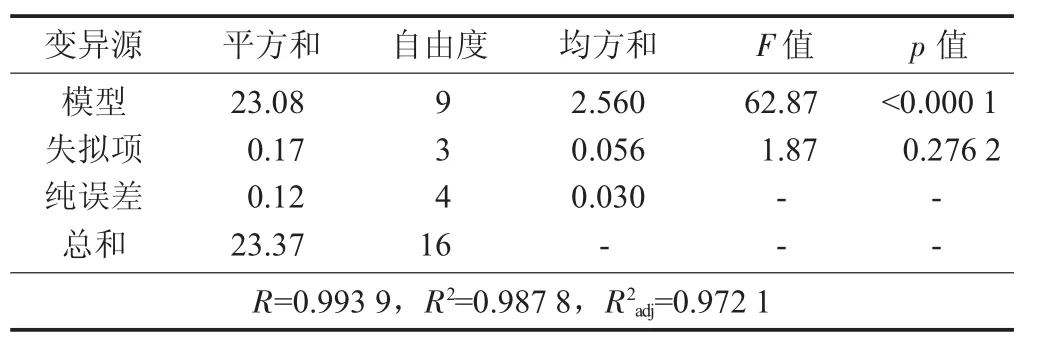
表3 响应面模型方差分析
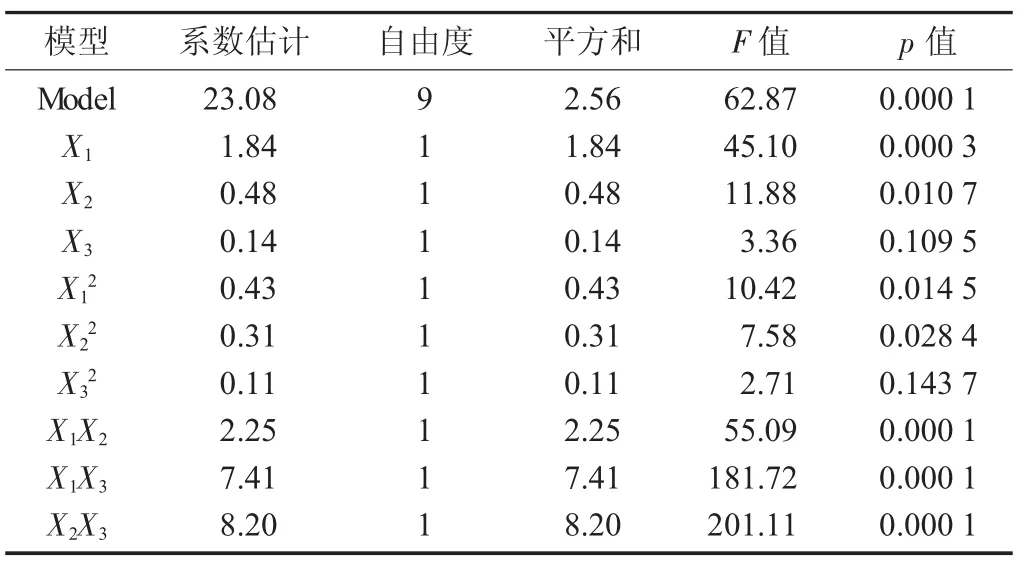
表4 回归方程系数显著性检验
超声温度与超声时间对蓝靛果多糖得率影响的响应曲面见图5。
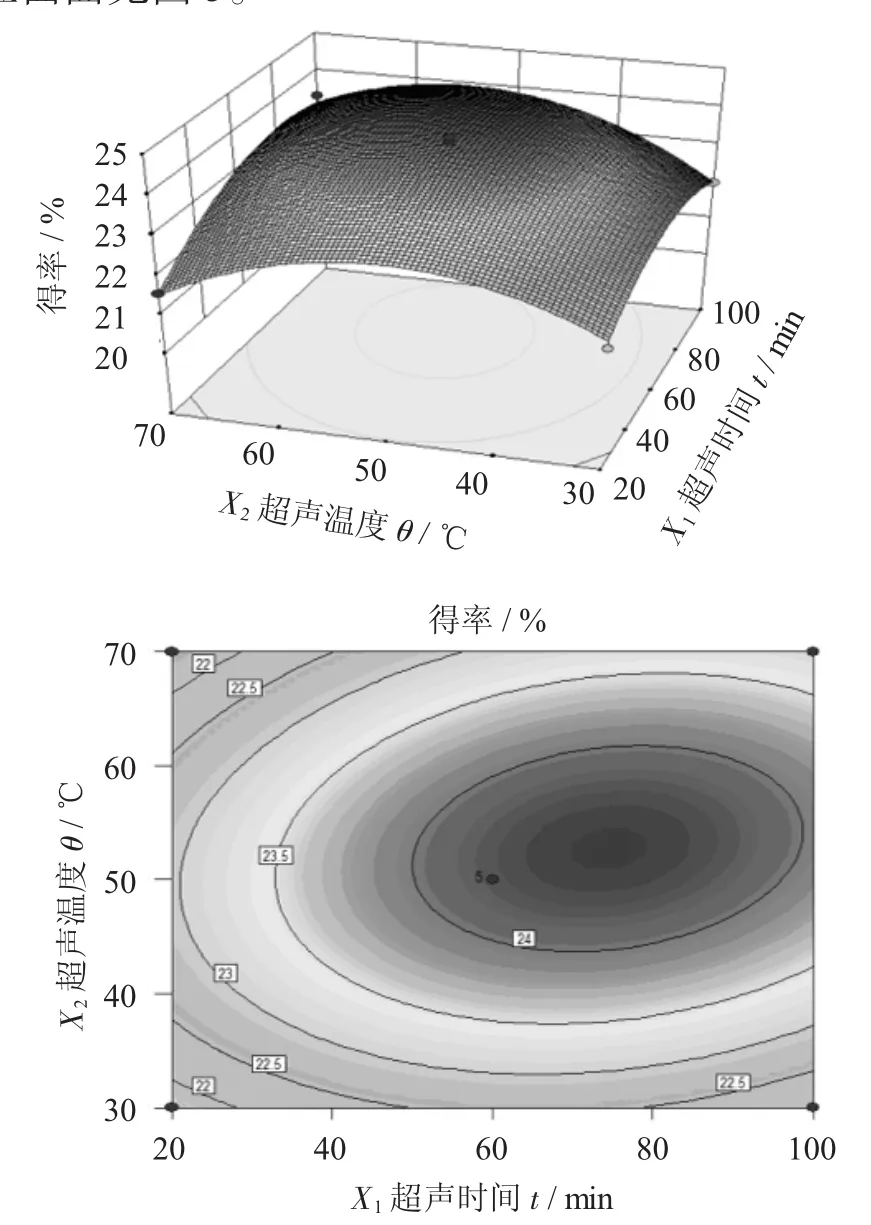
图5 超声温度与超声时间对蓝靛果多糖得率影响的响应曲面
由图5可以看出,在超声功率为最佳值时,超声温度与超声时间的交互作用对蓝靛果多糖得率产生了显著性影响。从等高线可以看出,随着超声温度和超声时间的增加,多糖得率也在增长;但超声温度大于40℃,超声时间大于60 min后,超声温度和超声时间的增加会导致蓝靛果多糖得率的下降。
超声功率与超声时间对蓝靛果多糖得率影响的响应曲面见图6。

图6 超声功率与超声时间对蓝靛果多糖得率影响的响应曲面
由图6可以看出,当超声温度为最佳条件时,超声功率与超声时间对蓝靛果多糖的得率有显著影响。蓝靛果多糖得率随着超声功率和超声时间的增加而增长,在超声时间60 min,超声功率175W时得率到达最大值,随后蓝靛果多糖得率随超声功率和超声时间的增加而降低。
超声功率与超声温度对蓝靛果多糖得率影响的响应曲面见图7。
由图7可以看出,当超声时间为最佳条件时,蓝靛果多糖得率随着超声功率和超声温度的增加而增长,在超声时间60 min,超声温度40℃时得率到达最大值,随后蓝靛果多糖得率随超声功率和超声温度的增加而降低。
由回归方程解得中心点的最佳解为超声时间67.17min,超声温度41.36℃,超声功率175.08W,预测最大提取得率24.263%。
调整预测最佳提取参数,超声时间67 min,超声温度41℃,超声功率175W。在该条件下进行验证试验,所得结果为24.324%,模型与实际没有显著差异。
3 结论

图7 超声功率与超声温度对蓝靛果多糖得率影响的响应曲面
以干燥后的蓝靛果为原料,通过热水浸提法,在单因素试验的基础上,利用响应面优化试验设计,探究超声辅助提取蓝靛果多糖的最佳工艺条件。单因素试验选取超声时间、超声温度和超声功率3个因素进行研究,并设计三因素的响应面试验。结果表明,单因素试验中的最佳条件为超声时间60min,超声温度40℃,超声功率175W;通过响应面法得到最终提取工艺为超声时间67min,超声温度41℃,超声功率175 W,在此条件下蓝靛果多糖得率为24.324%,与预测值相近,表明响应面法优化的提取条件可行。
[1]张启昌,李亮,张义涛,等.蓝靛果忍冬利用价值研究进展 [J].北华大学学报(自然科学版),2014(5):661-664.
[2]Wu S,He X,Wu X,et al.Inhibitory effects of blue honeysuckle(Lonicera caerulea L).on adjuvant-induced arthritis in rats:Crosstalk of anti-inflammatory and antioxidant effects[J].Journal of Functional Foods, 2015 (17):514-523.
[3]Wang Y,Zhu J,Meng X,et al.Comparison of polyphenol,anthocyanin and antioxidant capacity in four varieties of Lonicera caerulea berry extracts.[J].Food Chemistry,2016(4):522-529.
[4]Caprioli G,Iannarelli R,Innocenti M,et al.Blue honeysuckle fruit(Lonicera caerulea L).from eastern Russia:phenolic composition,nutritional value and biological activities of its polar extracts[J].Food&Function,2016,7(4):1 892-1 903.
[5]Wang Y,Li B,Lin Y,etal.Effects of Lonicera caerulea,berry extract on lipopolysaccharide-induced toxicity in rat liver cells:Antioxidant,anti-inflammatory,and anti-apoptotic activities[J].Journalof Functional Foods,2017 (2):217-226.
[6]吕闻明.蓝靛果忍冬酚类物质提取及抗氧化性研究 [D].长春:吉林大学,2012.
[7]刘敬华,王振宇.精制及高纯度蓝靛果花色苷的抗氧化性及稳定性研究 [J].食品工业科技,2013,34(19):87-92.
[8]张斯瑶,徐祎博,郝鑫,等.响应面优化超声辅助提取桔梗多糖工艺 [J].农产品加工,2015(7):26-29,32.
[9]张雁南,刘硕芳,李皓,等.蓝靛果红色素微波提取及抗氧化作用 [J].食品科学,2010(18):104-107.
[10]王恩福,包怡红.蓝靛果提取物调节血脂功能特性的研究 [J].食品与机械,2010(1):81-82.
[11]刘奕琳,王振宇.蓝靛果花色苷乙醇洗脱物抗癌活性的研究 [J].食品工业科技,2012(19):159-161,352.
[12]周丽萍,王化,李梦莎,等.蓝靛果保健功能研究进展 [J].国土与自然资源研究,2016(5):92-95.
[13]王振宇,杨玲.蓝靛果的研究利用现状及其发展前景 [J].安徽科技学院学报,2009(3):18-20.
[14]方元,许铭强,汪欣蓓,等.超声波辅助提取哈密大枣多糖的工艺优化 [J].食品与机械,2014,30(2):175-180.
[15]张高帆,苏东洋,张拥军,等.南瓜多糖对不同糖尿病模型小鼠的降糖作用 [J].中国食品学报,2014,14(2):23-27.
[16]张敏,刘刚,张雁南,等.响应面法优化蓝靛果花色苷提取工艺研究 [J].北方园艺,2014(23):113-116.
[17]徐丽萍,吴媛媛,王鑫,等.响应曲面法优化红树莓多糖提取工艺 [J].中国食品添加剂,2017(9):182-187.◇

