黄秋葵嫩荚粗多糖的抗氧化活性研究
周志航,苏文浩
(深圳职业技术学院应用化学与生物技术学院,广东深圳 518055)
黄秋葵(Abelmoschus esculentus),又有名洋芝麻、羊角豆、洋辣椒、补肾草等。黄秋葵原产自非洲东部地区,于20世纪90年代引入我国种植,由于生长周期短、耐干旱的特性,随着近年来推广普及工作的开展,已经在我国广东、福建、云南、海南和山东等多个地区开始种植栽培。黄秋葵含有多种营养物质,被多个国家地区评定为绿色食品,在崇尚食疗和药食同源概念流传已久的中国,是一种价值极高的药食两用蔬菜。
虽然黄秋葵的嫩花与叶子也可以食用,但黄秋葵最有食用价值的是黄秋葵嫩荚。除了日常的凉拌和炒食以外,国外还将其应用于低脂巧克力、饼干等的制作。黄秋葵嫩荚中蛋白质、膳食纤维、矿物质、维生素的含量非常丰富,经相关研究证实,Fe,P,K,Se等元素存在于新鲜的黄秋葵嫩荚中且含量高于其他植物,这些微量元素对于人体有着重要的特殊作用[1]。
黄秋葵具有利咽、通淋、预防和治疗肠胃炎症等入药功能,在黄秋葵嫩荚的黏液中,科学家研究并发现了一种叫做Lepidimoide(简称LM) 的物质[2],其性质类似天然荷尔蒙,在某种层面上,被称为咖啡黄葵的黄秋葵与咖啡起到同样的效果,能够帮助机体有效对抗疲劳。不仅如此,黄秋葵还有改善感到疲劳时的恢复力和对抗疲劳的能力,同时还具有提高动物的耐力、耐缺氧、耐寒与耐热能力的效果,甚至对男性性功能障碍起到辅助治疗的效果,这也是为什么人们会把黄秋葵称为“奥运蔬菜”“植物伟哥”的部分缘由。更加让人感到惊喜的是,黄秋葵除了可以作为天然的兴奋剂外,黄秋葵嫩荚中的组分中还有起到镇静催眠效果的组分[3],若是朝着这个方向深入开展研究,或许不久后失眠人士便可以将药物助眠改为食疗。新鲜的黄秋葵还能起到保护视力、舒缓眼睛疲劳、改善近视状况的作用,是因为其中包含了胡萝卜素和VA,嫩荚里Zn和Se等微量元素同秋葵含有的黄酮类物质一起参与人体内分泌,可达到恢复内分泌平衡的效果。另外,还有研究表明黄秋葵除了在降血脂、降血压方面也能发挥一定作用外,还具有抗糖尿病和高血脂的药效[4-5]。
因为黄秋葵自身蕴含的丰富营养物质本就具有研究意义,加上近些年生活水平有了大幅度的提升,人们对健康饮食也愈发看重。近年来,专家学者都开始把求知的热忱投向黄秋葵这一尚待开发的领域。目前,国内外绝大多数的研究成果集中在黄秋葵的农业种植培育条件的探索、果实外观形态和保藏、营养成分测定[6]、目的组分提取条件等方面,如秋葵多糖提取工艺的研究[7],或是在医药方面研究黄秋葵对于血糖、血脂、癌症等现代常见疾病的对抗效果[8-9]。现今国内外的主要想法仍停留在将黄秋葵作为食材利用,对于黄秋葵生物活性物质的研究还不多。试验利用热水浴法和微波超声协助法提取黄秋葵嫩荚中的粗多糖,并对其抗氧化活性进行了研究。
1 材料与方法
1.1 材料与试剂
黄秋葵嫩荚,购于深圳市西丽天虹超市。
无水乙醇、葡萄糖、抗坏血酸、苯酚、浓硫酸、过硫酸钾,以及DPPH和ABTS均为分析纯。
1.2 仪器
ALPHA 1-4 LSC型冷冻干燥机,德国Christ公司产品;A11小型粉碎机,德国IKA公司产品;马头牌电子天平,上海光正医疗仪器有限公司产品;MSNew Classic型电子分析天平,Mettler Toledo公司产品;加热磁力搅拌器,VELPScientifica产品;DKS22型电热恒温水浴锅、DHG-9123A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司产品;CW-2000型超声微波协助萃取/反应仪,上海新拓分析仪器科技有限公司产品;Centrifuge 5810R型高速冷冻离心机,德国 Eppendorf公司产品;上分-L6型紫外可见分光光度计,上海仪电公司产品;微量移液器,Eppendrof公司产品;双华牌DK-20型超级循环水浴磁力搅拌器,金坛市文华仪器有限公司产品。
1.3 试验方法
1.3.1 黄秋葵嫩荚粗多糖的提取方法
将黄秋葵嫩荚洗净、晾干,剖成合适大小,冷冻干燥。取冻干的黄秋葵嫩荚置于搅拌机中,加入80%乙醇打浆、过滤,滤渣烘干后用粉碎机粉碎,制得黄秋葵嫩荚干粉,置于阴凉干燥条件下储存备用。
(1)热水浴法提取黄秋葵嫩荚粗多糖。分别称取黄秋葵嫩荚干粉,按照料液比1∶30,1∶40,1∶50加入蒸馏水,放入磁力转子,用保鲜膜包裹后分别放置于60,70,80℃的电热恒温水浴锅中,开启磁力搅拌,水浴2 h。2 h过后取出混合液,冷却至室温后分装,于转速10 000 r/min,4℃条件下离心10min,取上清液。在搅拌条件下加入3倍体积的无水乙醇,混匀,于4℃下放置过夜后,于转速10 000 r/min,4℃条件下离心5 min,取沉淀。挥干乙醇后用冷冻干燥,得到黄秋葵嫩荚粗多糖。
(2)微波超声协助法提取黄秋葵嫩荚粗多糖。分别称取黄秋葵嫩荚干粉,按照料液比1∶30,1∶40,1∶50加入蒸馏水,转入特制的超声瓶后,放入超声微波协同萃取仪中,设置温度上限为60℃,并将微波功率分别设置为100,200,300W,超声时间20min。超声后取出混合液待其冷却至室温后分装,于转速10 000 r/min,4℃条件下离心10 min,取上清液,在搅拌条件下加入3倍体积的无水乙醇,混匀,于4℃条件下放置过夜。于转速10 000 r/min,4℃条件下离心5 min,取沉淀,挥干乙醇后冷冻干燥,得到黄秋葵嫩荚粗多糖。
1.3.2 黄秋葵嫩荚粗多糖得率的测定
将冷冻干燥的黄秋葵嫩荚粗多糖称质量,计算黄秋葵嫩荚粗多糖的得率,计算公式如下:

1.3.3 黄秋葵嫩荚粗多糖含量的测定
黄秋葵嫩荚粗多糖质量浓度的测定参照魏绍云等[10]的方法。
精密称取葡萄糖标准品100 mg,加入蒸馏水溶解,完全溶解后转入100mL容量瓶中,加蒸馏水定容,摇匀后取10mL转入100mL容量瓶中,同样加入蒸馏水定容,摇匀,得质量浓度为0.1 mg/mL的葡萄糖标准母液。分别精确吸取葡萄糖标准母液100,200,300,400,500,600μL分别置于试管中,加蒸馏水稀释至1 mL,吸取200μL到试管,分别加入200μL的5%苯酚溶液,摇匀,然后加入1 mL浓硫酸,混匀,置于30℃水浴20 min,冷却至室温,于490 nm处测定吸光度。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程。
精密称取20mg的粗多糖置于研钵中研磨成粉,加入蒸馏水溶解,制成粗多糖黏溶液,准确吸取粗多糖黏溶液1 mL于100 mL容量瓶中,加蒸馏水定容,摇匀备用,此为粗多糖工作液。准确吸取200μL粗多糖工作液置于试管中,准确吸取5%苯酚溶液200μL加入试管,摇匀,缓慢加入1 mL浓硫酸混匀,置于30℃水浴20 min,冷却至室温,于波长490 nm处测定吸光度,根据葡萄糖标准曲线计算粗多糖含量。
1.3.4 清除DPPH自由基能力的测定[11]
吸取粗多糖黏溶液,稀释至质量浓度为1.0,0.8,0.6,0.4,0.2 mg/mL的多糖工作液,然后准确吸取200μL不同质量浓度样品溶液分别加入1 mL的0.1μmol/L DPPH溶液中,充分混匀,于室温避光保存30min后在波长517 nm处测定吸光度。空白组用1 mL乙醇替代DPPH·溶液,对照组中取200μL乙醇替代样品溶液,在波长517 nm处对样品测定吸光度,平行3次取平均值。以抗坏血酸作为标准抗氧化剂。计算DPPH自由基的清除率,并计算IC50的值。

式中:A0——200μL乙醇和1mL的0.1μmol/LDPPH溶液的混合液在波长517nm处的吸光度;
Ai——200μL样品溶液和1mL的0.1μmol/L DPPH·溶液的混合液在波长517 nm处的吸光度;
Aj——200μL样品溶液和1mL乙醇的混合液在波长517 nm处的吸光度。
1.3.5 清除ABTS+自由基能力的测定[12]
吸取粗多糖黏溶液,将稀释至质量浓度为1.0,0.8,0.6,0.4,0.2mg/mL的多糖工作液,精准吸取各浓度工作液50μL分别加入1mL的ABTS+·混合液中,充分混匀,置于室温避光保存30min后在734 nm处测定吸光度。此外,另取50μL乙醇重复以上操作,作为空白对照试验,在波长734 nm处对样品测定吸光度,平行3次取平均值。抗坏血酸作标准抗氧化剂。计算ABTS+自由基的清除率,并计算IC50值。

式中:A0——空白组的吸光度;
At——样品的吸光度。
2 结果与分析
2.1 苯酚-浓硫酸法测黄秋葵嫩荚粗多糖质量浓度标准曲线
用葡萄糖作为标准品制作的标准曲线,回归方程为Y=11.993X+0.031 6,R2=0.999 7。
苯酚-浓硫酸法测黄秋葵嫩荚粗多糖质量浓度标准曲线见图1。
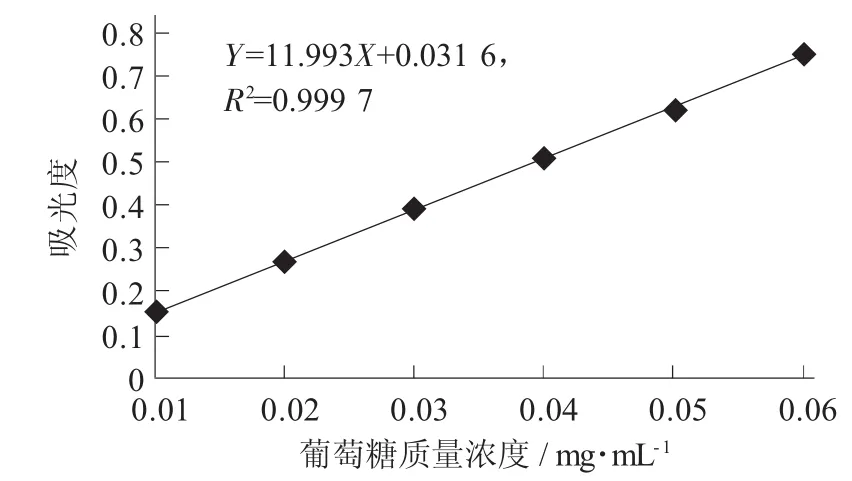
图1 苯酚-浓硫酸法测黄秋葵嫩荚粗多糖质量浓度标准曲线
由图1可知,在黄秋葵嫩荚粗多糖质量浓度0.01~0.06mg/mL的范围内吸光度与葡萄糖质量浓度有着良好的线性关系。
2.2 不同参数对热水浴提取黄秋葵嫩荚粗多糖得率的影响
不同参数条件下热水浴提取黄秋葵嫩荚粗多糖的得率见表1。

表1 不同参数条件下热水浴提取黄秋葵嫩荚粗多糖的得率
由表1可知,在相同的提取温度条件下,黄秋葵嫩荚粗多糖得率在料液比1∶40时达到最大值,且随着提取温度的升高而上升。
2.3 不同参数对超声微波协同提取黄秋葵嫩荚粗多糖得率的影响
不同参数条件下超声微波协同提取黄秋葵嫩荚多糖的得率见表2。
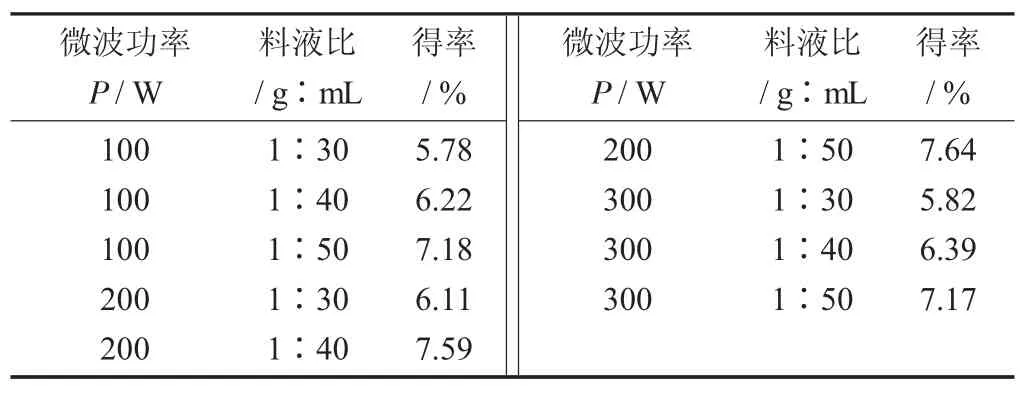
表2 不同参数条件下超声微波协同提取黄秋葵嫩荚粗多糖的得率
由表2可知,相同的微波功率作用下,粗多糖得率与料液比呈正相关,随着料液比的增大而提高。在功率大小不同的组间,微波功率为200W时最高。
2.4 不同参数条件下热水浴提取的粗多糖DPPH自由基清除能力
不同参数条件下热水浴提取黄秋葵嫩荚多糖对DPPH自由基清除结果见表3。

表3 不同参数条件下热水浴提取黄秋葵嫩荚粗多糖对DPPH自由基清除结果
由表3可知,黄秋葵嫩荚粗多糖清除DPPH自由基的能力随着质量浓度的减少呈明显下降趋势,具有一定的量效关系。相同提取温度下,加大料液比提取的黄秋葵嫩荚粗多糖对DPPH自由基的清除能力也有提升。随着提取温度的上升,提取的黄秋葵嫩荚粗多糖对DPPH自由基的清除率明显升高。
2.5 不同参数条件下超声微波协同提取的黄秋葵嫩荚粗多糖对DPPH自由基清除能力
不同参数条件下超声微波协同提取的黄秋葵嫩荚粗多糖对DPPH自由基清除结果见表4。

表4 不同参数条件下超声微波协同提取的黄秋葵嫩荚粗多糖对DPPH自由基清除结果
由表4可知,黄秋葵嫩荚粗多糖清除DPPH自由基能力和表3的趋势一致,随着质量浓度的减少而呈现明显的下降趋势,存在量效关系。黄秋葵嫩荚粗多糖提取物对DPPH自由基的清除能力受微波功率变化的影响明显,功率越高,DPPH自由基清除能力越强。
2.6 不同提取方法提取的黄秋葵嫩荚粗多糖清除DPPH自由基的IC50值
为了直观地呈现样品组别之间的差异,引入IC50值,IC50值越小对应的抗氧化能力越强[13]。
不同参数条件下黄秋葵嫩荚粗多糖清除DPPH自由基的IC50值见图2。

图2 不同参数条件下黄秋葵嫩荚粗多糖清除DPPH自由基的IC50值
由图2可知,抗坏血酸清除DPPH自由基能力较为出色,其IC50值为23.81μg/mL。微波超声协助法和热水浴法提取的黄秋葵嫩荚多糖随着料液比的增大,对于DPPH自由基的清除能都在逐渐增强,但热水浴法所提取的多糖在清除DPPH自由基方面的效果略差于微波超声协助提取的多糖。
2.7 不同参数条件下热水浴提取的多糖ABTS+自由基清除能力
不同参数条件下热水浴提取黄秋葵嫩荚粗多糖的ABTS+自由基清除能力结果见表5。
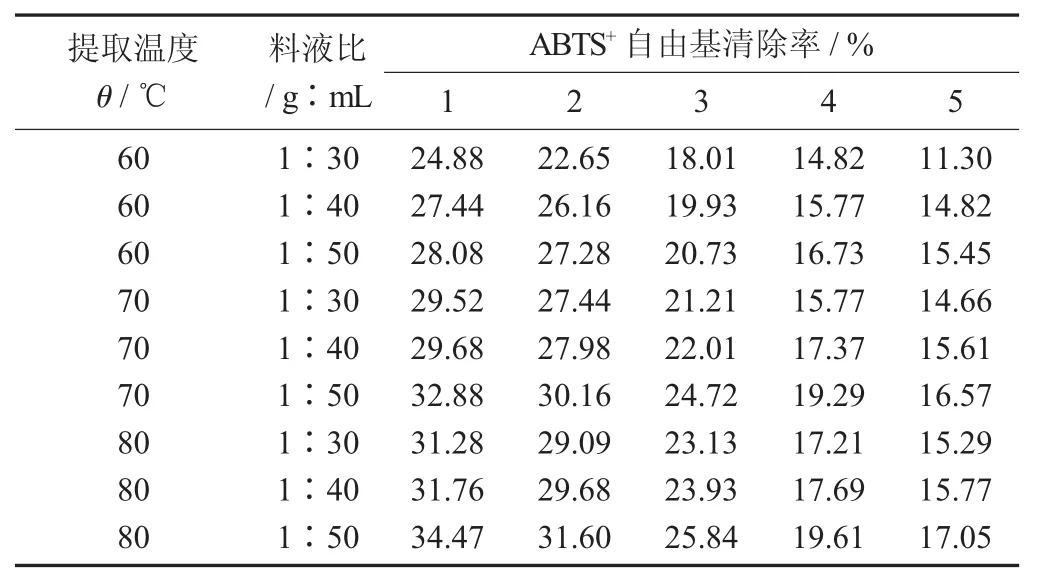
表5 不同参数条件下热水浴提取黄秋葵嫩荚粗多糖的ABTS+自由基清除能力结果
由表5可知,热水浴提取的黄秋葵嫩荚粗多糖对ABTS+自由基清除率随粗多糖质量浓度的提高而提高,对于ABTS+自由基的清除能力随着料液比的增大而提升,随着温度的升高,提取所得的黄秋葵嫩荚粗多糖对ABTS+自由基的清除能力也有一定程度提升。
2.8 不同参数条件下微波超声协助提取的黄秋葵嫩荚粗多糖ABTS+自由基清除能力
不同参数条件下微波超声协助提取黄秋葵嫩荚粗多糖的ABTS+自由基清除能力结果见表6。
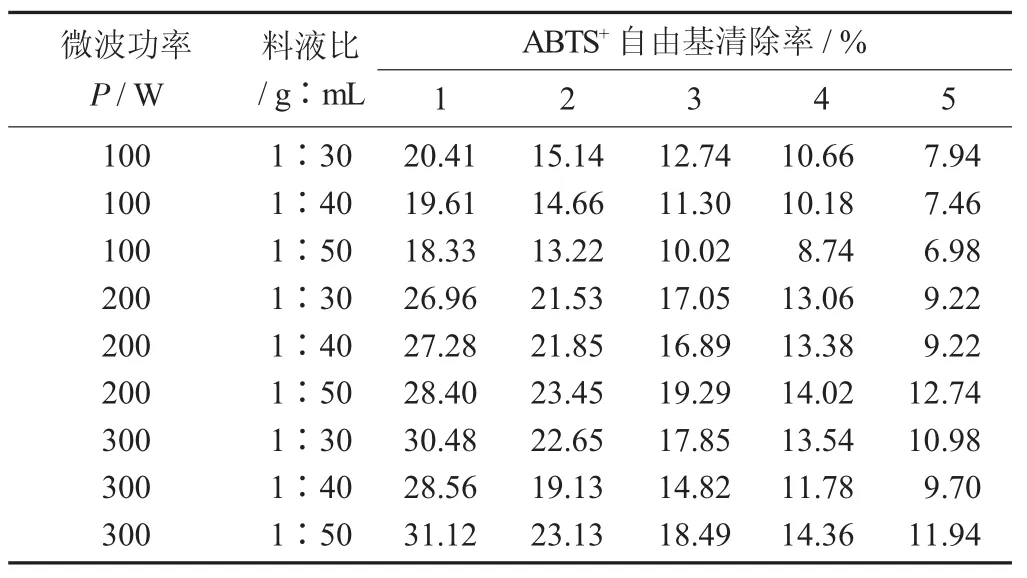
表6 不同参数条件下微波超声协助提取黄秋葵嫩荚粗多糖的ABTS+自由基清除能力结果
由表6可知,随着微波功率的提高,ABTS+自由基的清除能力也有明显的变化,相同质量浓度下范围由18.33%提高至31.12%。对比表5可知,微波超声协助提取的样品对于ABTS+自由基的清除能力环比低于热水浴提取的样品。
2.9 不同提取方法提取的黄秋葵嫩荚粗多糖清除ABTS+自由基的IC50值
不同参数条件下黄秋葵嫩荚粗多糖清除ABTS+自由基的IC50值见图3。

图3 不同参数条件下黄秋葵嫩荚粗多糖清除ABTS+自由基的IC50值
由图3可知,抗坏血酸对ABTS+自由基的清除效果也是十分出色,它对应的IC50值为36.53μg/mL。在微波功率逐渐增大的过程中,微波超声协助法出现了高点,热水浴法则呈现出逐渐增强的趋势。
3 结论与讨论
研究表明黄秋葵粗多糖有明显的抗氧化活性,而在黄秋葵叶子、花朵、果荚的抗氧化能力中,果荚的能力最为突出[14-15],所以选择黄秋葵的嫩荚作为研究对象,而DPPH自由基和ABTS+自由基能够提供有效可信的评定结果,因此可通过测定对DPPH自由基和ABTS+自由基的清除能力来确定黄秋葵嫩荚粗多糖更为合适的提取方法。
采用热水浴法和微波超声协助法对黄秋葵嫩荚粗多糖在多种参数条件下提取,测定其得率及其含量。结果显示,热水浴法所提取得到的粗多糖得率随着料液比和提取温度增大而增大;而对于微波超声协助法而言,样品中粗多糖得率则没有呈现明显的相关性,粗多糖得率的趋势为先升高后降低,于微波200W处达到最高点,这可能与微波超声容易导致粗多糖长链大分子断裂随后发生分解有关。除此以外,还测定了2种方法提取的粗多糖对于DPPH自由基和ABTS+自由基的清除率,比较其清除自由基能力的差异。试验结果表明,2种方法所提取出来的粗多糖对DPPH和ABTS+自由基都具有一定程度的清除能力,而且清除率与粗多糖质量浓度有一定的相关性[16],但微波超声协助提取的粗多糖样品对于ABTS+自由基的清除活性较低。综合以上因素,考虑到场地、仪器设备、人员操作等要素,热水浴法更合适提取黄秋葵嫩荚粗多糖。
此外,虽然黄秋葵嫩荚粗多糖提取物对DPPH和ABTS+自由基的清除能力明显弱于抗坏血酸(这可能与黄秋葵嫩荚粗多糖提取物中多糖的含量要低于纯的抗坏血酸有关),但黄秋葵嫩荚粗多糖提取物对于DPPH自由基和ABTS+自由基清除的IC50最低值分别为241.40,319.10μg/mL,其抗氧化性明显,同时黄秋葵嫩荚粗多糖属于天然无毒的抗氧化剂,因此具有继续研究的价值。
[1]于颖.火焰原子吸收光谱法测定黄秋葵中微量元素 [J].辽宁教育行政学院学报,2007,24(6):131-132.
[2]陈汝民,山田小须弥.新型植物生长调节物质Lepidimoide的生理作用及其与其它植物激素生理作用的比较 [J].华南师范大学学报(自然科学版),1999(1):106-109.
[3]廖争争,胡立汶,刘爱敬,等.黄秋葵镇静催眠活性部位的筛选研究 [J].沈阳药科大学学报,2015,32(10):790-793.
[4]张灵敏,王玲,贾奥,等.黄秋葵水提物对Ⅱ型糖尿病大鼠糖脂代谢的影响 [J].食品工业科技,2016,37(3):355-363.
[5]宫慧慧,于倩,王恩军,等.黄秋葵的应用价值和产业化开发前景 [J].山东农业科学,2013,45(10):131-134.
[6]黄阿根,陈学好,高云中,等.黄秋葵的成分测定与分析 [J].食品科学(分析检测版),2007,28(10):451-455.
[7]高愿军,幸美佳,周靖琦,等.2种方法提取秋葵多糖工艺研究 [J].食品科技,2013,38(11):189-192.
[8]任丹丹,陈谷.黄秋葵多糖组分对人体肿瘤细胞增殖的抑制作用 [J].食品科学,2010,31(21):353-356.
[9]裴文菡,张冬月.药食同用植物黄秋葵的研究进展及开发前景 [J].中国医药科学,2016,6(21):42-44.
[10]魏绍云,齐慧玲,王继伦,等.苯酚-硫酸法测定白芨多糖 [J].天津化工,2000(3):35-36.
[11]Zhang Ruifen,Zhang Fangxuan,Zhang Mingwei,et al.Phenolic composition and antioxidant activity in seed coats of 60 Chinese black soybean(Glycinemax L,Merr).varieties[J].Journal Agricultural and Food Chemistry,2011,59 (11):5 935-5 944.
[12]Re R,PellecrniN,Roteccente A.Antioxidantactivityapplyingan improved ABTSradicalcanon decolorization assay[J].Free Radical Biology&Medicine,1999,26 (9):1 231-1 237.
[13]张燕,张树淼,王飞,等.近年来植物多糖提取方法研究进展 [J].农产品加工,2015(11):65-68,72.
[14]陈艳珍,宋新华.黄秋葵果实粉对衰老模型小鼠抗氧化能力的影响 [J].食品研究与开发,2014,35(15):19-21.
[15]程旺开,许月明,张冬冬.响应面优化黄秋葵叶多糖的提取工艺及其抗氧化活性考察 [J].中国实验方剂学杂志,2017,23(4):38-42.
[16]张涛.黄秋葵多糖的体外抗氧化活性研究 [J].绿色科技,2017(6):194-196.◇

