腹腔镜与开腹Bismuth-Ⅰ型肝门胆管癌根治术的疗效分析*
(南昌大学第二附属医院 肝胆外科,江西 南昌 330006)
肝门胆管癌是常见的胆道恶性肿瘤之一,约占60.0%~70.0%[1],预后较差,外科手术治疗是唯一可能治愈的方式,若无远处及淋巴结转移,R0切除的患者术后5年生存率为67.1%,但三项有一项为阳性则5年生存率明显下降[2],手术主要包括肝外胆道切除、区域淋巴结清扫、胆道重建或联合肝叶切除术[3]。近年来随着腹腔镜技术的快速发展及腹腔镜设备的更新完善,腹腔镜下肝门胆管癌根治术虽已处于探索阶段[4-6],但缺少相关对照研究,且争议较大。为明确腹腔镜技术在Bismuth-Ⅰ型肝门胆管癌中的治疗价值,此研究回顾分析了2011年1月-2017年1月在本院行开腹(24例)及腹腔镜(10例)手术治疗的34例Bismuth-Ⅰ型肝门胆管癌患者的临床资料。现报道如下:
1 资料与方法
1.1 一般资料
腹腔镜组10例,男6例,女4例,年龄52~70岁,平均(62.00±7.42)岁,开腹组24例,男13例,女11例,年龄46~74岁,平均(59.24±8.05)岁,34例患者均通过病史、外周血浆肿瘤标志物、CT和MRI等相关检查初步诊断为Bismuth-Ⅰ型肝门胆管癌,两组患者一般情况及既往史的发生比例等比较差异均无统计学意义,两组资料存在可比性分析。
1.2 纳入和排除标准
1.2.1 纳入标准①肝功能Child-Pugh B级或A级且无乙型肝炎等病史;②术前影像学诊断、术中证实及术后病理确诊为Bismuth-Ⅰ型肝门胆管癌;③在本院行开腹或腹腔镜下Bismuth-Ⅰ肝门部胆管癌根治术。
1.2.2 排除标准①除术中发现Bismuth-Ⅰ型肝门胆管癌以外的其他分型;②肝十二指肠韧带以外、肝内、周围血管侵犯及远处转移患者;③非手术直接相关并发症致住院时间延长等患者;④其他无关因素影响需比较的相关数据;⑤无法随访的患者。
1.3 手术方法
1.3.1 腹腔镜组全麻,患者取仰卧体分腿位并于术野皮肤常规消毒及铺巾。建立气腹后并于脐孔下缘作一长约1.5 cm的竖形切口插入套管针,置入腹腔镜。直视下按5孔法分别戳孔,插入套管针。取头高左倾斜位,探查腹腔:腹腔无游离腹水及无明显肝硬化改变加之无淋巴结远处转移等情况后,分离肝十二指肠韧带,逐步暴露肝动脉、胆总管、门静脉并清扫第8、9、12、13组等淋巴结并装入标本袋,明确三者关系后。进一步游离肝外胆管,见肝总管璧增厚。于胆总管距肿瘤2.0 cm以上用Endo-GIA、可吸收夹、Homelock夹离断。逐步向上分离至肝门部见左右肝管汇合部无肿瘤浸润。于左右肝管汇合部用电勾切断胆管,离断标本,将标本装入标本袋,并适当延长脐下切口,取出标本袋送术中冰冻病理检查,检查示:胆管上下切缘阴性。于横结肠根部找到屈氏韧带,距屈氏韧带15.0 cm处用超声刀离断系膜,Endo-GIA离断空肠并将远段空肠由结肠前或结肠后提至肝门部,距空肠盲端约3.0 cm对系膜缘切开空肠壁适当大小(取决于肝管端),用4-0倒刺线或其他类型的可吸收线将胆管-空肠吻合。并将近端空肠断端与胆肠吻合口远端约40.0 cm处空肠对系膜缘用Endo-GIA行侧侧吻合,共同开口用倒刺线连续缝合关闭并于胆肠吻合口放置腹腔引流管于右腹引出。本次研究中腹腔镜组2例患者行肝管整形及重建(图1)。本院对于Ⅰ型不是常规选择扩大根治术,Ⅰ型肝门胆管癌的技术点在于肝外胆管的切除(R0)、区域淋巴结清扫(图2)、肝管与消化道重建(图3)。而腹腔镜下Bismuth-Ⅰ型肝门胆管癌根治术主要的难点在于腹腔镜下胆管切缘控制及肝管整形。
1.3.2 开腹组仰卧位,取右侧肋缘下斜切口,长约20.0 cm,逐层进腹,其区域淋巴结清扫及消化道重建等步骤同腹腔镜组。
1.4 观察指标和随访
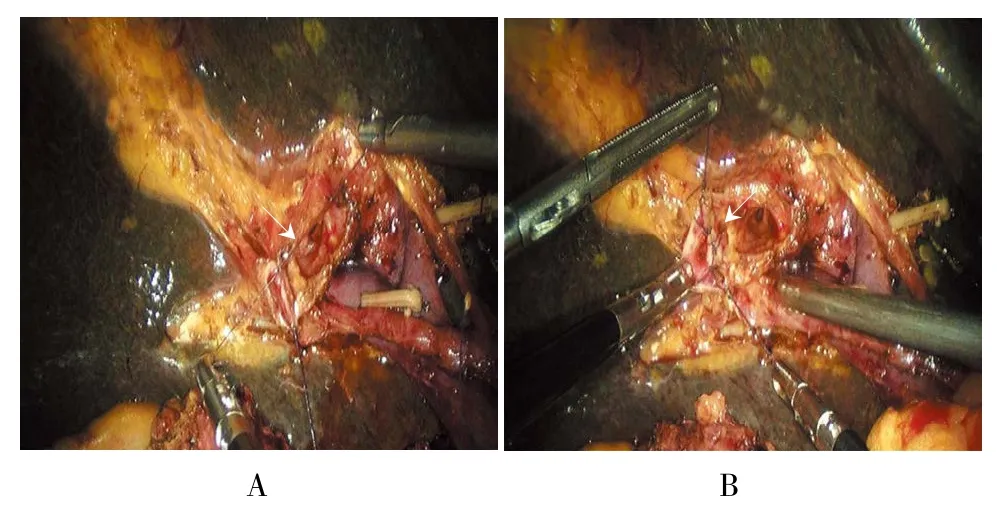
图1 腹腔镜下肝管整形Fig.1 Laparoscopic orthopedics of hepatic duct
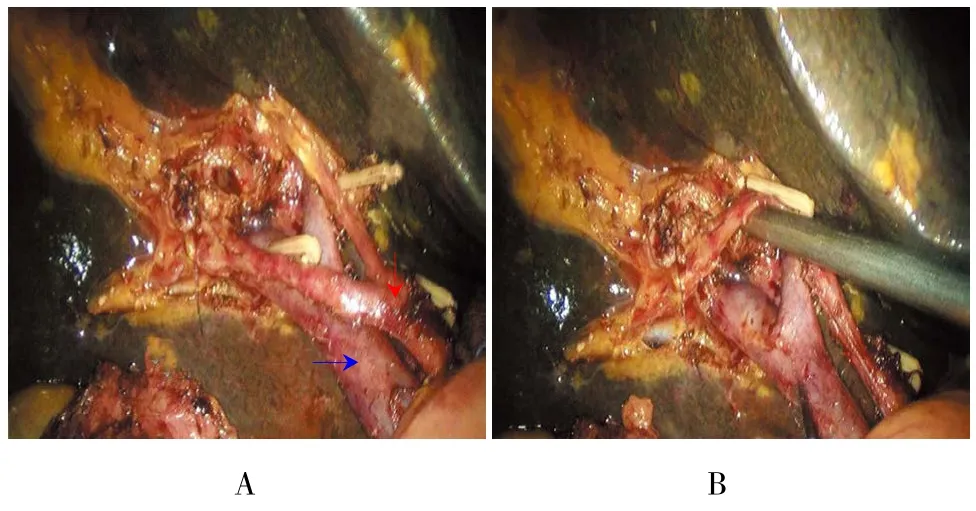
图2 腹腔镜下肝门区血管“骨骼化”及周围淋巴结清扫Fig.2 Laparoscopic hepatoduodenal lym phadenectom y with portal vein and hepatic arteries skeletonized
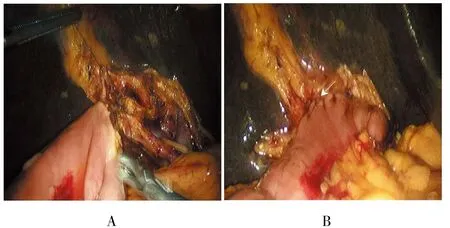
图3 腹腔镜下肝管-空肠吻合Fig.3 Laparoscopic hepatojejunostom y
记录两组患者围手术期肝功能、手术时间、术中出血量、术后住院时间、淋巴结检出数目、胆管上下切缘情况和术后并发症等。采用门诊复查、电话等方式随访。
1.5 统计学方法
采用SPSS 24.0软件进行统计分析,相关计量资料以均数±标准差(±s)表示,行t检验,计数资料行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组手术疗效比较
两组患者均顺利完成肝门胆管癌根治术,腹腔镜组与开腹组患者平均术中出血量分别为(179.50±98.05)和(261.25±97.33)m l,术后平均住院时间分别为(11.80±2.49)和(16.25±3.35)d,差异具有统计学意义(P<0.05)。且腹腔镜组术后淋巴结检出数(9.79±3.05)枚、术后并发症1例、切缘阳性数0例,开腹组术后淋巴结检出数(9.30±3.06)枚、术后并发症3例、切缘阳性数0例,两组差异无统计学意义(P>0.05)。腹腔镜组术后第1、3和5天的总胆红素(total bilirubin,TBIL)分别为(102.20±45.49)、(83.57±30.66)和(45.09±18.41)mmol/L;开腹组术后第1、3和5天TBIL分别为(148.17±62.78)、(121.60±43.35)和(80.59±43.89)mmol/L,差异有统计学意义(P<0.05)。腹腔镜组中术后第1天白蛋白(albumin,Alb)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)与开腹组比较,差异有统计学意义(P<0.05),腹腔镜组平均术中出血量、术后平均住院时间少于开腹组。在淋巴结检出数、术后并发症、胆管切缘阳性数方面两组相似。见表1和2。

表1 两组患者手术情况比较Table 1 Comparison of the opration general data between the two groups
2.2 随访结果
34例患者均获得随访,随访时间为6~18个月,在此期间未见明显肿瘤复发及转移;开腹组患者中3例因腹痛在术后3个月内再次入院,完善影像学检查后2例患者除术后改变外未见明显异常,1例患者提示胆肠吻合口狭窄,3例患者均予以护肝、补液等治疗后症状缓解后出院,未予以其他特殊治疗。余患者未见明显与行肝门胆管癌根治术直接相关因素再入院等情况。
表2 两组患者围手术期肝功能比较 (±s)Table 2 Comparison of perioperative period liver function between the two groups (±s)
TBIL/(mmol/L)术前 术后第1天 术后第3天 术后第5 天腹腔镜组(n=10) 107.59±41.13 102.20±45.49 83.57±30.66 45.09±18.41开腹组(n=24) 136.69±59.03 148.17±62.78 121.60±43.35 80.59±43.89 t值 1.42 2.09 2.43 2.95 P值 0.166 0.045 0.021 0.006组别Alb/(g/L) ALT/(u/L) AST/(u/L)术前 术后第1天 术前 术后第1天 术前 术后第1 天腹腔镜组(n=10) 39.94±2.75 30.80±2.07 121.15±56.21 131.25±46.42 86.12±45.15 122.61±41.43开腹组(n=24) 39.22±3.66 29.20±1.71 127.79±67.05 191.49±74.00 97.18±54.46 180.45±77.39 t值 0.56 2.34 0.28 2.37 0.57 2.22 P值 0.581 0.026 0.785 0.024 0.576 0.034组别
3 讨论
肝门胆管癌因其位于肝门部靠近周围重要血管,且具有沿着胆管壁及管周组织纵向浸润生长的病理学特性[7],增加了手术难度,影响手术效果。随着医学技术的进步及对肝门胆管癌病理生理等认识的提高,开腹行肝门胆管癌根治术的技术日益成熟,此外对于不同类型的肝门胆管癌的切除范围一直是争论的热点,对于Bismuth-Ⅰ型肝门胆管癌根治术是联合肝切除的扩大根治术还是仅行肝外胆管切除及区域淋巴结清扫也无明确的共识,相关报道称扩大根治的临床效果与后者相似[8]。本院对于Ⅰ型不是常规选择扩大根治术,Ⅰ型肝门胆管癌的技术点在于肝外胆管的切除(R0)、区域淋巴结清扫、肝管与消化道重建。在微创技术快速发展的时代,腹腔镜技术已经用于多种良、恶性疾病,其中腹腔镜下胰十二指肠切除术[9]、腹腔镜下肝部分切除术(包括结直肠癌肝转移)[10]等其临床疗效已形成共识。这使得腹腔镜下Bismuth-Ⅰ型肝门胆管癌根治术的开展有了技术的支持,其手术主要的难点在于腹腔镜下胆管切缘控制及肝管整形。
R0切除是肿瘤根治术的重要要求,对肝门胆管癌也是如此,切缘的阳性率直接影响患者的预后[11]。如何达到R0切除,在传统开腹手术中可以采用术中触摸胆管周围情况,联合术前影像比较,采用术中冰冻等可增加R0切除率;在腹腔镜手术中无法行触摸、观察等直接反馈,因而术中冰冻的重要性更加突出。本研究两组所有患者均无胆管上下切缘阳性,两组在胆管切缘的控制方面无差异。术中均采用术中冰冻且尽可能的远离肿瘤离断胆管避免因术中的假阴性率造成的术后病理提示切缘阳性结果。虽目前有相关研究报道胆管术中冰冻的准确率较低等情况[12-13],但其主要原因可能是因肝门胆管癌沿胆管壁及黏膜纵向扩展等生物学特性[12,14]。适当在远离术中冰冻的胆管切缘行胆肠吻合,有助于提高R0切除率。胆管断端的处理,当胆管上切缘离断后肝门部出现多支肝胆管开口时应进行整形,对于Ⅰ型肝门胆管癌患者术中需进行胆管整形的主要原因是解剖异常,如汇合位置低、异常胆管支等情况。整形后的胆管端尽量形成1个开口,以此避免多个胆管端分别吻合造成手术难度增大、术后并发症增多等情况。本次研究中腹腔镜组2例患者行胆管整形及重建。
区域淋巴结清扫的范围及数目对患者总体生存率的影响一直是讨论的热点。据报道,阳性淋巴结检出率在19.0%~53.0%[15],同时,较多研究表明淋巴结转移是影响术后患者预后的独立危险因素[16],淋巴结阳性的肝门胆管根治术后患者5年生存率低于25.0%,淋巴结阴性患者则可达50.0%[15,17]。笔者认为对于Bismuth-Ⅰ型肝门胆管癌根治术应使肝门区血管“骨骼化”,清扫8、9、12、13组所有淋巴结[18]。对于Bismuth-Ⅰ型肝门部胆管癌,肠系膜上血管区淋巴结及腹主动脉周围淋巴结不常规清扫,且相关研究报道行腹主动脉旁淋巴结预防性清扫不能提高患者预后[19]。虽腹腔镜下淋巴结清扫困难较大然其可行性早已被证实,但本研究中两组平均检出淋巴结数分别为(9.79±3.05)和(9.30±3.06)枚,两者未有明显差异,且已报道在多种肿瘤根治术中腹腔镜与开腹手术在淋巴结上的检出率相似。
腹腔镜与开腹的肝门部胆管癌的根治术的近期疗效相关数据对比分析,开腹组手术时间(213.83±37.06)min,腹腔镜组手术时间(263.00±30.93)min,腹腔镜组手术时间更长且差异具有统计学意义(P<0.05)。开腹组的术中出血量(261.25±97.33)ml,腹腔镜组术中出血量(179.50±98.05)ml,腹腔镜组患者术中出血量更少,差异具有统计学意义(P<0.05)。从以上数据分析腹腔镜组较开腹组手术时间更长,但能减少术中出血,手术时间更长其原因可能因腹腔镜在肝门部胆管癌中的运用时间较短,病例数较少,在手术熟练操作上暂时与开腹手术存在差异。腹腔镜组与开腹组的术后平均住院时间分别为(11.80±2.49)和(16.25±3.35)d,差异具有统计学意义(P<0.05),腹腔镜组的术后住院时间较开腹组明显缩短其可认为是腹腔镜的微创优势的体现。在围手术期肝功能变化方面分析,腹腔镜组术后1、3和5天的TBIL分别为(102.20±45.49)、(83.57±30.66)和(45.09±18.41)mmol/L;开腹组术后1、3和5天TBIL(148.17±62.78)、(121.60±43.35)和(80.59±43.89)mmol/L,两组差异具有统计学意义(P<0.05)。腹腔镜组术后第1天Alb(30.80±2.07)g/L较之开腹组(29.20±1.71)g/L差异具有统计学意义(P<0.05)。腹腔镜组术后第1天的ALT为(131.25±46.42)u/L、AST为(122.61±41.43)u/L较之开腹组的ALT(191.49±74.00)u/L、AST(180.45±77.39)u/L之间的差异具有统计学意义(P<0.05)。这些统计结果可在一定程度上表明,腹腔镜组较之开腹组在围手术期对肝功能的影响较小,且术后肝功能的恢复较快。因此,这是腹腔镜技术在肝门部胆管癌手术中运用的优势体现之一。
目前腹腔镜下肝门胆管癌根治术在国内[20-21]及国外均有报道,但缺乏高质量研究,已报告的文献多单病例报道、多病例分析等形式为主,无论是肝门部胆管癌微创治疗的技术可行性还是理论可行性均需要大量研究及实践,肝门胆管癌的微创治疗仍处于研究的早期阶段,应循序渐进,不应一味追求微创手术,且相关研究也暂表示对不合适的患者激进的行腹腔镜下肝门胆管癌根治术临床效果存疑及争议[22-24]。
综上所述,对于Bismeth-Ⅰ肝门胆管癌,腹腔镜手术是一种有望成为替代传统开腹手术的另一种选择,但目前仍缺少高质量的前瞻性研究及长期的随访评估两种手术方式患者的生存率等相关数据分析。目前对于其他类型的肝门胆管癌的微创治疗争议较大,随着技术的进步其微创治疗的可行性是否存在,这有待于后续的研究。
[1]ALJIFFRY M,WALSH MJ,MOLINARI M.Advances in diagnosis,treatment and palliation of cholangiocarcinoma: 1990-2009[J].World J Gastroenterol,2009,15(34): 4240-4262.
[2]NAGINO M,EBATA T,YOKOYAMA Y,et al.Evolution of surgical treatment for perihilar cholangiocarcinoma: a singlecenter 34-year review of 574 consecutive resections[J].Ann Surg,2013,258(1): 129-140.
[3]AGRAWAL S,BELGHITI J.Oncologic resection for malignant tumors of the liver[J].Ann Surg,2011,253(4): 656-665.
[4]GUMBS A A,JARUFE N,GAYET B.Minim ally invasive app roaches to ex trapancreatic cho langiocarcinoma[J].Surg Endosc,2013,27(2): 406-414.
[5]MACHADO MA,MAKDISSI F F,SURJAN R C,et al.Laparoscopic resection of hilar cho langiocarcinom a[J].J Laparoendosc Adv Surg Tech A,2012,22(10): 954-956.
[6]LEE W,HAN H S,YOON Y S,et al.Laparoscopic resection of hilar cholangiocarcinoma[J].Ann Surg Treat Res,2015,89(4): 228-232.
[7]HAN I W,JANG J Y,KANG MJ,et al.Role of resection for Bism uth type IV hilar cho langiocarcinom a and analysis of determining factors for curative resection[J].Ann Surg Treat Res,2014,87(2): 87-93.
[8]CHEN X P,LAU W Y,HUANG Z Y,et al.Extent of liver resection for hilar cholangiocarcinoma[J].Br J Surg,2009,96(10): 1167-1175.
[9]GODHI S A,NADI P R,SALUJA S,et al.Minimally invasive versus open pancreaticoduodenectomy for cancer.Practice patterns and short-term outcomes among 7061 patients[J].Ann Surg,2017,266(2): e26.
[10]MARTINEZ-CECILIA D,CIPRIANI F,VISHAL S,et al.Laparoscopic versus open liver resection for colorectal metastases in elderly and octogenarian patients: a multicenter propensity score based analysis of short- and long-term outcomes[J].Ann Surg,2017,265(6): 1192-1200.
[11]BUETTNER S,MARGONIS G A,KIM Y,et al.Conditional p robability of long-term survival after resection of hilar cholangiocarcinoma[J].HPB (Oxford),2016,18(6): 510-517.
[12]MANTEL H T,WESTERKAMP A C,SIEDERS E,et al.Intraoperative frozen section analysis of the proximal bile ducts in hilar cholangiocarcinoma is of limited value[J].Cancer Med,2016,5(7): 1373-1380.
[13]LEE J H,HWANG D W,LEE SY,et al.The proximal margin of resected hilar cholangiocarcinoma: the effect of microscopic positive margin on long-term survival[J].Am Surg,2012,78(4): 471-477.
[14]LIM J H,PARK C K.Pathology of cholangiocarcinoma[J].Abdom Imaging,2004,29(5): 540-547.
[15]AOBA T,EBATA T,YOKOYAMA Y,et al.Assessment of nodal status for perihilar cholangiocarcinoma: location,number,or ratio of involved nodes[J].Ann Surg,2013,257(4): 718-725.
[16]OKABE H,BEPPU T,NAKAGAWA S,et al.Percentage of future liver remnant volume before portal vein embolization influences the degree of liver regeneration after hepatectomy[J].J Gastrointest Surg,2013,17(8): 1447-1451.
[17]LAI E C,LAU W Y.Aggressive surgical resection for hilar cholangiocarcinoma[J].ANZ J Surg,2005,75(11): 981-985.
[18]BIRD N,ELMASRY M,JONES R,et al.Role of staging laparoscopy in the stratification of patients with perihilar cholangiocarcinoma[J].Br J Surg,2017,104(4): 418-425.
[19]MAO K,LIU J,SUN J,et al.Patterns and prognostic value of lymph node dissection for resected perihilar cholangiocarcinoma[J].J Gastroenterol Hepatol,2016,31(2): 417-426.
[20]陈德兴,曹春和,徐刚.腹腔镜上段胆管癌根治切除术[J].中国微创外科杂志,2008,8(1): 31-34.
[20]CHEN D X,CAO C H,XU G,et al.Laparoscopic cholangiotomy for radical excision of upper cholangiocarcinoma[J].Chin J Min Inv Surg,2008,8(1): 31-34.Chinese
[21]朱安东,刘奇,陈德兴.腹腔镜下肝门部胆管癌根治术中淋巴结廓清方法的探讨[J].中国微创外科杂志,2010,10(10): 922-924.
[21]ZHU A D,LIU Q,CHEN D X.Laparoscopic radical resection of hilar cholangiocarcinoma and lymph node dissection[J].Chin J Min Inv Surg,2010,10(10): 922-924.Chinese
[22]YU H,WU S D,CHEN D X,et al.Laparoscopic resection of Bismuth type I and II hilar cholangiocarcinoma: an audit of 14 cases from two institutions[J].Dig Surg,2011,28(1): 44-49.
[23]DONATI M,STAVROU G A,OLDHAFER K J.Laparoscopic resections for hilar cholangiocarcinomas: a critical appraisal[J].Dig Surg,2011,28(4): 277-278.
[24]CLARY B,JARNIGAN W,PITT H,et al.Hilar cholangiocarcinoma[J].J Gastrointest Surg,2004,8(3): 298-302.

