酯化红曲霉的分离纯化及其在固态发酵中的应用研究
单淑芳,丁 咚,赵 颖,徐 君,黄跃勇,张国强
(安徽口子酒业股份有限公司,安徽淮北 235100)
红曲霉属于真菌门、子囊菌亚门、不整子囊菌纲、散囊菌目、红曲科(Monascaceae)、红曲属(Monascus),是腐生真菌,能产生红色色素,可用做食品加工中天然红色色素的来源,如在红腐乳、饮料、肉类加工中用的红曲米,就是用红曲霉制作的[1-4]。近代发酵工业用它生产葡萄酒、酒精发酵和红曲色素,以及用于调节血脂、降低血压等系列功能性红曲制品等[5]。
高温季节中的酒醅,由于环境气温高,一般都存在酸度高、残余淀粉高、乳酸菌和杂菌数量多、繁殖快的现象,大量微生物侵入发酵体系中,影响酵母及有益菌的正常繁殖和发酵,从而导致曲酒产量和质量明显下降。酯化红曲是由红曲霉等多种产酯功能菌混合培养制成,是复合菌剂、生物酶和活菌体的生态混合体[6]。红曲霉具有嗜酸的特性,尤其是嗜乳酸,能够利用乳酸为碳源繁殖发酵,解除了酸对微生物细胞的毒害作用,因而在白酒生产中能降低酒醅中乳酸和乳酸乙酯的含量;红曲霉本身可以代谢产生己酸乙酯合成酶,加快白酒中己酸乙酯的生成速度,提高酯化率,从而达到提高优质酒率的目的[2]。
为了改进安徽口子酒传统大曲的生化性能,提高白酒的优质品率,我公司以酯化红曲为含菌源,分离出酯化力强的功能菌种。以此为试验菌株,经固态纯种培菌发酵,按一定比例添加到制曲原料中,制成强化大曲,或是直接与大曲混合,添加到酒醅中进行发酵。
1 材料与方法
1.1 材料、仪器
原料:红曲,某企业取样。
仪器设备:立式恒温生化培养箱,螺旋管蒸馏器,显微镜,高压灭菌锅,玻璃量筒,玻璃烧杯,三角瓶,试管,吸管,培养皿,酒精灯,涂布棒,安捷伦6820气相色谱仪等。
1.2 试验培养基
1.2.1 分离纯化培养基
麦芽汁培养基:麦芽浸膏30 g 、琼脂15 g、水1000 mL、pH5.5左右、121℃灭菌15 min。
改良麦芽汁培养基:麦芽浸膏30 g、琼脂15 g、酒精10%vol、水1000 mL、乳酸调pH3.5左右、121℃灭菌15 min。
1.2.2 试管斜面培养基
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、水1000 mL、pH值自然。
1.2.3 液体种子培养基
麦芽汁液体培养基:麦芽汁浸膏30g,水1000 mL,pH值自然。
1.2.4 三角瓶培养基
大米培养基:大米用蒸馏水浸泡24 h(米∶水=1∶1),按每瓶50 g干料装入500 mL三角瓶。
全麸皮培养基:按1∶1比例加入蒸馏水拌湿的大片麸皮,拌湿至手捏成团,松手即散为准,按50 g干料装入500 mL三角瓶。
大米和麸皮混合培养基:干料大米∶麸皮为2∶1,浸泡24 h的大米和按1∶1比例加入蒸馏水拌湿的大片麸皮,按每瓶50 g干料装入500 mL三角瓶内,混匀。
1.3 试验工艺
红曲酯化酶➝分离➝纯化➝母菌➝斜面➝液体种子➝大三角瓶➝红曲扩大生产➝红曲应用于生产

1.4 试验方法
1.4.1 红曲酯化酶的微生物分离、纯化
分离方法:稀释涂布平板法。
纯化方法:平板划线法。
1.4.2 菌种的初步鉴定
用肉眼观察菌落的生长、颜色、表面形态、质地、边缘形状等,用显微镜观察菌丝、孢子和子实体结构的形态。
1.4.3 红曲霉的斜面培养
培养条件:在无菌条件下接入红曲霉菌种,置入生化培养箱内,35℃培养7~8 d。
1.4.4 液体种子培养
三角瓶液体培养基在无菌条件下接入试管斜面菌种,置入生化培养箱内,以35℃、150 r/min振荡培养7 d。
1.4.5 三角瓶培养[2]
上述3种培养基置于0.1MPa压力下灭菌30min,取出冷却至室温摇散,使其充分吸收三角瓶壁的冷凝水,根据培养基的干湿情况补充含适量乳酸和乙醇的无菌水,继续润料30 min。
用微量移液器吸取10 mL液体种子至三角瓶固体培养基内,将接种好的三角瓶摇匀,然后把物料堆积在瓶的一角,以利升温,放入32~35℃培养箱中培养。
当大部分物料上可看到菌丝生长时,摇瓶1次,使附在瓶壁上的冷凝水被物料吸收,然后把物料摊开,再继续培养,随时观察曲料的干湿程度,视情况加入无菌水调湿度。
经过一段时间的培养,菌种发育成熟,红曲色泽深红,发酵均匀,无杂菌污染,有红曲特有的曲香味。
将曲料倒出,在40~45℃下进行烘干或在太阳下曝晒,晒干后,用粉碎机粉碎,干净塑料袋装好,放在干燥阴凉处保存备用。
1.4.6 酯化力测试
用吸管吸取1.5 mL(约1.5%)己酸于500 mL三角瓶中,再加入25 mL(约25%)无水乙醇,稍加振荡后加入75 mL蒸馏水,充分混匀,再称取红曲粉10 g(绝干曲)于三角瓶中,摇匀后用塞子塞上,置于35℃恒温箱内保温酯化7 d。将酯化7 d后的试样倒入500 mL蒸馏烧瓶中,量取50 mL30%乙醇溶液充分洗涤盛装酯化液的三角瓶,将洗液一并倒入蒸馏烧瓶中蒸馏,取蒸馏液50 mL,用色谱仪分析蒸馏液中己酸乙酯含量。
1.4.7 气相色谱条件
色谱柱:DNP不锈钢填充柱(3 m×3 mm),柱温:93℃,进样口温度:200℃,检测器温度:200℃,载气:高纯氮,柱头压0.3 MPa,氢气压力:0.06 MPa,空气压力:0.05 MPa,进样量为0.3 μL。
1.4.8 红曲扩大生产[2]
大米和麸皮混合培养基:干料大米∶麸皮为2∶1,浸泡24 h的大米(米∶水=1∶1)和按1∶1比例加入蒸馏水拌湿的大片麸皮,按每6斤干料放入一个匾配料,用纱布包裹放在托盘中,常压蒸1 h,然后冷却至35℃,送入培菌室。
大米培养基:大米用蒸馏水浸泡24 h(米∶水=1∶1),按每6斤干料放入一个匾配料,常压蒸1 h,然后冷却至35℃,送入培菌室。
将托盘中的熟料均匀的铺在培菌室的匾上,厚度3~4 cm,下铺2层医用纱布(已灭菌),倒出三角瓶液体种曲与物料充分混合,铺平,接种比例25%,注意接种过程中尽量避免手与物料接触。
接种后,保证品温在30℃左右,每天上下午观察室温、品温及物料的干湿情况,随时调整室温,控制品温不要超过35℃,及时喷洒无菌水。物料色泽深红,发酵均匀,无杂菌污染,有曲香味,说明菌种发育成熟,即可烘干,粉碎。
2 结果与分析
2.1 酯化红曲的微生物分离结果
此次分离的培养基是麦芽汁培养基和添加了乳酸和乙醇的改良麦芽汁培养基,分离出了红曲霉、根霉、毛霉、曲霉、青霉等霉菌(见表1),这说明酯化红曲是由红曲霉等多种产酯功能菌混合培养制成,是复合菌剂、生物酶和活菌体的生态混合体。

表1 酯化红曲中分离出的霉菌
2.2 菌落形态和个体形态观察
图1、图2、图3、图4是此次从酯化红曲中分离出来的1号菌株和6号菌株。
在麦芽汁培养基上培养1号菌株,初期为白色圆形绒毛状,继续培养菌落中央变为浅橙色,随着培养时间的变长,菌落中央的颜色越来越深,呈深橙色,背面颜色更深些,表面绒毛状气生菌丝,较易挑取。菌丝有横隔、分枝,分生孢子着生在菌丝及其分枝的顶端,单生或呈链、球形。8号菌株和12号菌株的菌落形态与1号一致(见图1和图3)。
6号菌株在麦芽汁培养基上培养初期为白色,以后呈紫红色,色素分泌到培养基中,背面也是紫色。边缘整齐,辐射状,有皱折。表面有膜状蔓延生长物,干燥、不易挑取。菌丝体有横隔、分枝,闭囊壳为球形,子囊球形。分生孢子着生在菌丝及其分支的顶端,单生或成链、球形(见图2和图4)。
这些菌株形态都与红曲霉属菌落特征一致,应属于红曲霉属的两个种,尤其是6号菌株与紫红曲霉的形态特征描述基本一致,如需要确定到种,还需通过分子测序技术进一步鉴定。

图1 1号菌株宏观形态
2.3 三角瓶培养红曲酯化力测定结果
三角瓶培养选取大米培养基、麸皮培养基和大米、麸皮混合培养基培养,培养15 d以后,晒干、粉碎,测水分、酯化力,色谱分析结果见表2。
从实验结果看,大米培养基和混合培养基上的红曲霉发酵产物酯化力相当,都明显高于纯麸皮培养基,可能是麸皮的营养不足以满足红曲霉的生长代谢。从4株菌株发酵产物酯化力来看,相同培养基比较,菌株之间无显著差异。纯麸皮培养的酯化力比外购红曲略高,纯大米和混合培养的酯化力显著高于外购红曲。

图2 6号菌株宏观形态
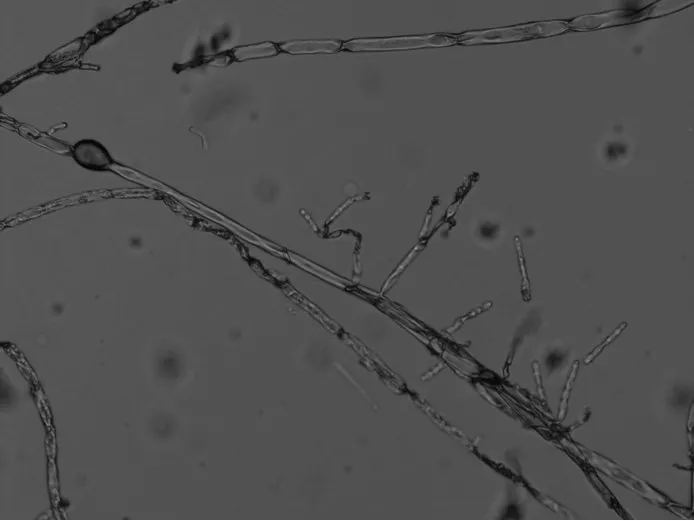
图3 1号菌株微观形态

图4 6号菌株微观形态
三角瓶培养选取大米培养基、麸皮培养基和大米、麸皮混合培养基培养。
⑤大米培养基上接种的菌株3 d后,全部产红色素或紫红色色素。

表2 三角瓶培养红曲酯化力测定结果 (mg/100 mL)
⑤麸皮及混合培养基1号、8号、12号菌株都长有白色菌丝,6号菌株产少量紫红色色素。
⑤混合培养基长势良好,布满白色菌丝,到后期因营养匮乏,渐渐停止生长。
⑤麸皮培养基上菌丝长势较弱,较开始几天长势缓慢,瓶壁上有小水珠生成,有可能是菌体自身新陈代谢产生的水分,所以后期不用再喷水,而需排湿。
⑤大米培养基到后期菌丝生长旺盛,并产大量红色或紫色色素,从酯化力来看,大米培养基较适宜于红曲霉生长,麸皮培养基营养不足以满足红曲霉的生长代谢,酯化力较低。随机选取的4株菌株同培养基之间酯化力也无显著差异。
2.4 第一批扩大培养红曲酯化力测定结果
根据三角瓶培养的结果可以看出,大米培养基和大米、麸皮混合培养基培养的红曲酯化力较高,单纯麸皮培养基营养匮乏,所以此次扩大培养选取大米培养基和混合培养基培养。培养7 d左右,菌丝在料中基本长透,且已产红色色素,即已成熟,取出晾干、粉碎,做酯化力测定,色谱分析结果见表3。
此次培养,由于温湿度没有控制好,除12号菌株大米培养基正常发酵没有污染外,其他所有菌株培养发酵的培养基全部都有不同程度的腐烂、发臭,晾干、粉碎后,测其酯化力,12号菌株的大米培养发酵产物酯化力明显高于其他培养基发酵产物。从此次污染的结果也可以看出,污染越严重,酯化力越低,说明红曲霉相对于其他霉菌、细菌在酯化能力上还是起到很大作用的。

表3 第一批扩大培养红曲酯化力测定结果(mg/100 mL)
根据三角瓶培养的结果,第一次扩大培养选取大米培养基和混合培养基培养,菌种仍是以上4株菌株。
在第一次扩大培养过程中,发现混合培养基保湿性好,前期产热快,说明红曲霉在其中代谢生长快,由于没有及时降低品温及室温,中后期菌丝已停止生长,物料发臭。大米培养基开始水分低,锁水性差,后期培养过程中很容易蒸发造成水分散失,因此要频繁观察其干湿情况,以免影响生长,到中后期品温突升,没有及时降低室温及品温,导致此次扩大培养物料大多发臭,因此酯化力也相当低,只有12号菌株在大米培养基上培养没有污染,温湿度控制适宜红曲霉生长,酯化力相应的要高些。
2.5 第二批扩大培养红曲酯化力测定结果
第一次扩大培养只有12号菌株在大米培养基上培养没有污染,长势很好,酯化力也很高,其他都已经有污染;总体来看大米、麸皮混合培养基培养的红曲酯化力不如大米培养基培养的好,所以此次全部选用大米培养基培养,色谱分析结果见表4。
此次扩大培养,在第一次失败的基础上,总体来说温湿度控制还不错,酯化力测试结果都挺高。比较各菌株在大米培养基上的发酵产物,1号菌株和6号菌株己酸乙酯都在790 mg/100 mL左右,12号菌株和混合菌株己酸乙酯都在850 mg/100 mL左右,相对于同等条件下的外购红曲均高很多。

表4 第二批扩大培养红曲酯化力测定结果(mg/100 mL)
综合三角瓶培养和第1次扩大培养的红曲酯化力发现,大米培养基是较适宜红曲霉生长的培养基,第2次扩大培养全部选用大米培养基培养。
大米要蒸透,软而不黏,刚接种时室温不能太高,由于培养基温度高,若室温也高,加上菌种自身生长代谢产热,容易导致品温上升过快,菌丝刚长出又因温度高而被抑制。渐渐地大米会在高温环境中慢慢腐烂,培养基中氧气渐渐变少,新长出的菌丝也因无氧气及高温而被抑制生长。因此,接种后的第2天要根据品温及时地调整室温。掌握好这一点,后期主要观察其干湿情况,调节干湿度。5~6 d的培养,曲外观色泽鲜红或白色,手抓起来很轻,有特有的曲香味,即已成熟,取出,晾干,粉碎,做酯化力测试,色谱分析结果显示,酯化力比外购红曲要高出2倍多。
3 结论
此次试验以酯化红曲为含菌源,分离纯化出酯化力强的功能菌种红曲霉。经形态观察,初步确定此次分离出的红曲菌种为两种红曲霉。选取其中4株为试验菌株,在不同的培养底物中,经固态纯种发酵制成固态红曲,从气相色谱仪测定其酯化力大小来看,大米较适宜于红曲霉生长代谢。在用大米作为培养底物时,大米要蒸透,软而不黏,刚接种红曲霉时,要注意室温的控制,根据品温情况及时调节室温,掌握好这一点是重中之重,后期主要观察其干湿情况,调节干湿度。另外,从三角瓶培养和第2次扩大培养结果看,选取的4株菌株同培养底物之间酯化力无显著差异。
接下来的试验要看在酒醅中能否提高出酒率,达到“增己降乳”的效果,如果一切顺利,则本试验应该针对红曲霉的培养条件、酯化过程条件控制等方面继续进行研究。
[1]胡晓龙,赵东,葛隐,等.五粮液大曲中产酯化酶红曲霉的分离及酯化酶的纯化[J].酿酒,2011(3):35-38.
[2]程江红,何汝良,程江浩,等.酯化红曲工艺研究及在酿

