六硝基六氮杂异戊兹烷自催化分解特性与热安全性研究
王凯, 肖松, 申孝立, 郭天吉, 涂建, 刘大斌
(1.北京航天长征飞行器研究所, 北京 100076; 2.南京理工大学 化工学院, 江苏 南京 210094; 3.火箭军驻国营519厂军事代表室, 山西 长治 046000)
0 引言
六硝基六氮杂异戊兹烷(CL-20)作为一种高能量密度含能材料,是具有笼型结构的硝胺化合物,也是多晶型化合物[1-5]。CL-20是目前公认的爆炸能量最高的含能材料,其爆炸能量比奥克托今高14%~20%,最高密度大于2 g/cm3 [6-7].
Gao等[8]利用差示扫描量热(DSC)仪和Micro-DSC装置研究了CL-20的热行为和非等温热分解反应动力学和比热容,并计算了其热爆炸临界温度、自加速分解温度等数据。蔡如琳等[9]采用DSC-热重(TG)同步热分析法和TG-红外(FTIR)联用技术研究了高氯酸铵(AP)/CL-20混合体系的热分解行为,分析了混合体系中AP与CL-20的相互作用。欧阳刚等[10]采用粉碎机成功制备了亚微米级CL-20,利用DSC-TG和DSC分析其热分解特性,同时表征了产品的冲击波感度。宋乃孟等[11]运用DSC仪研究了间苯三酚铁对CL-20热分解过程及动力学参数的影响。上述文献均对CL-20的热分解进行了研究,但没有研究CL-20的具体反应类型及特征。
自催化分解反应在含能材料中很常见,这类反应容易受到未知的外部影响而被意外引发,并伴随热量的突然释放,因此这类反应十分危险。不同于一般的n级动力学分解反应,自催化反应在发生剧烈反应前的很长一段时间内,都不会有明显的温升现象,而一旦发生明显的温升就会迅速发展成热爆炸[12]。因此,研究CL-20的反应类型及其特性具有重要的意义。
Roduit等[13]研究发现,对于自催化反应,受热部分分解的样品,其动态DSC曲线将发生很大变化。基于Roduit的理论,本文用中断回归法[14]研究了CL-20的自催化分解特性。同时利用瑞士安全技术与保障研究所提出的一种比较有效可靠且具有较高统计学意义的鉴别自催化反应的方法——瑞士方法[15],研究了CL-20的自催化分解特性,并利用等温法对上述两种方法的实验结果进行了验证。
1 实验条件与方法
1.1 实验样品与仪器
选用自制CL-20作为试剂,纯度大于99%.
DSC仪选用瑞士Mettler-Toledo公司生产的专业型DSC-1仪;坩埚为高压密封不锈钢坩埚并配有镀金垫片;吹扫气与保护气均为高纯氮气,流量为40 mL/min;所用参比物为空的不锈钢坩埚。
1.2 实验方法
1.2.1 动态DSC实验
升温速率β分别为2 ℃/min、5 ℃/min、10 ℃/min、20 ℃/min,温度范围为50~400 ℃.
1.2.2 中断回归法实验
步骤1对待测样品进行完整的动态DSC实验,升温速率为10 ℃/min,得到第1条DSC曲线。从第1条DSC曲线中得到起始分解温度To、峰温Tp、放热量ΔHr等数据,曲线标记为10 ℃/min-1.
步骤2重新装样,在同样的实验条件下升温至中断温度Ti,然后将样品冷却。对冷却后的样品进行完整的动态DSC实验,得到第2条DSC曲线。同样得到第2条DSC曲线的To、Tp、ΔHr等数据。如果第2条曲线的To、Tp低于第1条曲线,则判定其分解反应为自催化反应。为了验证该方法的可重复性,Ti取3个温度,得到的不同曲线标记为10 ℃/min-2、10 ℃/min-3和10 ℃/min-4.Ti的取值方法是:对步骤1得到的曲线进行面积积分,得到转化率分别为0.1、0.2和0.3时所对应的反应温度,此温度即为Ti所取的3个温度。
1.2.3 瑞士方法实验
假定反应初期可以用一级反应模型进行描述。采用一个简单的一级反应模型,通过调整模型中的活化能,对放热峰的开始阶段进行拟合。设qo为起始分解温度To对应的放热速率。在To时转化率α非常小,可以认为接近于0,因此反应初期的放热速率可用(1)式表示:
(1)
式中:Eα为表观活化能(kJ/mol);R为理想气体常数(kJ/(mol·K));T为反应温度(℃). 截取α为0.001~0.100范围内的曲线数据,得到To和qo. 将数据(To、qo和(q,T,α)在不同温度点的对应关系)代入(1)式进行拟合,得到拟合曲线与原实验曲线相关系数最大时的表观活化能Eα.
当表观活化能Eα>220 kJ/mol时,判定其分解为自催化反应;当表观活化能Eα<180 kJ/mol时,判定其分解为n级反应[15]。需要强调的是,这里的表观活化能Eα只用来判定物质分解的自催化反应特性,不代表任何意义。
1.2.4 等温DSC实验
实验温度为210 ℃. 当DSC实验仪器升温至210 ℃并稳定一段时间后,放入盛有样品的坩锅,记录样品放热情况。当放热速率曲线回归到基线位置时,实验结果。
2 实验结果与分析
2.1 动态DSC实验
CL-20在不同升温速率下的动态DSC曲线如图1所示,实验条件及结果如表1所示。从图1可以看出,随着升温速率的提高,CL-20的放热分解峰向高温方向偏移。在升温速率分别为2 ℃/min、5 ℃/min、10 ℃/min、20 ℃/min的条件下,其起始分解温度在233.5~255.7 ℃范围内,峰温在244.6~259.8 ℃范围内,放热量的平均值为3 923.5 J/g.
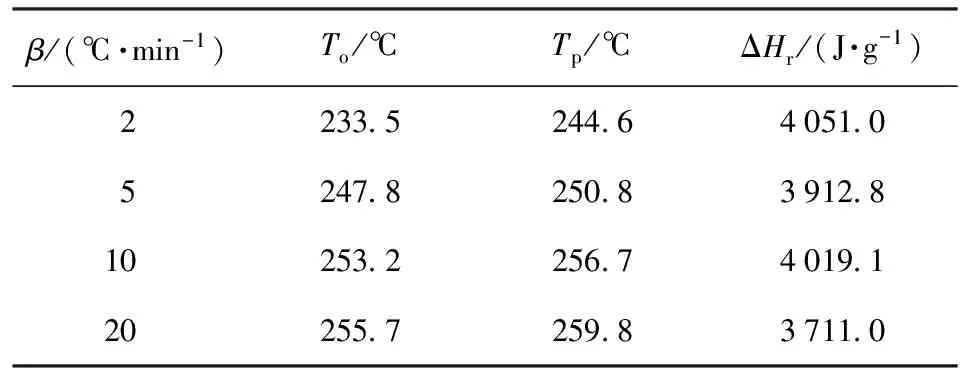
表1 CL-20动态DSC实验的条件及结果
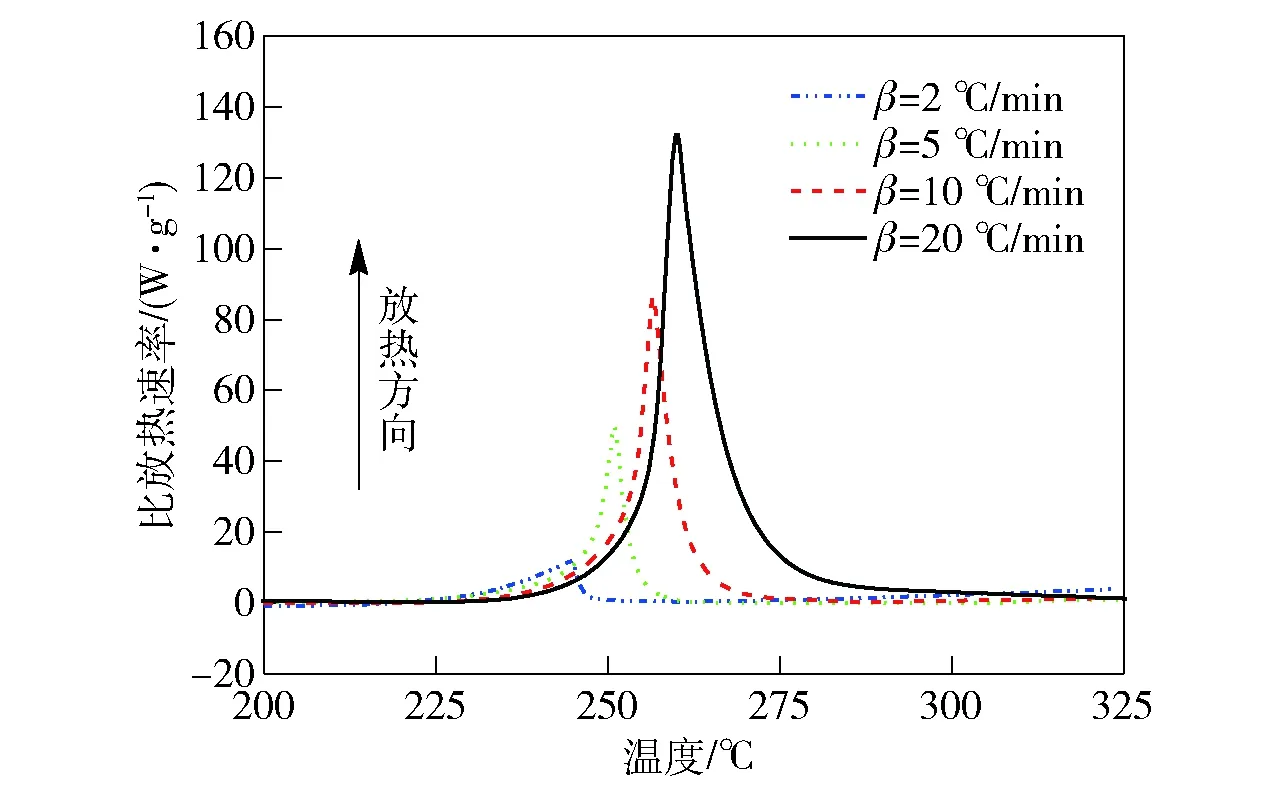
图1 CL-20在不同升温速率条件下的动态DSC曲线Fig.1 Dynamic DSC curves of CL-20 at different heating rates
由图1和表1可以看出,CL-20的放热量很大,其放热峰的峰形较尖锐。由此可见,放热峰形尖锐的物质其分解反应倾向于自催化反应[12]。本文将继续利用中断回归法、瑞士方法和等温法来进一步鉴别CL-20的反应类型。
2.2 中断回归法实验
为了研究CL-20的自催化反应特性,同时研究热履历对CL-20热安全性的影响,应用1.2节中的中断回归法对CL-20进行实验。本文中Ti的取值是根据多次摸索实验得到的结果,其具体取值以及中断回归法实验的条件与结果见表2. 图2为该方法得到的DSC曲线。

表2 CL-20中断回归法实验的条件及结果
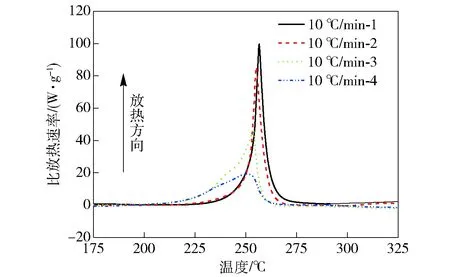
图2 CL-20的中断回归法实验曲线Fig.2 DSC curves of CL-20 collected by the “interruption and re-scanning” method
由图2及表2可以看出,中断回归法实验中步骤2得到的曲线分解放热峰明显向低温方向偏移,且随着中断温度的增大,分解放热峰向低温方向的偏移越严重。中断实验之后,CL-20 DSC曲线的起始分解温度和峰温均降低,在曲线10 ℃/min- 4中,其起始分解温度为219 ℃,大大低于中断之前CL-20的起始分解温度253.2 ℃,这意味着其热安全性降低,即热履历显著降低了CL-20的热安全性。在中断回归法实验的步骤2之后,CL-20部分分解产生了一定量的产物,这些产物将对CL-20的热分解产生催化作用。根据中断回归法的判定依据可知,CL-20的热分解是自催化反应。
2.3 瑞士方法实验
利用瑞士方法实验对CL-20的自催化反应特性进行研究。图3为该实验获得的不同升温速率下的实验曲线与拟合曲线,表3为该实验的条件与结果。
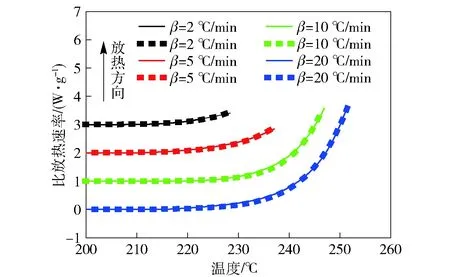
图3 CL-20的瑞士方法实验曲线与拟合曲线(实线代表实验曲线,虚线代表拟合曲线)Fig.3 Dynamic DSC and fitting curves of Swiss method (solid line: experimental curve, dot line: fitting curve)

样品β/(℃·min-1)Eα/(kJ·mol-1)`Eα/(kJ·mol-1)CL⁃2023688530983501103961203257
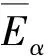
2.4 等温DSC实验
等温DSC实验可检测和表征自催化分解:若物质的放热速率随时间逐渐下降,则说明其分解遵循n级规律;若物质在等温实验中出现钟形放热速率曲线,则说明这种物质的分解具有自催化特性[16-17]。CL-20的等温DSC实验结果如图4所示。由图4可以看出,CL-20的等温放热曲线为钟形曲线,证明其热分解为自催化反应。
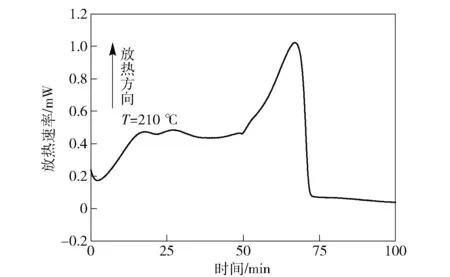
图4 CL-20的等温DSC实验Fig.4 Isothermal DSC curve of CL-20
2.5 动态DSC曲线动力学方程与绝热诱导期
Friedman法[18]同时使用几条热分析曲线上同一转化率α处的数据信息,能够在不假定动力学模式函数的前提下计算出较为可靠的活化能值,从而得到活化能随着反应进度变化而变化的曲线。该方法避免了数据处理过程中的多种假设,使计算结果更具说服力。Friedman法的动力学方程如(2)式所示:
(2)
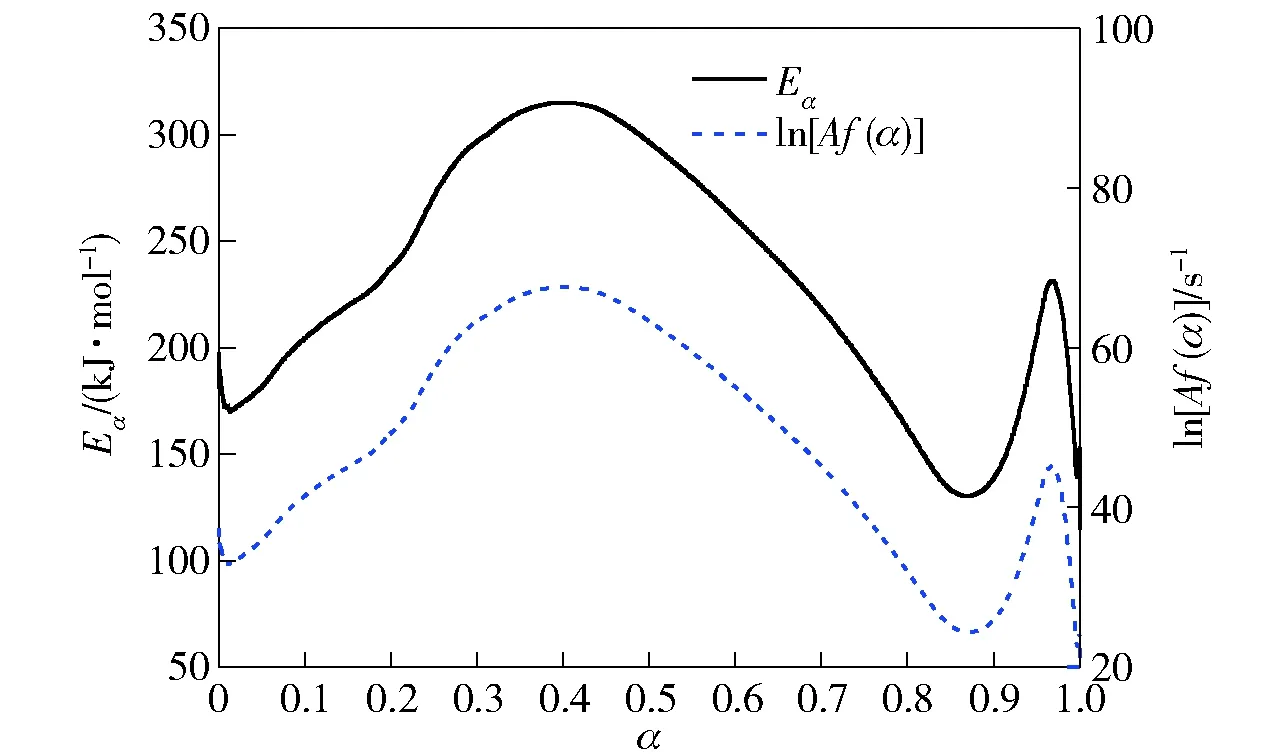
图5 采用Friedman法求得的Eα和ln[Af(α)]值与α的关系曲线 Fig.5 Kinetic parameters of CL-20 as a function of reaction process
式中:A为指前因子;f(α)为分解反应方程。图5为利用热动力学AKTS软件法求得的Eα与ln[Af(α)]值随转化率α的变化情况。由图5可以看出,在反应的开始阶段活化能较小,随着反应的进行,活化能逐渐增大,直至达到最大值。然后随着反应的进行,其活化能又逐渐减小,直至反应结束。这可能是因为CL-20的分解是比较复杂的反应,在反应的不同阶段有不同的反应类型。
最大反应速率到达时间TMRa又称绝热诱导期,是衡量事故发生可能性的一个重要指标[19]。在计算绝热诱导期的过程中,假定样品分解产生的热量全部用来加热样品本身,即表示最危险的情况。热平衡方程为
(3)
式中:t为反应时间(s);ΔTad为绝热温升(℃),该值由比放热量与比热容Cp求出,本文中Cl-20的比热容取值为Cp=1.40 J/(g·K)。在线性升温实验中β=dT/dt,(2)式可变形为
(4)
将Eα与ln[Af(α)]代入(4)式,可求得dα/dt在不同转化率处的值,即可求得dα/dt与α的关系曲线。将上述关系曲线代入(3)式,可得到样品的温度历程dT/dt. 在对反应的热危险性进行评估时,通常将诱导期为8 h和24 h对应的温度TD8和TD24作为重要指标。本文利用Friedman法得到的动力学参数,求解CL-20的绝热温度历程,并得到相应的TD8和TD24.
图6 CL-20在绝热条件下的诱导期Fig.6 TMRad of CL-20 at different temperatures
图6为CL-20在不同温度下的诱导期。由于计算所用的数据来自不同升温速率下的DSC曲线,其比放热量为一范围。图6中的虚线表示在同一起始温度下由比放热量的不同所导致的计算误差。由图6可以看出:起始温度越低,绝热诱导期受比放热量的影响越大,计算误差也越大;当绝热诱导期为8 h时,起始温度为162.3 ℃,即TD8为162.3 ℃. 同理,TD24为152.8 ℃. 当起始温度高于TD8时曲线斜率较大,说明绝热诱导期在高温时受温度的影响较小。当起始温度较低如低于TD24时曲线斜率较小,说明绝热诱导期在低温时受温度的影响较大。
3 结论
1) 动态DSC实验测得的CL-20在升温速率分别为2 ℃/min、5 ℃/min、10 ℃/min、20 ℃/min条件下,其起始分解温度在233.5~255.7 ℃范围,峰温在244.6~259.8 ℃范围,放热量的平均值为3 923.5 J/g.
2) 中断回归法、瑞士方法以及等温DSC实验的结果表明:CL-20的分解反应为自催化反应,热履历显著降低了其起始分解温度和峰温以及热安全性。
3) 在不同的反应阶段,CL-20具有不同的活化能,其绝热诱导期8 h和24 h对应的温度TD8和TD24分别为162.3 ℃和152.8 ℃.
)
[1] 徐金江, 孙杰, 周克恩, 等. CL-20重结晶过程中的晶型转变研究进展[J]. 含能材料, 2012, 20(2): 248-255.
XU Jin-jiang, SUN Jie, ZHOU Ke-en, et al. Review on polymorphic transformation on CL-20 recrystallization[J]. Chinese Journal of Energetic Materials, 2012, 20(2): 248-255. (in Chinese)
[2] 王江宁, 郑伟, 舒安民, 等. 含CL-20改性双基推进剂的燃烧性能[J]. 火炸药学报, 2013, 36(1): 61-64.
WANG Jiang-ning, ZHENG Wei, SHU An-min, et al. Combustion properties of CMDB propellant containing hexaazaisowutzitane[J]. Chinese Journal of Explosives and Propellants, 2013, 36(1): 61-64. (in Chinese)
[3] 王保国, 陈亚芳, 张景林, 等. 超细 CL-20/Cr2O3复合物的制备、表征与性能[J]. 火工品, 2013(3): 26-29.
WANG Bao-guo, CHEN Ya-fang, ZHANG Jing-lin, et al. Preparation, characterization and performances of ultrafine CL-20/Cr2O3 composite energetic materials[J].Initiators and Pyrotechnics, 2013 (3): 26-29. (in Chinese)
[4] 李玉川, 祁才, 孙成辉, 等. 2, 6, 8, 12-四硝基-2, 4, 6, 8, 10, 12-六氮杂异伍兹烷的合成及量子化学研究[J]. 含能材料, 2010, 18(2): 121-127.
LI Yu-chuan, QI Cai, SUN Cheng-hui, et al. Synthesis and quantum chemical study on 2, 6, 8, 12-tetranitro-2, 4, 6, 8, 10, 12-hexaazaisowurtzitane[J]. Chinese Journal of Energetic Materials, 2010, 18(2): 121-127. (in Chinese)
[5] 王东旭, 陈树森, 李丽洁, 等. HBIW 的纯度分析方法[J]. 火炸药学报, 2011, 34(2): 29-32.
WANG Dong-xu, CHEN Shu-sen, LI Li-jie, et al. Purity analysis method of HBIW[J].Chinese Journal of Explosives and Propellants, 2011, 34(2): 29-32. (in Chinese)
[6] 庞思平, 申帆帆, 吕芃浩, 等. 六硝基六氮杂异伍兹烷合成工艺研究进展[J]. 兵工学报, 2014, 35(5): 725-732.
PANG Si-ping, SHEN Fan-fan,LYU Peng-hao, et al. Research progress in synthesis of hexanitrohexaazaisowurtzitane[J]. Acta Armamentarii, 2014, 35(5): 725-732. (in Chinese)
[7] Xue X G, Ma Y, Zeng Q, et al. Initial decay mechanism of the heated CL-20/HMX cocrystal: a case of the cocrystal mediating the thermal stability of the two pure components[J]. The Journal of Physical Chemistry, 2017, 121(9): 4899-4908.
[8] Gao H X, Zhao F Q, Hu R Z, et al. Estimation of kinetic parameters of thermal decomposition reaction and thermal safety on hexanitrohexaazaisowurtzitane[J]. Chinese Journal of Explosives and Propellants, 2013, 36(5): 41-50.
[9] 蔡如琳, 胡伟, 王敏, 等. AP/HNIW混合体系的热分解研究[J]. 化学推进剂与高分子材料, 2015, 13(5): 52-57.
CAI Ru-lin, HU Wei, WANG Min, et al. Study on thermal decomposition of AP/HNIW mixed systems[J]. Chemical Propellants and Polymeric Materials, 2015, 13(5): 52-57. (in Chinese)
[10] 欧阳刚, 郭效德, 席海军, 等. 亚微米六硝基六氮杂异伍兹烷的制备及其性能研究[J]. 兵工学报, 2015, 36(1): 64-69.
OUYANG Gang, GUO Xiao-de, XI Hai-jun, et al. Preparation and characterization of submicron hexanitrohexaazaisowurtzitane[J]. Acta Armamentarii, 2015, 36(1): 64-69. (in Chinese)
[11] 宋乃孟, 张同来, 高红旭, 等.亚微米级球形间苯三酚铁的制备及对六硝基六氮杂异伍兹烷热分解的影响[J].兵工学报, 2016, 37(3): 547-552.
SONG Nai-meng, ZHANG Tong-lai, GAO Hong-xu, et al. The preparation of sub-micron spherical phloroglucinol-Fe and its effects on thermal decomposition of hexanitrohexaazaisowurtzitane[J]. Acta Armamentarii, 2016, 37(3): 547-552. (in Chinese)
[12] Stoessel F. 化工工艺热安全:风险评估与工艺设计[M]. 陈网桦, 彭金华, 陈利平, 译. 北京: 科学出版社, 2009.
Stoessel F. Thermal safety of chemical processes: risk assessment and process design[M]. CHEN Wang-hua,PENG Jin-hua,CHEN Li-ping,translated. Beijing: Science Press, 2009. (in Chinese)
[13] Roduit B, Hartmanna M, Follyb P, et al. Parameters influencing the correct thermal safety evaluations of autocatalytic reactions[J].Chemical Engineering Transactions, 2013, 31: 907-912.
[14] 杨庭,陈利平,陈网桦,等. 分解反应自催化性质快速鉴别的实验方法[J]. 物理化学学报,2014, 30(7): 1215-1222.
YANG Ting, CHEN Li-ping, CHEN Wang-hua, et al. Experimental method on rapid identification of autocatalysis in decomposition reactions[J]. Acta Physico-Chimica Sinica, 2014, 30(7): 1215-1222. (in Chinese)
[15] Bou-Diab L, Fierz H. Autocatalytic decomposition reactions, hazards and detection[J]. Journal of Hazardous Materials, 2002, 93(1): 137-146.
[16] Vyazovkin S, Burnham A K, Criado J M, et al. ICTAC Kinetics Committee recommendations for performing kinetic computations on thermal analysis data[J]. Thermochimica Acta, 2011, 520(1/2): 1-19.
[17] Long G T, Brems B A, Wight C A. Autocatalytic thermal decomposition kinetics of TNT[J]. Thermochimica Acta, 2002, 388(1/2): 175-181.
[18] Singh A, Soni P K, Singh M, et al. Thermal degradation, kinetic and correlation models of poly (vinylidene fluoride-chlorotrifluoroetheylene) copolymers[J]. Thermochimica Acta, 2012, 548: 88-92.
[19] Roduit B, Brogli F, Mascarello F, et al. Eestimation of TMRad using kinetics parameters derived from DSC-investigation of thermal behavior of 3-methy-4-nitrophenol[J]. Journal of Thermal Analysis and Calorimetry, 2009, 94: 1-9.

