黑曲霉菌渣综合利用研究进展
有小娟, 刘家扬*, 焦国宝
(1.黄淮学院 生物与食品工程学院,河南 驻马店 463000;2.河南仰韶生化工程有限公司,河南 三门峡 472400)
黑曲霉(Aspergillusniger)是一种世界性曲霉属真菌,由于具有外源基因表达能力强、遗传稳定性高、高产和高安全性等优点,已成为工业上一种重要的发酵菌种[1],用以生产很多产量高、用途广的发酵产品,如糖化酶、蔗糖酶、蛋白酶、脂肪酶、阿魏酸酯酶、纤维素酶、阿拉伯木聚糖酶等,可应用于食品、饲料、医药和轻工纺织业等行业[2-6];葡萄糖酸、柠檬酸、没食子酸等有机酸,可应用于食品添加剂行业等领域[7-9];同时作为一种丝状真菌,因其对重金属离子优良的生物吸附性能,可用于环境保护领域。近年我国发酵行业得到了长足的发展,其中用黑曲霉制备生物产品的项目不断增多,尽管目前国内黑曲霉菌渣年产量无法准确获得,但可估算其产量相当巨大,如河南仰韶生化工程有限公司生产糖化酶年产6 000 t粉剂项目,黑曲霉菌渣年产量可达9 000 t。发酵后的菌渣湿重约占发酵液总量的2%~3%,含有蛋白质、纤维素、细胞酶等多种营养物质和有效成分。过去对菌渣的处理一般采取露天堆积一段时间后被直接填埋,造成了环境污染及生物资源的浪费。近年来关于黑曲霉菌渣的研究逐渐增多,主要集中于菌渣的高附加值转化与利用,涉及菌渣营养成分分析及饲用研究,甲壳素、壳聚糖、细胞酶类、麦角甾醇等有用成分的提取工艺研究,以及作为有机肥料和生物吸附剂研究等,为黑曲霉菌渣的综合利用及企业创收做了积极探索。
1 黑曲霉菌渣成分的研究
1.1 菌渣营养成分
黑曲霉在发酵过程中通过新陈代谢作用富集了发酵液中的各种营养成分,发酵后的过滤菌渣包含少量培养基和大部分黑曲霉菌丝体的固体残渣,因此使得菌渣中含有多种营养成分,其中干物质含量约97%,粗蛋白约10%,粗脂肪约4%,粗纤维约14.5%,粗灰分约21%,总糖约32.6%,并富含Ca、P、Mg、Fe、K、Na 等多种矿物元素,各种营养成分的含量与几种饲料原料的基本营养成分比较见图1和表1,菌渣中可检出的有害重金属不论种类还是含量都比较少,可达到国家相关安全控制与排放标准[10-12],因此黑曲霉菌渣可以作为家畜家禽的饲料原料,也可以菌渣还田,作为有机肥料的原材料,并能节约生产成本。
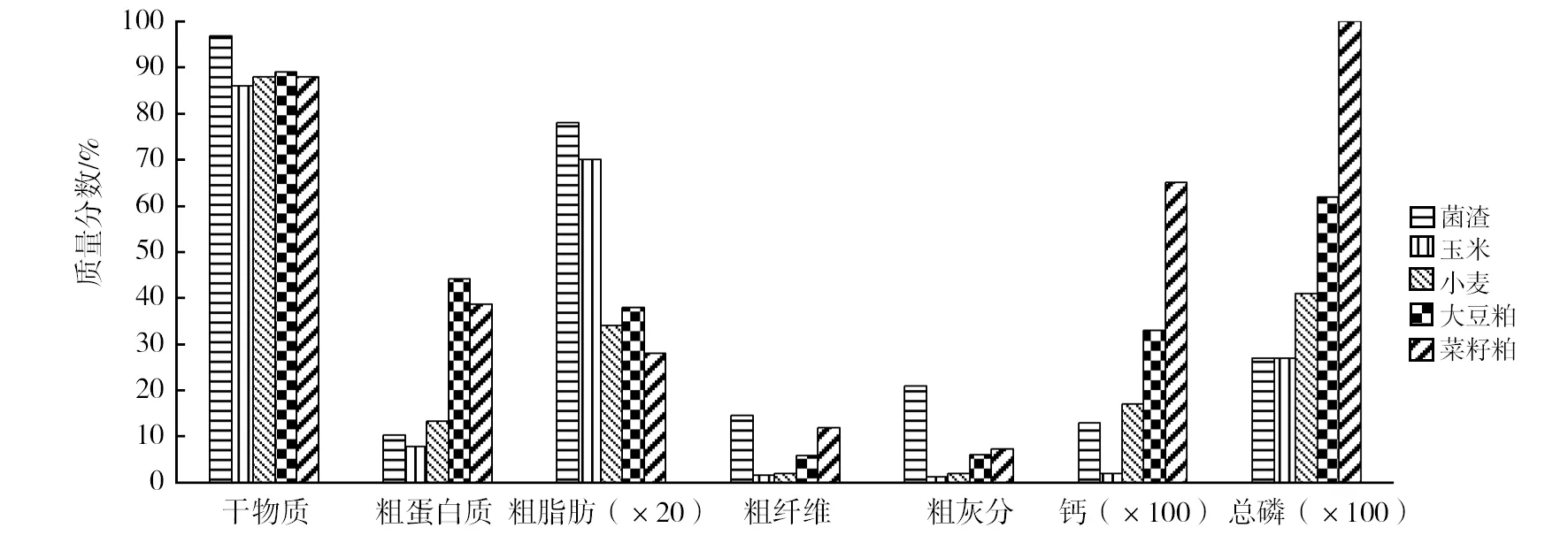
图1 黑曲霉菌渣与几种饲料原料基本营养成分含量比较[13-15]Fig.1 Comparison of basic nutrients content about Aspergillus niger biomass waste with several feed ingredients[13-15]
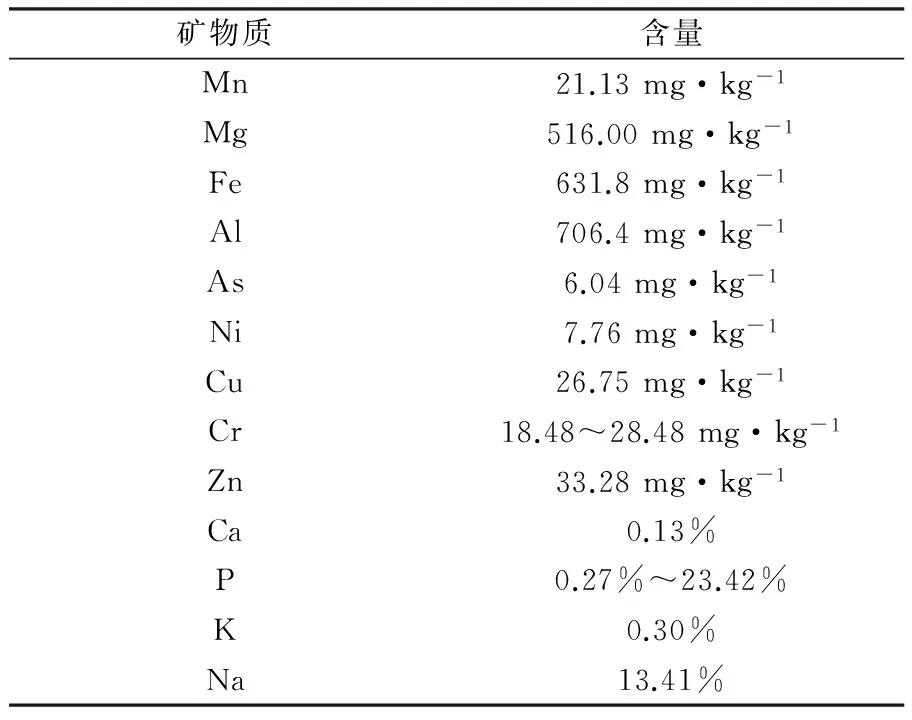
矿物质含量Mn21.13mg·kg-1Mg516.00mg·kg-1Fe631.8mg·kg-1Al706.4mg·kg-1As6.04mg·kg-1Ni7.76mg·kg-1Cu26.75mg·kg-1Cr18.48~28.48mg·kg-1Zn33.28mg·kg-1Ca0.13%P0.27%~23.42%K0.30%Na13.41%
1.2 菌渣有效成分研究现状
1.2.1 粗蛋白 黑曲霉菌渣中含有丰富的粗蛋白成分,将粗蛋白提取可以获得大量有价值的饲料蛋白,成为一种新的增加饲料蛋白含量的有效途径。目前测定蛋白质含量常用的方法主要有四种:凯氏定氮法、双缩脲试剂法、Folin-酚试剂法(Lowry法)和考马斯亮蓝法。Jernejc等[16]利用这四种方法测定了从黑曲霉菌丝体中提取的粗蛋白含量,发现双缩脲试剂法更适用于菌丝体中蛋白质含量的测定,Lowry法测定的结果偏低,而考马斯亮蓝法不适用于菌丝体中蛋白质含量的测定。刘军[17]从以黑曲霉为发酵菌种的柠檬酸发酵废液中提取得到单细胞蛋白,当提取条件为壳聚糖浓度90 mg/kg废液、废液温度45 ℃、pH 4.5、搅拌20 min时,单细胞蛋白提取率可达97.8%,废液COD值减少31.7%。
1.2.2 壳聚糖 壳聚糖(Chitosan)是甲壳素脱乙酰基度超过55%的衍生物,具有无毒、可被生物降解和生物相容性好的特点[18]。甲壳素和壳聚糖的结构式见图2和图3。在自然界中,甲壳素广泛存在于甲壳动物的外壳和植物的细胞壁中[19]。壳聚糖在很多领域都有广泛应用,在食品行业可作为乳化剂、抗氧化剂和膳食补充剂使用,在生物技术领域可用作固定化酶,在农业上用作生物杀虫剂,在污水治理领域作为絮凝剂、金属螯合剂使用,在医学领域可用于人造皮肤、血液抗凝剂、药物传输系统和基因治疗方面[20-22]。目前,工业上制取壳聚糖主要以甲壳类动物的外骨骼为原料,但容易受到季节性和供应量的限制,生产过程还会造成环境污染。而利用真菌制备壳聚糖则具有不受季节限制、发酵成本低、无需脱盐、不含过敏性虾蛋白、活性高等优点,受到行业越来越多的关注。全世界每年仅柠檬酸发酵和糖化酶发酵产生的黑曲霉菌渣就已超过630 000 t[14,23],所以黑曲霉菌渣用作制备壳聚糖的原料具有非常好的前景。
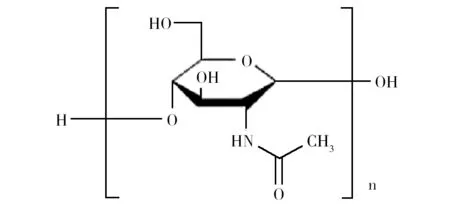
图2 甲壳素的结构式Fig.2 Structural formula of chitin
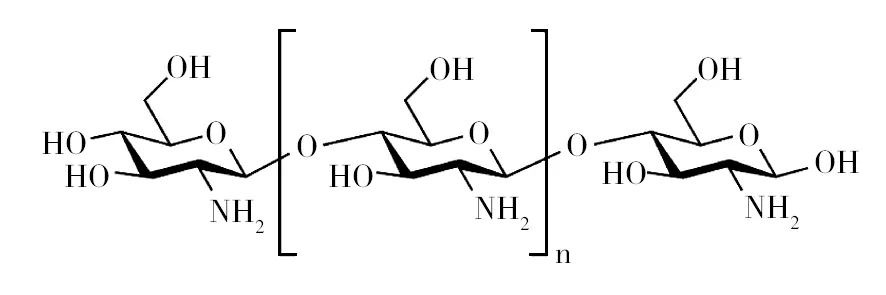
图3 壳聚糖的结构式Fig.3 Structural formula of chitosan
1.2.3 麦角甾醇 麦角甾醇(Ergosterol)又称麦角固醇,是微生物细胞膜的重要组成成分,真菌能以胞外乙酸为原料合成麦角甾醇[29],结构式见图4。麦角甾醇可以增强机体抵抗力,是脂溶性维生素D2的前体,具有抑菌、抗肿瘤的药理作用[30],广泛应用于医药、饲料、食品、化工等领域[31]。
目前麦角甾醇的萃取方法主要有皂化回流法、超声波萃取法、微波萃取法、超临界流体CO2萃取法[32]。皂化回流法是一种经典萃取方法,具有萃取成本低、操作耗能少、方法简便的优点,与其他方法相比优势明显,是萃取麦角甾醇常用的方法之一;超声波萃取法除具有操作耗能少的特点外,还具有萃取速度快的优点;微波萃取法的优点是萃取速度快,试剂用量省;超临界流体CO2萃取法是一种绿色环保萃取技术,具有萃取时间短、无毒、产品性质稳定的优点[33]。何翠红等[13]以葡萄糖酸钠生产厂的黑曲霉菌渣为原料,利用石油醚连续萃取、浓缩、重结晶,得到麦角甾醇的提取率为0.81%。郭育涛等[34]从黑曲霉粗提液中分离得到麦角甾醇,用紫外吸光光谱法和薄层色谱法对麦角甾醇进行定量测定,得到麦角甾醇的产量达0.983 mg/g干培养基;邱从平等[35]采用先以酸碱降解然后用有机溶剂萃取的方法,从废弃菌丝中提取麦角甾醇,极大降低了有机溶剂使用量,节约了麦角甾醇的回收成本。
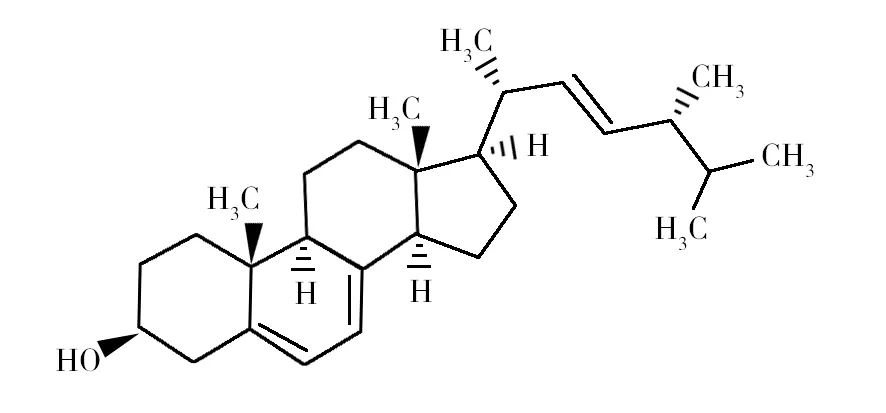
图4 麦角甾醇的结构式Fig.4 Structural formula of ergosterol
1.2.4 细胞酶类 黑曲霉作为重要的工业发酵菌,可生产超过30 种酶制剂,黑曲霉菌渣中仍含有一定量的细胞酶。目前,主要应用黑曲霉菌渣提取蔗糖酶、葡萄糖氧化酶和植酸酶。
蔗糖酶(Sucrase)能够催化蔗糖水解,生成葡萄糖和果糖[36],是动物、植物和微生物体中重要的水解酶。钦传光[37]以黑曲霉废菌体为原料提取蔗糖酶,在以pH 4.6的磷酸盐缓冲液为提取剂,35 ℃条件下提取1 h获得活力达到93单位/g的蔗糖酶提取物。
葡萄糖氧化酶(Glucose oxidase)是一种需氧脱氢酶,能够有效去除氧,起到杀菌的作用,工业上多用黑曲霉提取得到该酶,由于葡萄糖氧化酶具有无毒、无副作用的优点,因而被广泛应用于食品、医药和饲料等行业[38-41]。Lu等[42]的研究表明从生产葡糖糖酸钠、葡萄糖酸钾、葡萄糖酸钙和葡萄糖酸镁的黑曲霉菌渣中都可以提取到葡萄糖氧化酶,在低盐浓度下金属氯化物和葡萄糖酸盐能够激活葡萄糖氧化酶的活性,在高盐浓度下金属氯化物和葡萄糖酸盐不同程度地抑制葡萄糖氧化酶的活性,而在同一盐浓度下,金属氯化物对葡萄糖氧化酶活性的抑制程度要高于葡萄糖酸盐。郭刚军等[43]以黑曲霉菌渣为原料,使用有机溶剂沉淀法、聚乙二醇(PEG)分步沉淀法、羟基磷灰石柱层析法提取得到了比活为193 U/mg的葡萄糖氧化酶,酶的纯度提高8.58倍,并且该方法成本低、操作简便,适合大规模生产。
植酸酶(Phytase)又称肌醇六磷酸磷酸水解酶,广泛分布于植物和微生物(细菌、酵母菌、霉菌)中,能够将植酸水解成肌醇和无机磷酸盐[44-45],是一种重要的饲料和食品添加剂,可起到补充矿物质和减少粪便中磷酸盐排泄的作用,能减少富营养化导致的环境污染问题,已被广泛应用于食品、饲料、环保等行业[46]。冯立志[47]以废弃黑曲霉菌丝体为原料制备酸性植酸酶,并用于食品和饲料原料的脱磷酸,每克饲料用12~30 U粗酶制剂,结果表明脱磷酸作用效果明显。
2 黑曲霉菌渣应用现状
2.1 制备饲料
黑曲霉菌渣中含有丰富的营养成分,与市售饲料原料相比,菌渣所含的总糖、粗脂肪、粗蛋白、粗纤维的含量都比较高,特别是总糖含量高达32.6%,可以作为饲料原料添加到动物饲料中。菌渣中含有的矿物元素也极其丰富,尤其是钠和铁的含量比较高,并且有害重金属含量少,可以适当补充饲料中的矿物元素。因此从营养成分上看,黑曲霉菌渣是一种良好的饲料添加剂,不仅可以丰富饲料的营养成分,还可降低饲喂成本。
梁锐君等[48]以黑曲霉菌渣作为饲料,采用真代谢能法(TME)饲喂鸡(鸭),证明黑曲霉菌渣作为饲料添加剂添加到饲料中具有可行性,既节约资源又保护环境,达到“双赢”的结果。吴萍等[49]以废菌渣为原料生产单细胞蛋白饲料,通过混合固态发酵法大大提高了粗蛋白的含量。阮南等[50]的研究结果表明以黑曲霉菌渣作为单细胞蛋白饲料来源,能够提高活性蛋白质的利用率,进而提高饲料的营养价值。
2.2 制备有机肥或土壤改良剂
黑曲霉菌渣中含有丰富的营养物质和微量元素,可在农业生产上作为有机肥料或土壤改良剂使用。陈秀龙等[14]对干燥后的黑曲霉菌渣成分进行检测,发现菌渣含有丰富的有机质和营养元素,其中有机质含量为53.40%,全氮含量为1.67%,有效磷含量为0.06%,速效钾含量为0.07%,并且菌渣中的重金属含量符合直接排放标准,所以黑曲霉菌渣可以作为复混肥料的原材料。Kadatoka[51]以柠檬酸生产厂产生的黑曲霉菌渣为研究对象,研究了废菌渣作为种植玉米的土壤改良剂的可行性,结果表明废菌渣可以增强土壤颗粒的稳定性,改善土壤的理化性质,增加玉米的产量,所以废菌渣可以作为一种良好的土壤改良剂。
2.3 用作生物吸附剂或生物修复剂
随着农业、工业和生活用水的增加,水污染逐年加剧,受到污染的水又严重威胁着人和动植物的生命健康[52]。人们尝试通过不同的途径处理水污染情况,其中具有高效、适应性强特点的生物吸附法是目前应用较多的一种污水处理方式。真菌以活菌或死菌(菌渣)状态都可以作为生物吸附剂,活菌细胞主要利用新陈代谢活动来处理废水,而菌渣主要依赖于物理和化学去除机制处理废水,相对于活菌吸附需要提供基质,必须在适宜环境条件下进行吸附的特点,菌渣的生物吸附过程则不太复杂,而且菌渣允许对其进行预处理以提高生物吸附能力。黑曲霉菌渣作为一种热门生物吸附剂,已被广泛应用于金属、腐殖酸、苯酚和染料的生物吸附过程中。

图5 黑曲霉菌渣综合利用工艺流程Fig.5 Comprehensive utilization of Aspergillus niger biomass waste
3 展 望
黑曲霉作为广泛用作生产食品的发酵菌株,可生产多种酶制剂和有机酸,但是由此也产生了大量工业废渣。目前,以黑曲霉菌渣为原料制备饲料添加剂研究较多,但如何降低含量过高的金属元素钠,进一步检测有害的有机成分,以及改善饲料的适口性等方面,是黑曲霉菌渣研究的一个新方向。黑曲霉菌渣作为工业废渣的二次资源利用,可用作制备饲料添加剂、有机肥料或土壤改良剂、生物吸附剂等(图5),既能变废为宝,解决饲料添加剂、有机肥料、生物吸附剂原材料紧缺、成本高的问题,还可减轻环境污染,具有较好的经济和社会效益。本文结合目前国内外研究进展,综述了黑曲霉菌渣高附加值转化与利用的研究进展,为工业菌渣的高值化利用提供参考。
[1] Patel H, Chapla D, Divecha J, et al. Improved yield of α-L-arabinofuranosidase by newly isolatedAspergillusnigerADH-11and synergistic effect of crude enzyme onSaccharificationof maize stover[J]. Bioresources & Bioprocessing, 2015, 11(2): 157-169.
[2] Piumi F, Levasseur A, Navarro D, et al. A novel glucose dehydrogenase from the white-rot fungusPycnoporuscinnabarinus:production inAspergillusnigerand physicochemical characterization of the recombinant enzyme[J]. Applied Microbiology and Biotechnology, 2014, 98(24): 10105-10118.
[3] Oyedejia O, Bakarea M, Adewaleb I, et al. Optimized production and characterization of thermostable invertase fromAspergillusnigerIBK1,using pineapple peel as alternate substrate[J]. Biocatalysis and Agricultural Biotechnology, 2017,(9): 218-223.
[4] Zhanga J, Lib Q, Thakura K, et al. A possible water-soluble inducer for synthesis of cellulase inAspergillusniger[J]. Bioresource Technology, 2017,(226): 262-266.
[5] Salihua A, Balab M, Alam M. Lipase production byAspergillusnigerusing sheanut cake: An optimization study[J]. Journal of Taibah University for Science, 2016, 10(6): 850-859.
[7] Horeh N, Mousavi S. Enhanced recovery of valuable metals from spent lithium-ion batteries through optimization of organic acids produced byAspergillusniger[J]. Waste Management, 2017,(60): 666-679.
[8] Wawrzyniak U, Ciosek P, Wróblewski W, et al. Electrochemical monitoring of citric acid production byAspergillusniger[J]. Analytica Chimica Acta, 2014,(823): 25-31.
[9] Alekseev K, Dubina M, Komov V. Molecular-genetic and biochemical characteristics of citrate synthase from the citric-acid producing fungusAspergillusniger[J]. Applied Biochemistry and Microbiology, 2016, 52(9): 810-817.
[10] 国家环境保护局. GB 8172-87, 城镇垃圾农用控制标准[Z]. 1987-11-06.
[11] 中国石油和化学工业协会. GB/T 18877-2009, 有机-无机复混肥料[Z].2009-04-27.
[12] 中华人民共和国国家质量监督检验检疫总局. GB 13078-2001, 饲料卫生标准(含第一号修改单)[Z]. 2001-07-02.
[13] 何翠红, 邵加春, 梁锐君, 等. 葡萄糖酸钠生产厂黑曲霉菌渣的利用研究[J]. 食品工业科技, 2011, 6(32): 185-187.
[14] 陈秀龙, 蔡冠杰, 覃新导, 等. 黑曲霉菌渣资源化再利用途径分析[J]. 热带农业科学, 2011, 31(6): 24-27.
[15] 熊本海, 罗清尧, 赵峰. 中国饲料成分及营养价值表(2016年第27版)[J]. 中国饲料, 2016,(22): 37-42.
[16] Jernejc K, Cimerma A, Perdih A. Comparison of different methods for protein determination inAspergillusnigermycelium[J]. Applied Microbiology and Biotechnology, 1986, 23(6): 445-448.
[17] 刘军. 从柠檬酸发酵废液中提取单细胞蛋白的研究[J]. 食品科学, 1999,(8): 47-48.
[18] Lu T, Peng X, Yang H, et al. The production of glucose oxidase using the waste myceliums ofAspergillusnigerand the effects of metal ions on the activity of glucose oxidase[J]. Enzyme and Microbial Technology, 1996, 19(5): 339-342.
[19] Dutta J. Isolation, purification, and nanotechnological applications of chitosan[J]. Polysaccharides,2015,(5): 1029-1063.
[20] Kandra P, Kalangi H. Current understanding of synergistic interplay of chitosan nanoparticles and anticancer drugs:merits and challenges[J]. Applied Microbiology and Biotechnology, 2015, 99(5): 2055-2064.
[21] Xing K, Zhu X, Peng X, et al. Chitosan antimicrobial and eliciting properties for pest control in agriculture:a review[J]. Agronomy for Sustainable Development, 2015, 35(2): 569-588.
[22] Chen X, Sun H, Pan J. Decolorization of dyeing wastewater with use of chitosan materials[J]. Ocean Science Journal, 2006, 41(4): 221-226.
[23] Tayela A, Moussaa S, El-Trasb W, et al. Antimicrobial textile treated with chitosan fromAspergillusnigermycelial waste[J]. International Journal of Biological Macromolecules,2011,(49): 241-245.
[25] Abdel-Gawad K, Hifney A, Fawzy M, et al. Technology optimization of chitosan production fromAspergillusnigerbiomass and its functional activities[J]. Food Hydrocolloids, 2017,(63): 593-601.
[26] 曹健, 代养勇, 李浪, 等. 黑曲霉电解法制备甲壳素的研究[J]. 食品科学,2006, 27(2): 186-192.
[27] 陈畑, 彭婷婷, 王尧, 等. 响应面法优化从丝状真菌中制取壳聚糖的研究[J]. 广州化工,2014,42(20): 80-82.
[28] Xie Y, Wei Y, Hu J. Depolymerization of chitosan with a crude cellulase preparation fromAspergillusniger[J]. Applied Biochemistry and Biotechnology, 2010, 160(4): 1074-1083.
[29] 韩庆雪. 麦角固醇提取工艺的中试放大研究[D]. 天津:天津大学, 2007.
[30] 高虹, 史徳芳, 杨德, 等. 巴西菇麦角甾醇抗肿瘤活性及作用机理初探[J]. 中国食用菌, 2011, 30(6): 35-39.
[31] Padgett D, Mallin M, Cahoon L. Evaluating the use of ergosterol as a bioindicator for assessing fungal response to water quality[J]. Environmental Monitoring and Assessment, 2000, 65(3): 547-558.
[32] 曹龙辉, 李晓珺, 赵文红, 等. 麦角甾醇的研究进展[J]. 中国酿造, 2014, 33(4): 9-12.
[33] Santanaa, Jesus S, Larrayozm A, et al. Supercritical carbon dioxide extraction of algal lipids for the biodiesel production[J]. Procedia Eng, 2012, (42): 1755-1761.
[34] 郭育涛, 柯亚萍, 杨琴, 等. 黑曲霉固体发酵生产麦角固醇的研究[J]. 中国科技信息, 2008,(9): 35-37.
[35] 邱从平, 张慧波, 施立钦, 等. 麦角固醇提取及分离纯化研究[J]. 中国科技信息, 2005,(12): 138.
[36] Montiel-González A, Fernández F, Viniegra-González G, et al. Invertase production on solid-state fermentation byAspergillusnigerstrains improved by parasexual recombination[J]. Applied Biochemistry and Biotechnology, 2002, 102(1): 63-70.
[37] 钦传光. 柠檬酸生产中黑曲霉菌体的利用研究[J]. 粮食与饲料工业, 1997,(10): 22-23.
[38] 邢良英, 王远山, 郑裕国. 葡萄糖氧化酶的生产及应用[J]. 食品科技, 2007,(6): 24-26.
[39] Mehmeti E, Stankovic D, Chaiyo S, et al. Wiring of glucose oxidase with graphene nanoribbons:an electrochemical third generation glucose biosensor[J]. Microchimica Acta, 2017, 184(4): 1127-1134.
[40] Lee Y, Yoon I, Suh S, et al. Enhanced disease resistance in transgenic cabbage and tobacco expressing a glucose oxidase gene fromAspergillusniger[J]. Plant Cell Reports, 2002, 20(9): 857-863.
[41] Wong C, Wong K, Chen X. Glucose oxidase: natural occurrence, function, properties and industrial applications[J]. Applied Microbiology and Biotechnology, 2008, 78(6): 927-938.
[42] Lu T, Peng X, Yang H, et al. The production of glucose oxidase using the waste myceliums ofAspergillusnigerand the effects of metal ions on the activity of glucose oxidase[J]. Enzyme and Microbial Technology, 1996, 19(5): 339-342.
[43] 郭刚军, 计亮年, 杨惠英. 从工业废菌丝生产葡萄糖氧化酶[J]. 中国药学杂志, 1996, 31(10): 615-617.
[44] Gaind S, Singh S. Production, purification and characterization of neutral phytase from thermotolerantAspergillusflavusITCC 6720[J]. International Biodeterioration & Biodegradation, 2015,(99): 15-22.
[45] GuptaR K, Gangoliya S, Singh N. Isolation of thermotolerant phytase producing fungi and optimisation of phytase production byAspergillusnigerNRF9 in solid state fermentation using response surface methodology[J]. Biotechnology and Bioprocess Engineering, 2014, 19(6): 996-1004.
[46] Bala A, Jain J, Kumari A, et al. Production of an extracellular phytase from a thermophilic mouldHumicolanigrescensin solid state fermentation and its application in dephytinization[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4): 259-264.
[47] 冯立志. 利用废弃黑曲霉菌丝体的酸性磷酸酶提高饲料中植酸磷的有效性[J]. 国外畜牧学(饲料),1991(1): 47.
[48] 梁锐君, 何翠红, 许少玉, 等. 黑曲霉菌渣在鸡鸭饲料中的利用研究[J]. 饲料研究, 2012,(4): 52-53.
[49] 吴萍, 李正鹏, 饶圣宏, 等. 利用废菌渣生产单细胞蛋白饲料研究[J]. 中国饲料, 2008,(22): 38-41.
[50] 阮南, 周晓辉, 冯惠勇, 等. 利用柠檬酸渣生产单细胞蛋白饲料的研究[J]. 粮食与饲料工业, 2003,(10): 26-28.
[51] Kadatoka C. Evaluation of waste mycelium from citric acid production plant as a soil amendment[D]. Iowa State : Iowa State University, 1999.
[52] Gupta Vi, Suhas D. Application of low-cost adsorbents for dye removal-a review[J]. Journal of Environmental Management, 2009, 90(8): 2313-42.
[55] 孟雪娇, 熊小京, 黄艺海, 等. 黑曲霉死菌与活性炭对直接耐晒翠蓝FBL的吸附性能[J]. 环境工程学报, 2010, 4(6): 1317-1320.
[56] Vale M, Do Nascimento R, Leitao R, et al. Cr and Zn biosorption byAspergillusniger[J]. Environmental Earth Sciences, 2016, 75: 462.
[57] Song W, Liang J, Wen T, et al. Accumulation of Co(II) and Eu(III) by the mycelia ofAspergillusnigerisolated from radionuclide-contaminated soils[J]. Chemical Engineering Journal, 2016, 304: 186-193.
[58] Sivasamy A, Sundarabal N. Biosorption of an azo dye byAspergillusnigerandTrichodermasp. fungal biomasses[J]. Current Microbiology, 2011, 62: 351-357.
[59] Grainger S, Fu G, Hall E. Biosorption of colour-imparting substances in biologically treated pulp mill effluent usingAspergillusnigerfungal biomass[J]. Water, Air & Soil Pollution, 2011, 217(1): 233-244.
[60] Senturk I, Buyukgungor H, Geyikci F. Biosorption of phenol from aqueous solutions by theAspergillusnigerbiomass: comparison of linear and non-linear regression analysis[J]. Desalination and Water Treatment, 2016, 57: 19529-19539.
[61] Sana S, Roostaazad R, Yaghmaei S. Biosorption of uranium (VI) from aqueous solution by pretreatedAspergillusnigerusing sodium hydroxide[J]. Iranian Journal of Chemistry & Chemical Engineering, 2015, 34: 65-74.