内生真菌与大花红景天互作的RAPD标记分析
崔晋龙, 任晓琳, 王梦亮
(山西大学 应用化学研究所,山西 太原 030006)
红景天为高山植物,生长海拔超过2 000 m[1],隶属于景天科(Crassulaceae)红景天属(RhodiolaL.),是中华人民共和国药典收录的药食兼用的适应原性植物药[2],功能主治为“益气活血,通脉平喘,用于气虚血瘀,胸痹心痛,中风偏瘫,倦怠气喘”[3]。现代研究表明,它具有抗疲劳、抗氧化、抗辐射等生理活性[1],具有强烈的适应原性,大量使用故在医药、保健品、化妆品等行业。全球大约分布96个红景天品种,我国超过70种,是主要生产国和消费国[4]。我国药典只收录了生长于青藏高原地带的大花红景天(R.crenulata)为药用基源植物,其他各地红景天品质多有不同,影响其品质的因素除了传统的环境和地域原因外,内生菌对植物尤其对特殊地域植物的代谢和发育也起着重要作用[5]。阐明内生菌与红景天相互作用机理,对于评价和深入开发红景天资源具有重要意义。 RAPD (Random Amplification Polymorphic DNA)分子标记方法,能从分子水平对植物的遗传变异程度进行标示和鉴别,具有精确、可靠、多样性高等优点[6]。菌株ZPRs-R-11分离自红景天根部,具有促进大花红景天积累活性成分红景天苷和酪醇[7],并保持红景天在实验室条件下健康生长的菌株。本研究旨在采用RAPD分子标记法,对ZPRs-R-11接种红景天之后,对红景天不同时间条件下的遗传性状变化进行标记研究,以研究内生真菌对宿主DNA遗传水平的影响。这将对完善药材道地性观点、提高内生菌是药材品质重要影响因素的认识提供重要科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 内生真菌ZPRs-R-11筛选自我国东北长白山的库页红景天(R.sachalinensis),鉴定为粉粒座孢属(Trimmatostromasp.)真菌[7],GenBank库编号为KJ542345。保藏于山西大学应用化学研究所生物化工实验室。
1.1.2 红景天组培苗 本课题组于2012年9月以西藏野生大花红景天(R.crenulata)为基础建立的组培苗繁殖体系[8]。
1.1.3 主要试剂 实验中所用的EasyTaqPCR SuperMix, 100 bp DNA Ladder等试剂由北京全式金生物技术公司提供;其他试剂及RAPD引物由上海生工生物工程股份有限公司提供。
1.2 方法
1.2.1 内生真菌接种组培苗 无菌条件下,打取直径为0.5 cm的ZPRs-R-11菌饼,各取3块均匀接种于组培苗生长的组培培养基上(菌面朝下),并与组培苗基部紧密接触。菌苗互作植株共培养条件:光14 h/暗10 h;对应温度28 ℃/22 ℃;湿度70~75% RH;光照强度30 μmol/m2/s。活性菌与组培苗基部真正开始接触时计为第1天,培养周期为15 d,每天取样,共15批。以独立培养生长的ZPRs-R-11以及大花红景天组培苗作为对照。
1.2.2 共生苗中内生真菌的验证 为了验证接种真菌ZPRs-R-11与大花红景天相互作用的真实性,采用两种方法分别检验:①采用石蜡切片法,对每个批次接种苗进行显微观察,证明接入真菌的有效性;②对接种苗进行菌种再分离,对于优势菌种进行ITS序列测序,与原接入真菌进行序列比对,以保证接入真菌为优势真菌。
1.2.3 DNA的提取及检测 植物总DNA的提取采用CTAB法[9],1%琼脂糖凝胶电泳检测。
1.2.4 RAPD-PCR反应体系 经文献报道[10-11]及预试验,选取12条RAPD引物进行扩增。PCR反应体系为EasyTaqPCR SuperMix 7 μL(2 mmol/L Mg2+),引物0.6 μmol/L,模板DNA 70 ng,ddH2O补足至20 μL。扩增程序:94 ℃预变性5 min;94 ℃变性1 min,37 ℃退火1 min,72 ℃延伸1.5 min,40个循环;72 ℃延伸7 min,4 ℃保存。
1.2.5 结果检测及数据分析 对RAPD标记结果进行1.5%凝胶电泳检测,上样5 μL,电压120 V,拍照。同一引物扩增产物中迁移率相同的条带被认为是同源性的。以8 000 bp DNA Marker为标准,对样品的RAPD电泳条带数进行统计,将电泳图谱上清晰且稳定的条带赋值为“1”,无条带或弱带的赋值为“0”,形成0/1矩阵。假设分析对象均符合Hardy-Weinberg平衡,用软件PopGene 32[12]计算多态位点百分率(TPPB)、等位基因数(Na)、有效等位基因数(Ne)、基因多样性指数(HT)、Shannon多样性指数(I)等。采用 NTSYS-pc2.10e[13]软件对 Nei′s 遗传距离进行UPGMA(unweight pair-group method with arithmetic average)聚类分析。
2 结果与分析
2.1 ZPRs-R-11与组培苗共生15 d的 RAPD多样性分析
12条RAPD引物共扩增出87条条带,多态性条带73条,多态性百分比为83.91%。每条引物平均扩增7.25条带,扩增片段长度在100~8 000 bp间,由此可看出菌苗互作后的扩增结果与对照组相比有新的条带出现或原有条带消失,部分引物扩增结果见图1。

图1 引物R2(A)、R10(B)对红景天的RAPD-PCR结果示意图Fig.1 Amplification electrophorogram of RAPD Primers R2(A) and R10(B)0~15依次为菌苗互作的天数;J为内生真菌ZPRs-R-11;M:Marker0~15 refers to the number of days for vaccine interactions; J refers to endophytic fungi;M:Marker
ZPRs-R-11与组培大花红景天共生15 d的样品及两个对照组的Nei′s遗传距离(D)和遗传一致度(J)由PopGene32软件计算,结果见表1。数据显示,D在0.273 7~1.064 7之间,J在0.344 8~0.760 6之间。遗传距离最近的是菌苗互作样品与无菌培养的组培苗(D=0.273 7,J=0.760 6),遗传距离最远的是真菌ZPRs-R-11与无菌组培苗(D=1.064 7,J=0.344 8)。

表1 基于RAPD的红景天组培苗与ZPRs-R-11互作后遗传一致度(加黑数字)和遗传距离
注:****表示同种组织交驻,无需计算
通过PopGene32软件同样可以得出种群总基因多样性(H)为0.355 7,组培大花红景天与接种ZPRs-R-11组培苗之间的基因流Nm=0.209 8<1,说明菌-苗互作后真菌与宿主植物发生了一定程度的遗传交换,但交换率较低。
2.2 ZPRs-R-11与组培苗共生15 d基于RAPD的聚类分析
根据RAPD扩增结果得出的0/1矩阵,经过NTSYS2.10软件计算得出17个样品间的聚类结果,见图2。由图2可以看出当遗传相似系数为0.740 0时,17个样品可以聚为三大类:第I大类包括对照组无菌大花红景天及ZPRs-R-11与组培苗的互作1~5 d后的红景天组培苗;第II大类包括ZPRs-R-11与组培苗的互作6~10 d后的红景天组培苗;第III大类包括ZPRs-R-11与组培苗的互作11~15 d后的红景天组培苗及对照组ZPRs-R-11真菌。
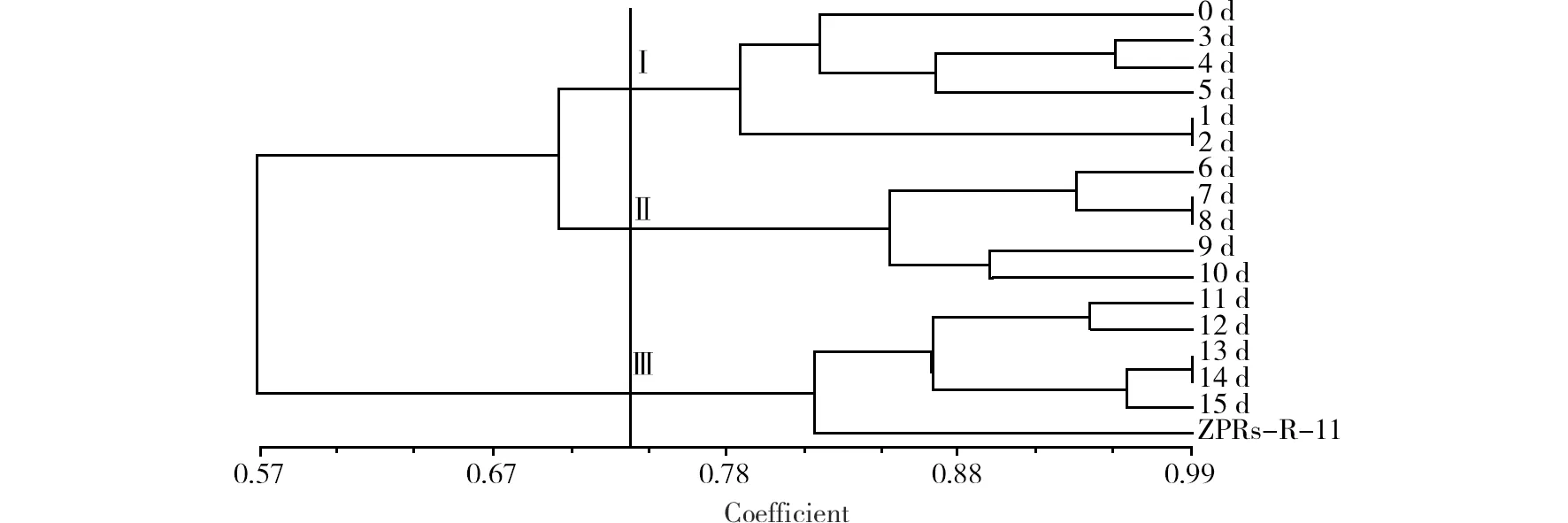
图2 ZPRs-R-11与组培苗互作后RAPD聚类图Fig.2 Dendrograms of cluster for R. crenulata inoculated with ZPRs-R-11 based on RAPD molecular markers
2.3 接种的真实性验证
将内生真菌接入大花红景天后,采用石蜡切片法分别对采集的样品进行显微观察,结果显示,在未接种的组培苗中没有发现明显的真菌菌丝,见图3A。接种后,菌丝逐步侵入表皮并繁殖。其后的15 d中分别可以观察到真菌菌丝侵入红景天组织,未造成红景天细胞的破裂,共生良好。图3B和C分别是真菌侵染第3天和9天时红景天内部组织结果示意图,表明真菌接入有效。同时,对采集材料进行可培养真菌分离、纯化,结果表明,未接种组培苗材料分离不到ZPRs-R-11为优势菌种的真菌群,而在不同时间段接种的红景天材料中分别分离到以ZPRs-R-11为优势真菌的真菌群。优势真菌的ITS序列和接入真菌比对率为100%,系同一真菌,其ITS序列见GenBank库,序号为KJ542345。说明实验过程真实有效。

图3 真菌ZPRs-R-11侵入真菌的石蜡切片显微结果示意图Fig.3 The results of endophytic fungus ZPRs-R-11 was inoculated on R. crenulata observed under microscope A、B、C分别为对照、侵入3天、侵入9天时的显微观察结果,箭头所指为真菌侵入植物细胞和组织的可见菌丝A,B,C are the results of control,the 3rd and 9th day of fungal invation,respectively;the hyphae in cell and tissue invaded by inoculating fungus were marked by arrow
3 讨 论
本研究中使用的内生真菌ZPRs-R-11是前期研究[7]中通过抗氧化活性筛选,获得的与红景天具有相同生物活性的优势菌株,与宿主具有种属专一性和功能专一性。为了验证真菌对宿主遗传性状影响的可靠性,本研究结果表明内生真菌ZPRs-R-11接种于宿主植物R.crenulata,能够引起宿主DNA遗传性状的改变;随着共培养时间的延长,菌苗互作后组培苗与内生真菌之间的遗传相似系数变大;反之,与无菌组培苗之间的遗传相似系数变小。产生这种现象的原因可能是真菌作为“诱导子”诱导植物基因水平发生变化,或者真菌与宿主植物之间发生了“横向基因转移”等现象,导致宿主红景天遗传性状的改变这为下一步着手确定具体的遗传改变、以及应用ZPRs-R-11改良宿主表型特征提供了研究依据。
内生真菌与宿主的互作关系已经成为植物代谢和发育影响因素的重要研究方向[14],研究表明,内生菌与宿主之间存在着紧密的信号传导、基因调控、营养交换等互作机制[15-16],本研究对内生真菌与宿主不同共生时期的遗传性状差异表达进行标记,对了解不同植物-真菌相互关系的异同、改良植物品质、品质监控等都具有参考价值,也为进一步阐明植物真菌互作的分子机制提供依据。
[1] Han F, Li YT, Mao XJ, et al. Characterization of chemical constituents inRhodiolacrenulataby high-performance liquid chromatography coupled with Fourier-transform ion cyclotron resonance mass spectrometer (HPLC-FT-ICR MS)[J]. J Mass Spectrom, 2016, 51(5): 363-368.
[2] Ma CY, Tang J, Wang HX, et al. Simultaneous determination of six active compoundsinRhodiolaL. by RP-LC[J]. Chromatographia, 2008, 67(5): 383-388.
[3] 国家药典委员会.《中华人民共和国药典》[M]. 北京: 中国医药科技出版社, 2010: 144.
[4] Panossian A, Wikman G, Sarris J. Rosenroot (Rhodiolarosea): traditional use, chemical composition, pharmacology and clinical efficacy[J]. Phytomedicine, 2010, 17(7): 481-493.
[5] Wani ZA, Ashraf N, Mohiuddin T, et al. Plant-endophyte symbiosis, an ecological perspective[J]. Appl Microbiol Biot, 2015, 99(7): 2955-2965.
[6] Kumar H, Priya P, Singh N, et al. RAPD and ISSR marker-based comparative evaluation of genetic diversity among Indian germplasms ofEuryaleferox: an aquatic food plant[J]. Appl Microbiol Biot, 2016, online. Doi:10.1007/s12010-016-2171-z.
[7] Jinlong C, Tingting G, Zhenxing R, et al. Diversity and antioxidant activity of culturable endophytic fungi from alpine plants ofRhodiolacrenulata,R.angusta, andR.sachalinensis[J]. Plos one, 2015, 10(3):e0118204.
[8] 王梦亮,张娜莎,郭婷,等. 植物生长物质对大花红景天愈伤组织诱导及苗再生的影响[J].植物生理学报,2014, 50(2): 192-196.
[9] Huanca MW, Rivera CD, Maita MJ. A simple, fast, and inexpensive CTAB-PVP-silica based method for genomic DNA isolation from single, small insect larvae and pupae[J]. Genet Mol Res, 2015, 14(3): 8001-8007.
[10] 虞泓, 朱荣勋, 李永谊, 等. 云南常见药用红景天的 RAPD 分析[J]. 中草药, 2005, 36(1): 96-99.
[11] 王梦亮,任晓琳,崔晋龙,等. 野生红景天的RAPD和ISSR遗传多样性分析[J]. 中草药, 2016, 47(3):469-473.
[12] Rohlf FJ. NTSYS-pc: Numerical Taxonomy and Multivariate Analysis System. Version 2.2[M]. New York : Applied Biostatistics Inc, 2009: 1-43.
[13] Yeh FC, Boyle TJB. Population genetic analysis of co-dominant and dominant markers and quantitative traits[J]. Belg J Bot, 1997, 129: 157-163.
[14] Rodriguez RJ, White JF, Arnold AE, et al. Fungal endophytes: diversity and functional roles[J]. New Phytol, 2009, 182:314-330.
[15] Sanchez-Azofeifa A, Oki Y, Fernandes GW, et al. Relationships between endophyte diversity and leaf optical properties[J]. Trees, 2012, 26:291-299.
[16] Coutinho BG, Licastro D, Mendonca PL, et al. Plant-influenced gene expression in the rice endophyteBurkholderiakururiensisM130[J]. Mol Plant In, 2015, 28(1): 10-21.