弗赖森草螺菌RE3-3合成生长素及其促生作用的研究
程怀月, 石先阳
(安徽大学 资源与环境工程学院,安徽 合肥 230039)
生长素(Auxin)是一类含有吲哚环结构的植物内源激素,可调节植物细胞的生长、根茎叶的分化及果实发育,在植物生长发育的各阶段发挥着重要作用[1-2]。吲哚-3-乙酸(Indole-3-acetic acid,IAA)是植物体内主要的生长素形式,植物细胞IAA库的填充主要通过以L-色氨酸(L-tryptophan,L-trp)为前体的生物合成[3]。这种合成途径同样也在一些植物内生细菌体内发现[4-5]。具有分泌IAA活性的内生细菌可通过调节植物内源激素含量或提供外源激素,促进宿主植物的生长和发育[6-7]。草螺菌(Herbaspirillum)是一类广宿主内生固氮菌,已从甘蔗、玉米、高粱、水稻和多种牧草的根、茎、叶和种子器官内成功分离[8-9]。除了具有典型的固氮酶活性进行生物固氮,草螺菌还可通过产生IAA类物质而具有使宿主植物增产的潜能[10]。已有的草螺菌对植物促生作用研究主要集中于提高农作物产量[11-12],而对湿地植物研究很少。随着城市化的日益剧增,芦苇(Phragmites)和香蒲(Typhaceae)等湿地植物的自然群落正在大面积减少[13-14],因此对其量的增产研究是有必要的。本研究通过对菌株RE3-3产IAA的功能鉴定,深入解析营养物质和环境条件因素对菌株合成IAA的影响,优化其培养条件以便迅速且大量合成IAA。在最佳培养条件的基础上,研究该菌株合成IAA对水生植物芦苇及香蒲生长的影响,从而为合理利用该菌株提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 弗赖森草螺菌(Herbaspirillumfrisingense)RE3-3菌株,由本课题组成员从芦苇根中分离筛选并鉴定。
1.1.2 培养基(g/L) 营养培养基(Nutrient Broth,NB)用于活化菌株RE3-3:牛肉膏 1.0,酵母粉 2.0,蛋白胨 5.0,NaCl 5.0,pH 7.2;基础培养基(Minimal Medium,MM)用于检测IAA的形成:NH4Cl 0.25,MgSO4·7H2O 0.226,KH2PO43.0,NaHPO4·12H2O 15.12,pH 7.0;植物生长所需的基本培养基为1/2 MS(Murashige and Skoog),根据文献提供的MS培养基配方[15],配制本实验所需的1/2 MS培养基(即所有试剂浓度相对于MS培养基减半)。
1.2 方法
1.2.1 菌株RE3-3产IAA的鉴定 将菌株RE3-3接种到NB培养液中,150 r/min、30 ℃培养24 h。取0.1 mL菌液(OD600为1.0)接种到含0.05% L-trp的MM培养液中,以1%葡萄糖为碳源,150 r/min、30 ℃培育48 h。将所得菌液12 000 r/min离心5 min,上清液保存备用。取1 mL上清液与Salkowski′s显色液[16](H2SO4∶ddH2O∶0.5 mol/L FeCl3·6H2O=150∶250∶7.5)以1∶2(体积比)的比例进行混匀,IAA标准液作为阳性对照,室温避光静置30 min后,观察其颜色变化,若有红色生成则表明有IAA的形成。
1.2.2 培养条件对菌株RE3-3合成IAA的影响 下述实验中若无特别说明,则pH为7.0,温度30 ℃,L-trp含量为0.05%,以葡萄糖为碳源,培养48 h。分别研究pH、温度、L-trp含量、碳源及培养时间对菌株RE3-3合成IAA的影响,通过优化培养条件从而得到IAA的合成最大量。pH:3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0;温度:15、20、25、30、35、40 ℃;L-trp含量:0.03%、0.04%、0.05%、0.06%、0.07%、0.08%、0.09%、0.10%(质量分数);碳源:蔗糖、淀粉、果糖、甘露醇、葡萄糖,添加量为1%;培养时间:24、48、72、96、120、144、168 h。
1.2.3 IAA对芦苇及香蒲的促生作用 以1/2 MS培养基为负对照,培养基中加入IAA标准物质为正对照,观察菌株RE3-3合成IAA对芦苇及香蒲幼苗生根的诱导现象[17]。选取生长状态良好、植株茎高相似的4周龄芦苇与香蒲无菌幼苗作为实验样本,将这些幼苗进行无菌切根处理,处理后的幼苗移栽到无菌培养皿中生长,并在培养皿中分别加入IAA标准物质及菌株合成IAA,每种IAA的浓度设定分别为0.5、1.0、1.5 mg/L,每个浓度有5组平行,每板培养皿中均有6株植株。培养2周后观察芦苇及香蒲生长情况,并记录在不同浓度IAA条件下芦苇和香蒲再生根及茎叶长度。
1.2.4 分析方法 通过测定培养液在600 nm处的吸光度来表征菌体细胞的生长量。培养液在12 000 r/min下离心5 min后,用Salkowski′s比色法在λ=530 nm下定量测吸光值。将1 g/L IAA标液稀释为系列浓度,与测样品相同方法测定吸光值,绘制标准曲线,参考标准曲线确定IAA含量[16]。采用液相色谱分析进一步证实IAA的产生:将备用上清液的pH值用1 mol/L HCl调至2.5,用等量的乙酸乙酯将溶液中的生成物质置换出来,重复3次,将乙酸乙酯层置于空气中干燥。用甲醇溶解干燥残留物作为高效液相色谱(AGILENT1260)及质谱(SATUKN2200)分析的试样[18]。其中以C18柱为高效液相色谱(HPLC)的固定相,流动相为V(甲醇)∶V(水)=75∶25。根长、茎长测量参照文献方法[19],以游标卡尺为测量工具。在促生实验结束后,从每个培养皿中选取30株长势较均匀的芦苇和香蒲幼苗,用游标卡尺测量根长和茎长。利用ORIGIN 8.0和SPSS 20.0软件对实验数据进行处理和差异显著性分析。
2 结果与分析
2.1 菌株RE3-3合成IAA的定性检测
2.1.1 标液对照检测 为了分析菌株RE3-3是否具有产IAA能力,实验以MM培养液为对照,不同浓度(10、50、100 mg/L)IAA标准溶液为参照,对其产IAA能力进行分析[16]。结果发现菌株RE3-3培养液的显色液呈红色(图1),即初步判定菌株RE3-3能够合成IAA。

图1 菌株产IAA的定性检测Fig.1 Qualitative test of IAA production of bacterial isolates
2.1.2 色谱检测 通过色谱法分析发现草螺菌GSF30T及Mb11均可在L-trp存在的前提下合成IAA[20]。而在本研究中IAA标准物的HPLC图谱显示主峰保留时间为6.093 min(图2A),菌株培养液代谢产物的主峰保留时间则为6.157 min(图2B),2个主峰保留时间几乎相同,误差在可接受范围(±0.2 min)内,即草螺菌RE3-3在L-trp存在的条件下,其培养液中代谢产物同样为IAA。通过质谱分析发现最强离子峰的m/z值为174(图2C),生成物质的分子量为175(M+H+),通过查找NIST数据库可进一步验证该物质是IAA。
2.2 不同培养条件对菌株RE3-3合成IAA的影响
2.2.1 pH的影响 菌株RE3-3在酸性(pH值3.0~6.0)与碱性(pH值8.0~10.0)条件下,IAA合成量都很少;但在酸性条件下,其合成量随着pH的增大而增大,而在碱性条件下其变化趋势相反(图3A);pH在(7.0±1.0)范围内,IAA合成量先增至最大值(60 mg/L)再迅速下降,这一系列结果表明菌株RE3-3 IAA的合成对pH的适应能力弱。为了菌株RE3-3更好地合成IAA,与成团泛菌(Pantoeaagglomerans)PVM合成IAA对pH的要求一致[17],后续实验中pH值设定为7.0。
2.2.2 温度的影响 温度不仅直接影响IAA的合成,还通过影响菌体量的生成从而间接影响菌株合成IAA[21]。温度为15 ℃时,菌株RE3-3的生长缓慢,其IAA的合成量也很少(1.5 mg/L);随着温度升高,菌株RE3-3合成的IAA量也随之快速增长;温度到达30 ℃时,IAA的合成量达到最大值(61 mg/L);之后IAA合成量随着温度的继续升高而下降,但变化较为平缓(图3B)。说明温度30 ℃是菌株RE3-3在pH 7.0培养条件下合成最大量IAA的最佳温度。
2.2.3 L-trp含量的影响 L-trp作为IAA合成的前体物质,其浓度过高或过低都会导致IAA合成量的减少(图3C)。当L-trp浓度为0.07%,IAA合成量达最大为74 mg/L;当L-trp浓度超过0.07%时,其合成量会受到抑制,这是因为L-trp过量时会形成邻氨基苯甲酸而对IAA的合成产生抑制作用,从而导致IAA合成量降低[22]。大多数弗赖森草螺菌属的细菌合成IAA的L-trp最适浓度为0.05%[20],而本研究菌株RE3-3对L-trp的最适浓度则为0.07%。
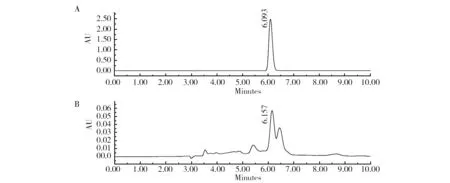
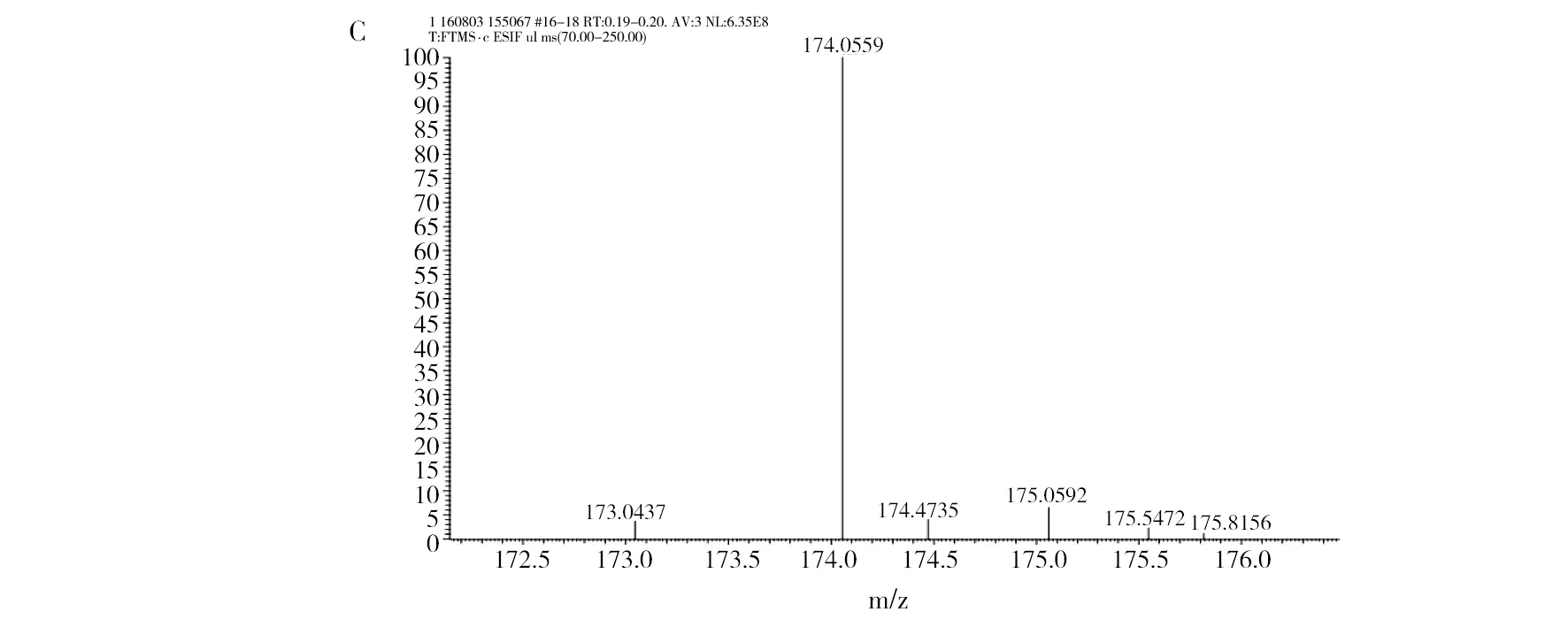
图2 IAA谱图分析Fig.2 The spectrogram analysis of IAAA:工业合成IAA的液相色谱图;B:菌株合成IAA的液相色谱图;C:菌株合成IAA的质谱分析图A:HPLC analysis of standard IAA;B:HPLC analysis of synthetic IAA;C:mass spectroscopy analysis of synthetic IAA
2.2.4 碳源的影响 在5种碳源中,菌株RE3-3利用葡萄糖为碳源时最有利于IAA的合成(图3D)。不同碳源下产生的IAA量大小依次为葡萄糖(74 mg/L)>甘露醇(64 mg/L)>果糖(18 mg/L)>淀粉(1.2 mg/L)。蔗糖作为碳源,菌株RE3-3几乎不生长。这是由于草螺菌属不含有分解蔗糖的相应糖苷酶,从而不能利用蔗糖[23]。与固氮菌属根瘤菌(Rhizobiaceae)合成IAA对碳源的要求一样[24],菌株RE3-3为了合成最大量IAA,后续实验要以1%葡萄糖为最佳碳源。
2.2.5 时间的影响 图3E给出了随着培养时间的递增,菌株RE3-3 IAA合成量先增至最大值而后随着时间的变化保持不变。即所有培养条件最优化后,培养24 h该菌合成IAA的量为41 mg/L,最大IAA合成量在48 h处,其值为74 mg/L。在最佳培养条件下,肺炎克雷伯菌(Klebsiellapneumonia)合成IAA最大量为22.7 mg/L[25],链霉菌(Streptomycessp.)3s、荧光假单胞菌(Pseudomonasfluorescens)540 以及植物短小杆菌(Curtobacteriumplantarum)6-I合成IAA最大量分别为20、67、78 mg/L[26],对比其他菌属IAA合成量,菌株RE3-3的IAA合成能力明显较强。
2.3 IAA促进芦苇及香蒲生长
在培养条件最优的基础上,菌株RE3-3合成IAA为水生植物芦苇及香蒲提供外源生长物质。不同于对照组的芦苇及香蒲苗在生长过程中的茎叶出现枯黄,再生根生长长势极为缓慢,根部逐渐腐烂(图4b、图5b)。实验组两种形式IAA作用的植株生长长势良好,茎叶面积大,叶色浓绿,根系发达(图4、图5),其中又以菌株合成IAA促生效果最好。IAA浓度的过高或过低对植株根系生长都存在不同程度的影响[27],1.0 mg/L菌株合成IAA对芦苇及香蒲的促生效果最好,但IAA浓度为1.5 mg/L时则对植株的生长有着抑制作用(表1、表2)。
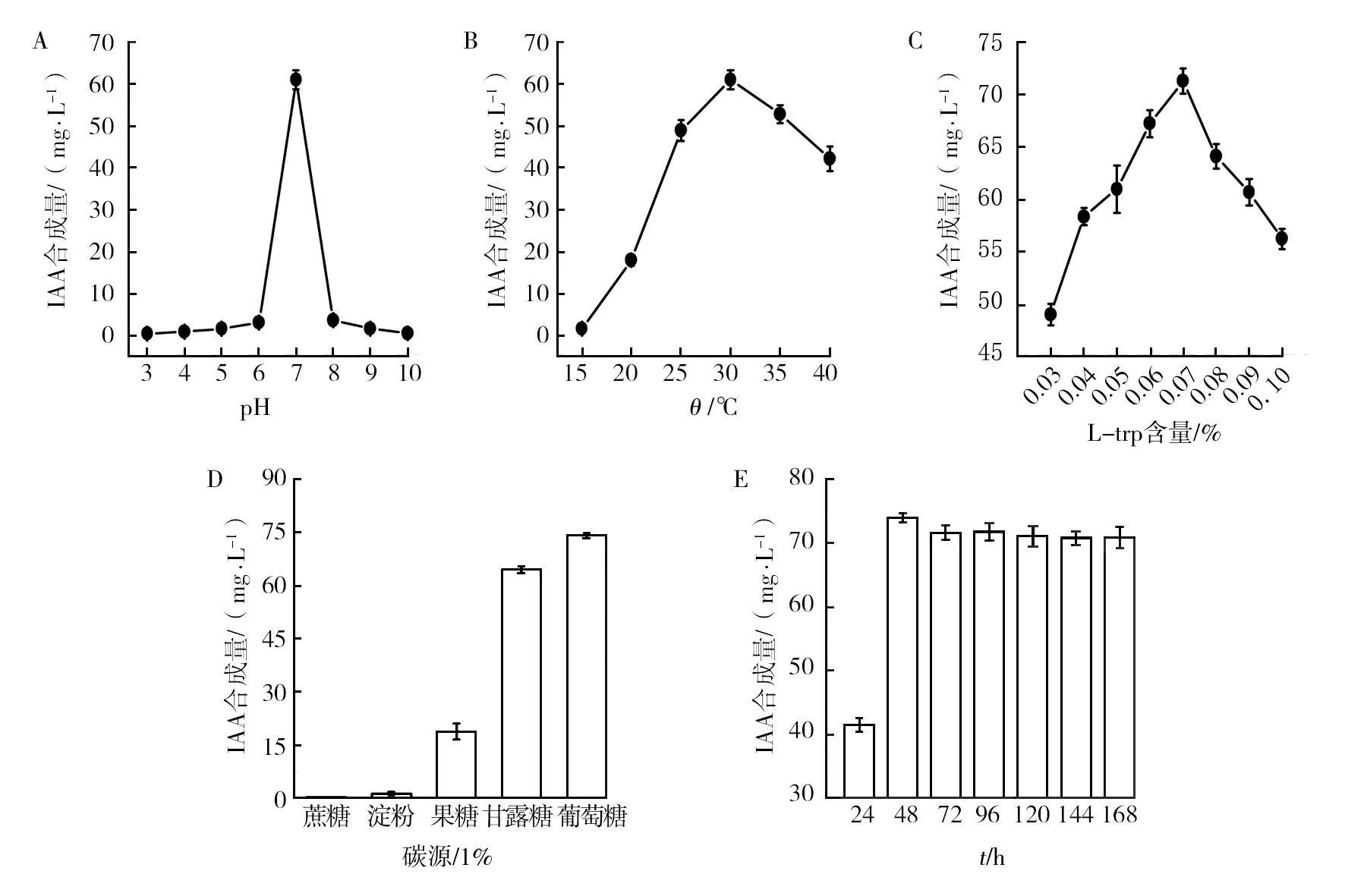
图3 菌株RE3-3合成IAA的影响因素Fig.3 The influence factors of strain RE3-4 synthesize IAA

图4 IAA对芦苇苗生长的影响Fig.4 Affecting Phragmites seedling growth by IAA a为正常培养且切根的芦苇苗;c、d、e分别为0.5、1.0、1.5 mg/L IAA标准物;b为对照组;f、g、h分别为0.5、1.0、1.5 mg/L菌株合成IAAa:meant normal culture and root pruning reed seedlings;c,d,e was 0.5,1.0,1.5 mg/L of standard IAA, respectively;b:meant control group; f,g,h was 0.5,1.0,1.5 mg/L of synthetic IAA, respectively
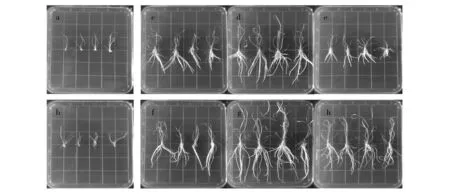
图5 IAA对香蒲苗生长的影响Fig.5 Affecting Typhaceae seedling growth by IAAa为正常培养且切根的香蒲苗;c、d、e分别为0.5、1.0、1.5 mg/L IAA标准物;b为对照组;f、g、h分别为0.5、1.0、1.5 mg/L合成IAAa:meant normal culture and root pruning cattail seedlings;c,d,e was 0.5,1.0,1.5 mg/L of standard IAA, respectively;b:meant control group;f,g,h was 0.5,1.0,1.5 mg/L of synthetic IAA, respectively
不同植物器官组织对IAA的敏感程度不同,植株根、茎组织在IAA的作用下其伸长率也不同[28]。对比相同浓度IAA标准物的作用效果,芦苇及香蒲苗在1.0 mg/L菌株合成IAA的作用下根系伸长最明显,分别增长27.78%、34.59%(表1),茎高也分别增长了66.46%、40.88%(表2)。
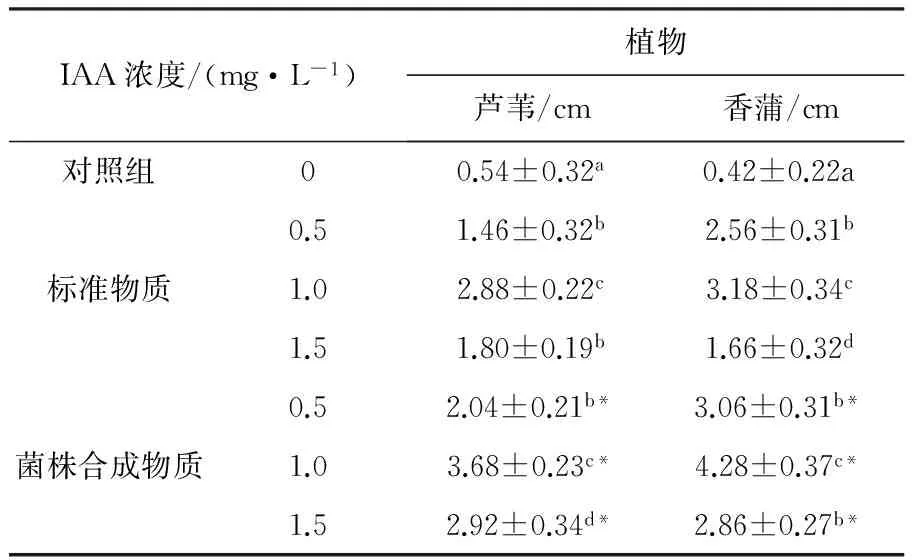
表1 IAA标准物及菌株合成IAA对芦苇及香蒲再生根的影响Table 1 Effect of Phragmites and Typhaceae root by standard IAA and biosynthetic IAA
注:数据表示为平均值±标准差,每次实验重复3次,小样本个数为30;不同的小写字母表示在不同IAA浓度水平中的(在同一种IAA中)显著性差异(P≤0.05),*表示在IAA标准物质与菌株合成IAA两个水平中的(在同一浓度IAA中)显著性差异(P≤0.05);下表同
通过显著性差异分析(表1、表2)可看出,与成团泛菌(P.agglomerans)合成IAA促进烟草叶片生根效果优于IAA标准物作用的结果相似[17],菌株合成IAA作用的芦苇及香蒲再生根长度都显著高于IAA标准物作用的,尤其是香蒲再生根根系明显发达、壮硕。则菌株RE3-3合成IAA以其自身合成快速、经济划算、促生效果明显等优点,有望应用于湿地生态系统植被增产等领域。
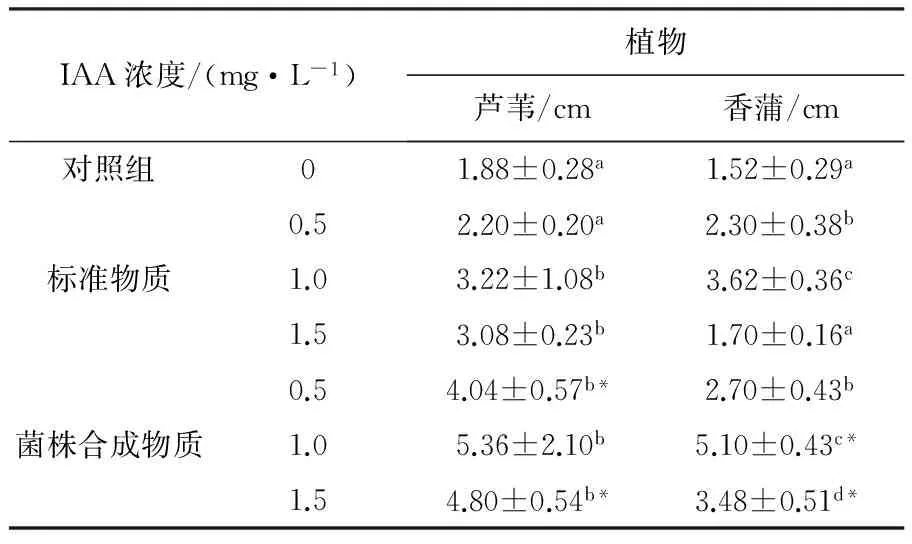
表2 IAA标准物及菌株合成IAA对芦苇及香蒲茎长的影响Table 2 Effect of Phragmites and Typhaceae stem length by standard IAA and biosynthetic IAA
3 讨 论
近年来,植物内生菌产生IAA对农作物促生作用的报道不断增多,但多集中于固氮螺菌和假单胞菌属等种属,弗赖森草螺菌作为一类常见的植物内生细菌,其合成IAA作用于水生植物的研究还鲜有报道。本研究结果表明弗赖森草螺菌RE3-3在L-trp存在的条件下合成的代谢产物是IAA。菌株RE3-3合成IAA的能力与培养基营养成分以及某些环境因素有直接的关系。在最优培养条件(培养基中含0.07% L-trp及1%葡萄糖,pH 7.0,温度30 ℃,培养时间48 h)的基础上,可使该菌产生较多的IAA,为水生植物芦苇及香蒲提供外源生长物质,促进芦苇及香蒲的生长和发育。这也意味着可将菌株RE3-3合成IAA有效地应用于湿地生态系统植被增产等领域,使该菌种具有一定的应用性价值。
[1] 吕剑,喻景权. 植物生长素的作用机制[J]. 植物生理学通讯,2004,40(5):624-628.
[2] Khamna S,Yokota A,Peberdy JF,et al. Indole-3-acetic acid production byStreptomycessp. isolated from some Thai medicinal plant rhizosphere soils[J]. Eurasian Journal of Biosciences,2010,4(4):23-32.
[3] BB布坎南,W格鲁依森姆,RL琼斯. 植物生物化学与分子生物学[M]. 北京:科学教育出版社, 2004,720.
[4] Jasim B,Jimtha John C,Shimil V,et al. Studies on the factors modulating indole-3-acetic acid production in endophytic bacterial isolates fromPipernigrumand molecular analysis ofipdcgene[J]. Journal of Applied Microbiology, 2014,117(3):786-799.
[5] Pedraza RO,Ramírez-Mata A,Xiqui ML,et al. Aromatic amino acid aminotransferase activity and indole-3-acetic acid production by associative nitrogen-fixing bacteria[J]. FEMS Microbiology Letters,2004,233(1):15-21.
[6] Spaepen S,Vanderleyden J,Remans R. Indole-3-acetic acid in microbial and microorganism-plant signaling[J]. FEMS Microbiology Reviews,2007,31(4):425-448.
[7] Bulgarelli D,Schlaeppi K,Spaepen S,et al. Structure and functions of the bacterial microbiota of plants[J]. Annual Review of Plant Biology,2013,64:807-838.
[8] 罗明,卢云. 植物内生固氮菌研究进展[J]. 微生物学杂志,2005,25(1):82-88.
[9] Straub D,Yang HY,Liu Y,et al. Root ethylene signalling is involved inMiscanthussinensisgrowth promotion by the bacterial endophyteHerbaspirillumfrisingenseGSF30T[J]. Journal of Experimental Botany,2013,64(14):4603-4615.
[10] Monteiro RA,Balsanelli E,Wassem R,et al.Herbaspirillum-plant interactions: microscopical, histological and molecular aspects[J]. Plant and Soil,2012,356(1):175-196.
[11] Bastián F,Cohen A,Piccoli P,et al. Production of indole-3-acetic acid and gibberellins A1 and A3 byAcetobacterdiazotrophicusandHerbaspirillumseropedicaein chemically-defined culture media[J]. Plant Growth Regulation,1998,24(1):7-11.
[12] 张鑫. 乌头内生菌Herbaspirillumsp. Aconite 5-28的分离鉴定及其基因组学研究[D]. 西安:陕西师范大学,2015.
[13] 芦晓峰,苏芳莉,周林飞,等. 芦苇湿地生态功能及恢复研究[J]. 西北林学院学报,2011,26(4):53-58.
[14] 项学敏,宋春霞,李彦生,等. 湿地植物芦苇和香蒲根际微生物特性研究[J]. 环境保护科学,2004,30(124):35-38.
[15] 沈惠娟. 木本植物组织培养技术[M]. 北京:中国农业科技出版社,1992.
[16] Shahab S,Ahmed N,Khan NS. Indole acetic acid production and enhanced plant growth promotion by indigenous PSBs[J]. African Journal of Agricultural Research,2009,4(11):1312-1316.
[17] Apine OA,Jadhav JP. Optimization of medium for indole-3-acetic acid production usingPantoeaagglomeransstrain PVM[J]. Journal of Applied Microbiology,2011,110(5):1235-1244.
[18] Goswami D,Thakker JN,Dhandhukia PC. Simultaneous detection and quantification of indole-3-acetic acid (IAA) and indole-3-butyric acid (IBA) produced by rhizobacteria from L-tryptophan (Trp) using HPTLC[J]. Journal of Microbiological Methods,2015,110:7-14.
[19] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000.
[20] Rothballer M,Eckert B,Schmid M,et al. Endophytic root colonization of gramineous plants byHerbaspirillumfrisingense[J]. FEMS Microbiology Ecology,2008,66(1):85-95.
[21] Malhotra M,Srivastava S. Stress-responsive indole-3-acetic acid biosynthesis byAzospirillumbrasilenseSM and its ability to modulate plant growth[J]. European Journal of Soil Biology,2009,45(1):73-80.
[22] Okon Y,Kapulnik Y. Development and function ofAzospirillum-inoculated roots[J]. Plant and Soil,1986,90(1):3-16.
[23] 王婷,杨升,陈亚雪,等. 两株茶树内生草螺菌的微生物学特性[J]. 微生物学报,2014,54(4):424-432.
[24] Datta C,Basu PS. Indole acetic acid production by a Rhizobium species from root nodules of a leguminous shrub[J]. Microbiological Research,2000,155(2):123-127.
[25] Sachdev DP,Chaudhari HG,Kasture VM,et al. Isolation and characterization of indole acetic acid (IAA) producingKlebsiellapneumoniaestrains from rhizosphere of wheat (Triticumaestivum) and their effect on plant growth[J]. Indian Journal of Experimental Biology,2009,47(12):993-1000.
[26] Merzaeva OV,Shirokikh IG. The production of auxins by the endophytic bacteria of Winter Rye[J]. Applied Biochemistry and Microbiology,2010,46(1):44-50.
[27] Hoffman MT,Gunatilaka MK,Wijeratne K,et al. Endohyphal bacterium enhances production of indole-3-acetic acid by a foliar fungal endophyte[J]. PloS One,2013,8(9):1-8.
[28] 田会会,蔡春响,李莉,等. 抗镉并且产吲哚乙酸的细菌的筛选鉴定及其植物促生作用[J]. 基因组学与应用生物学,2014,33(4):888-896.