不同碳源、氮源对中国被毛孢固体发酵工艺的影响*
陈家明,马诗经,焦春伟,张命龙,陈天洪,谢意珍,2**,李崇,2,李良秋,2,杨伟君
(1.广东粤微食用菌技术有限公司,广东广州510663;2.广东省微生物研究所,广东省菌种保藏与应用重点实验室,省部共建华南应用微生物国家重点实验室,广东省微生物应用新技术公共实验室,广东广州510070)
冬虫夏草[Ophiocordyceps sinensis(Berk.)G.H.Sung et al.]是珍贵的虫生真菌[1],具有良好的补肺益肾、抗氧化[2]、抗肿瘤[3]、调节免疫[4]、抗衰老、降血糖等功效[5]。但存在野生资源匮乏,人工培育尚存技术困难等问题。加之过度采挖,目前野生的冬虫夏草已处于濒危状态[6]。中国被毛孢(Hirsutella sinensis)已被证实为冬虫夏草的无性型[7-8],含有核苷、多糖和甾醇等与冬虫夏草类似的有效成分,具有调节免疫、抗肿瘤等作用[9],成为冬虫夏草最佳的替代品。目前,国内中国被毛孢以液体发酵为主,但液体发酵对设备要求高、工艺较复杂、成本高以及发酵过程易污染。而固体发酵具有原料低廉,设备和工艺简单等优点,部分研究者对中国被毛孢进行固体发酵研究,并取得一定的成果。
研究表明,添加不同类型的碳源、氮源对中国被毛孢发酵过程的生物量和生长情况影响较大[10-11],其中以葡萄糖、蔗糖为碳源,蚕蛹粉、酵母粉、蛋白胨等较有利于中国被毛孢的生长[12]。目前,文献报道以菌丝体生物量为指标,对中国被毛孢固体、液体发酵工艺、参数进行优化研究为主[13],以功能成分如麦角甾醇[14]、核苷类物质[15]等作为指标的研究相对较少。此外,由于核酸在细胞内的含量较稳定,也成为测定生物量的评价指标之一,魏培莲等[16]发现以细胞中的核酸成分较麦角固醇、氨基葡萄糖量更适合作为土曲霉固态发酵物中生物量测定指标。余昌霞等[17]亦证明了以核酸(DNA)含量测定金针菇菌丝体生物量的方法可行。
本文在水解乳蛋白为适宜氮源、葡萄糖为适宜碳源的基础上,添加大米、小麦作为碳源,玉米粉、黄豆粉作为氮源,并以菌丝体核酸含量作为间接指标测定菌丝体生物量,确定固体发酵的最佳配方并测定发酵产物的腺苷含量,优化中国被毛孢固体发酵工艺,以期为中国被毛胞固体发酵的产业化提供研究基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
中国被毛孢菌株(编号:3.14243),由中国科学院微生物研究所鉴定并提供。
1.1.2 主要仪器与试剂
HPG-280HX人工气候培养箱,哈尔滨市东联电子技术开发有限公司;HZQ-QG旋转式空气恒温振荡器,哈尔滨市东联电子技术开发有限公司;GUJS 10 L小型发酵罐,镇江东方生物工程设备技术有限责任公司;UV1750紫外分光光度计,日本岛津公司;Agilent 1200高效液相色谱仪,美国安捷伦科技公司等。
腺苷标准品(纯度≥99%),中国食品药品检定研究所;中国被毛孢纯菌丝体粉购于浙江万丰企业集团制药有限公司。
1.2 方法
1.2.1 斜面培养
斜面培养基:马铃薯(去皮)200 g、葡萄糖20 g、胰蛋白胨2 g、水解乳蛋白2 g,KH2PO41 g、MgSO41 g、琼脂20 g,水1 000 mL,pH 6.5,121℃灭菌30 min。
制备方法:取中国被毛孢保藏菌种,18℃活化培养后转接至试管斜面上,长成菌落直径约2 cm的斜面种后置4℃冰箱保存,备用。
1.2.2 液体发酵培养
(1)液体发酵培养基
根据中国被毛孢液体发酵经验配方,设置4个液体发酵培养基,Y1培养基:葡萄糖30 g·L-1、蛋白胨10 g·L-1、MgSO4·7H2O 1 g·L-1、KH2PO41 g·L-1、维生素B10.1 g·L-1,pH6.5;Y2培养基:葡萄糖30 g·L-1、水解乳蛋白10 g·L-1、MgSO4·7H2O 1 g·L-1、KH2PO41 g·L-1、维生素B10.1 g·L-1,pH6.5;Y3培养基:蔗糖30 g·L-1、酵母粉10 g·L-1、MgSO4·7H2O 1 g·L-1、KH2PO41 g·L-1、维生素B10.1 g·L-1,pH6.5;Y4培养基:淀粉30 g·L-1、蛋白胨10 g·L-1、MgSO4·7H2O 1 g·L-1、KH2PO41 g·L-1、维生素B10.1 g·L-1,pH 6.5。
(2)制备方法
在500 mL三角瓶中装入150 mL液体培养基,121℃灭菌30 min后,从斜面种上挑取5块等大的菌块接入液体种培养基中,于18℃、150 r·min-1恒温振荡培养30 d。Y1、Y2、Y3、Y4各配方重复3次。收集每种配方的纯菌丝体,烘干备用。
1.2.3 中国被毛孢纯菌丝体培养基
(1)中国被毛孢纯菌丝体培养基
葡萄糖30 g·L-1、蛋白胨10 g·L-1、MgSO4·7H2O 1 g·L-1、KH2PO41 g·L-1、维生素B10.1 g·L-1,pH 6.5。
(2)制备方法
在10 L发酵罐装入7 L液体培养基,灭菌冷却后以接种量8%接入培养好的种子液,设置发酵温度为18℃,搅拌速度100 r·min-1,发酵罐通气量为4 L·min-1。在此条件下发酵9 d后,将发酵液离心(10 025 g,10 min),弃去发酵液,收集菌丝体,纯水洗涤2遍后,低温烘干至恒重,作为标准菌丝体,绘制菌丝体生物量标准曲线。
1.2.4 固体发酵培养
(1)固体发酵种子液培养
种子液培养基按1.2.3(1);用接种铲刮取试管斜面菌块接种到盛有液体培养基的500 mL三角瓶中(装液量为150 mL/500 mL三角瓶),于18℃、150 r·min-1恒温振荡培养30 d。
(2)固体发酵培养基
根据其它虫草无性型菌株的经验配方,以大米、小麦为碳源,以玉米粉、黄豆粉为氮源,对固体发酵的碳源、氮源进行筛选试验。
基础培养基:葡萄糖20 g·L-1、水解乳蛋白5 g·L-1、MgSO4·7H2O 1 g·L-1、KH2PO41 g·L-1、维生素B10.1 g·L-1。除基础培养基外,添加其它碳源与氮源的总量为20 g,设置8个固态发酵的培养基配方,每个配方重复4次,并添加各配方组的空白对照(不接入种子液),如表1所示。
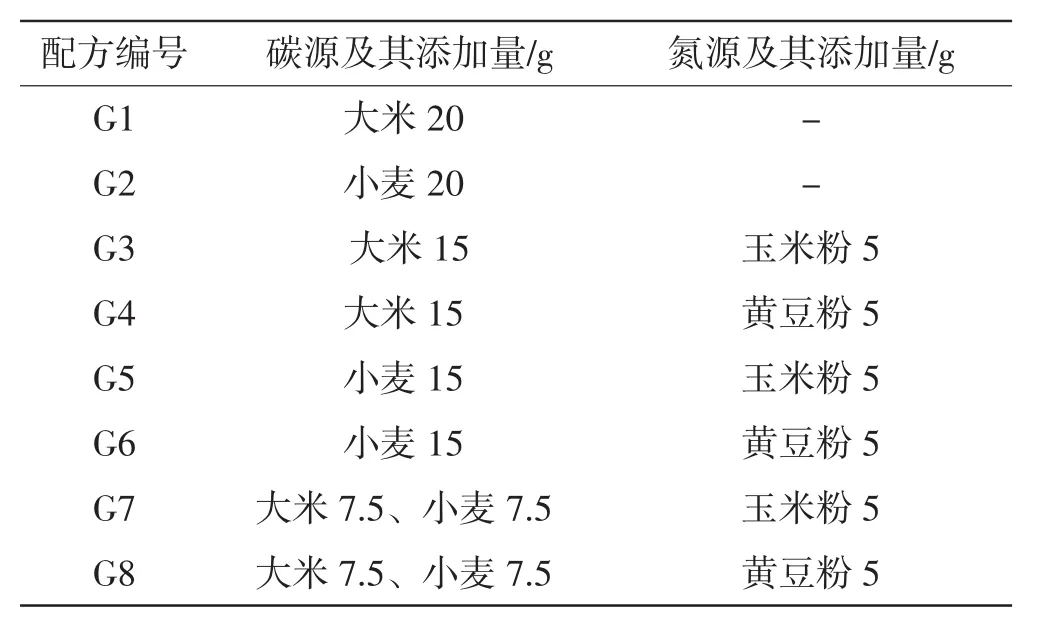
表1 固体发酵培养基配方Tab.1 Composition of solid fermentation medium
称取20 g培养料于250 mL罐头瓶中,加入30 mL基础培养基,搅拌均匀,采用通气封瓶膜封口,常温浸泡12 h。次日于121℃灭菌30 min,然后冷却降至室温。挑选菌球密度大、大小均一、不易沉降的种子液,摇匀后精确吸取4 mL,均匀接种于固体培养基表面,在温度18℃,相对湿度80%~85%的人工气候培养箱中培养50 d。空白对照组不接入种子液,其余操作相同。
1.2.5 菌丝体核酸的测定
(1)纯菌丝体中核酸的提取测定
参照参考文献[16]方法,分别准确称取10 L发酵罐培养所得的中国被毛孢菌丝体干粉0.05 g、0.1 g、0.15 g、0.2 g、0.3 g、0.4 g,置于10 mL具塞试管内,加入8 mL的5%三氯乙酸溶液,摇匀后80℃水浴提取40 min。取出后冰浴冷却,离心(8 000 r·min-1,4℃,15 min),取上清液,用5%三氯乙酸溶液定容至10 mL。取定容液,稀释40倍,以5%三氯乙酸作为空白对照,于260 nm处测定OD值,建立菌丝体质量(g)与吸光值之间的线性方程。
(2)发酵物中核酸的提取测定
各配方固体发酵物经60℃干燥,粉碎。准确称取1.0 g粉末按1.2.5(1)方法提取核酸,未经发酵的固体发酵培养基质采用同样的方法处理作为空白对照,在260 nm处测定提取液的OD值,由所测OD值对照纯菌体与核酸紫外吸收曲线关系(见图2),换算成菌丝体量。
1.2.6 固体发酵物中腺苷含量的测定
(1)色谱条件
Waters Atlantis T3色谱柱(250 mm×4.6 mm,5 μm),柱温30℃,紫外检测器,波长260 nm,流动相20%甲醇-水溶液,流速1 mL·min-1,进样量为20 μL。
(2)腺苷标准曲线的制作
精确称取10 mg腺苷标准品,用超纯水溶解于25 mL容量瓶,分别配置1.00 μg·mL-1、2.00 μg·mL-1、5.00 μg·mL-1、10.0 μg·mL-1、20.0 μg·mL-1和40.0 μg·mL-1的腺苷标准溶液,在给定的仪器条件下进行液相色谱分析,以出峰时间定性分析,以试样峰面积对标准液浓度制作标准曲线,计算线性回归方程为y=43.82x-3.62,R2=0.9999。
(3)样品腺苷含量的测定
精确称取2 g固体发酵物粉末,置于25 mL容量瓶中,加超纯水定容,超声处理1 h,放冷后补水至满刻度,充分摇匀,8 000 r·min-1,离心5 min,取适量上清液经0.22 μm的微孔滤膜过滤后供液相色谱检测用。通过标准曲线,计算含量。
2 结果与分析
2.1 菌丝体质量与核酸含量的线性关系
研究表明,核酸在细胞中含量稳定,不受营养条件、菌龄等因素的影响,理论上讲应与生物量具有较好的线性关系。菌丝体质量与核酸OD值的标准曲线见图1。
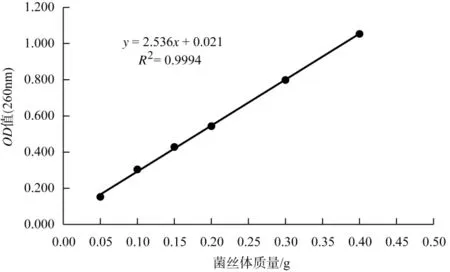
图1 菌丝体质量与核酸OD值的标准曲线Fig.1 Standard curve between amount of mycelia and nucleic acid content
由图1可知,中国被毛孢纯菌丝体质量与吸光度之间具有良好的线性关系。线性方程y=2.536x+0.021,相关性良好,相关系数R2=0.9994。
2.2 不同来源的中国被毛孢菌丝体中核酸含量
不同来源的中国被毛孢菌丝体中核酸含量情况见表2。

表2 不同来源的中国被毛孢菌丝体中核酸含量Tab.2 Nucleic acid content of Hirsutella sinensis mycelium from different sources
由表2可知,液体发酵所得菌丝体、纯菌丝体与市售中国被毛孢菌丝体中核酸含量相差不大。说明培养基中碳源、氮源、营养素,以及培养条件对菌丝体中核酸的影响较小,进一步验证了核酸作为中国被毛孢菌丝体生物量的表征指标之一。
2.3 固体发酵菌丝体生长情况
不同配方条件下,中国被毛孢生长情况见表3。

表3 中国被毛孢菌丝生长情况Tab.3 Growth of Hirsutella sinensis mycelium
由表3可知,在3 d~5 d各配方均有菌丝体萌发生长,其中G7配方菌丝体长势良好。发酵培养50 d后,不同配方的中国被毛孢菌落形态特征差异较为明显,配方G1、G2、G4仅在培养基表面出现呈灰白色的菌丝体,配方G1、G2表面无明显菌落,培养基内也无菌丝体,而配方G4表面则呈现少量不规则菌落,培养基内则看到少量菌丝体。配方G3、G5、G6、G8的培养基表面出现呈灰白色的菌丝体,形成部分不规则的菌落,而培养基内部亦发现稀松至较密集的菌丝体。配方G7整个培养基表面出现呈灰白至亮白色的成片规则菌落,培养基内菌丝体密集,长势良好。结果表明,在水解乳蛋白为动物型氮源基础上,仅以大米、小麦作为单一碳源时,中国被毛孢的长势较差,在培养基表面仅形成了部分的菌丝组织,随着时间增加,菌落几乎无变化。
而在单一碳源基础上再添加玉米粉、黄豆粉植物型氮源,中国被毛孢菌丝体长势表现为玉米粉好于黄豆粉,说明在本文配方中,玉米粉作为氮源更适于中国被毛孢菌丝体生长。进一步研究表明,以大米、小麦作为复合碳源,添加玉米粉和黄豆粉,中国被毛孢菌丝体长势表现为玉米粉好于黄豆粉。研究也表明,动物型氮源更适于中国被毛孢生长,本文则发现动物型氮源与植物型氮源合理组合,更利于中国被毛孢菌丝体生长,并随着碳源种类的增加,可获得长势良好和菌落密集的中国被毛孢菌丝体。因此,在配方中将不同种类碳源与动物型氮源、植物型氮源合理搭配,可有效提高中国被毛孢固体发酵的产率。
2.4 固体发酵物中菌丝体含量
不同配方对中国被毛孢菌丝体生物量的影响见图2。

图2 不同固体发酵配方中发酵物菌丝体含量Fig.2 Mycelium content in different solid fermentation formulas
由图2可知,固体发酵配方G3、G5、G7、G8中菌丝体含量较高,超过37 mg·g-1,其中配方G7中菌丝体含量高达80.70 mg·g-1;而配方G1、G2、G4、G6中菌丝体含量较低。以菌落生物量为指标,最佳碳源、氮源配方依次为:G7>G3>G5>G8>G6>G2>G1>G4,并结合菌丝体的生长情况,在配方中添加大米、小麦为复合碳源,玉米粉、水解乳蛋白为复合氮源,能有效增加中国被毛孢菌丝体的生物量。
2.5 优化配方固体发酵物中腺苷含量
腺苷标准品和固体发酵物的HPLC色谱图见图3。不同固体发酵配方(4个较优配方)发酵物中腺苷含量情况见图4。
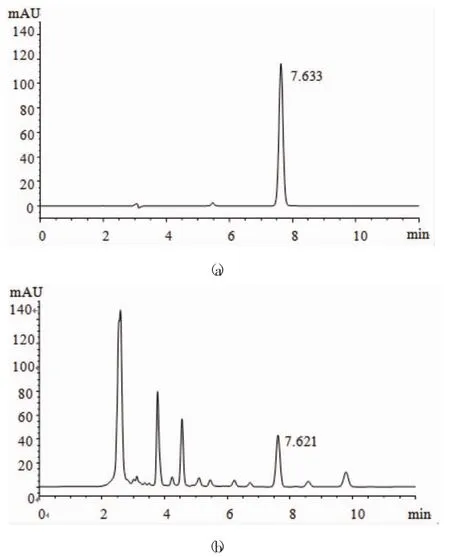
图3 腺苷标准品(a)和固体发酵物的HPLC色谱图(b)Fig.3 HPLC chromatograms of adenosine standard(a)and solid fermentation samples(b)
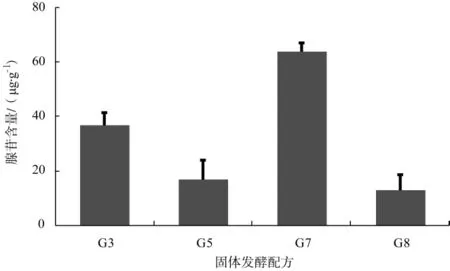
图4 不同固体发酵配方发酵物中腺苷含量Fig.4 Content of adenosine in solid fermentation formulas
图3结果显示,由固体发酵获得中国被毛孢菌丝体中的腺苷具有良好的峰形和分离度。根据不同配方固体发酵菌丝体生长情况及生物量结果,得到4个中国被毛孢固体发酵较优配方(配方G3、G5、G7、G8)。配方G7中腺苷含量高达63.76 μg·g-1,配方G3次之,配方G5、G8中腺苷含量较少,并且腺苷含量与菌丝体含量的变化呈正相关,而配方G8中以黄豆粉为复合氮源,其生物量和腺苷含量均小于以玉米粉为复合氮源的配方,进一步证明了在固体发酵配方中添加玉米作为复合氮源,能有效改善中国被毛孢菌丝体的长势以及提高菌丝体有效成分的含量。
3 结论
中国被毛孢作为1种真菌,其菌丝体生长繁殖离不开碳氮源等营养成分。由于核酸在细胞内的含量较稳定,不受培养条件影响,因此,本研究首先验证核酸能作为生物量的间接指标,发现菌丝体质量与核酸含量呈现良好的线性关系。同时在配方中将不同种类碳源与动物型氮源、植物型氮源合理搭配,并从8种固体发酵配方中筛选出以大米和小麦作为复合碳源,玉米粉为复合植物型氮源的配方,获得的菌丝长势最佳,其生物量和功效成分腺苷含量最高。
目前关于中国被毛孢固体发酵的研究较少,并且固体发酵研究主要以菌丝体生物量为指标,以功能成分为指标的研究不多。本文以核酸含量作为间接指标评价菌丝体含量,筛选出中国被毛孢较佳的固体发酵配方工艺,进一步地以功能成分腺苷含量作为指标,获得以大米和小麦作为复合碳源,玉米粉为复合植物型氮源的最佳配方。前期研究主要确定碳源、氮源种类并在添加量基础上选用了2种植物型氮源,由于植物型和动物型氮源的来源较多,下一步将继续针对不同种类碳源、氮源及其添加量进行更深入研究,以期为中国被毛孢固体发酵工业化生产提供更多研究数据。
[1]Varshney VK,Pandey A,Kumar A,et al.Chemical screening and identification of high cordycepin containing cultured isolate(s)of medicinal Chinese caterpillar mushroom,Ophiocordyceps sinensis(Berk.)G.H.Sung et al[J].International Journal of Medicinal Mushrooms,2011,13(4):327.
[2]Chen J,Zhang W,Lu T,et al.Morphological and genetic characterization of a cultivated Cordyceps sinensis fungus and its polysaccharide component possessing antioxidant property in H22 tumor-bearing mice[J].Life Sciences,2006,78(23):2742.
[3]Zhang W,Yang J,Chen J,et al.Immunomodulatory and antitumour effects of an exopolysaccharide fraction from cultivated Cordyceps sinensis(Chinese caterpillar fungus)on tumourbearing mice[J].Biotechnology&Applied Biochemistry,2005,42(1):9-15.
[4]Lee JS,Hong EK.Immunostimulating activity of the polysaccharides isolated from Cordyceps militaris[J].International Immunopharmacology,2011,11(9):1226.
[5]王林萍,余意,冯成强.冬虫夏草活性成分及药理作用研究进展[J].中国中医药信息杂志,2014,21(7):132-136.
[6]劳景辉,闫文娟,方佳茂,等.冬虫夏草发酵技术的研究进展[J].中国食用菌,2012,31(6):5-7.
[7]刘锡琎,郭英兰,俞尤信,等.冬虫夏草菌无性阶段的分离和鉴定[J].菌物学报,1989(1):35-39.
[8]Kirk P,Cannon P,Minter D,et al.Dictionary of the Fungi(10th Edition)[M].Wallingford:CAB International,2008:507-508.
[9]傅惠英,张利棕,寿旗扬,等.中国被毛孢和蝙蝠蛾拟青霉小鼠免疫功能调节作用的比较[J].中国比较医学杂志,2012,22(9):16-20.
[10]张安宁,袁书林,孙林超,等.4种虫草真菌生长适宜碳、氮源的研究[J].江苏农业科学,2011,39(6):404-406.
[11]周宇爝,江明艳,姜福星,等.不同氮源对中国被毛孢生长的影响[J].广东农业科学,2013,40(18):22-24.
[12]李春如,彭凡,樊美珍,等.中国被毛孢RCEF0273培养工艺的研究[J].安徽农业大学学报,2004,31(4):460-465.
[13]秦鹏,赵玉卉,王龙,等.冬虫夏草无性型发酵技术研究进展[J].中国酿造,2014,33(6):10-12.
[14]葛飞,桂琳,李春如,等.冬虫夏草无性型-中国被毛孢固态发酵条件的初步研究[J].生物学杂志,2009,26(3):22-25.
[15]葛飞,李春如,胡丰林,等.不同培养条件对中国被毛孢胞内核苷类组分的影响[J].菌物学报,2007,26(2):234-242.
[16]魏培莲,岑沛霖,盛春琦.3种固态发酵生物量测定方法的比较[J].食品与生物技术学报,2006,25(1):60-64.
[17]余昌霞,陈建华,曹晖,等.金针菇不同生长时期培养基质中菌丝相对生物量的确定[J].食用菌学报,2014(2):19-24.

