成年大鼠丘脑底核离体脑片的制备方法
孙唐娜 王文挺 朱俊玲 李柱一
离体脑片技术与膜片钳技术分别创建于20世纪60年代与70年代,而将这两种技术成熟地结合运用,是由Edwards及Blanton两个实验组于1989年首先报道。与急性分离或培养的神经元相比,离体脑片的神经元保持了神经细胞之间突触联系及胶质细胞对神经细胞的支持和联系,因此生理功能也更接近整体状态[1]。与整体记录相比,离体脑片避免了血-脑屏障的影响,各种试剂、药物等可直接通过灌流液进入脑片作用于神经元与胶质细胞,适合药理学的研究;其次,离体脑片的机械稳定性高,因此能获得高质量长时间的记录。
丘脑底核(STN)在神经解剖学上位于未定带腹侧与大脑脚之间,主要接受来自皮层、丘脑束旁核及苍白球外侧部等的纤维投射,其投射神经元为兴奋性的谷氨酸能神经元,纤维投射到苍白球内侧部或黑质网状部,通过调控这些中继核团后最终作用于皮层,因其纤维联系广泛,在运动调节过程中起着关键作用。被科学家称之为基底节活动的动力源泉[2]。STN在神经系统退行性疾病比如帕金森病(Parkinson disease,PD)的发病机制中发挥重要作用。经典理论认为PD条件下,纹状体系统γ-氨基丁酸(GABA)能神经元的过度兴奋,导致苍白球外侧部投射到STN的GABA能神经纤维对STN的抑制作用减弱,基底节向皮层的输出增加[3]。采用离体脑片对STN电生理特性进行研究有助于对STN功能的认识,但既往研究多采用幼龄大鼠进行离体脑片制作[4],并不适用于PD等退行性疾病的研究。该研究采用氯化胆碱替换氯化钠配制的低温切片液切片,取脑时间严格把控在30 s之内,孵育液中添加抗坏血酸等抗氧化剂等方法,有效保证了成年大鼠STN的活性,并对其电生理特性进行了初步的记录和分析。
1 材料和方法
1.1材料成年健康Sprague-Dawley(SD)大鼠,体重280~450 g左右,雌雄不限,由空军军医大学(原第四军医大学)实验动物中心提供。实验动物饲养符合国家医学实验动物管理标准,所有实验获空军军医大学(原第四军医大学)医学伦理委员会批准,并遵循实验动物保护、伦理规范。
1.2主要试剂及仪器(1)切片液成分(单位:mmol/L)包括:氯化胆碱115.00、氯化钾2.50、磷酸二氢钠1.25、氯化钙0.50、氯化镁8.00、碳酸氢钠26.00、葡萄糖10.00、抗坏血酸0.10、丙酮酸钠0.40,渗透压300~305 mOsm/L,用盐酸(1 mol/L)将pH调至7.35~7.45。(2)人工脑脊液(artificial cerebrospinal fluid,ACSF)成分(mmol/L):氯化钠 119.0、氯化钾2.3、磷酸二氢钠1.0、氯化镁1.3、氯化钙 2.5、碳酸氢钠 26.2、葡萄糖 11.0、抗坏血酸 0.1、丙酮酸钠 0.4,渗透压300~305 mOsm/L,用盐酸(1 mol/L)将pH调至7.35~7.45。(3)电极内液成分(单位:mmol/L)包括:葡萄糖酸钾128.0、羟乙基哌嗪乙磺酸10.0、磷酸肌酸钠10.0、乙二醇双(2-氨基乙醚)四乙酸1.1、三磷酸腺苷镁盐5.0、三磷酸鸟苷钠盐0.4,用氢氧化钾将pH值调至7.4,用蔗糖将渗透压调至300 mOsm/L,经0.22 μm滤器过滤后分装,-20℃保存。以上药品均购自Sigma公司。(4)其他试剂和仪器包括:95%O2-5%CO2混合气(来自第四军医大学教保处),振动切片机(VT1200S,Leica,Germany),水平程控电极拉制仪(P-97,Sutter Instruments,USA),膜片钳放大器(axon 200A amplifier,Molecilar Devices,USA),数据采集系统(Digidata 1322A,Molecular Devices)和Clampex 9.0软件(Molecular Devices),电动显微三维操纵器(MX7600,SD,USA),红外微分干涉相差显微镜(BX51-WI,Olympus,Japan)。
1.3方法
1.3.1STN脑片制备:1%(质量浓度)戊巴比妥钠按体重40 mg/kg麻醉大鼠,剪开胸腔,暴露心脏,将钝头灌流针自左心室插入主动脉固定,灌注60 mL预冷(4℃)并经95%O2-5%CO2混合气饱和的切片液,推送液体速度约3 mL/s,以保证足够的心输出量。迅速断头取脑,取脑过程轻柔迅速,避免挤压脑组织,取脑过程控制在30 s之间。脑组织在预冷和95%O2-5%CO2混合气饱和的切片液中冷却1~2 min,经修块用振动切片机切取含STN 300 μm厚的冠状脑片。获得的脑片置于95%O2-5%CO2混合气饱和的切片液中32℃孵育30 min,之后再将脑片置于充分含有95%O2-5%CO2混合气的ACSF中室温(25℃)至少孵育60 min。
1.3.2STN全细胞膜片钳记录:将脑片移入记录浴槽中,并用铂金盖网压住脑片,注意盖网丝避开STN。在红外微分干涉相差显微镜(IR-DIC)低倍镜下确定STN位置,再切换高倍镜,选择健康的STN进行全细胞膜片钳记录。记录时首先使细胞处于-60 mV钳制电压恢复约5 min,然后切换到电流钳模式记录细胞的电压反应,选择串联电阻在10~20 MΩ,动作电位具有超射的神经元用于离线分析细胞膜电位、动作电位等电生理指标[5-6]。数据经膜片钳放大器放大,用Digidata 1322A数据采集系统和Clampex 9.0软件采集、存储,数据采样率为20 kHz,低频滤波为5 kHz。用Clampfit9.0进行数据分析,Origin7.5软件进行统计处理和作图。
1.3.3碘化丙啶(propidium iodide,PI)染色:制备好的STN脑片置于充分含有95%O2-5%CO2混合气的ACSF中孵育1 h后,移至含5 μg/mL PI的饱和95%O2-5%CO2混合气的ACSF中继续孵育15 min,进行染色。随后用ACSF清洗3次,每次10 min,染色及清洗过程皆避光进行。在IR-DIC下观察脑片。
2 结果
2.1成年STN中存活神经元的形态特点将脑片转移到浸没式记录槽中,4倍物镜下根据大脑脚的位置判定STN的位置(图1A),可见STN呈凸透镜形,位于未定带腹侧与大脑脚之间,较大脑脚稍透亮(图1B、C)。40倍镜下再次确认STN定位并观察细胞形态,可见神经元胞体、轴突清晰可见,表面光滑、饱满、有立体感形态符合STN神经元特征(图1D)。
2.2成年STN脑片神经元存活状况IR-DIC低倍镜所见STN区域见图2A。低倍镜下观察发现,在STN区域可见红色荧光阳性颗粒染色(图2B),高倍镜下可见存活的STN神经元,STN存活神经元形态饱满,轮廓清晰,有立体感(图2D),与PI染色红色荧光标记不共存(图2E、F)。具体结果见图2。
2.3STN神经元电生理特征STN神经元电生理主要特征有超极化刺激起始段的电压骤降“Sag”、刺激末伴随反跳去极化产生的动作电位及动作电位后的平台电位(图3A)。记录30个STN神经元的“输入电流刺激-输出放电个数”曲线结果见图3B。将钳制电流设置在-200 pA,以20 pA的步阶脉冲至380 pA,提示基强度为40 pA,放电数随电流刺激而增加,刺激强度为40 pA、380 pA时,其放电个数分别为(4.17±0.72)个和(44.32±6.09)个(图3B)。超极化产生的“Sag”幅度见图3C,可见“Sag”幅度随电压超极化程度增加而增大(图3D,n=13)。在全细胞电压钳模式下,给予一系列超极化步阶电压刺激,记录引起“Sag”的离子电流——超极化激活的阳离子流(Ih),表现为一缓慢激活的内向电流(图3E),I-V曲线提示电压越超极化Ih幅度越大(图3F)。表1为记录到的STN神经元被动和主动膜特性。
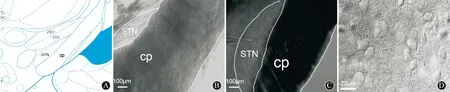
ZID:未定带,背侧部;ZIV:未定带,腹侧部;cp:大脑脚;STN:丘脑底核;A:SD大鼠脑图谱中STN定位及附近解剖学标志(×4);B:低倍镜下STN的定位(图中不同区域范围用虚线进行标识);C:低倍镜下STN的纪录区域的图像(图中不同区域范围用虚线进行标识);D:IR-DIC模式下典型的STN神经元 图 1 IR-DIC下观察SD大鼠脑片STN及其神经元特征
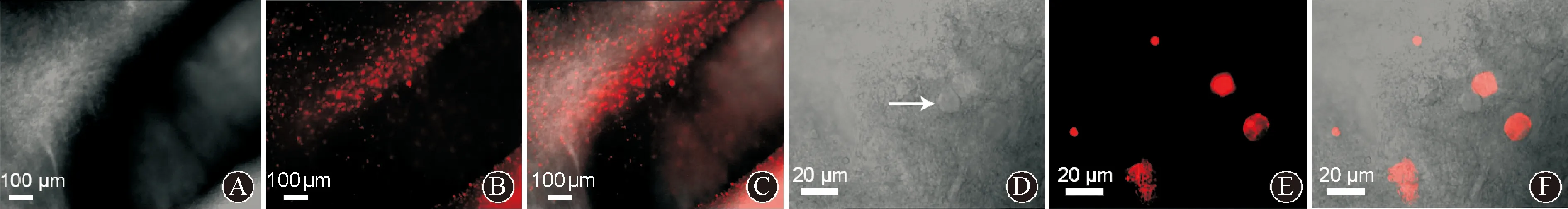
A:低倍镜IR-DIC下STN的纪录区域;B:低倍镜红色荧光通道下显示STN PI染色结果;C:图A和B的叠加图像;D:高倍镜IR-DIC模式下典型的健康STN神经元(箭头所示);E:高倍镜红色荧光通道下的图像;F:图D和E的叠加图像 图 2 SD大鼠脑片STN神经元活性检测
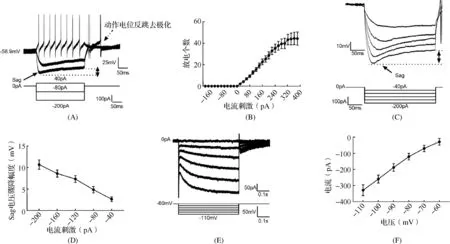
A:给予40 pA电流刺激后STN被诱发出动作电位(图中实线单向箭头示“Sag”、双向箭头示“Sag”测量范围、虚线单向箭头示动作电位的反跳去极化);B:不同大小电流刺激,STN被诱发出的动作电位个数;C:细胞超极化产生的“Sag”(实线单向箭头示“Sag”、双向箭头示“Sag”测量范围);D:不同大小电流刺激情况下“Sag”的幅度变化;E:一系列超极化电压刺激产生的Ih电流;F:Ih电流的I-V曲线 图 3 全细胞膜钳技术检查SD大鼠离体STN神经元电生理结果
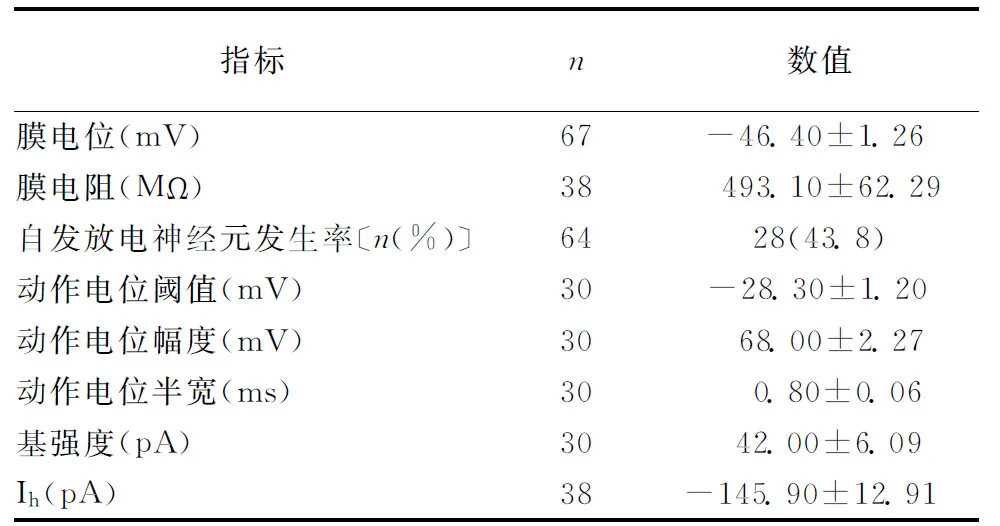
指标n数值膜电位(mV)67-46.40±1.26 膜电阻(MΩ)38493.10±62.29自发放电神经元发生率〔n(%)〕6428(43.8)动作电位阈值(mV)30-28.30±1.20 动作电位幅度(mV)3068.00±2.27动作电位半宽(ms)300.80±0.06基强度(pA)3042.00±6.09Ih(pA)38-145.90±12.91
3 讨论
本研究通过采用氯化胆碱切片液、主动脉灌流、切片液和ACSF中添加抗氧化剂、控制取脑时间和手法等措施,成功获得健康的成年大鼠STN离体脑片,并对成年STN神经元进行了初步的电生理特性分析,为离体情况研究诸如PD等神经退行性疾病STN神经元兴奋性以及突触功能等提供了方法。
STN是基底神经节(basal ganglion,BG)内重要的核团,参与了生理情况BG-皮层环路振荡的形成[7]。PD情况下BG-皮层原有频率振荡节律增强,异常频率活动的出现均与STN有关[8]。然而,STN紧邻皮质脑干束、皮质脊髓束和皮质脑桥束等下行传导束组成的大脑脚,同时接收皮层、丘脑束旁核及苍白球外侧部等的纤维在STN内部交织,制作脑片时刀片切割这些方向的纤维可能牵拉STN神经元。另外,STN作为BG-皮层环路的重要振荡控制核团,其神经元常有自发放电[9]。这些因素导致STN神经元在切片过程中更容易受损和死亡,使得制作成年STN离体脑片异常困难。因此既往离体STN研究多用20 d以下的幼龄大鼠[4, 10-11]。但是,STN是PD等神经退行性疾病重要的靶点,采用幼龄大鼠获得的结果对PD的研究帮助有限。与既往研究方法相比,本研究采用氯化胆碱替换ACSF中的氯化钠,胆碱作为一价阳离子取代钠离子,可减少切片对脑组织损伤引起的神经元去极化(无钠离子进入细胞)进而导致的兴奋性毒作用。以往亦有研究者采用蔗糖替换氯化钠进行切片的方法[12],但多用于小鼠及幼龄大鼠的脑片制作。作者研究团队曾尝试用蔗糖切片液切取成年STN脑片,但效果不佳(未公开发表)。本研究采用的氯化胆碱仅仅是替换钠离子,仍然保留了胞外的高氯离子浓度。氯离子是GABA受体的离子流,因此,氯化胆碱可在切片过程中维持一定程度的抑制性突触发放,使神经元处于超级化状态,也有助于神经元活性的维持。因此,采用氯化胆碱替换氯化钠配成的切片液是本方法的关键之一。
由于成年大鼠对缺氧耐受力差,同时颅骨较硬,取脑所花时间较幼龄大鼠时间长。本研究先用预冷和95%O2-5%CO2混合气饱和的切片液给予大鼠主动脉灌流,然后再断头取脑。这样可以降低大鼠脑组织温度,从而减少脑组织耗氧量。另外,采用主动脉灌流而非左心室灌流,可确保切片液进入体循环。而心室灌流有时会存在误插入右心室进入肺循环的可能。为进一步提高成年STN脑片的活性,本方法将取脑时间控制在30 s以内。在切片液和ACSF中加入抗坏血酸、丙酮酸钠,有助于保护细胞膜免受脂质过氧化、改善切片过程中的脑缺血,提高细胞存活[13]。此外,通过提高切片液中镁离子浓度、降低钙离子浓度,可以降低切片损伤导致N-甲基-D-天冬氨酸(NMDA)受体激活引起的兴奋毒作用。综合以上措施,本研究可在体重高达450 g的大鼠获得健康的STN离体脑片。
综上所述,本文研究采用如下主要步骤成功制备了健康成年大鼠STN离体脑片:(1)切片液采用氯化胆碱替换氯化钠,稍高渗,切片液和ACSF中加入抗坏血酸及丙酮酸钠;(2)将灌流针插入主动脉灌注切片液,保证切片液充分置换脑组织细胞外液;(3)取脑应快速,动作迅速轻柔,避免牵拉和挤压,整个过程持续通95%O2-5%CO2混合气。以上措施能提高STN脑片的活性,这种脑片制备方法将有助于对成年大鼠STN神经元兴奋性及突触功能的研究,对包括PD在内的神经退行性疾病的大鼠模型研究提供帮助。
[1]徐祖才, 陈恒胜, 刘靓,等. 膜片钳技术在成年大鼠海马脑片应用的初步研究[J]. 重庆医科大学学报, 2012,37(09):799-801.
[2]Remple MS, Bradenham CH, Kao CC, et al. Subthalamic nucleus neuronal firing rate increases with Parkinson’s disease progression[J]. Mov Disord, 2011,26(9):1657-1662.
[3]Tass P, Smirnov D, Karavaev A, et al. The causal relationship between subcortical local field potential oscillations and Parkinsonian resting tremor[J]. J Neural Eng, 2010,7(1):16009.
[4]Albertson AJ, Bohannon AS, Hablitz JJ. HCN channel modulation of synaptic integration in GABAergic interneurons in malformed rat neocortex[J]. Front Cell Neurosci, 2017,11:109.
[5]Harris NC, Constanti A. Mechanism of block by ZD 7288 of the hyperpolarization-activated inward rectifying current in guinea pig substantia nigra neurons in vitro[J]. J Neurophysiol, 1995,74(6):2366-2378.
[6]Shen KZ, Johnson SW. 5-HT inhibits synaptic transmission in rat subthalamic nucleus neurons in vitro[J]. Neuroscience, 2008,151(4):1029-1033.
[7]Kase D, Inoue T, Imoto K. Roles of the subthalamic nucleus and subthalamic HCN channels in absence seizures[J]. J Neurophysiol, 2012,107(1):393-406.
[8]Yang C, Zhang JR, Chen L, et al. High frequency stimulation of the STN restored the abnormal high-voltage spindles in the cortex and the globus pallidus of 6-OHDA lesioned rats[J]. Neurosci Lett, 2015,595:122-127.
[9]Deng WS, Jiang YX, Han XH, et al. HCN channels modulate the activity of the subthalamic nucleus in vivo[J]. J Mol Neurosci, 2015,55(1):260-268.
[10]Xue W, Wang Y, He S, et al. SK- and h-current contribute to the generation of theta-like resonance of rat substantia nigra pars compacta dopaminergic neurons at hyperpolarized membrane potentials[J] Brain Struct Funct, 2012,217(2):379-394.
[11]Yan ZQ, Liu SM, Li J, et al. Membrane resonance and its ionic mechanisms in rat subthalamic nucleus neurons[J]. Neurosci Lett, 2012,506(1):160-165.
[12]Li XY, Ko HG, Chen T, et al. Alleviating neuropathic pain hypersensitivity by inhibiting PKMzeta in the anterior cingulate cortex[J]. Science, 2010,330(6009):1400-1404.
[13]Rice ME. Use of ascorbate in the preparation and maintenance of brain slices[J]. Methods, 1999,18(2):144-149.
——从一道浙江选考生物学试题谈起

