多发性硬化患者外周血T淋巴细胞受体β链可变区多态性研究
吴岩 张纪红 董会卿 万岁桂 孙雪静 苏圣尧
多发性硬化(multiple sclerosis,MS)是一种常见的中枢神经系统炎性脱髓鞘疾病,目前研究认为其是一种自身免疫性疾病,免疫系统尤其是T淋巴细胞(包括CD4+T细胞与CD8+T细胞)在致病中具有重要作用。T细胞直接或者通过分子模拟机制对髓鞘自身抗原[1]发生反应而致病。有研究结果显示,由于中枢性或周围性免疫调节异常,导致髓鞘特异性T细胞数目扩增至致病程度[2],MS患者髓鞘特异性T细胞处于激活状态并具有记忆表型,而健康者髓鞘特异性T细胞处于休眠状态的原始表型[3],处于激活状态的髓鞘反应T淋巴细胞表面的黏附分子增多,更易与血-脑脊液屏障发生反应而进入中枢神经系统,进而导致炎性脱髓鞘。T细胞受体由αβ或γδ两条肽链构成,前者占成熟T细胞的90%~95%,T细胞的活动均通过T细胞受体而实现,通过监测T淋巴细胞可变区β链(T cell receptor β chain variable region,TCRVβ)可了解T细胞免疫功能,以探讨MS的发病机制。
1 对象和方法
1.1观察对象(1)病例组:收集2012-08-20—2014-03-20首都医科大学宣武医院神经内科住院的患者80例,其中临床孤立综合征(clinically isolated syndrome,CIS)30例、复发-缓解型MS(relapsing-remitting MS,RRMS)40例、继发-进展型MS患者(secondary-progressive MS,SPMS)10例。CIS组男性16例、女性14例,年龄11~66岁,平均(37.4±16.3)岁;RRMS组男性16例、女性24例,年龄11~70岁,平均(34.6±13.7)岁;SPMS组男性4例、女性6例,年龄30~67岁,平均(40.1±10.9)岁。纳入标准:(1)患者符合McDonald 2010 MS诊断标准;(2)复发期;(3)入院前6周内未使用糖皮质激素及入院前3个月未使用免疫抑制剂;(4)无急性、慢性感染性疾病(血常规、红细胞沉降率检查结果正常);(5)无恶性肿瘤性疾病;(6)无其他自身免疫性疾病。
(2)对照组:来自同期首都医科大学宣武医院体检中心的健康体检者30名,其中男15名、女15名,年龄20~40岁,平均(31.23±5.98)岁。纳入标准:(1)年龄20~40岁;(2)体检结果(血常规、尿常规、大便常规、生化全项及胸X片检查)正常;(3)采血前1个月内无感冒或流感病史;(4)无感染性疾病;(5)无恶性肿瘤性疾病;(6)无自身免疫性疾病。入组人员均被告知研究目的、内容及参与研究可能带来的风险,并签署知情同意书。各组之间性别构成及年龄比较差异无统计学意义(均P>0.05)。
1.2试剂和仪器TCRVβ单克隆抗体试剂盒、CD3 PERCP、CD8 APC、红细胞裂解液均为美国BD公司产品,主要仪器包括离心机、四色双激光流式细胞仪、移液器等。
1.3方法
1.3.1外周血TCRVβ流式细胞术检测:治疗开始前采集空腹外周血2 mL,EDTA抗凝,立即进行检测。取试管1支,加入20 μL CD3-percp、5 μL CD8-APC、5 μL TCRVβ(A-H),随后加入充分混匀的100 μL抗凝血,摇匀后室温避光20 min;加入2 mL红细胞裂解液,摇匀,室温避光10 min,以2600g离心5 min,去上清,碱性磷酸液洗两次,加入1 mL 1%(质量浓度)多聚甲醛,摇匀;流式细胞仪上机操作(测定前校正仪器),发射激光采用氩离子激光器,功率15 mW,激光波长488 nm。用CellQuest多功能数据获取软件得到相关数据。
1.3.2结果判断:一般指标包括:外周血淋巴细胞比例、T淋巴细胞比例、CD4+T细胞比例、CD8+T细胞比例及CD4+T细胞/CD8+T细胞比例。目前TCRVβ单克隆抗体试剂盒可检测24个Vβ亚家族,包括Vβ1、Vβ2、Vβ3、Vβ4、Vβ5.1、Vβ5.2、Vβ5.3、Vβ7.1、Vβ7.2、Vβ8、Vβ9、Vβ11、Vβ12、Vβ13.1、Vβ13.2、Vβ13.6、Vβ14、Vβ16、Vβ17、Vβ18、Vβ20、Vβ21.3、Vβ22、Vβ23。TCRVβ表达水平≥10%认为存在扩增,TCRVβ扩增程度以扩增个数(TCRVβ表达水平≥10%的片段个数)及扩增分数(TCRVβ扩增分数=TCRVβ扩增的各个片段表达水平相加)表示。对TCRVβ扩增程度及TCRVβ 24个亚家族进行定性分析(该片段存在扩增者占总例数的百分比,以了解TCRVβ表达增高亚家族)及定量分析(该片段表达水平占总TCRVβ片段的百分比,以了解表达水平下降的TCRVβ亚家族)。
1.4统计学处理统计分析采用SPSS 20.0软件,计数资料以率表示,采用卡方检验,两两比较采用卡方分割法(显著性水平调整为α=0.008);符合正态分布和方差齐性的计量资料以均数±标准差表示,组间比较采用方差分析,两组间比较采用Bonferroni(LSD)检验;不符合正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验,两组间比较用Nemenyi法。以P<0.05认为差异有统计学意义。
2 结果
2.1各组TCRVβ扩增程度CIS、RRMS及SPMS组总TCRVβ、CD4+TCRVβ、CD8+TCRVβ存在扩增患者比例、扩增个数、扩增分数均高于对照组(P<0.05),而3种疾病组之间总TCRVβ、CD4+TCRVβ、CD8+TCRVβ的存在扩增患者比例、扩增个数、扩增分数间比较无统计学差异(P>0.05)。结果见表1~3。
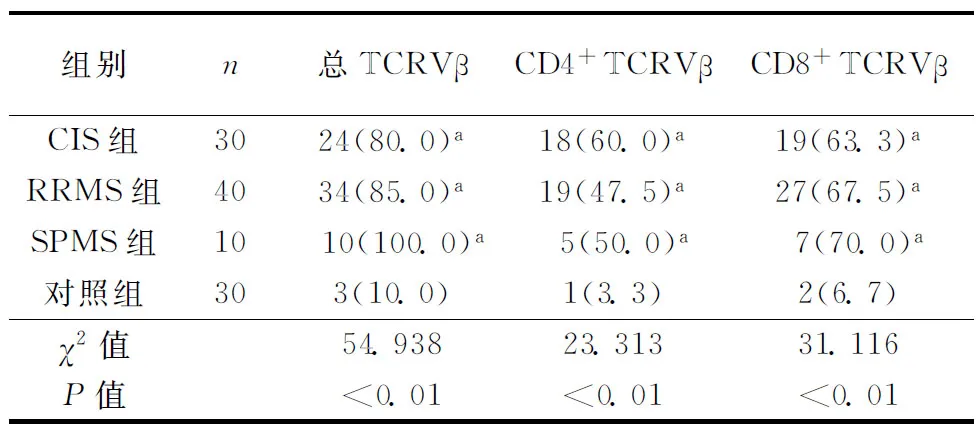
表1 各组TCRVβ存在扩增患者比例〔n(%)〕
注:TCRVβ:T淋巴细胞可变区β链,CIS:临床孤立综合征,RRMS:复发-缓解型多发性硬化,SPMS:继发-进展型多发性硬化;表2~8同。与对照组比较,aP<0.01
2.1.1TCRVβ定性分析:4组CD4+TCRVβ 2、7.1、9、13.1,CD8+TCRVβ 1、7.1、9、13.2、14片段存在扩增的例数百分比比较差异有统计学意义(P<0.05)。CIS组CD4+TCRVβ 2、CD8+TCRVβ 14,RRMS组CD4+TCRVβ 2,SPMS组CD4+TCRVβ 2、CD8+TCRVβ 9和13.2出现扩增者频率高于对照组(P<0.008)。结果见表4~5。
2.1.2TCRVβ定量分析:CIS组、RRMS组、SPMS组及对照组间CD4+TCRVβ 1、2、4、5.3、13.2、14、17、20、21.3、23,CD8+TCRVβ 4、11、16片段表达水平占总TCRVβ片段百分比比较差异有统计学意义(P<0.05)。CIS组、RRMS组、SPMS组CD8+TCRVβ 11表达水平均低于对照组。SPMS组CD4+TCRVβ 21.3表达水平低于CIS组(P<0.05)。结果见表6~7。
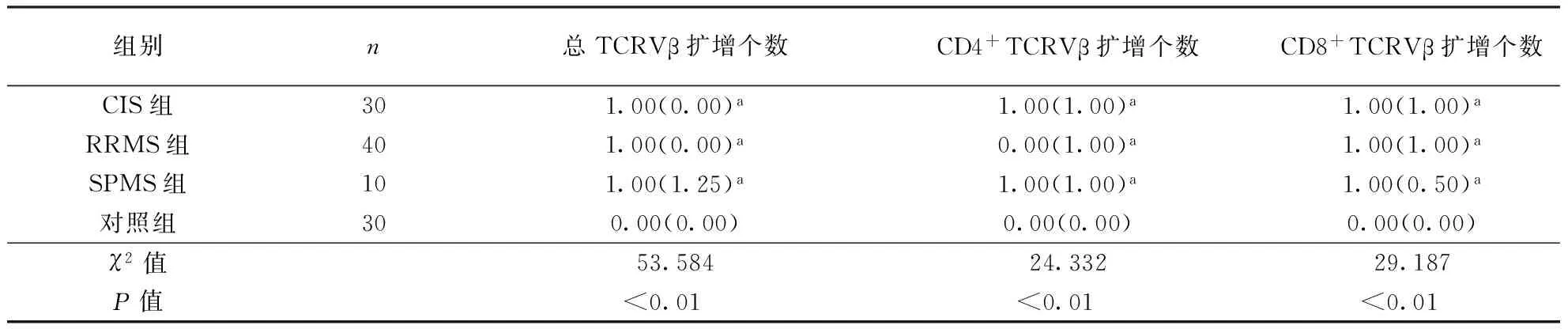
表2 各组TCRVβ扩增个数比较
注:表中数据以中位数(四分位数间距)表示,表3、6、7同;与对照组比较,aP<0.01
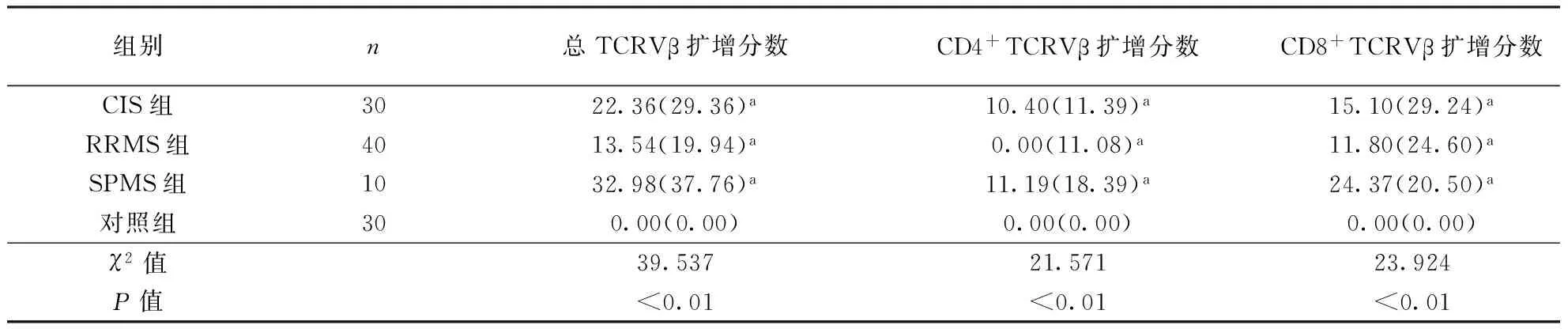
表3 各组TCRVβ扩增分数比较
注:与对照组比较,aP<0.01
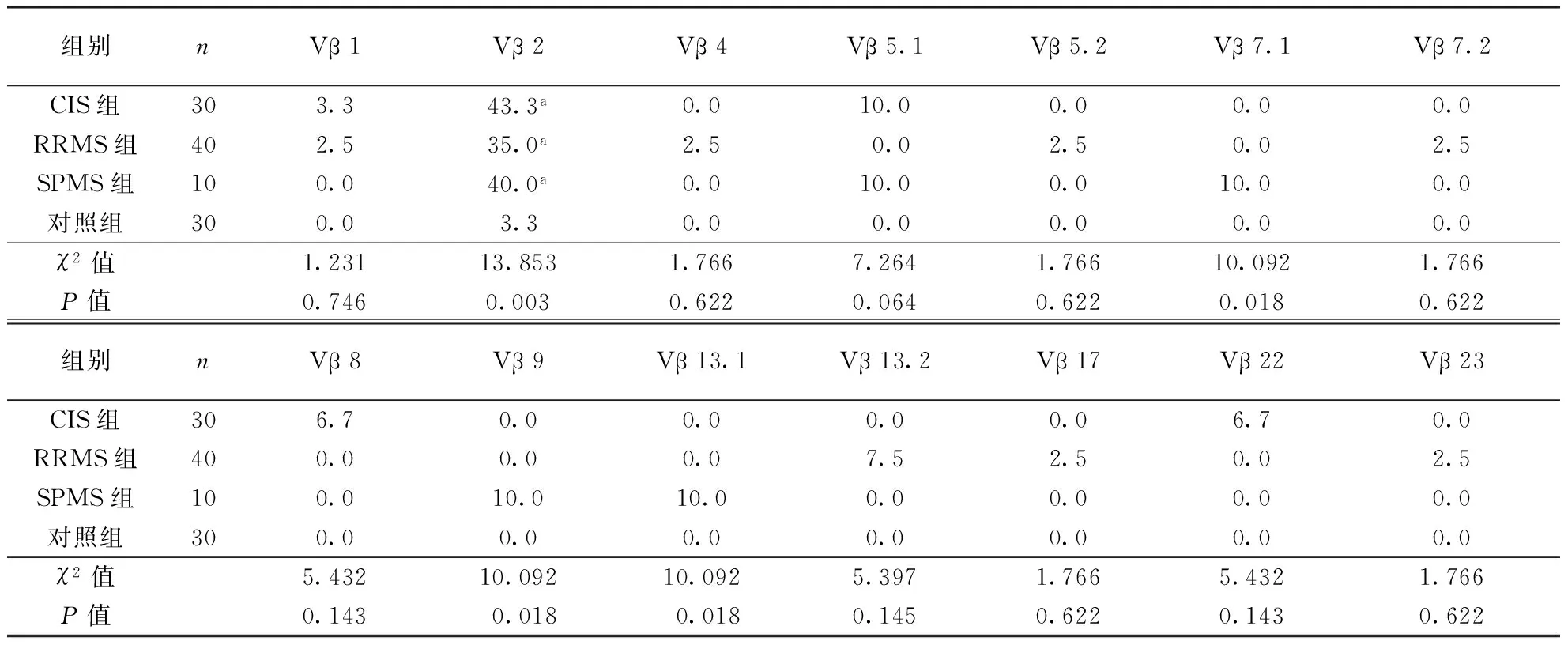
表4 各组CD4+TCRVβ 24个亚家族存在扩增者的频率(%)
注:CD4+TCRVβ 3、5.3、11、12、13.6、14、16、18、20、21.3亚家族扩增频率均为0,数据省略;与对照组比较,aP<0.008
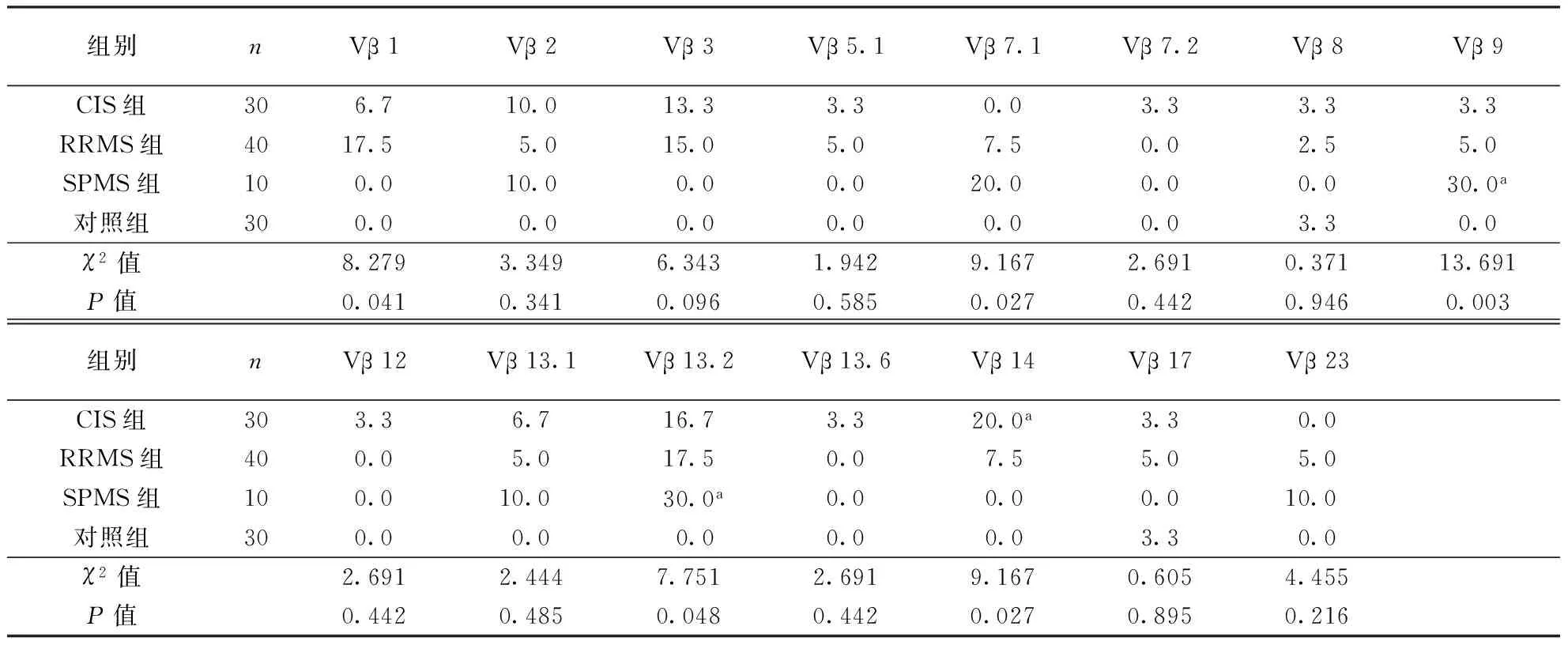
表5 各组CD8+TCRVβ 24个亚家族存在扩增者的频率(%)
注:CD8+TCRVβ 4、5.2、5.3、11、16、18、20、21.3、22数据均为0,结果省略;与对照组比较,aP<0.008
2.2血清各TCR片段的诊断价值根据上述定性分析和定量分析结果,将各组具有统计学差异的TCR片段绘制ROC曲线,并计算ROC曲线下面积(AUC),结果显示,CD8+TCRVβ 11的定量分析对MS(CIS+SPMS+RRMS)的诊断具有中等诊断价值(AUC=0.847,P<0.01),对MS分型无诊断价值;CD4+TCRVβ 21.3的定量分析对SPMS诊断具有中等诊断价值(AUC=0.741,P=0.047),而CD4+TCRVβ 2的定性分析对MS(包括CIS)的诊断价值较低(AUC=0.632,P=0.012)。
2.3外周血淋巴细胞检测结果各组外周血淋巴细胞占有核细胞比例、T淋巴细胞占淋巴细胞比例、CD4+T细胞占T淋巴细胞比例、CD8+T细胞占T淋巴细胞比例及CD4+T细胞/CD8+T细胞比例间比较差异无统计学意义(P>0.05,表8)。
3 讨论
临床上MS根据病程分为CIS、RRMS、SPMS、PPMS 4种类型,其中RRMS最常见,RRMS患者以CIS形式起病,可看做是RRMS的早期阶段,发病10年后40%~50%的RRMS型转化为SPMS型。免疫活动存在于MS疾病的所有阶段。
本研究发现,疾病组患者外周血TCRVβ有限制性扩增,存在扩增患者比例及扩增程度较健康对照显著增高,这与MS的病理机制相一致。目前研究认为,MS发病的免疫病理机制为T淋巴细胞介导的自身免疫性疾病,T淋巴细胞免疫活动基本通过T淋巴细胞受体实现,因此可以通过监测TCR来监测MS患者的免疫状态[1-2],TCRVβ片段具有高度特异性,可代表TCR的表达及表达水平。目前有关研究对象多为白种人群,比如Mandel等研究发现12例CIS患者(起病3个月内)外周血TCRVβ 6~9表达水平较对照组增高[4];RRMS复发期患者外周血TCRVβ 4、5、7、9、11表达较对照组增高,外周血TCRVβ 3、27表达较对照组下降[5];Buhler 等发现RRMS缓解期患者外周血TCRVβ 3、8表达较对照组增高[6];Beall 等对83例SPMS患者外周血TCRVβ 8、11表达观察发现其水平较对照组增高[7]。本研究结果显示,与对照组相比,疾病组CD4+TCRVβ 2表达增高,CD8+TCRVβ 11表达下降;CIS组CD8+TCRVβ 14,SPMS组CD8+TCRVβ 9、13.2表达增高,SPMS组CD4+TCRVβ 21.3表达水平低于CIS组。产生这种差异可能与以下原因有关:(1)MS是一种免疫介导的异质性疾病,参与致病的抗原较多;从MS患者外周血分离出来的髓磷脂特异性T细胞可识别多种髓磷脂蛋白(如髓鞘碱性蛋白、髓鞘结合脂蛋白、髓鞘少突胶质细胞糖蛋白、少突胶质细胞髓鞘相关蛋白[8]等);同时体内存在非髓磷脂特异性T淋巴细胞可识别αB晶体、神经元蛋白接触素-2[9]等抗原,T细胞同时或先后与一种或多种抗原产生免疫反应,造成不同类型的损害。(2)本研究患者除CIS外均为复发期,脱髓鞘疾病的复发可能与感染有关,某些TCRVβ片段的扩增可能是一过性存在[10],患者出现的TCRVβ扩增片段可能是针对该次的感染性抗原。(3)种族差异性。
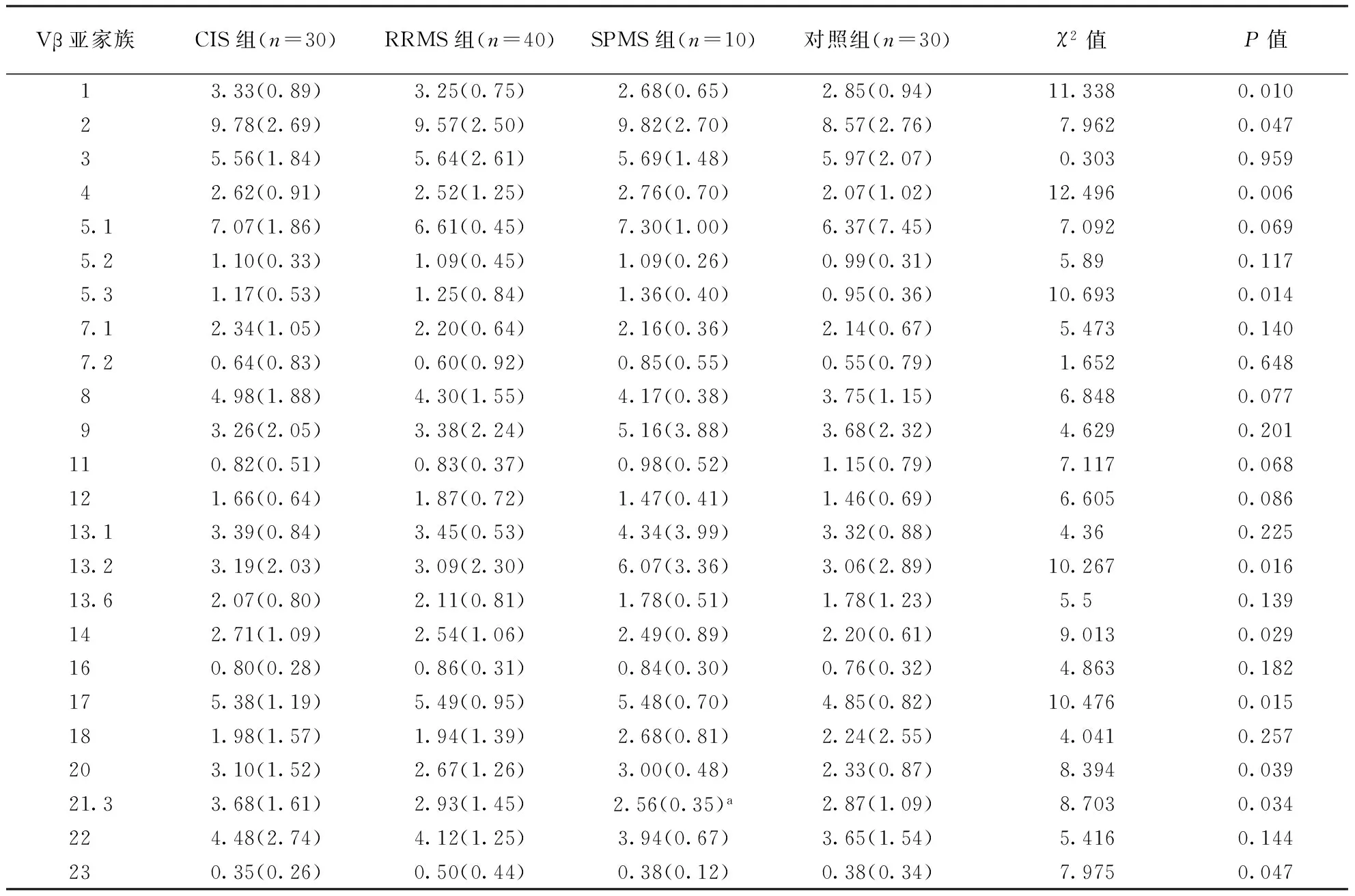
表6 各组CD4+TCRVβ 24个亚家族定量表达水平比较(%)
注:与CIS组比较,aP<0.05
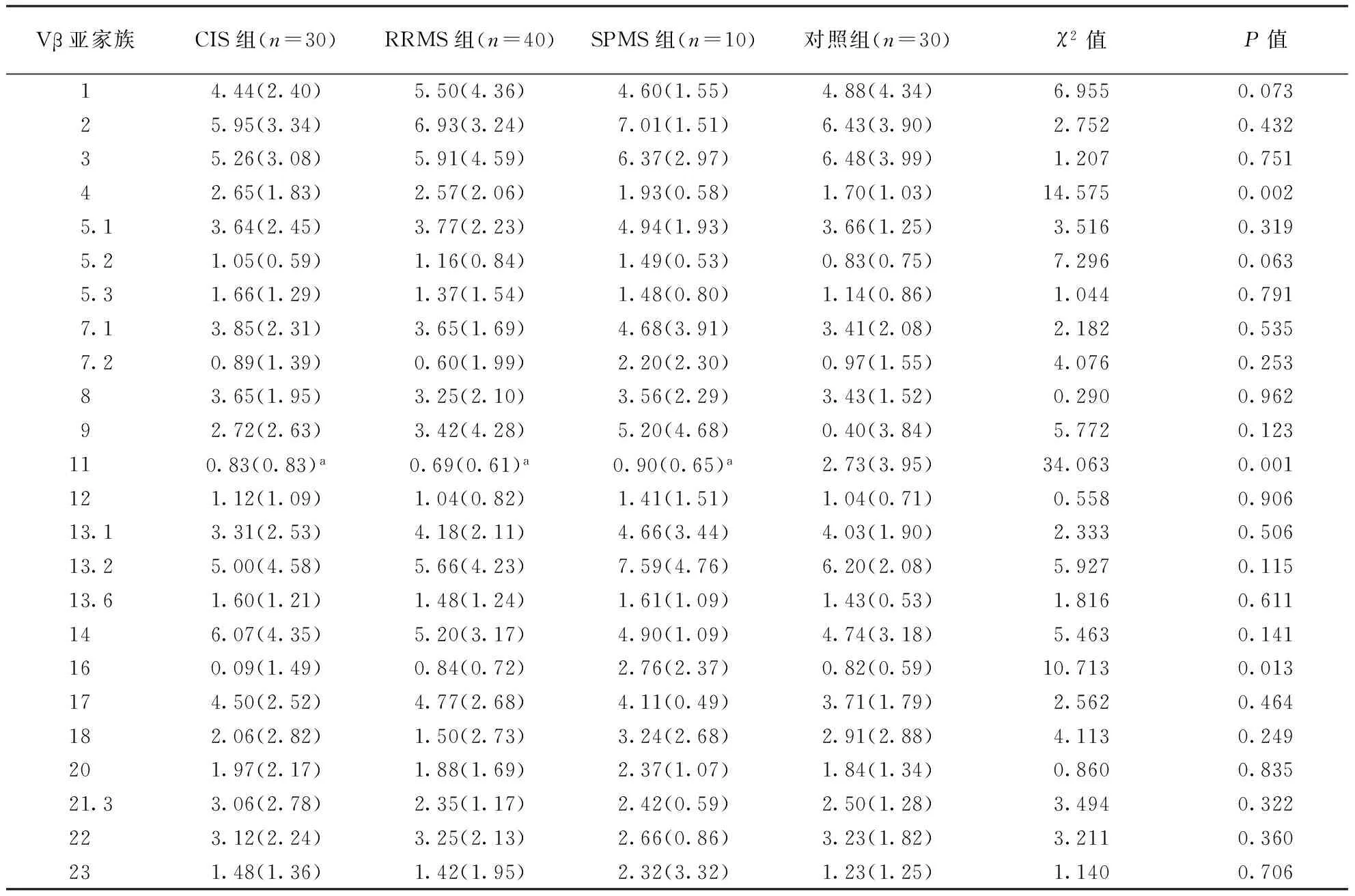
表7 各组CD8+TCRVβ 24个亚家族定量表达水平比较(%)
注:与对照组比较,aP<0.05
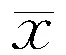
表8 各组外周血淋巴细胞检测结果(±s)
另外,本研究结果显示,TCRVβ扩增程度在3个疾病组之间无统计学差异,反映脱髓鞘疾病患者外周血淋巴细胞数量及组成无统计学差异,T细胞免疫活动程度基本一致,但其功能发生异常[11]。Warabi等[12]通过对13例RRMS患者、8例SPMS患者(病程大于8年),25名健康人研究发现,RRMS患者TCRVβ扩增个数与SPMS患者间存在差异〔(1.3±1.0)比(3.2±3.1)〕。本研究中,SPMS患者(病程3~13年)尚处于继发进展阶段的早期,可能尚未完全表现出TCRVβ扩增,导致各疾病组之间扩增个数无统计学差异。CIS患者亦存在TCRVβ扩增,提示在CIS阶段即进行免疫调节治疗具有一定意义,但外周血TCRVβ检测能否作为CIS预后判断指标需对CIS组患者定期随访,进一步研究予以证实。
该研究发现,CIS组、RRMS组、SPMS组出现扩增的TCRVβ者比例依次增多。有研究显示,在MS早期阶段TCRVβ扩增针对新抗原一过性存在,抗原刺激减退后,相应细胞群凋亡继而数量下降,致病主要抗原或反复出现的抗原使TCRVβ持续存在且扩增[10],并且随疾病进展,抗原表位发生扩展;疾病早期抗原较为局限,随疾病发展,致病抗原数量增多[11]。所以随疾病进程发展,出现扩增的TCRVβ亚家族增多。本研究还发现,随疾病进程进展,表达水平下降的TCRVβ亚家族增多,这与MS病理机制中免疫调节异常可能有关,数量减少的T细胞群可能对疾病有保护作用。健康人亦会出现TCRVβ扩增,存在扩增者比例、扩增程度显著低于疾病组。有报道称健康者扩增的TCRVβ与病毒感染有关,健康者髓鞘特异性T细胞处于休眠状态的原始表型[3],扩增的TCRVβ亚家族不会对髓磷脂抗原发生反应[12],属于正常扩增。
根据本研究结果显示,MS不同阶段患者外周血TCRVβ扩增程度增高,CD4+T细胞和CD8+T细胞均有TCRVβ扩增。3个疾病组的定性分析均高表达CD4+TCRVβ 2、定量分析均低表达CD8+TCRVβ 11;CD8+TCRVβ 11的定量分析对MS的诊断具有一定意义,但对MS分型无诊断价值;CD4+TCRVβ 21.3的定量分析对SPMS诊断具有一定意义。可通过检测部分TCRVβ片段对MS及SPMS的早期诊断提供相关依据。更加深入的分型特异性研究需要后续如细胞因子检测、抗原性检测等进一步证实。这些TCRVβ亚家族有望可以做为治疗靶点对MS进行免疫调节治疗[13]。
[1]Allegretta M,Nicklas JA,Sriram S,et al. T cells responsive to myelin basic protein in patients with multiple sclerosis[J]. Science,1990,247(4943):718-721.
[2]Venken K,Hellings N,Hensen K,et al. Memory CD4+CD127 high T cells from patients with multiple sclerosis produce IL-17 in response to myelin antigens[J].Neuroimmunol, 2010,226(1-2):185-191.
[3]Frohman EM,Racke MK,Raine CS. Multiple sclerosis—the plaque and its pathogenesis[J]. N Engl J Med,2006,354(9):942-955.
[4]Mandel M,Achiron A,Tuller T,et al. Clone clusters in autoreactive CD4 T-cell lines from probable multiple sclerosis patients form disease-characteristic signatures[J]. Immunology,2009,128(2):287-300.
[5]Biegler BW,Yan SX,Ortega SB,et al. Clonal composition of neuroantigen-specific CD8+and CD4+T-cells in multiple sclerosis[J].Neuroimmunol,2011,234(1-2):131-140.
[6]Buhler MM,Bennetts BH,Heard RN,et al. T cell receptor beta chain genotyping in Australian relapsing-remitting multiple sclerosis patients[J]. Mult Scler,2000,6(3):140-147.
[7]Beall SS,Biddison WE,McFarlin DE,et al. Susceptibility for multiple sclerosis is determined,in part,by inheritance of a 175-kb region of the TCR V beta chain locus and HLA class Ⅱ genes[J].Neuroimmunol,1993,45(1-2):53-60.
[8]Rosbo NK,Kaye JF,Eisenstein M,et al. The myelin-associated oligodendrocytic basic protein region MOBP15-36 encompasses the immunodominant major encephalitogenic epitope(s) for SJL/J mice and predicted epitope(s) for multiple sclerosis-associated HLA-DRB1*1501[J].Immunol,2004,173(2):1426-1435.
[9]Derfuss T,Parikh K,Velhin S,et al. Contactin-2/TAG-1-directed autoimmunity is identified in multiple sclerosis patients and mediates gray matter pathology in animals[J]. Proc Natl Acad Sci USA,2009,106(20):8302-8307.
[10]Muraro PA,Jacobsen M,Necker A,et al. Rapid identification of local T cell expansion in inflammatory organ diseases by flow cytometric T cell receptor Vβ analysis[J]. Immunol Methods,2000,246:131-143.
[11]Fasso M. Anandasabapathy N. Crawford F, et al. T cell receptor (TCR)-mediated repertoire selection and loss of TCRVβ diversity during the initiation of a CD4+T cell response in vivo[J]. Exp Med,2000,92:1719-1730.
[12]Laplaud DA,Berthelot L,Miqueu P,et al. Serial blood T cell repertoire alterations in multiple sclerosis patients; correlation with clinical and MRI parameters[J].Neuroimmunol,2006,177(1-2):151-160.
[13]Vandenbark AA,Culbertson NE,Bartholomew RM,et al. Therapeutic vaccination with a trivalent T-cell receptor (TCR) peptide vaccine restores deficient FoxP3 expression and TCR recognition in subjects with multiple sclerosis[J]. Immunology,2008,123(1):66-78.

