AQP4-IgG阳性视神经脊髓炎谱系疾病的脑脊液细胞学特点
刘慧勤 任海涛 徐雁 高鑫雅 李玮 张杰文 关鸿志
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是一类中枢神经系统自身免疫性脱髓鞘疾病,以视神经炎和急性横贯性脊髓炎为主要临床表现,其致残率高。致病性抗体即抗水通道蛋白4抗体(AQP4-IgG)是其最特异性的血清学标志,在NMOSD的发病机制中起重要作用。其特异性高达85%~99%,在68%~91%的NMOSD患者血清中可检测到该抗体[1-3]。目前已知多种类型的免疫细胞参与NMOSD的免疫过程,包括自然杀伤细胞、T淋巴细胞、B细胞亚群、中性粒细胞、嗜酸性粒细胞和巨噬细胞[2-7]。脑脊液细胞学从形态上可一定程度反映疾病的炎性反应状态和免疫机制,但目前有关NMOSD脑脊液细胞学及其他脑脊液指标特点的研究较少被关注[8]。本研究通过回顾分析AQP4-IgG阳性NMOSD患者的脑脊液检查结果,旨在探讨其脑脊液细胞学的特点及诊断意义。
1 对象和方法
1.1观察对象回顾性收集2016-01-01—2016-12-31在北京协和医院及河南省人民医院神经病理实验室检测证实的AQP4-IgG阳性NMOSD患者237例,其中来自北京协和医院209例,河南省人民医院28例。237例中,女210例,男27例,女∶男=7.8∶1,年龄3~81岁,平均(40.9±16.6)岁。入组标准:(1)患者均符合2016年《中国视神经脊髓炎谱系疾病诊断与治疗指南》AQP4-IgG阳性NMOSD的诊断标准[9];(2)均接受间接免疫荧光血AQP4-IgG检测并呈阳性;(3)均行脑脊液细胞学检查,且脑脊液来源于急性发作期或复发期。排除标准:(1)神经系统感染性疾病,如细菌、病毒、分枝杆菌、真菌引起的脑炎、脑膜炎或脑脓肿;(2)自身免疫性脑炎;(3)神经系统原发肿瘤或转移瘤。
1.2方法
1.2.1临床资料收集:收集患者的一般资料,脑脊液细胞学、常规、生化及寡克隆区带(OB)检测结果。
1.2.2血AQP4-IgG检测:所有患者行血液AQP4-IgG检测,采用间接免疫荧光法,通过转染重组的AQP4的人胚肾293(HEK293)细胞系表达AQP4肽段全长进行检测。试剂盒由德国欧蒙医学实验诊断股份公司提供,批号:FA112c-1005-1。按试剂盒推荐的检测步骤进行:滴加待检血清或血浆〔经磷酸盐缓冲液(PBS)按1∶10稀释〕30 μL至加样板的反应区,然后将载片贴有生物薄片的一面朝下,与加样板相对应的凹槽紧密结合,反应即刻开始,室温下温育30 min,PBS冲洗,滴加25 μL异硫氰酸荧光素(FTTC)标记的羊抗IgG在室温下温育30 min,PBS冲洗,置于荧光显微镜下观察。
1.2.3脑脊液检查:脑脊液检查包括脑脊液细胞学、脑脊液常规细胞计数、脑脊液生化及OB。脑脊液细胞学检查采用脑脊液细胞学沉淀室(自然沉淀法)制片:取0.5 mL的脑脊液加入脑脊液沉淀室,置于4℃冰箱中过夜,待细胞自然沉淀并干燥后,采用迈-格-姬(May-Grun-wald-Giemsa,MGG)染色法,光镜下观察细胞形态、分类及数量[10]。依据镜下细胞计数及形态,将炎性反应程度分为4级:(1)正常:细胞数≤200个/0.5 mL且未见炎性反应细胞(中性粒细胞、嗜酸性粒细胞、激活淋巴细胞、激活单核细胞、浆细胞);(2)轻度:细胞数≤200个/0.5 mL但可见炎性反应细胞,或细胞数201~500个/0.5 mL;(3)中度:细胞数501~2000个/0.5 mL;(4)重度:细胞数>2000个/mL(自然沉淀法的细胞收集率为15%左右)。依据镜下细胞形态及分类将炎性反应类型分为:(1)淋巴细胞性炎性反应;(2)淋巴细胞与中性粒细胞性炎性反应;(3)淋巴细胞与嗜酸性粒细胞性炎性反应;(4)淋巴细胞、中性粒细胞与嗜酸性粒细胞性炎性反应。并观察有无激活淋巴细胞、激活单核细胞及浆细胞。
1.3统计学处理采用SPSS 21.0统计软件进行分析,符合正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数(四分位数间距)表示。计数资料以率(%)表示。脑脊液常规和细胞学两种方法判断患者炎性反应的差异性分析采用配对χ2检验,一致性分析用Kappa一致性检验。以P<0.05为差异有统计学意义。
2 结果
2.1脑脊液细胞学
2.1.1炎性反应程度:237例AQP4-IgG阳性的NMOSD患者均完成脑脊液细胞学检测。细胞学检查结果显示正常117例(49.4%),120例(50.6%)可见炎性反应,其中轻度炎性反应63例(26.6%),中度炎性反应43例(18.1%),重度炎性反应14例(5.9%)。
2.1.2炎性反应分类:120例脑脊液细胞学异常的NMOSD患者中,95例(79.2%)为淋巴细胞性炎性反应(图1A),其炎性反应程度为轻、中、重的患者分别为54、35、6例;20例(16.7%)为淋巴细胞与中性粒细胞性炎性反应(图1B),其炎性反应程度为轻、中、重的患者分别为8、7、5例,中性粒细胞占白细胞总数的百分比范围为1%~85%;4例(3.3%)患者为淋巴细胞与嗜酸性粒细胞性炎性反应(图1C),其炎性反应程度为轻、中、重的患者分别为1、1、2例,嗜酸性粒细胞占白细胞总数的百分比为5%~20%;1例(0.8%)患者为淋巴细胞、中性粒细胞为主的炎性反应,并可见嗜酸性粒细胞,其细胞总数为5000/0.5 mL,淋巴细胞、单核细胞、中性粒细胞、嗜酸性粒细胞比值为分别为68%、8%、20%、4%。
2.1.3激活淋巴细胞、激活单核细胞、浆细胞:120例脑脊液细胞学异常的NMOSD患者中,71例(30.0%)可见激活淋巴细胞(图1A),11例(4.6%)可见激活单核细胞,15例(6.3%)可见浆细胞(图1D)。
2.2脑脊液OB检查176例患者行OB检查,其中脑脊液特异性OB阳性47例(26.7%)。
2.3脑脊液常规、生化检查81例患者行脑脊液常规、生化检查,脑脊液常规白细胞计数为(0~138)×106/L,中位数6×106/L,四分位数间距为14×106/L,其中白细胞计数≤5×106/L者35例,(5~10)×106/L者20例(24.7%),(10~50)×106/L者19例(23.5%),>50×106/L者7例(8.6%)。脑脊液蛋白为0.20~1.67 g/L,平均(0.514±0.26)g/L,<0.45 g/L者41例(50.6%),(0.45~1.00)g/L者37例(45.7%),(1.00~1.50)g/L者1例(1.2%),>1.5 g/L者2例(2.5%)。
2.4一致性检验对81例行脑脊液细胞学与脑脊液常规计数检查的患者进行统计分析,脑脊液常规细胞数>5×106/L者46例(56.8%),脑脊液细胞学提示炎性改变亦为46例(56.8%),两种方法判断患者炎性反应的阳性率比较无统计学差异(P=1.0)。对两种检测方法行Kappa一致性检验,结果示两种检验方法的一致性一般(表1)。
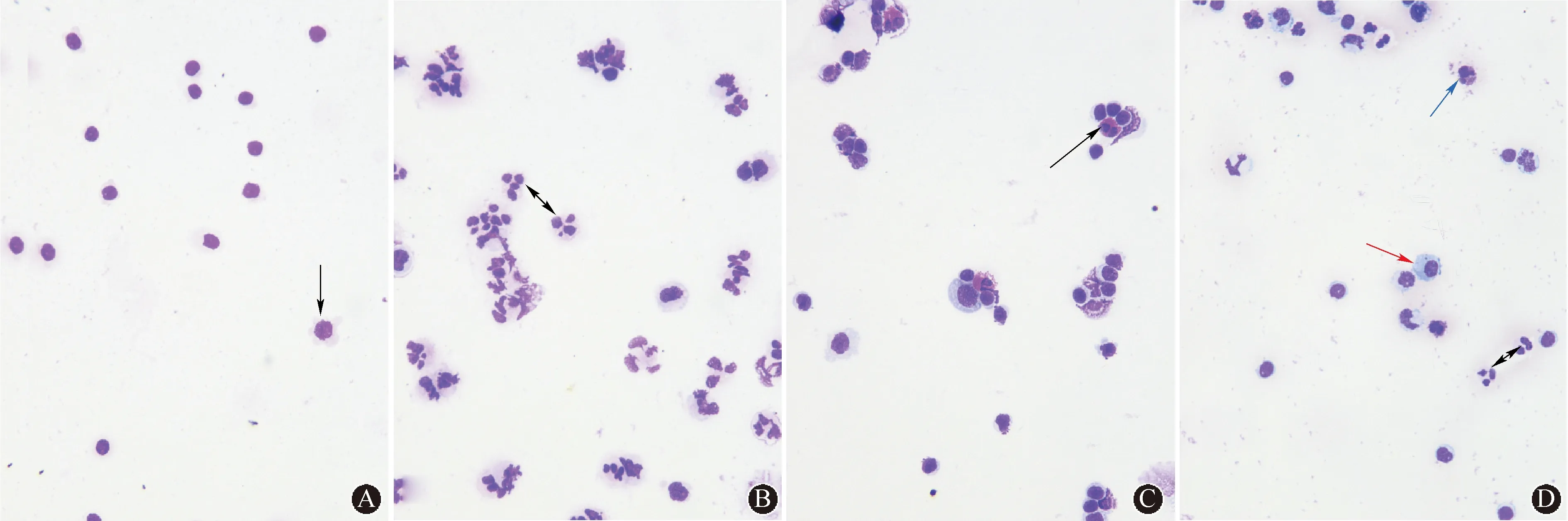
注:AQP4-IgG:水通道蛋白4抗体;NMOSD:视神经脊髓炎谱系疾病;A:淋巴细胞性炎性反应(箭头所示为激活淋巴细胞);B:淋巴细胞与中性粒细胞性炎性反应(箭头所示为中性粒细胞);C:淋巴细胞与嗜酸性粒细胞性炎性反应(箭头所示为嗜酸性粒细胞);D:淋巴细胞与中性粒细胞(黑色箭头所示)为主炎性反应,偶见嗜酸性粒细胞(蓝色箭头所示),并可见浆细胞(红色箭头所示) 图 1 AQP4-IgG阳性的NMOSD患者脑脊液细胞学典型表现(迈-格-姬染色,×300)
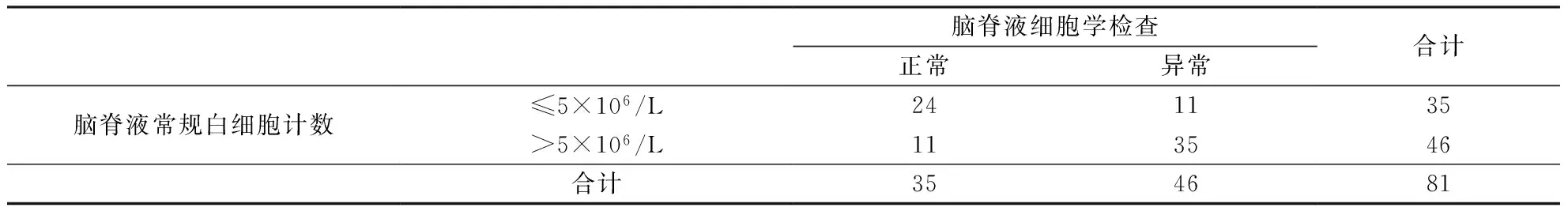
脑脊液细胞学检查正常异常合计脑脊液常规白细胞计数≤5×106/L241135>5×106/L113546合计354681
注:Kappa=0.447,P<0.01
3 讨论
本研究结果显示,约半数AQP4-IgG阳性的NMOSD患者脑脊液细胞学呈炎性反应,炎性反应程度以轻中度为主,少数患者可呈重度炎性反应;炎性反应类型以淋巴细胞性炎性反应为主,也可见中性粒细胞与嗜酸性粒细胞;脑脊液细胞学检查还可见激活淋巴细胞、激活单核细胞和浆细胞;该病例组患者脑脊液OB阳性率明显低于多发性硬化患者。
AQP4-IgG是NMOSD明确的致病性抗体,约68%~91%的患者血清中可检测到该抗体[1-2]。中枢神经系统的AQP4高表达于脊髓、视神经、脑干、下丘脑、脑室周围区,也表达于血管周围、室管膜周、极后区及视上核等[1]。在细胞水平,AQP4主要表达在星形胶质细胞的足突[2]。AQP4-IgG在外周产生后,通过通透性增加或细胞外途径进入中枢神经系统与AQP4结合,从而引起一系列免疫反应。与多发性硬化相比,NMOSD脑脊液细胞数增多更常见,脑脊液常规白细胞数>50×106/L可作为NMOSD诊断的支持标准[11]。本研究结果显示,237例AQP4-IgG阳性的NMOSD患者中120例脑脊液细胞学显示细胞数增高,占50.6%,这与Jarius等[8]报道的50.5%接近。本组患者炎性反应程度轻、中、重的比例为26.6%(63例)、18.1%(43例)、5.9%(14例),与脑脊液常规细胞数增多的趋势基本一致。对81例脑脊液常规、生化、细胞学数据均完整的AQP4-IgG阳性的NMOSD患者进行分析发现,脑脊液常规细胞数增高(>5×106/L)与细胞学异常患者的阳性率相等,但两种检测方法的一致性一般(Kappa值=0.447,P<0.01),表明脑脊液细胞学异常与脑脊液常规的细胞数增多不完全平行。因细胞学脑脊液的检测量为0.5 mL,远大于脑脊液常规的检测量,并可从细胞类型、比例上进行更深入的细胞形态学评价,因此它较脑脊液常规检查能提供更多信息,更能反映脑脊液的炎性状态[12-13],这似乎解释了两种检测方法一致性一般的原因。
本组120例脑脊液细胞学呈炎性反应的AQP4-IgG阳性的NMOSD患者中,以淋巴细胞性炎性反应者为主,达95例,占总炎性反应患者的79.2%,这与既往研究结果一致[8]。其原因可能与淋巴细胞在NMOSD免疫机制中的重要作用有关。AQP4-IgG所属IgG1亚型的活动有赖于T淋巴细胞的存在,T淋巴细胞还参与免疫耐受的打破、粒细胞至中枢神经系统的动员、炎性反应的介导等过程[5]。B淋巴细胞则可演变为浆细胞,参与抗体合成[7]。但脑脊液细胞学尚不能分辨T、B淋巴细胞,需要借助流式细胞仪或免疫组化进行细胞因子的检测。
本组21例NMOSD患者的脑脊液细胞学可见明确的中性粒细胞,其中20例呈淋巴细胞与中性粒细胞性炎性反应,1例呈淋巴细胞、中性粒细胞与嗜酸性粒细胞性炎性反应。中性粒细胞来源于外周血细胞,一般不出现于正常的脑脊液细胞学中。既往多个研究结果显示,视神经脊髓炎(neuromyelitis optica,NMO)病灶区域可见中性粒细胞是NMO有别于多发性硬化的特点[2-3],NMO患者脑脊液中的中性粒细胞及粒细胞集落刺激因子水平也明显升高[3]。AQP4-IgG所介导的补体激活导致外周中性粒细胞进入中枢神经系统,并通过中性粒细胞弹性蛋白酶依赖机制参与早期NMO病灶的进展[14]。此外,中性粒细胞还可加剧NMO的炎性反应水平[14]。部分NMOSD患者脑脊液中性粒细胞显著升高并可在细胞学分类中占优势[8]。如本组患者中性粒细胞比值最高可达85%,高度类似细菌引起的中枢神经系统感染。但NMOSD患者脑脊液常规的白细胞计数明显低于大部分细菌性脑膜炎的白细胞计数,如本组患者脑脊液常规白细胞计数最高为138×106/L,此特点有助于鉴别中枢神经系统细菌性感染。
该研究结果显示,120例脑脊液呈炎性反应的NMOSD患者中,5例脑脊液细胞学可见嗜酸性粒细胞,其中1例与中性粒细胞同时出现。嗜酸性粒细胞在NMO中的作用尚不完全清楚,但它的出现也是NMO病灶区域或脑脊液比较特征性的表现[11,15-16]。有研究发现,NMO脊髓病变中的嗜酸性粒细胞明显增加,并证实CC趋化因子受体3(嗜酸性粒细胞趋化因子的主要受体)在NMO病灶区可强力趋化嗜酸性粒细胞[16]。活化的嗜酸性粒细胞从颗粒中释放多种细胞毒性因子参与炎性反应[15]。嗜酸性粒细胞的激活在NMO的病变过程中是原发事件还是继发事件尚未明确[14]。因AQP4-IgG介导的补体激活可导致多种趋化因子如补体C5a的产生,所以嗜酸性粒细胞的活化可能是补体激活的结果[15]。
本研究显示,在120例脑脊液细胞学异常的患者中,71例可见激活淋巴细胞,11例可见激活单核细胞。淋巴细胞是NMO免疫反应中重要的免疫细胞,被激活后可能参与抗原呈递、免疫调节等过程。激活的单核细胞与巨噬细胞属于同一系统,在NMO中可能参与清理由星形胶质细胞和粒细胞渗透产生的细胞残余物[4]。
该组176例行脑脊液OB检查的患者中47例脑脊液特异性OB阳性,阳性率为26.7%。这与国外报道的OB阳性率10%~30%基本一致,但低于多发性硬化的80%~90%[17],提示NMOSD患者脑脊液OB阳性率低是其区别于多发性硬化的一项重要实验室指标。浆细胞作为抗体合成细胞[7],其出现提示可能存在鞘内合成。目前认为AQP4-IgG是外周合成的抗体,合成之后进入中枢神经系统[3]。本组患者AQP4-IgG的检测均来源于血清,反映AQP4-IgG多为外周合成。但有少部分研究证实在NMO的起病阶段可能存在鞘内合成的AQP4-IgG,并直接参与中枢神经系统NMO病灶的形成[18]。本组患者脑脊液细胞学检查发现15例可见浆细胞,提示部分AQP4-IgG可能为鞘内合成,但其在NMO发病机制中的意义还需要进一步的研究。
从性别构成上讲,本研究的患者女性与男性之比为7.8∶1,女性患者比例高于男性,提示女性较男性更易患病。这与国外报道结果一致[2]。从年龄构成上讲,最小患者仅3岁,最大者达81岁,年龄跨度大,各年龄段均可受累,但以40岁左右的青中年女性为好发人群。这些人口学特征表明本研究所收集的病例具有一定代表性。
综上所述,本研究通过对AQP4-IgG阳性的NMOSD患者脑脊液细胞学的分析发现,50.6%的患者脑脊液细胞学呈炎性反应,其炎性反应类型可见淋巴细胞性炎性反应、淋巴细胞与中性粒细胞性炎性反应、淋巴细胞与嗜酸性粒细胞性炎性反应及淋巴细胞、中性粒细胞与嗜酸性粒细胞性炎性反应;脑脊液细胞学可见中性粒细胞和嗜酸性粒细胞是NMOSD相对特异的表现;此外,AQP4-IgG阳性的NMOSD患者脑脊液细胞学还可见激活淋巴细胞、激活单核细胞和浆细胞。以上脑脊液细胞学特征有助于为AQP4-IgG阳性的NMOSD提供诊断依据,并为揭示AQP4-IgG独特的致病机制提供思路。
[1]Wingerchuk DM,Lennon VA,Lucchinetti CF,et al. The spectrum of neuromyelitis optica[J]. Lancet Neurol,2007,6:805-815.
[2]Wingerchuk DM. Neuromyelitis optica spectrum disorders[J]. Continuum (Minneap Minn),2010,16:105-121.
[3]Papadopoulos MC,Verkman AS. Aquaporin 4 and neuromyelitis optica[J]. Lancet Neurol,2012,11:535-544.
[4]Hendriks JJ,Teunissen CE,de Vries HE et al. Macrophages and neurodegeneration[J]. Brain Res Brain Res Rev,2005,48:185-195.
[5]Bradl M,Misu T,Takahashi T,et al. Neuromyelitis optica:Pathogenicity of patient immunoglobulininvivo[J]. Ann Neurol,2009,66:630-643.
[6]Ratelade J,Zhang H,Saadoun S,et al. Neuromyelitis optica IgG and natural killer cells produce NMO lesions in mice without myelin loss[J]. Acta Neuropathol,2012,123:861-872.
[7]Chihara N,Aranami T,Sato W,et al. Interleukin 6 signaling promotes anti-aquaporin 4 autoantibody production from plasmablasts in neuromyelitis optica[J]. Proc Natl Acad Sci USA,2011,108:3701-3706.
[8]Jarius S,Paul F,Franciotta D,et al. Cerebrospinal fluid findings in aquaporin-4 antibody positive neuromyelitis optica:Results from 211 lumbar punctures[J]. J Neurol Sci,2011,306:82-90.
[9]中国免疫学会神经免疫学分会,中华医学会神经病学分会神经免疫学组,中国医师协会神经内科分会神经免疫专业委员会. 中国视神经脊髓炎谱系疾病诊断与治疗指南[J]. 中国神经免疫学和神经病学杂志,2016,23(02):155-166.
[10]粟秀初,孔繁元. 神经系统临床脑脊液细胞学[M]. 北京:人民军医出版社,2001.34-36.
[11]Tan CT,Mao Z,Qiu W,et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology,2016,86:491-492.
[12]赵燕环,邵宇权,任海涛,等.神经精神狼疮脑脊液细胞学特点[J].中国现代神经疾病杂志,2013,13:132-135.
[13]关鸿志,陈琳,崔丽英,等. 吉兰-巴雷综合征的脑脊液细胞学特点及诊断意义[J]. 协和医学杂志,2015,6 :14-17.
[14]Saadoun S,Waters P,MacDonald C,et al. Neutrophil protease inhibition reduces neuromyelitis optica-immunoglobulin G-induced damage in mouse brain[J]. Ann Neurol,2012,71:323-333.
[15]Lucchinetti CF,Mandler RN,McGavern D,et al. A role for humoral mechanisms in the pathogenesis of Devic’s neuromyelitis optica[J]. Brain,2002,125:1450-1461.
[16]Correale J,Fiol M. Activation of humoral immunity and eosinophils in neuromyelitis optica[J]. Neurology,2004,63:2363-2370.
[17]Reiber H,Teut M,Pohl D,et al. Paediatric and adult multiple sclerosis:Age-related differences and time course of the neuroimmunological response in cerebrospinal fluid[J]. Mult Scler,2009,15:1466-1480.
[18]Bennett JL,Lam C,Kalluri SR,et al. Intrathecal pathogenic anti-aquaporin-4 antibodies in early neuromyelitis optica[J]. Ann Neurol,2009,66:617-629.

