对视神经脊髓炎谱系疾病国际诊断标准和中国指南的综合理解
司建荣 张雅丽
2015-07由国际视神经脊髓炎诊断小组(IPND)公布了《视神经脊髓炎谱系疾病诊断标准的国际共识》(简称“国际标准”)[1],2016-05中国免疫学会神经免疫学分会等公布了《中国视神经脊髓炎谱系疾病诊断与治疗指南》(简称“中国指南”)[2]。尽管仍有一些免疫介导的中枢神经系统(CNS)炎性脱髓鞘疾病既不能满足国际标准和中国指南,也不能诊断为其他疾病,需要密切结合临床、影像学和免疫标记物的随访观察,但就目前来说,国际标准和中国指南均具有很高的权威性、科学性,为视神经脊髓炎谱系疾病(NMOSD)的早期诊断、准确诊断提供了简明、实用的依据[3]。
国际标准和中国指南中,诊断NMOSD的关键依据是血清水通道蛋白-4抗体(aquaporin-4 immunoglobulin G antibodies,AQP4-IgG)和核心临床特征(core clinical characteristics,CCC)。即使AQP4-IgG阴性(检测阴性或未知AQP4-IgG情况)以及病变未累及视神经和脊髓,也能确立NMOSD的诊断。
CCC有6种(组)[1]:(1)视神经炎;(2)急性脊髓炎;(3)最后区综合征,即其他原因不能解释的呃逆、或恶心和呕吐;(4)急性脑干综合征;(5)症状性发作性睡眠病或急性间脑临床综合征,并且头颅MRI显示间脑有典型的NMOSD 病灶;(6)症状性大脑综合征,并且头颅MRI显示大脑有典型的NMOSD病灶。实际上,每一种CCC包含了临床表现(症状与体征)和对应的MRI表现两个部分,6种CCC分别代表了CNS不同的空间区域。
但国际标准和中国指南对CCC 4~6单项阳性的最低要求不一致,即对于AQP4-IgG阳性患者:CCC 4阳性,国际标准仅需要临床表现,而中国指南仅需要MRI表现;CCC 5、6阳性,国际标准需要临床表现+MRI表现,而中国指南仅需要MRI表现;对于AQP4-IgG阴性患者:CCC 4~6阳性,国际标准需要临床表现+MRI表现,而中国指南仅需要MRI表现[1-2]。这些不同可能对NMOSD临床诊断带来一定困扰,不知参照哪一个标准。因此,有必要进一步探讨如何灵活而不失精准地综合应用国际标准和中国指南。
1 对国际标准中6种CCC表现与MRI表现的理解
IPND在制订标准的过程中,形成了许多限定性结论,其中之一是“无症状不能诊断NMOSD”原则[1]。最终达成共识的NMOSD诊断标准为[1]:(1)要排除其他疾病;(2)至少要有1次(任何1种)与CCC相对应的CNS症状的临床发作;(3)对于AQP4-IgG阳性患者,至少有1种CCC阳性;(4)对于AQP4-IgG阴性患者,必须满足以下条件,1)至少有2种CCC阳性,且阳性CCC中有一种是视神经炎、急性长节段横断性脊髓炎或最后区综合征;2)CCC 1有临床表现,或CCC 2~6有临床表现+MRI表现。
1.1对于AQP4-IgG阳性患者只要有1种CCC阳性,即符合最低诊断标准;CCC 1~4单项阳性的最低条件是有临床表现,而CCC 5、6单项阳性的最低条件是临床表现+MRI表现。
IPND在说明中指出,虽然CCC 1~3的临床表现对NMOSD不具备定性诊断的作用,但具有非常重要的提示价值(即非常高的特异性)[1],所以没有要求同时具备对应的MRI表现。
IPND对CCC 4(脑干综合征)的临床表现没有强调,但在文献中[4-5],通常将CCC 3(最后区综合征)归为CCC 4的表现之一。 CCC 3特异的临床表现被定义为顽固性呃逆、或恶心和呕吐,即每天的大部分时间都有发作,至少持续7 d,无其他原因解释;如果MRI上最后区/延髓背侧有病灶,症状持续2 d即符合标准[1]。CCC 4的其他表现有眼球运动障碍、瘙痒、听力丧失、面瘫、眩晕或前庭性共济失调、三叉神经痛、饮水呛咳、其他脑神经症状、各种长束征等[1,4,6];虽然其他病因(如脑出血、脑梗死、肿瘤等)也可引起上述症状,但IPND对CCC 4的定义和注释中提出的症状进展时间节点(症状达到最严重或持续加重的时间在4 h到3周之间)[1],非常有助于确定NMOSD,因此CCC 4的临床表现也具备较高的特异性,也不要求同时具备相应的MRI表现。
IPND强调CCC 5、6临床表现必须伴有典型的MRI表现,但标准中未做进一步说明与解释。笔者理解IPND这样规定的原因为:CCC 5、6临床表现形式多样,轻重差异大,即使结合IPND对症状进展时间节点的定义,其特异性也不高;除NMODS外,精神因素、各种感染、肿瘤、创伤、血管性因素、代谢紊乱、肝性脑病和急性播散性脑脊髓炎等其他疾病或因素[7-10]可引起与CCC 5、6相似的临床表现,而MRI表现则具有较高的特征性。
NMODS引起的CCC 5(特别指丘脑、下丘脑和第三脑室周边区域病灶)的症状有嗜睡、发作性睡眠病样综合征、厌食伴体重下降和低体温等[1];CCC 6的症状有脑病、偏身轻瘫、皮层性视力障碍、昏迷、癫痫发作、头痛、小脑性共济失调[1,11],以及急性播散性脑脊髓炎样和可逆性后部脑病样表现[5]。
包括了CCC 5、6在内的、具备较高特异性的MRI表现有:病灶在T1WI上呈低信号,T2WI上呈高信号;病灶大多数无强化,绝大多数无占位效应[1,11-12]。病灶累及下丘脑、丘脑,或中脑导水管、第四和第三脑室室管膜周边;单侧或双侧的、较大融合性皮质下或深部白质病灶;弥漫性、非均质性或水肿性胼胝体病灶,长度≥胼胝体长度的1/2;同时累及内囊和大脑脚的皮质脊髓束病灶,病灶较长,可为单侧或双侧;广泛的侧脑室室管膜周边的病灶;累及延髓背侧(特别是最后区)的病灶,通常与上段颈髓病灶相延续;视神经病灶范围>视神经长度的1/2或累及视交叉;脊髓内病灶范围≥3个连续的椎体节段。所以,与MRI上典型的NMODS病灶相匹配的CCC 5、6临床表现才能表明是NMODS的临床表现。
1.2对于AQP4-IgG阴性患者达到最低诊断标准的要求,除了强调上述提到的“至少有2种CCC阳性,且其中之一必须是视神经炎、急性长节段横断性脊髓炎或最后区综合征”外,最严格的要求是上述提到的第二条,即CCC 1只需临床表现,CCC 2~4必须是临床表现+MRI表现。因为CCC 5~6的初步要求已为临床表现+MRI表现,因此国际标准中没有更进一步强调MRI表现。
为何对AQP4-IgG阴性患者要求CCC 2~6临床表现+MRI表现才能为阳性?除依据大量的统计数据支持外,关键点应是NMOSD的MRI表现具有较高的特征性[1,11-12],特别是MRI表现与AQP4在CNS的高表达区域,或与AQP4-IgG在CNS的致病解剖部位非常吻合[13-16]。
AQP4抗体不仅是NMOSD诊断的生物标志物,而且还具有致病性[17]。在CNS,AQP4大量存在于视神经和脊髓,同时也遍及脑组织各部位,AQP4是AQP4-IgG的靶抗原[18]。在生理情况下,AQP4在CNS呈极性分布[19]:(1)从细胞层面讲,AQP4特异性地分布在星形胶质细胞的特定区域,如在足突上高度聚集。(2)从脑组织整体层面讲,AQP4可与周边组织形成特定结构:星形胶质细胞足突与软脑膜形成胶质界膜,即脑-蛛网膜下腔的脑脊液交界面;星形胶质细胞足突可与血管形成脑-血液交界面,参与血-脑屏障的形成;室管膜与胶质细胞足突形成脑-脑室的脑脊液交界面。当AQP4-IgG与AQP4相结合,可导致星形胶质细胞损伤和血-脑屏障破坏,进而引起一系列NMOSD临床表现[18]。当病灶累及CNS的功能区域(如皮质、脑干、小脑等)即会产生相应的NMOSD症状[11]。
在CNS内,视神经和脊髓AQP4的信使RNA(mRNA)、蛋白及其超分子聚合物的表达明显高于脑干、大脑皮层和小脑,这与临床上NMOSD病变最易于累及视神经和脊髓,也可累及脑干,但较少累及皮质相一致[19-20]。如前所述,NMOSD典型MRI表现与AQP4高表达部位的一致性还体现在病灶范围长(视神经、脊髓、颈髓-延髓和皮质脊髓束等病灶),病灶与室管膜(中脑导水管、侧脑室、第三和四脑室)密切相关联。笔者认为:典型的MRI表现,特别是病灶的部位分布和病灶范围较长的特点,表明了AQP4-IgG在CNS的致病靶区,起到了“AQP4-IgG的影像学指示剂”效应;在AQP4-IgG阴性情况下(特别是未知AQP4-IgG情况时),强调MRI表现,实际上隐喻着用MRI表现“替代” 检测血清AQP4-IgG的价值。
2 对中国指南中 “CCC4~6临床症候可以为阴性”的理解
中国指南在阐述NMOSD的临床表现与MRI影像特征时指出[2]:在6组(种)CCC中,视神经炎、急性脊髓炎和延髓最后区综合征的临床及影像表现最具特征性。需要强调每组核心临床症候群与影像同时对应存在时,支持NMOSD的诊断特异性最高,如果仅单一存在典型临床表现或影像特征,其作为支持诊断的特异性会有所下降(视神经炎的MRI特征可以为阴性,后3组临床症候可以为阴性)。
按照字面含义及其上下文相关内容,可以理解为:CCC 4~6中,如果单项只有MRI表现而无对应的临床表现,可以认定该CCC为阳性。但在临床应用中,笔者认为应该视 AQP4-IgG阳性与阴性的不同而有区别地理解和应用。
2.1对于AQP4-IgG阳性患者前述“无症状不能诊断NMOSD”原则仍然有决定性作用。显然,CCC 4~6中,单项仅有MRI表现而无临床表现者,不能达到单项CCC阳性的最低要求。尽管CCC 5、6的MRI表现特异性高于临床表现[1,11-12],但无临床表现时不能作为阳性判断。
甜荞优良品种筛选及配套栽培技术研究…………………………… 罗中旺,金晓蕾,辛万和,智 锐,靳伟龙,关 奎,黄颍奇(22)
2.2对于AQP4-IgG阴性患者CCC 1~3阳性判断的标准与国际标准一致。标准中,CCC 1~3其中之一必须阳性的要求,已经满足了“无症状不能诊断NMOSD”原则,如果再有 CCC 4~6任何一种的阳性,则满足了对AQP4-IgG阴性患者的最低诊断标准。
关键的问题是在CCC 4~6中,如果每种只有MRI表现而无对应的临床表现,能否视为阳性?笔者观点与中国指南一致,认为此时可以作为阳性看待。理由是:CCC 4~6中,MRI表现有高度特异性,特别是后二者的MRI表现特异性高于临床表现[1,11-12];MRI表现有AQP4-IgG在CNS致病靶区的“指示剂效应”;另外,CCC 4~6 MRI表现的发生率明显高于临床表现[3,11-12,21];IPND也指出,在纵向研究中,累计60%的NMOSD患者存在无症状性脑白质病灶[1]。以此作为最低诊断标准,应该不会降低诊断特异性,同时还可增加早期诊断的可能性;如要求临床症状+MRI表现,则显然会降低首诊的诊断率。
但为何IPND 在国际标准中不如此要求?笔者认为,IPND可能对每种CCC均采用了“无症状不能诊断NMOSD”原则,故每种CCC必须具备临床表现;也可能考虑到临床症状+MRI表现更能够保证CCC 4~6对NMOSD诊断的特异性。但应该没有专门考虑AQP4-IgG阴性患者诊断的特殊情况:它是在CCC 1~3其中之一阳性的先决条件下,判定CCC 4~6为阳性,这样才有诊断价值;这也正是需要探讨的问题。
3 对国际标准和中国指南的综合理解
笔者认为,确认每种CCC阳性的最低要求可以是:(1)对于AQP4-IgG阳性患者,CCC 1~4只要有临床表现即可判断阳性,CCC 5、6需要 MRI表现+临床表现才可判断阳性。(2)对于AQP4-IgG阴性患者,CCC 1只要有临床表现即可判断阳性,CCC 2、3阳性必须有临床表现+MRI表现支持,CCC 4~6只要有MRI病灶即为阳性。
当然,要诊断NMOSD,首先需排除其他疾病。笔者对最新NMOSD诊断标准最低要求的综合理解是否正确,有待专家的评价。在目前细胞法检测AQP4-IgG尚不普及,而MRI检查较为普及的情况下,如果能够对“国际标准”和“中国指南”形成一致的理解,无疑对临床诊断,特别是对AQP4-IgG阴性NMOSD的诊断有极其重要的指导意义。下面报道一病例,以佐证笔者的理解。
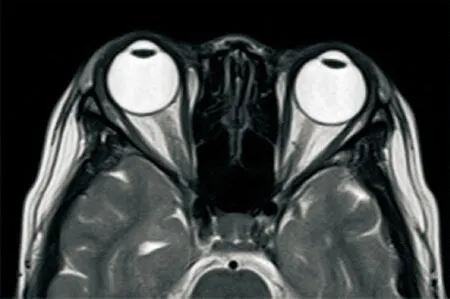
图 1 NMOSD患者头颅轴面T2WI序列检查示右侧视神经较对侧增粗,双侧侧脑室颞角周围白质呈云雾状高信号
该病例阳性临床表现为视神经炎,MRI阳性表现为视神经炎、急性脑干综合征、急性间脑综合征和大脑综合征。需要思考的是:在AQP4-IgG检测结果出来之前,能否诊断为NMOSD?如按国际标准尚不能满足诊断要求,而按中国指南则满足诊断要求。笔者认为也满足NMOSD诊断要求。
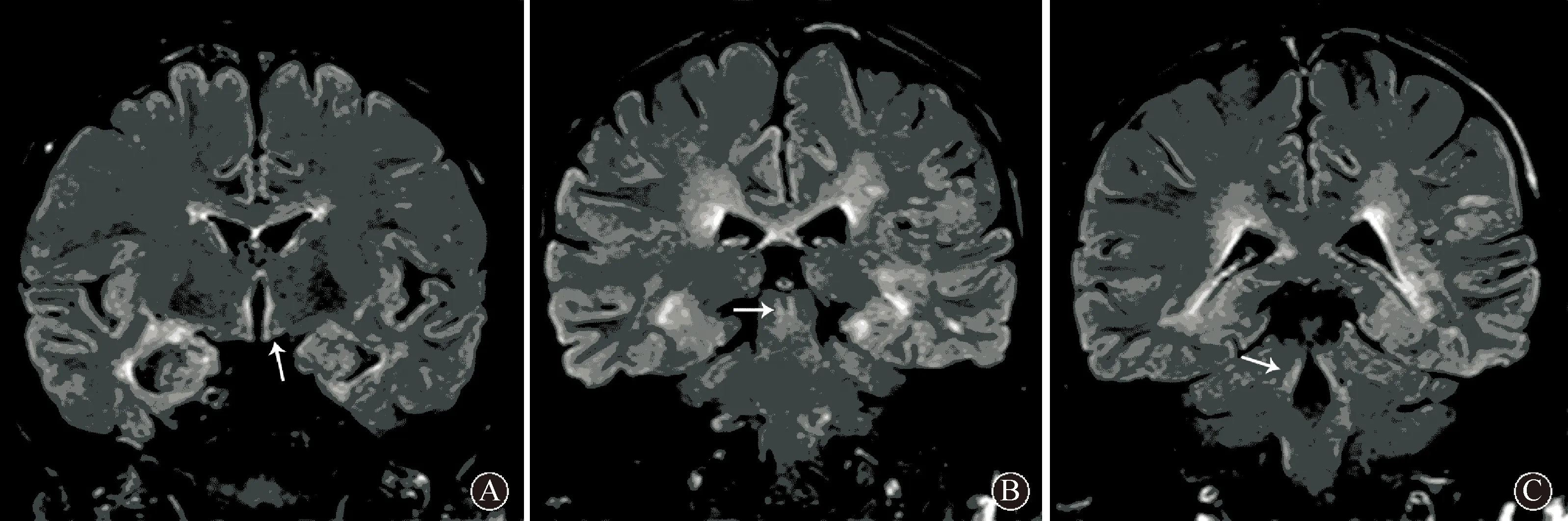
图 2 NMOSD患者头颅冠状面T2WI-Flair序列显示双侧视束信号增高(箭头所示,A),双侧半卵圆中心、胼胝体、双侧侧脑室(体部和颞角)周边、中脑导水管周边(箭头所示,B)、第三脑室和第四脑室周边(箭头所示,C)广泛的云雾状、斑片状高信号
[1]Wingerchuk DM,Banwell B,Bennett JL,et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology,2015,85(2):177-189.
[2]中国免疫学会神经免疫学分会,中华医学会神经病学分会神经免疫学组,中国医师协会神经内科分会神经免疫专业委员会.中国视神经脊髓炎谱系疾病诊断与治疗指南[J].中国神经免疫学和神经病学杂志,2016,23(3):155-166.
[3]张祥,李翔,邓波,等.水通道蛋白4抗体阳性和阴性视神经脊髓炎谱系病患者临床表现的分析和比较[J].临床内科杂志,2016,33(8):521-524.
[4]Kremer L,Mealy M,Jacob A,et al. Brainstem manifestations in neuromyelitis optica:a multicenter study of 258 patients[J]. Mult Scler,2014,20(7):843-847.
[5]Kim W,Kim SH,Lee SH,et al. Brain abnormalities as an initial manifestation of neuromyelitis optica spectrum disorder[J]. Mult Scler,2011,17(9):1107-1112.
[6]尤小凡,胡洪涛,叶静,等.视神经脊髓炎谱系疾病患者脑干损害的临床和影像学特点[J].中风与神经疾病杂志,2014,31(9):794-798.
[7]薛启蓂,刘占东.长期应激状态所致皮质-间脑综合综合征[J].临床心身疾病杂志,2015,21(1):110-113.
[8]孙文鑫,陈凤生.下丘脑综合征诊断与治疗[J].中国实用儿科杂志,2006,21(11):806-808.
[9]Chou IJ,Wang HS,Whitehouse WP,et al. Paediatric multiple sclerosis:update on diagnostic criteria,imaging,histopathology and treatment choices[J]. Curr Neurol Neurosci Rep,2016,16(7):68.
[10]Mahdi N,Abdelmalik PA,Curtis M,et al. A case of acute disseminated encephalomyelitis in a middle-aged adult[J]. Case Rep Neurol Med,2015:601706.
[11]Cheng C,Jiang Y,Chen X,et al. Clinical,radiographic characteristics and immunomodulating changes in neuromyelitis optica with extensive brain lesions[J]. BMC Neurol,2013,13:72.
[12]Kim W,Park MS,Lee SH,et al. Characteristic brain magnetic resonance imaging abnormalities in central nervous system aquaporin-4 autoimmunity[J]. Mult Scler,2010,16(10):1229-1236.
[13]Wingerchuk DM,Lennon VA,Pittock SJ,et al. Revised diagnostic criteria for neuromyelitis optica[J]. Neurology,2006,66(10):1485-1489.
[14]马文巧,杨丽娜,赵宁,等.以最后区综合征为首发症状的视神经脊髓炎谱系疾病8例临床分析[J].中国神经免疫学和神经病学杂志,2016,23(3):221-223.
[15]程忱,江滢,胡学强,等.抗AQP4抗体对脑干临床孤立综合征转归的影响[J].中华神经医学杂志,2016,15(5):472-477.
[16]Pittock SJ,Weinshenker BG,Lucchinetti CF,et al. Neuromyelitis optica brain lesions localized at sites of high aquaporin 4 expression[J]. Arch Neurol,2006,63(7):964-968.
[17]张星虎.客观认识水通道蛋白4抗体及其他胶质细胞抗体与视神经脊髓炎谱系疾病的关系[J].中国神经免疫学和神经病学杂志,2017,24(2):85-87.
[18]米芳,贾宏阁.视神经脊髓炎与抗水通道蛋白4抗体研究进展[J].中华神经医学杂志,2016,15(1):96-100.
[19]陈志志,张淑坤,吴世政. 水通道蛋白4与神经系统疾病[J].中国神经精神疾病杂志,2014,40(10):633-637.
[20]武雷,黄德晖,吴卫平. 水通道蛋白4抗体在视神经脊髓炎发病机制中的作用[J]. 中国神经免疫学和神经病学杂志,2011,18(6):431-434.
[21]Pittock SJ,Lennon VA,Krecke K,et al. Brain abnormalities in neuromyelitis optica[J]. Arch Neurol,2006,63(3):390-396.

