一种来源于酒曲地衣芽孢杆菌溶菌酶基因在毕赤酵母中的诱导表达及活性分析
王凤寰,韩 煦,孙 博,赵飞函,温 赛,杜 鉴,廖永红
(1.北京工商大学 食品学院 中国轻工业清洁生产和资源综合利用重点实验室,北京 100048;2.中国食品添加剂和配料协会,北京 100020)
溶菌酶作为一种天然的非特异性抗菌物质,广泛存在于动物、植物和微生物中[1]。溶菌酶通过水解细菌细胞壁中N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键而达到杀菌的目的[2]。近年来,随着细菌耐药性问题的日益严重,对抗生素替代品的研究与开发已成为众多科研人员的重要工作之一[3-4]。基于溶菌酶具有良好的抗菌活性以及较好的热稳定性等优良特性,溶菌酶现已成功应用于食品防腐、饲料、医药以及化妆品等领域[5-9]。
酒曲是经自然培养而成的一种含有多种微生物和酶系的复合糖化发酵剂。酒曲中微生物的种类和密度对酒的品质及风味都有极大的影响[10]。已有研究显示,在白酒酿造过程中的不同时期,微生物群落组成及丰度是不同的[11]。传统理论认为,发酵环境的变化(如酒醅及酒窖环境的改变)影响了微生物的生长代谢,导致了微生物群落的变化。
基于本课题组之前的研究[12-14],笔者提出一种设想,是否有可能是由于某些菌株在特定时期分泌了溶菌酶,抑制了其他微生物的生长,从而改变了微生物群落的组成和丰度?基于这样的设想,笔者对酒曲中的微生物进行了分离、纯化,获得一株产溶菌酶的地衣芽孢杆菌,并用毕赤酵母真核表达系统对其溶菌酶蛋白进行重组表达,以期为进一步实现其工业化应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种、质粒和材料
溶壁微球菌、X33菌株、pPICZαA表达载体、枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、克雷伯氏菌和酒曲保存于笔者所在实验室。E.coliTop10感受态细胞,天根生物公司。pMD19-T克隆载体,TaKaRa公司。
1.1.2 DNA限制性内切酶、工具酶和试剂
限制性内切酶EcoRⅠ、NotⅠ和SacⅠ,NEB公司,T4 DNA连接酶,Thermo公司; 2×Utaq PCR Mix、10×DNA Loading buffer,北京庄盟国际生物基因科技有限公司;DNA Marker和蛋白Marker,宝如亿公司;高纯度质粒小提试剂盒和DNA凝胶回收试剂盒,OMEGA公司;细菌基因组DNA提取试剂盒,天根生物公司;无氨基酵母氮源(YNB),Biotopped公司;PCR引物由上海生工生物工程有限公司合成;其他试剂均为市售分析纯。
1.1.3 培养基
LB培养基(g/L):蛋白胨 10,NaCl 10,酵母浸粉 5;pH 7.0。
若制固体LB培养基,则在液体培养基中加入琼脂粉20 g/L。
孟加拉红培养基(RBA)(g/L):蛋白胨 5,KH2PO41,MgSO40.5,葡萄糖10,氯霉素0.1,孟加拉红0.033,琼脂18.5。
YPD培养基:酵母浸粉 10,蛋白胨20,葡萄糖20;若制YPD固体培养基,则加入琼脂粉 20 g/L。
BMGY培养基:蛋白胨 20 g/L,酵母浸粉 10 g/L,磷酸钾缓冲液(pH 6.0)100 mmol/L,无氨基酵母氮源(YNB) 13.4 g/L,生物素4×10-4g/L,甘油1.00%(体积分数)。
BMMY培养基:蛋白胨20 g/L ,酵母浸粉10 g/L,磷酸钾缓冲液(pH 6.0)100 mmol/L,YNB 13.4 g/L,生物素4×10-4g/L,甲醇 1%(体积分数)。
1.2 试验方法
1.2.1 菌种的分离纯化
称取10 g粉碎的酒曲,加入装有90 mL无菌水和若干玻璃珠的250 mL三角瓶中,置于恒温摇床中,25 ℃条件下200 r/min振荡30 s至摇散混匀,使酒曲中微生物均匀分散在无菌水中,记此样品稀释度为10-1。然后将此样品进行10倍梯度稀释,稀释至10-6。取10-3、10-4和10-5稀释液,分别涂布于LB培养基、RBA培养基平板,涂布量为100 μL,每种培养基每个稀释倍数各涂布3个平行,待菌液完全吸收后,倒置于37和30 ℃恒温培养箱中培养1~5 d。根据菌落生长形态、大小及颜色的不同,分别挑取不同的单菌落接种于相应的固体培养基中进行纯化,直至得到单克隆。之后进行镜检,确定是单一菌后进行保菌,存放于4 ℃冰箱中备用。
1.2.2 菌种的液体培养
对分离得到的细菌在LB液体培养基中培养,于37 ℃、200 r/min条件下培养16~24 h,对分离得到的酵母在YPD液体培养基中培养,于30 ℃、220 r/min条件下培养24~48 h,之后用比浊法检测发酵上清液是否具有溶菌酶酶活。
1.2.3 菌种的分子生物学鉴定
对具有溶菌酶酶活的菌株以甘油管的形式进行保菌,存放于-20 ℃冰箱中。将具有酶活的菌株发酵液由华大基因完成菌种测序鉴定,获得16S rDNA序列。
1.2.4 溶菌酶基因序列的克隆
在NCBI中找到对应的溶菌酶蛋白所对应的基因序列,设计带有酶切位点的特异性引物:Lyz-F(带有EcoRⅠ酶切位点)和Lyz-R(带有NotⅠ酶切位点),以全基因组为模板进行PCR;将PCR产物连接到pMD-19T载体上,转化至E.coliTop10,经氨苄青霉素抗性筛选出阳性转化子,提取质粒,双酶切验证,测序。
1.2.5 重组表达质粒pPICZαA-Lyz的构建
利用限制性内切酶EcoRⅠ、NotⅠ对克隆载体pMD19-T-Lyz和毕赤酵母表达载体pPICZαA双酶切,利用T4连接酶将胶回收片段和载体片段连接,转化至E.coliTop 10中,重组质粒pPICZαA-Lyz经菌落PCR鉴定正确后,摇菌提取质粒并测序。
1.2.6 毕赤酵母的电转化及高拷贝子的筛选
取10 μL经限制性内切酶SacⅠ线性化的重组质粒pPICZαA-Lyz与毕赤酵母X33感受态细胞混匀后加入预冷的0.2 cm的电转杯中,在电压1.5 kV的电转条件下完成电转化,电击时间5.2 ms(以表达载体pPICZαA为阴性对照)。分别培养于含较低质量浓度Zeocin(100 μg/mL)和较高质量浓度Zeocin(500 μg/mL)抗性的YPDS培养基上。在30 ℃条件下恒温静置培养48 h,筛选阳性转化子。
1.2.7 重组酵母的诱导表达
将筛选得到的阳性拷贝子及阴性对照酵母菌接种于4 mL YPD培养基中扩大培养,在30 ℃、250 r/min条件下培养24 h。按照2.00%(体积分数)的接种量接种于50 mL BMGY培养基中,同等条件下培养至OD600达到5~6。离心收集菌体,用200 mL的BMMY培养基重悬菌体,每隔24 h补加1次甲醇至终体积分数为1.00%,30 ℃诱导培养72 h。每隔24 h取样,离心收集培养液上清。
1.2.8 重组蛋白的分离纯化
利用丙酮法沉淀发酵上清液中的蛋白,用20 mL磷酸缓冲液(PB,pH 7.0,20 mmol/L)溶解蛋白,轻微搅拌均匀后用截留分子量为5 000的透析袋透析48 h,然后用0.22 μm的滤膜过滤透析袋中的蛋白溶液,再用截留分子质量为1.0×104的超滤离心管将蛋白溶液浓缩至3 mL左右。将蛋白溶液与1 mL SP-Sepharose Fast Flow column(GE)结合,以PB为平衡液,磷酸钠缓冲液(PBS,pH 7.0)在不同浓度(0.3、0.5和1.0 mol/L)下梯度洗脱,收集洗脱蛋白,SDS-PAGE电泳检测。
1.2.9 溶菌酶的活性测定
利用比浊法进行溶菌酶活性测定。在25 ℃条件下,以溶壁微球菌为底物,波长450 nm处每分钟吸光度下降0.001个单位所需的酶量为1个活力单位,酶活性单位为U/mL。在室温下,迅速向2 mL底物悬液中加入发酵上清液0.1 mL,记下反应15 s和75 s时波长为450 nm的吸光值(A450),计算二者差值,即每分钟吸光度下降数ΔA450。
1.2.10 重组蛋白的酶学性质测定
最适pH的测定:在室温条件下,测定发酵上清液在pH 2.0~ 9.0内的相对酶活;热稳定性的测定:在最适pH的条件下,将发酵上清液经4、20、40、60、80和100 ℃处理30 min后,检测发酵上清液的相对酶活。
1.2.11 溶菌酶的抑菌活性测定
以枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌和克雷伯氏菌为测试对象,用纸片法检测重组毕赤酵母发酵上清液对4种细菌的抑制活性。将枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌和克雷伯氏菌分别在LB液体培养基中培养,于37 ℃、200 r/min条件下培养至OD450达到2~3。将培养液稀释至10-4后,涂布于LB固体平板上。待菌液涂布均匀被培养基吸收后,用无菌镊子在平板上放入5片无菌滤纸片(1片在中间,4片在周围),中间1片滤纸片作为阴性对照滴加10 μL无菌水,周围4片滤纸片滴加10 μL发酵上清液。将平板置于37 ℃培养箱中过夜培养,观察是否出现抑菌圈。
2 结果与讨论
2.1 菌种的筛选鉴定
酒曲是白酒发酵的基础,在白酒酿造的过程中,微生物种类的更迭也存在周期性变化。在酒曲入酒醅后的酿造过程中,细菌在发酵前期大量繁殖,其中芽孢杆菌属细菌属于优势菌群[15]。从酒曲中分离、纯化得到的菌种中,经试管培养、比浊法检测后得到一株具有溶菌酶活性的菌种,命名为FGB1。FGB1经LB液体培养基摇床培养48 h后,培养上清液的酶活为55 U/mL。将华大基因16S rDNA测序结果与NCBI的GenBank中序列经BLAST分析比对后,确定FGB1为地衣芽孢杆菌。
2.2 目的基因的扩增
经NCBI查找地衣芽孢杆菌基因组序列后,确定地衣芽孢杆菌中含有一段编码糖苷水解酶的基因,糖苷水解酶属于溶菌酶的一种。以地衣芽孢杆菌基因组DNA为模板,利用设计的特异性引物Lyz-F(5′-TCAGAATTCATGGGAATCAAAGGAATCGAC-3′)和Lyz-R(5′-ATTGCGGCCGCTTATCTAACACGAATTTTC-3′)通过PCR扩增得到目的基因序列。PCR产物经1.00%琼脂糖凝胶电泳检测,在950 bp左右出现明显的条带,如图1中通道1所示。通道M为DL2000 plus marker。将PCR产物回收后与pMD19-T克隆载体连接,转化至E.coliTop10中。经蓝白斑筛选后,挑取白色单克隆,菌落PCR鉴定其为阳性克隆后,提取重组质粒pMD19-T-Lyz。

图1 PCR产物电泳图Fig.1 Electrophoresis of PCR amplified lysozyme sequence from Bacillus licheniformis strain
在众多抗生素替代品中,天然来源的溶菌酶是安全性最高且最具潜力的替代品。近几年来,国内外科研人员先后发现了来源于人类、哺乳动物以及海洋动物等多种不同的天然溶菌酶,并通过PCR技术实现了相应溶菌酶目的基因的扩增以及后续在毕赤酵母中的异源表达[16-19]。对不同来源的溶菌酶同源性进行分析,结果见表1。由表1可知:从酒曲地衣芽孢杆菌中获取的溶菌酶,与已克隆表达的溶菌酶相似度最高,为9.12%,表明该溶菌酶具有一定的新颖性。

表1 氨基酸序列同源性分析
2.3 重组表达载体pPICZαA-Lyz的构建和验证
对克隆载体pMD19-T-Lyz和毕赤酵母分泌型表达载体pPICZαA分别进行EcoRⅠ和NotⅠ双酶切。将纯化回收后的目的基因片段和pPICZαA载体片段经1.00%琼脂糖凝胶电泳验证,结果见图2。由图2可见,通道1和2所示在954和3 500 bp处均有条带。用T4连接酶将两部分连接后,连接产物转化至E.coliTop10中。经菌落PCR鉴定,重组表达质粒pPICZαA-Lyz构建成功。
细菌中天然溶菌酶的产量和活性都非常低,为了提高溶菌酶的表达效果,笔者将地衣芽孢杆菌的溶菌酶基因重组到巴斯德毕赤酵母中。因为毕赤酵母表达系统的pPICZαA表达载体有α信号肽基因,可以使外源蛋白分泌到培养基中,便于后期的分离纯化,大幅降低了工业成本,适用于工业化生产[20]。

图2 胶回收产物验证电泳图Fig.2 Electrophoresis of gel extraction of pMD19-T-Lyz and pPICZαA
2.4 高拷贝子的筛选
重组表达载体pPICZαA-Lyz转化至毕赤酵母X33菌株后整合于毕赤酵母染色体组中。在100 μg/mL Zeocin平板上筛选得到长势较好的拷贝子。为进一步提高重组蛋白的表达水平,对重组毕赤酵母进行高拷贝子的筛选。在500 μg/mL Zeocin平板上成功筛选到高拷贝子。用酵母基因组提取试剂盒提取拷贝子的酵母基因组,结果见图3。由图3的菌落PCR鉴定结果可知,基因被成功重组到毕赤酵母,说明Lyz基因整合到酵母基因组中。
毕赤酵母整合型质粒在进行单位交换整合时会以1.00%~10.00% 的几率发生重复性整合,由此产生外源基因的多拷贝菌株。而多拷贝菌株往往可以耐受更高质量浓度的抗生素,故可通过提高Zeocin的质量浓度,尝试筛选高拷贝子,从而提高重组蛋白的表达水平。
2.5 重组地衣芽孢杆菌溶菌酶的酶活测定
通过比浊法测定阳性拷贝子菌株经甲醇诱导24、48和72 h的发酵上清液中的溶菌酶酶活。摇瓶诱导产酶试验证实高拷贝菌株在72 h后酶活可达1 360 U/mL。其中,阴性对照菌的酶活为0。

图5 重组地衣芽孢杆菌溶菌酶酶学性质Fig.5 Effects of pH and temperature on the enzyme activity of recombinant lysozyme
2.6 溶菌酶蛋白的分离纯化
发酵上清液经丙酮沉淀、透析除盐、超滤浓缩和阳离子交换柱吸附梯度洗脱后,洗脱液进行SDS-PAGE电泳检测。梯度洗脱采用浓度分别为0.3、0.5和1.0 mol/L pH 7.0的PBS,每个浓度梯度洗脱体积为10 mL,分别与图4中通道1、2、3对应。由图4可以发现:用浓度为1 mol/L的PBS洗脱的洗脱液在3.5×104左右有一条蛋白条带,与地衣芽孢杆菌溶菌酶的理论分子质量相符,即图4中第3通道所示条带,且洗脱液有酶活,第1、2通道的洗脱液无酶活。在分离纯化过程中,丙酮沉淀的时间应控制在3 h以内,沉淀时间过长会沉淀出过多的杂蛋白,沉淀时间过短会得不到目的蛋白。在丙酮沉淀的过程中,丙酮要预冷处理,避免有机试剂对蛋白质结构的过多损坏。但丙酮法的优点是操作简便省时,适合工业化生产。
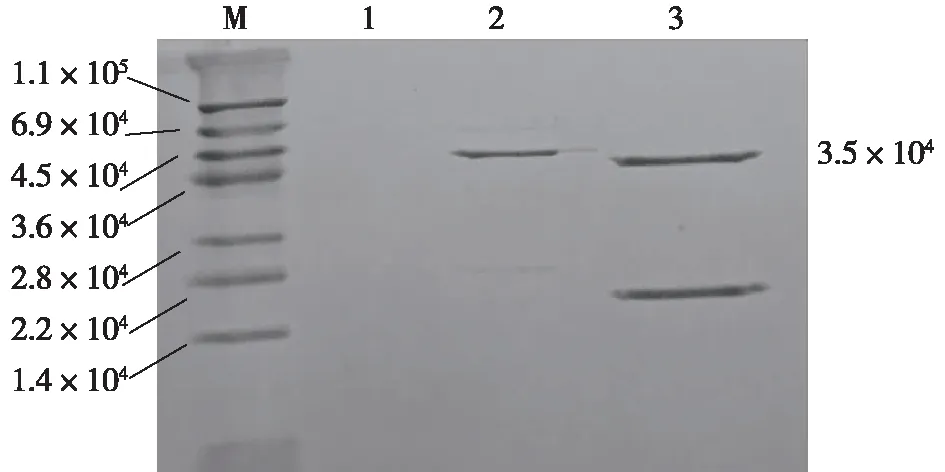
图4 SDS-PAGE电泳图Fig.4 Electrophoresis of SDS-PAGE
2.7 重组蛋白酶学性质分析
考察重组蛋白酶的酶学性质,结果见图5。由图5可知:在室温条件下,地衣芽孢杆菌溶菌酶的最适pH为3.0。当pH为2.0时,酶活降为0;当pH为6.0~9.0时,酶活保持稳定差别不大。在最适pH 3.0条件下,重组地衣芽孢杆菌溶菌酶具有较好的热稳定性。在4和20 ℃处理30 min后的酶活基本无变化;当温度为40 ℃时,酶活开始逐渐下降;当温度为60 ℃时,可保持50%以上的酶活;当温度为80 ℃时,酶活下降为0。说明地衣芽孢杆菌溶菌酶具有良好的耐酸碱能力以及良好的热稳定性。
2.8 溶菌酶的抑菌活性
枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌和克雷伯氏菌在37 ℃、200 r/min条件下培养12 h后,稀释度为10-4的培养液涂布效果最好。在稀释度为10-4的平板上,培养枯草芽孢杆菌和金黄色葡萄球菌,结果见图6。由图6可知:平板出现了比较明显的抑菌圈;培养大肠杆菌和克雷伯氏菌的平板没有出现抑菌圈。说明地衣芽孢杆菌溶菌酶可以对革兰氏阳性菌有比较明显的抑制效果,但是对革兰氏阴性菌的抑制效果不明显。
基于溶菌酶的水解作用机制,溶菌酶可以抑制绝大部分革兰氏阳性菌的生长,但是对革兰氏阴性菌的抑制作用却不明显。已有研究表明,可以通过对溶菌酶分子进行变性处理、分子改造以及结合其他防腐剂共同作用的方法提高溶菌酶的抑菌特性,扩大溶菌酶的抑菌范围[9,21-24]。近几年,国内外研究者针对这一问题,尝试通过融合两种不同的溶菌酶基因从而提高溶菌活性和稳定性[25-28]。特别地,本研究得到地衣芽孢杆菌溶菌酶对金黄色葡萄球菌具有良好的溶菌作用。金黄色葡萄球菌是一种人类病原菌,能够引起多种感染。溶菌酶对金黄色葡萄球菌的抑制活性表明它拥有作为食物和饲料防腐剂的应用潜力。

图6 抑菌圈实验结果Fig.6 Antimicrobial activity of recombinant lysozyme
3 结论
本研究从酒曲中分离纯化得到一株产溶菌酶的地衣芽孢杆菌,提取该地衣芽孢杆菌的基因组,设计特异性引物获取溶菌酶基因Lyz,构建重组表达载体pPICZαA-Lyz,经SacⅠ线性化后电转化至毕赤酵母表达菌株X33中,在Zeocin高抗性平板中筛选出高拷贝转化子。甲醇诱导72 h,通过比浊法测定高拷贝菌株经甲醇诱导表达的发酵上清液,结果显示酶活可达1 360 U/mL。将发酵上清液分离纯化后经SDS-PAGE分析,在3.5×104处有一条明显的目的条带。重组地衣芽孢杆菌溶菌酶可以在pH 3.0~9.0、温度4~60 ℃的范围内保持足够的活力,具有良好的耐酸碱性和热稳定性,为进一步研究其抗菌应用、实现工业化生产奠定基础。
[1] FLEMING A.On a remarkable bacteriolytic element found in tissues and secretions[J].Proc Royal Soc London,1922,93:306-317.
[2] SALTON M R J,GHUYSEN J M.Acetylhexosamine compounds enzymically released fromMicrococcuslysodeikticuscell walls:III.the structure of di- and tetra-saccharides released from cell walls by lysozyme andStreptomycesF1 enzyme[J].Biochim Biophys Acta,1960,45:355-363.
[3] PADGETT T,HAN I Y,DAWSON P L.Incorporation of food-grade antimicrobial compounds into biodegradable packaging films[J].J Food Prot,1998,61(10):1330-1335.
[4] PLÜSS-SUARD C,PANNATIER A,RUFFIEUX C,et al.Changes in the use of broad-spectrum antibiotics after cefepime shortage:a time series analysis[J].Antimicrob Agents Chemother,2012,56(2):989-994.
[5] SIM Y C,LEE S G,LEE D C,et al.Stabilization of papain and lysozyme for application to cosmetic products[J].Biotechnol Lett,2000,22(2):137-140.
[6] 吴晓英,林影,陈慧英.溶菌酶的研究进展[J].工业微生物,2002,32(4):55-58.
[7] 谷绒,车振明,万国福.溶菌酶在食品工业中的应用[J].乳业科学与技术,2006(6):264-266.
[8] 赵龙飞,徐亚军.鸡蛋清中溶菌酶的应用性研究[J].食品工业,2006(3):19-20.
[9] CEGIELSKA-RADZIEJEWSKA R,LEŜNIEROWSKI G,KIJOWSKI J.Properties and application of egg white lysozyme and its modified preparations:a review[J].Polish J Food Nutr Sci,2008,58(1):5-10.
[10] 程光胜.中国酒曲微生物利用的发展现状[J].酿酒科技,2014(3):122-124.
[11] 陈林.酱香型白酒发酵过程中微生物群落结构分析[D].北京:北京林业大学,2012.
[12] 续丹丹,温赛,王凤寰,等.柞蚕溶菌酶真核表达系统的构建及重组蛋白纯化分析[J].饲料研究,2016(10):31-37.
[13] 张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[14] 赵爽,杨春霞,窦灿,等.白酒生产中酿酒微生物研究进展[J].中国酿造,2012,31(4):5-10.
[15] 谭映月,胡萍,谢和.应用PCR-DGGE技术分析酱香型白酒酒曲细菌多样性[J].酿酒科技,2012(10):107-111.
[16] ZHOU X,YU Y,TAO J,et al.Production of LYZL6,a novel human c-type lysozyme,in recombinantPichiapastoris,employing high cell density fed-batch fermentation[J].J Biosci Bioeng,2014,118(4):420-425.
[17] ZHU D,CAI G,WU D,et al.Comparison of two codon optimization strategies enhancing recombinantSusscrofalysozyme production inPichiapastoris[J].Cell Mol Biol,2015,61(2):43-49.
[18] WANG T,XU Y,LIU W,et al.Expression ofApostichopusjaponicuslysozyme in the methylotrophic yeastPichiapastoris[J].Protein Exp Purif,2011,77(1):20-25.
[19] WU D,WEN C G,HU B Q,et al.Expression analysis of i-type lysozyme gene fromCristariaplicata,and enzymatic activity analysis[J].Fish Shellfish Immunol,2013,34(6):1746-1747.
[20] BYRNE B.Pichiapastorisas an expression host for membrane protein structural biology[J].Curr Opin Struct Biol,2015,32:9-17.
[21] IBRAHIM H R,HIGASHIGUCHI S,JUNEJA L R,et al.A structural phase of heat-denatured lysozyme with novel antimicrobial action[J].J Agric Food Chem,1996,44(6):1416-1423.
[22] DESANTIS G,JONES J B.Chemical modification of enzymes for enhanced functionality[J].Curr Opin Biotechnol,1999,10(4):324-330.
[23] IBRAHIM H R,KATO A,KOBAYASHI K.Antimicrobial effects of lysozyme against gram-negative bacteria due to covalent binding of palmitic acid[J].J Agric Food Chem,1991,39(11):2077-2082.
[24] ELLISON R T 3rd,GIEHL T J.Killing of gram-negative bacteria by lactoferrin and lysozyme[J].J Clin Invest,1991,88(4):1080-1091.
[25] KUMARESAN V,BHATT P,GANESH M R,et al.A novel antimicrobial peptide derived from fish goose type lysozyme disrupts the membrane ofSalmonellaenterica[J].Mol Immunol,2015,68(2):421-433.
[26] ZHAO H,TANG J,CAO L,et al.Characterization of bioactive recombinant antimicrobial peptide parasin I fused with human lysozyme expressed in the yeastPichiapastorissystem[J].Enzyme Microb Technol,2015,77(3):61-67.
[27] YANG D,WANG Q,CAO R,et al.Molecular characterization,expression and antimicrobial activities of two c-type lysozymes from manila clamVenerupisphilippinarum[J].Dev Compar Immunol,2017,73:109-118.
[28] ZHU D,CAI G,LI X,et al.Enhancing the antimicrobial activity ofSusscrofalysozyme by N-terminal fusion of a sextuple unique homologous peptide[J].J Biotechnol,2017,243:61-68.

