应用好氧生物菌剂深度处理消化污泥
何品晶,王 玥,胡 洁,邵立明,吕 凡* (.同济大学固体废物处理与资源化研究所,上海 0009;.住房和城乡建设部村镇建设司,农村生活垃圾处理技术研究与培训中心,上海 0009)
厌氧消化被广泛用于城市污水厂剩余污泥的处理[1-6],但是,经过消化后的污泥仍有 34.5%~87%[7]的有机物未被降解,导致消化污泥稳定性低,脱水性能差[8-9],存在环境生态风险.为了提高剩余污泥的厌氧消化效率,常用的强化厌氧消化方法包括提高厌氧消化温度[10],引入生物膜技术[11],以及对剩余污泥进行预处理改性[12-13].
目前已有研究[7,14-15]将重点放在了已消化污泥的深度处理,污泥处理后再次进行厌氧消化,以提高消化污泥的生化可降解性,进一步提升有机物降解水平.由于剩余污泥的易降解有机物在第一次厌氧消化过程中已基本被消耗,消化污泥中残留的有机物主要为慢速生物降解物质.因此,消化污泥的深度处理更具针对性,也更能凸显其作用,需要处理的物料量较少,可望降低外部处理的成本.
深度处理方法与主要的预处理方法相似,仍然为热处理,机械处理,化学处理,超声处理或生物处理等.其中,生物方法由于其低能耗,低污染而受到关注,现阶段主要分为生物酶法和生物强化法两种[13].其中,生物强化法选择直接向污泥中投加具有特定功能的微生物,包括分泌胞外酶的细菌,充分发挥微生物的潜力,利用微生物分泌多种酶的作用,效果稳定,操作方便,节约成本,具有较大发展空间.Lü等[7]利用嗜热厌氧菌Coprothermobacter proteolyticus高温厌氧消化已经中温消化稳定的消化污泥,可以明显加速蛋白质和多糖等难降解有机物的水解和发酵,但高温厌氧的条件控制要求较高.也有研究利用好氧菌预处理剩余污泥以实现污泥的减量化,提高消化水解速率和程度,缩短消化时间[16-17].但是,将好氧生物菌剂用于消化污泥深度处理方面的研究还很少,作用效果有待评估.
另外,好氧生物菌剂的类型也是采用生物强化法深度处理消化污泥时应考虑的因素.蛋白质约占消化污泥总有机物的 54%~86%[18],因此,对于好氧生物菌剂的选择,能够分泌蛋白质酶是主要条件之一.芽孢杆菌是污泥中主要的好氧消化优势菌之一[19],而地衣芽孢杆菌(Bacillus licheniformis)则是芽孢杆菌中应用较为广泛的一种[20].地衣芽孢杆菌会产生丰富的胞外酶系[21-23],包括高活性的蛋白酶,脂肪酶,淀粉酶等,可以水解水体中的高聚物如蛋白质等,更有利于被吸收利用.何品晶等[24]利用地衣芽胞杆菌预水解剩余污泥,对比了不同接种比下的污泥液化效果和对脱水性能的影响,其效果存在最佳接种比.而为了探究好氧生物菌剂对消化污泥深度处理的作用效果,本文也选择地衣芽孢杆菌处理消化污泥,菌解后的污泥再进行二次消化,以探索不同接种比条件下消化污泥中有机物的降解效果及其脱水性能的变化;同时,与传统机械破碎预处理方法[25]对比,考察两种不同方法对消化污泥二次消化性能影响的差异.
1 材料与方法
1.1 生物菌剂-地衣芽孢杆菌
本实验选用地衣芽孢杆菌(Bacillus licheniformisDSM 13)作为生物菌剂,由广东微生物研究所分离纯化保存.地衣芽孢杆菌为中生芽孢的革兰氏阳性需氧或兼性菌,细胞形态和排列呈杆状,单生,最适生长温度大约为 50℃.生长过程中可分泌大量蛋白酶,淀粉酶和脂肪酶等多种胞外酶,酶分泌的最适温度为 37℃,且地衣芽孢杆菌 DSM13含有高度保守的蛋白分泌系统,分泌胞外酶的能力更强[26].在不良环境下会形成芽孢,以抵抗恶劣环境.
在进行接种之前,生物菌剂需要活化和扩大培养,选择最适菌种进行接种.离心分离确定接种的菌液,在 5000r/min下离心 15min,弃去上清液,再将沉淀的菌体用0.5%的氯化钠溶液重新悬浮,得到配置菌液,以去除菌种培养基的本底值影响.按生物菌剂干重/污泥干重计算接种比例.为了对比地衣芽孢杆菌这一类生物菌剂对不同种类污泥的效果,本文选择接种扩大培养 29h后的地衣芽孢杆菌[24]来接种厌氧消化污泥.
1.2 厌氧消化污泥
本实验所用的厌氧消化污泥取自上海市某污水处理厂的中温厌氧消化池,其停留时间为24.3d,有机负荷为 1.21kgVSS/(m3·d).污泥取回后常温保存,使用前先经过30min静置沉淀,弃去上清液,再经过 1×1mm 的筛网过滤去除杂质,后再经2000g离心30min除去上清液,下部沉淀物用0.5%的氯化钠溶液使其重新悬浮,配制成厌氧消化污泥,以达到去除污泥液中液相抑制成分的目的.原始污泥和配制的厌氧消化污泥进行化学性质测定和元素分析,结果如表1所示.

表1 原始污泥和配制厌氧消化污泥化学性质Table 1 Characteristics of the tested sludge
1.3 厌氧颗粒污泥
本实验采用厌氧颗粒污泥作为生化产甲烷潜力测试(BMP)实验启动甲烷化的接种物.该接种污泥取自上海某中温厌氧内循环反应器,用于处理造纸厂废水,污泥颗粒粒径为 2~3mm,置于35℃恒温室保存,沥干水分后使用.
1.4 实验设计
1.4.1 消化污泥菌解实验 消化污泥菌解处理装置的反应容器是容积为 1L的玻璃制锥形瓶.容器内盛有600mL消化污泥和地衣芽孢杆菌混合液.反应器瓶口塞有硅胶透气塞,既可以阻隔空气中的杂质,又能够保证容器内必要的气体交换.反应器置于恒温振荡摇床上培养,培养环境温度为(37±2)℃,转速为 130r/min,同时间歇测定容器内溶解氧浓度,以确保其维持在4mg/L左右.
菌解实验设计4个工况,每个工况设置2平行.其中,工况 DS0为对照工况,未接种地衣芽孢杆菌.根据预实验的结果,同时考虑到扩大接种比的梯度范围需求,工况DS1,DS2和DS3分别接种了2.7×10-3,2.7×10-2和2.7×10-13种按指数递增的不同比例的地衣芽孢杆菌配制菌液,该接种比(ri/s)以菌剂与厌氧消化污泥的总固体之比计量.1.4.2 消化污泥菌解后的生化产甲烷潜力 生化产甲烷潜力是指在适宜条件下,待测物的最高甲烷产量.反应器为容积 500mL的血清瓶,盛有300mL待测污泥和BMP厌氧消化营养液的混合液[27](营 养 液 组 成 为 :0.2g/L MgCl2·6H2O,1g/L NH4Cl,0.1g/L CaCl2,0.2g/L Na2S·9H2O,2.77g/L K2HPO4,2.8g/L KH2PO4,0.1g/L酵母浸膏,5mL/L微量元素和 2mL/L维生素储备液),同时,装有接种量为 3gVS/L的厌氧颗粒污泥.瓶出气口处连接装有80mL浓度为3mol/L的氢氧化钠溶液吸收瓶,用来吸收产生的沼气中的CO2.实验装置连接完毕后,需通入3min高纯N2排空装置中的空气,营造厌氧环境氛围.反应环境温度为水浴35℃.
截至9月底,纳入统计的236户省级成长型中小企业总体发展态势较好,营业收入达192.0亿元,同比增长12.0%;完成工业总产值161.1亿元,同比增长12.9%;完成用电量10.7亿千瓦时,同比下降1.0%;上缴税金6.8亿元,同比上升9.5%;从业人员为2.7万人,同比下降2.2%;利润总额为8.11亿元,同比增长6.9%。

表2 厌氧消化污泥BMP实验中不同污泥物料的性质Table 2 Characteristics of different sludges used in BMP experiment
BMP实验设计 4个工况,每个工况设置 3个平行样.对照工况为消化污泥离心去除沉淀物后的上清液,加入 0.5%氯化钠溶液重新悬浮后的配制消化污泥.同时,根据1.4.1的实验结果,选择地衣芽孢杆菌接种比为2.7×10-2和2.7×10-1并经菌解处理 3d后的消化污泥,以及经机械破碎处理后的消化污泥作为其他3种工况,用以对比菌解和机械破碎2种不同处理方式,以及不同接种比的菌解处理对消化污泥再消化性能的影响.机械破碎处理采用旋转球磨法,其工作原理是在装满玻璃珠和污泥的圆柱形桶内,利用搅拌机驱动桶内磨珠的旋转运动,使得污泥微生物在磨珠剪切力与压力作用下发生破碎.本文采用0.2~0.25mm的磨珠,破碎强度为6000r/ min,破碎时间 3×20s,每次中间间隔 10s,采用的破碎仪为法国Bertin-Precellys多功能样品均质器[25].各个工况使用的消化污泥和接种颗粒污泥性质如表2所示.
1.5 测试方法
消化污泥菌解处理实验,初期每隔 12h取样1次,中期每隔24h取样一次,后期每隔48h取样1次.每次采集的污泥样品先后测定其 pH值(pHS-25数显pH计,上海精科仪器有限公司),总固体(TS,测定温度为 105℃,减重法测定),挥发性固体(VS,测定温度为 600℃,减重法测定),氨氮(Kjeltiec8400A凯式定氮仪,丹麦 FOSS公司),凯式氮(Kjeltiec8400A凯式定氮仪,丹麦FOSS公司)和CST(TYPE 304M型CST测定仪,英国Triton公司),经 0.45μm 滤膜过滤后的上清液测定其溶解性有机碳(DOC,TOC-Vcpn,日本 Shimadzu公司),溶解性总氮(DN,TOC-Vcpn,日本 Shimadzu公司),氨氮(Kjeltiec8400A 凯式定氮仪,丹麦FOSS公司)和三维荧光光谱(EEM)分析(F-4500型三维荧光光谱仪,日本 Hitachi公司).本实验采用模化 CST(毛细吸水时间)来衡量污泥的脱水性能.污泥的毛细吸水时间CST是指污泥中的毛细水在滤纸上渗透1cm距离所需要的时间,且与污泥的含固率相关.因此,不能直接用来评价污泥中的结合水量.需用同一样品的CST/TS值(即为模化CST)来衡量污泥的脱水性能,以去除含固率的影响[28].
菌解后 BMP测试(Bioprocess装置,瑞士Bioprocess公司)是在周期 20d内通过实时记录厌氧消化产甲烷的体积反映产气规律.
2 结果与讨论
2.1 菌解过程pH值的变化
菌解过程中液相pH值的变化可间接反映消化污泥的降解程度.pH值变化主要受菌解过程中脂肪,蛋白质,多糖等有机物发生水解酸化产生小分子的有机酸和蛋白质水解酸化产生的氨之间的平衡关系影响.图 1显示,初始消化污泥的pH 值为 7.77,呈弱碱性.在菌解处理开始的 65h内,4个工况的消化污泥 pH值均呈下降趋势,这是由于菌解发酵导致大分子有机物向小分子有机酸转化所致.其中,工况DS0,DS1,DS2的pH值下降较快,达到 6.0左右,酸化现象较严重 ;工况DS3下降速度较慢,仅降至 7.0,接近中性.在处理65h后,由于消化污泥中的本底微生物和接种的生物菌剂分泌的胞外蛋白酶促进了污泥胞内蛋白质的溶出和降解,使得蛋白质水解酸化生成氨,会中和酸化过程中产生的有机酸,pH值因此有所回升.但是,工况 DS0,DS1,DS2接种的生物菌剂量少,产生氨的量不足以中和有机酸,同时,随着后续有机酸的进一步生成,pH值在略微上升后又再次下降至5.5左右;而工况DS3接种的生物菌剂量比较多,氨的产生速率远大于有机酸的产生速率,因此,pH 值不断上升,最后稳定在 8.6左右.由此可见,只有达到一定的接种比,接种地衣芽孢杆菌才可以明显减弱菌解消化污泥过程中的酸化现象.
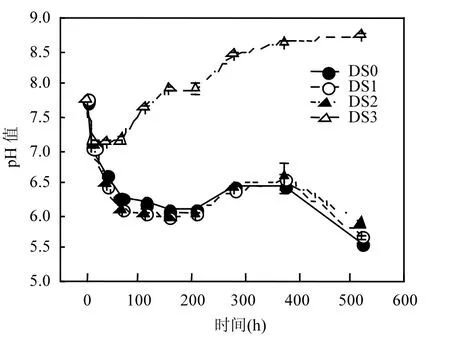
图1 不同生物菌剂接种比下消化污泥pH值随时间的变化趋势Fig.1 Temporal evolution of pH under different inoculation ratios
2.2 菌解过程液相DOC的变化
液相DOC变化反映了菌剂和消化污泥自身兼性土著微生物对消化污泥细胞中有机物溶出程度的影响.如图2所示,4个工况消化污泥的液相 DOC变化趋势大体一致,均先上升后下降,最后稳定,主要是胞内有机物溶出速率和液相有机物消耗速率之间的平衡关系所致.工况DS0,DS1,DS2之间的差异有显著性(P<0.05),而总体上这3种工况的液相DOC值较低,说明接种地衣芽孢杆菌对消化污泥中有机物的溶出是有效果的.但是,低菌剂接种比时菌剂中微生物生长量仍较低,因此,消化污泥中的土著微生物占据主导作用.在处理初期,消化污泥中大分子有机物被水解溶出,DOC值上升,但随后大分子有机物水解溶出速率低于小分子有机物由于微生物增殖而被消耗的速率,DOC值略有下降.处理结束时,二者速率相当,DOC值保持动态平衡.而工况DS3的菌剂接种比高,反应初期大幅加速了消化污泥胞内有机物的溶出,而在后期液相有机物的生成速率最终也与消耗速率达到平衡.在处理过程中,工况DS3的DOC最高累积量相比对照工况DS0增加了6.23倍.由此可见,地衣芽孢杆菌需要达到一定接种比才能对消化污泥起到很好的水解作用,促进消化污泥中有机物的溶出.

图2 不同生物菌剂接种比下消化污泥液相DOC随时间的变化趋势Fig.2 Temporal evolution of DOC concentrations in the liquid phase under different inoculation ratios
2.3 菌解过程中消化污泥的液相溶解性总氮,氨氮及絮体蛋白质,氨氮的变化
在菌解过程中,消化污泥絮体与消化污泥液相中的氮相互转化和迁移.消化污泥絮体中的氮主要以蛋白质的形式存在,在菌解处理的过程中,蛋白质在蛋白酶的作用下先后经过水解反应和脱氨反应生成小分子有机酸,氨和 CO2.因此,可以用消化污泥絮体中的蛋白质浓度和消化污泥液相中溶解性总氮的含量表征以蛋白质为主的含氮有机物的溶出效果,用消化污泥絮体中的氨氮浓度和消化污泥液相中的氨氮浓度表征以蛋白质为主的含氮有机物的降解效果.其中,蛋白质的浓度是根据凯氏氮值和氨氮值计算得出.图 3反映了在菌解过程中消化污泥液相溶解性总氮含量,氨氮浓度和消化污泥絮体中蛋白质,氨氮浓度的变化趋势.
如图 3a所示,初始各工况消化污泥絮体中的蛋白质浓度为配制消化污泥的蛋白质浓度与各工况投加的不同接种比的地衣芽孢杆菌蛋白质浓度之和.在菌解处理初期,工况 DS0,DS1,DS2的消化污泥絮体蛋白质含量均快速上升,随后逐渐降低,最终趋于平衡;而工况 DS3中的蛋白质含量随着反应进行一直降低.这是由于反应初期,接种比较低时,地衣芽孢杆菌和消化污泥中的土著微生物需要通过利用有机物来自身繁殖,导致消化污泥中的蛋白质总量快速增加;而达到一定接种比后,外加菌剂分泌的蛋白酶能快速起作用,水解消化污泥中的蛋白质.其中,工况DS3中的蛋白质含量从初始的10772mg/L降至3634mg/L,降解率为66.3%.而图3b反映出,随着蛋白质被不断水解,工况DS0,DS1,DS2的消化污泥液相溶解性总氮含量的变化趋势大体与液相中 DOC的变化趋势一致,呈现快速上升后一直保持稳定的趋势;同时,工况 DS0,DS1,DS2之间仍存在一定差异性(p < 0.05),最高溶解性总氮浓度分别为416,393和390mg/L;而工况DS3则呈现先上升,后略微下降,最后又上升的趋势,在预处理278h时达到最大值1179mg/L,相比对照工况DS0增加了2.83倍.由于消化污泥中的N元素占污泥干重的 4.3%,实验使用的配制消化污泥干重为 31.2g/L,计算得污泥中的总氮(TN)应为 1.34g/L.另外,根据好氧菌通用分子式C5H7O2N计算得,工况DS1,DS2,DS3外加菌剂所含的TN分别为10.4,104和1041mg/L,继而得到4种工况下菌剂与消化污泥混合物的氮溶出率分别为30.98%,29.03%,26.95%和49.50%.由此可见,接种生物菌剂达到一定比例后,地衣芽孢杆菌才能克服环境条件,通过分泌蛋白酶等胞外酶促进蛋白质的溶出,并大幅度增加消化污泥絮体中蛋白质的溶出速率和溶出总量.

图3 不同生物菌剂接种比下消化污泥液相和絮体中各指标随时间的变化趋势Fig.3 Temporal evolution of different indicators in the liquid phase and in the solid phase under different inoculation ratios
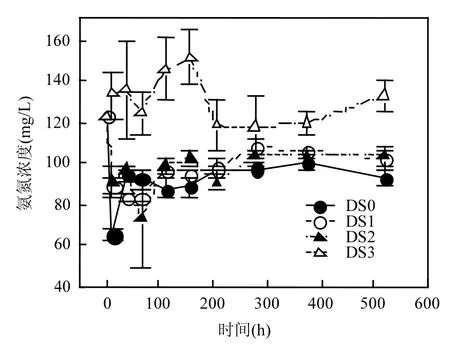
图4 不同生物菌剂接种比下消化污泥絮体中吸附的氨氮含量随时间的变化趋势Fig.4 Temporal evolution of ammonium nitrogen concentrations absorbed by sludge flocs under different inoculation ratios
如图3c、3d所示,消化污泥絮体中的氨氮含量和消化污泥液相中的氨氮含量变化趋势保持一致.工况 DS0,DS1,DS2呈现从反应初始开始下降,随后保持稳定的趋势,且氨氮浓度一直低于初始氨氮浓度;工况 DS3呈现持续上升而最终达到平衡的趋势,上升速率随时间不断变化.培养517.5h后,工况DS1,DS2,DS3的消化污泥液相氨氮浓度分别比对照工况 DS0提高了 3.05%,12.8%和 5.93倍;其污泥絮体氨氮浓度分别比对照工况 DS0提高了 5.35%,12.20%和4.94倍.此外,工况DS3的液相溶解性总氮中95%左右是由氨氮构成,而其余 3个工况的液相溶解性总氮中约一半为有机氮.由此可见,接种地衣芽孢杆菌不仅能促进消化污泥中蛋白质的水解和脱氨反应,也提高了氨氮的产生速率和产生量,且随接种比的提高这种效应显著增强.
将消化污泥絮体中的氨氮浓度与污泥液相中的氨氮浓度做差,可以得到污泥絮体中吸附的氨氮浓度,如图4所示,可知,消化污泥絮体可吸附氨氮浓度基本维持在 80~150mg/L,而由于蛋白质降解而新生成的氨氮分布在液相中.


图5 不同生物菌剂接种比下培养过程中消化污泥液相EEM光谱图Fig.5 Fluorescence EEM spectra of liquid phase under different inoculation ratios
2.4 消化污泥液相EEM的变化
EEM 测试可以得到污泥液相中几类能产生荧光的特征有机物的相对含量,如蛋白质类,胡敏酸类,富里酸类有机物.通过 EEM 测试所得的数据,先去除瑞利和拉曼散射,使 EEM 光谱图中荧光峰的特征更加明显;再除以该样品的 DOC值,进行DOC归一化[28-30];然后,绘制激发-发射矩阵图,结果如图5所示.
根据 Chen等[31]的研究,可将荧光物质所在的EEM图谱分为5个区域.即区域1(Ex<250nm,Em<330nm)类络氨酸物质;区域 2(Ex<250nm,330nm<Em<380nm)类色氨酸物质;区域 3(Ex>250nm,Em<380nm)微生物副产物;区域 4(Ex<250nm,Em>380nm)富里酸类物质;区域 5(Ex>250nm,Em>380nm)胡敏酸类物质.比激发发射区域体积(Φ)表示该区域内荧光强度值的大小,荧光区域综合指数(FRI)可以定量表征 EEM 各区域荧光的相对含量.由于区域 1,区域 2和区域 3均可以表征消化污泥液相中蛋白质类物质的荧光强度,因此,将这3个区域的荧光强度进行叠加,以表征蛋白质类物质的总量.同时,区域5并未出现明显的荧光峰值,则可用图 6分别表示消化污泥液相中单位 DOC的蛋白质类,富里酸类物质含量的变化趋势.
投加地衣芽孢杆菌这类生物菌剂能分泌大量酶类,既有溶胞作用,释放出消化污泥中的蛋白质,又具有降解利用溶出蛋白质的作用.也由于这两种作用的共同结果,导致了消化污泥液相中单位DOC(mg/L)蛋白质含量的变化.由图6中蛋白质类物质的荧光强度变化趋势可以看出,在菌解处理开始后37h内,工况DS0,DS1和DS2的单位DOC中蛋白质的含量均呈现下降趋势,表明蛋白质的溶出速率低于其降解速率;培养37h后,3个工况的蛋白质含量趋于稳定,表明蛋白质的溶出速率与其降解速率基本上达到了平衡.而工况DS3的单位DOC中蛋白质含量随着消化污泥菌解的进行呈现上下波动的趋势,表明蛋白质的溶出与其降解一直处于波动变化状态.

图6 不同生物菌剂接种比下消化污泥液相单位DOC中不同组分的荧光强度变化趋势Fig.6 Temporal evolution of fluorescence intensity of different components per DOC under different inoculation ratios
从图6中类富里酸物质的荧光强度变化趋势看,在菌解开始后的 65h内,4个工况单位DOC中的类富里酸物质含量均迅速下降;培养65h后,工况DS0、DS1和DS2的类富里酸物质含量无显著变化,而工况 DS3的类富里酸物质含量一直呈上升趋势;且在处理结束时,工况DS3中单位 DOC的类富里酸物质含量是对照工况DS0的2.23倍.由此可见,添加地衣芽孢杆菌还可促进消化污泥中类富里酸等难降解物质的溶出.
2.5 菌解处理后消化污泥的脱水性能
本实验采用模化CST值(同一样品CST/TS比值)来衡量消化污泥的脱水性能,模化 CST值越大代表消化污泥的脱水性能越差.裴海燕等[32]发现,污泥经厌氧消化后粒径变小,脱水性能变差.图7显示了各个工况菌解过程中模化CST值的变化趋势,4个工况的模化CST值均随时间的延长呈现先增大后降低,随后又增大再降低的趋势;同时,菌解处理结束时其余 3个工况的模化CST值均高于对照工况 DS0,工况 DS3的模化CST值明显高于其余3个工况.由此可见,消化污泥经菌解后其脱水性能会变差.投加生物菌剂对消化污泥的脱水性能有不利影响,且接种比越高,这种不利影响越显著.地衣芽孢杆菌生长过程中会分泌胞外聚合物[33-34],这是使得其脱水性能劣化的原因.

图7 不同生物菌剂接种比下消化污泥模化CST随时间的变化趋势Fig.7 Temporal evolution of normalized CST under different inoculation ratios
2.6 菌解和机械预处理后消化污泥的厌氧产气潜力
图 8为经不同处理方法后消化污泥进行BMP测试的单位投加碳的累计产甲烷量和产甲烷速率.其中,生物处理1使用经菌解实验中工况DS2(接种比为 2.7×10-2)处理 3d后的消化污泥,生物处理2使用经菌解实验中工况DS3(接种比为2.7×10-1)处理3d后的消化污泥.

图8 不同处理方法下消化污泥单位碳累计产甲烷量和单位碳产甲烷速率的变化趋势Fig.8 Temporal evolution of cumulative methane production and methane production rate per carbon under different treatments
如图8所示,在周期20d的污泥BMP实验过程中,消化污泥未进行处理的对照工况和生物处理1工况一直没有产气;机械破碎工况经过4d的迟滞期后开始缓慢产气,20d后累计产气量不再增加,达到 17.6mL/g-C;生物处理 2工况在经过4d的迟滞期后进入快速产气阶段,12d后进入平台期,产气速率减缓,而后又进入快速产期阶段,20d后累计产气量不再增加,达到105mL/g-C.而从单位投加碳的产甲烷速率的变化趋势看,对照工况在实验初期出现一个产气高峰,然后速率降至0mL/(g-C·d);生物处理1工况的产气速率一直维持在 0mL/(g-C·d);机械破碎工况实验初期前 4d的产气速率一直为0mL/(g-C·d),随后出现两个产气高峰,最大产气速率接近,为 2.5mL/(g-C·d),12d后速率又降至 0mL/(g-C·d);生物处理 2工况前4d的产气速率稳定在 0mL/(g-C·d),出现一个产气高峰后下降接近至 0mL/(g-C·d),后又出现一个产气高峰,最大产气速率为 14.2mL/(g-C·d).由此可见,经过机械破碎处理和生物处理后,一些难降解大分子有机物能够再次被产甲烷菌利用产生沼气;并且,经接种比为 2.7×10-1菌解处理后的消化污泥比机械破碎后消化污泥的产气潜力提高幅度更大;而经接种比为 2.7×10-2菌解处理对消化污泥的产气潜力没有显著影响.此结果与消化污泥的菌解实验结论一致.说明接种地衣芽孢杆菌需要达到一定的接种量时,才能对消化污泥起到较好的水解作用,提高消化污泥的再消化性能.需要说明的是,即便假设外加菌剂也能被全部转化为甲烷,则生物处理 2工况的最终产甲烷量也可达到19.3mL/g-C,超过机械破碎处理消化污泥的产甲烷量,说明产生的甲烷的确是来自于菌解后消化污泥的贡献.
2.7 讨论
消化污泥菌解处理的实验结果表明,在不同接种比下,生物菌剂对消化污泥中有机物的降解程度,产物的脱水性能以及后续的厌氧消化性能都呈现明显的差异性.投加地衣芽孢杆菌能促进消化污泥胞内物质(如,蛋白质和类富里酸物质)的溶出,以及蛋白质等难降解有机物的转化.但是,生物菌剂的投加效果存在明显的累积效应,需要达到较高的接种比时才有明显的促进作用,这一结果与生物菌剂作用于剩余污泥的效果有明显差别,后者在消化过程中存在最优接种比(接种比为 1.16%,以菌剂与剩余污泥的总固体之比计)[24].本实验中,在接种比为 2.7×10-1条件下,胞内物质的溶出效果和蛋白质的降解程度最明显.通过消化污泥液相 DOC的变化趋势看,在菌解前65h内,胞内物质快速溶出,而菌解时间延长后,溶出的有机物会被微生物重新利用,使得 DOC值下降至稳定.从消化污泥蛋白质含量的变化趋势也可以发现,在预处理初期的13h内,蛋白质浓度直线下降,被快速降解,随后下降速率逐渐减缓,直到517.5h菌解后消化污泥的蛋白质浓度低于未经处理的蛋白质浓度,蛋白质的溶出程度得到提高.通过分析菌解后消化污泥单位碳的产甲烷累积量和产气速率的变化趋势,就胞内物质的利用率看,本文中的生物预处理优于机械预处理.有研究表明,EPS中蛋白质/多糖的比值是影响污泥脱水性能的关键因素,比值越小脱水性能越差[35].随着地衣芽孢杆菌的投加量增加,消化污泥中的蛋白质浓度降低,其脱水性能进一步变差.由本文研究结果可见,采用地衣芽孢杆菌处理消化污泥,处理的时间越长,改善消化污泥再消化性能的效果越明显.但是,从经济性角度考虑,可将菌解时间控制至200h左右.
3 结论
3.1 在菌解实验过程中,以地衣芽孢杆菌作为接种生物菌剂处理消化污泥,可以加速消化污泥胞内有机物的更大程度溶出,促进污泥液相中溶解性有机碳(DOC)的累积;但是,需要较高的接种比才能表现出显著的 DOC积累增强效果.接种比为 2.7×10-1时,液相 DOC 最大累积量为1208mg/L,相比对照工况增加了 6.23倍;当接种比为 2.7×10-3和 2.7×10-2时,液相 DOC 累积效果与对照工况相比虽有显著差异,但总体的 DOC值均较低.
3.2 菌解处理可以促进消化污泥中蛋白质的溶出和降解,但是,同样需要较高的接种比才能表现出显著的积累增强效果.接种比为 2.7×10-1时,消化污泥液相中的溶解性总氮最大积累量相比对照工况增加了2.83倍,消化污泥液相中的最大氨氮浓度为对照工况的5.93倍,消化污泥絮体中的最大氨氮浓度为对照工况的4.94倍,消化污泥中蛋白质的最大平均降解速率为211mg/(L·h);当接种比为2.7×10-3和2.7×10-2时,消化污泥液相的溶解性总氮含量,氨氮浓度,消化污泥絮体的氨氮浓度和消化污泥中蛋白质的降解速率与对照工况相比虽有一定差异,但效果不显著.
3.3 菌解过程会导致消化污泥的脱水性能变差,并且,随着添加的地衣芽孢杆菌菌剂量的增加,消化污泥脱水性能变差的程度提高.经过菌解处理后,4个工况的模化CST值均升高,并且,随着生物菌剂接种比的增加,3个工况的最终模化CST值分别为对照工况的1.15,1.51和2.69倍.
3.4 机械破碎预处理和达到一定生物菌剂投加量的菌解处理均可以进一步深度利用消化污泥厌氧产气,而经接种比为 2.7×10-1的菌剂菌解后的消化污泥,其单位碳产甲烷量为机械破碎处理后产气量的5.96倍,产气效果明显高于机械破碎处理方法,消化污泥中的有机物能得到更好地释放和利用.
[1]何品晶.城市污泥处理与利用 [M]. 北京:科学出版社,2003:103-106.
[2]Wei Y, van Houten R T, Borger A R, et al. Comparison performances of membrane bioreactor and conventional activated sludge prcesses on sludge reduction induced by Oligochaete [J].Environmental Science & Technology, 2003,37(14):3171-3180.
[3]Zhang D, Chen Y, Zhao Y, et al. New Sludge Pretreatment,Method to Improve Methane Production in Waste Activated Sludge Digestion [J]. Environmental Science & Technology.2010,44(12):4802-4808.
[4]Appels L, Lauwers J, Degrève J, et al. Anaerobic digestion in global bio-energy production: Potential and research challenges[J]. Renewable & Sustainable Energy Reviews, 2011,15(9):4295-4301.
[5]Astals S, Esteban-Gutiérrez M, Fernández-Arévalo T, et al.Anaerobic digestion of seven different sewage sludges: a biodegradability and modelling study [J]. Water Research, 2013,47(16):6033-6043.
[6]Yang G, Zhang G, Zhuan R, et al. A critical review on sludge anaerobic digestion progress from 2012 to 2015 [J]. Current Organic Chemistry, 2016,20(999):1.
[7]Fan L, Li T, Wang T, et al. Improvement of sludge digestate biodegradability by thermophilic bioaugmentation [J]. Applied Microbiology and Biotechnology, 2014,98(2):969-977.
[8]Novak J T, Sadler M E, Murthy S N. Mechanisms of floc destruction during anaerobic and aerobic digestion and the effect on conditioning and dewatering of biosolids [J]. Water Research,2003,37(13):3136-3144.
[9]Batstone D J, Tait S, Starrenburg D. Estimation of hydrolysis parameters in full-scale anerobic digesters [J]. Biotechnology and Bioengineering, 2009,102(5):1513-1520.
[10]Suhartini S, Heaven S, Banks C J. Comparison of mesophilic and thermophilic anaerobic digestion of sugar beet pulp: performance,dewaterability and foam control [J]. Bioresource Technology,2014,152(1):202-211.
[11]Wang T, Shao L, Li T, et al. Digestion and dewatering characteristics of waste activated sludge treated by an anaerobic biofilm system [J]. Bioresource Technology, 2014,153(2):131-136.
[12]Zhen G, Lu X, Kato H, et al. Overview of pretreatment strategies for enhancing sewage sludge disintegration and subsequent anaerobic digestion: Current advances, full-scale application and future perspectives [J]. Renewable & Sustainable Energy Reviews, 2017,69:559-577.
[13]郝晓地,蔡正清,甘一萍.剩余污泥预处理技术概览 [J]. 环境科学学报, 2011,31(1):1-12.
[14]Onyeche T I. Economic benefits of low pressure sludge homogenization for wastewater treatment plants [Z]. 2007.
[15]Ayol A. Enzymatic treatment effects on dewaterability of anaerobically digested biosolids-I: performance evaluations [J].Process Biochemistry, 2005,40(7):2427-2434.
[16]Hasegawa S, Shiota N, Katsura K, et al. Solubilization of organic sludge by thermophilic aerobic bacteria as a pretreatment for anaerobic digestion [J]. Water Science & Technology, 2000,41(3):163-169.
[17]Miah M S, Tada C, Yang Y, et al. Aerobic thermophilic bacteria enhance biogas production [J]. Journal of Material Cycles and Waste Management, 2005,7(1):48-54.
[18]Shao L, Wang X, Xu H, et al. Enhanced anaerobic digestion and sludge dewaterability by alkaline pretreatment and its mechanism[J]. Journal of Environmental Sciences, 2012,24(10):1731-1738.
[19]刘树根,朱南文,楼紫阳,等.污泥高温好氧消化过程的生物多样性分析 [J]. 环境科学学报, 2010,30(5):990-995.
[20]唐 娟,张 毅,李雷雷,等.地衣芽孢杆菌应用研究进展 [J]. 湖北农业科学, 2008,47(3):351-354.
[21]王 斐,郑天凌,洪华生.细菌胞外酶的生态作用 [J]. 海洋科学,1999,23(3):33-36.
[22]Kim Y, Cho J Y, Kuk J H, et al. Identification and Antimicrobial Activity of Phenylacetic Acid Produced by Bacillus licheniformis Isolated from Fermented Soybean, Chungkook-Jang [J]. Current Microbiology, 2004,48(4):312-317.
[23]Tamehiro N, Okamotohosoya Y, Okamoto S, et al. Bacilysocin, a novel phospholipid antibiotic produced by Bacillus subtilis 168[J]. Antimicrobial Agents & Chemotherapy, 2002,46(2):315-320.
[24]何品晶,王 颖,胡 洁,等.应用解蛋白菌生物预水解剩余污泥[J]. 环境科学, 2016,37(11):4317-4325.
[25]Baier U, Schmidheiny P. Enhanced anaerobic degradation of mechanically disintegrated sludge [J]. Water Science &Technology, 1997,36(11):137-143.
[26]张 菊,李金敏,张志焱,等.地衣芽孢杆菌的研究进展 [J]. 中国饲料, 2012,(17):9-11.
[27]Lin Y, Lü F, Shao L, et al. Influence of bicarbonate buffer on the methanogenetic pathway during thermophilic anaerobic digestion[J]. Bioresource Technology, 2013,137C(6):245-253.
[28]Merlo R P, Trussell R S, Hermanowicz S W, et al. A comparison of the physical, chemical, and biological properties of sludges from a complete-mix activated sludge reactor and a submerged membrane bioreactor [J]. Water Environment Research A Research Publication of the Water Environment Federation,2007,79(3):320-328.
[29]Zepp R G, Sheldon W M, Moran M A. Dissolved organic fluorophores in southeastern US coastal waters: correction method for eliminating Rayleigh and Raman scattering peaks in excitation—emission matrices [J]. Journal of Environmental Sciences, 2004,21(6):795-800.
[30]Lu F, Chang C, Lee D, et al. Dissolved organic matter with multi-peak fluorophores in landfill leachate [J]. Chemosphere,2009,74(4):575-582.
[31]Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science &Technology, 2003,37(24):5701.
[32]裴海燕,胡文容,李 晶,等.活性污泥与消化污泥的脱水特性及粒径分布 [J]. 环境科学, 2007,28(10):2236-2242.
[33]梁 君,宋文成,马金宝,等.微生物胞外聚合物对水中 As(Ⅴ)的吸附性能研究 [J]. 环境工程, 2016,34(S1):226-229.
[34]万红贵,袁建锋,单咸旸,等.芽孢杆菌胞外多糖的结构初步分析[J]. 食品与发酵工业, 2009,35(1):35-38.
[35]刘 轶,周 健,刘 杰,等.污泥脱水性能的关键影响因素研究[J]. 环境工程学报, 2013,7(7):2689-2693.

