气候变化对太岳山中部油松单萜烯排放的影响
吴建国,徐天莹 (1.中国环境科学研究院,北京 100012;2.甘肃农业大学林学院,甘肃 兰州 734000)
大气挥发性有机物(VOCs)中很多成分具有高度化学活性,极易与大气中NO和NO2、氧化剂和 OH自由基等发生反应,在对流层臭氧光化学过程中具有重要作用[1-3].另外, VOCs为臭氧形成的重要前体物之一,对气候变暖有间接的影响[3-5].准确确定 VOCs排放特征及影响因素, 对科学认识对流层臭氧光化学过程及大气环境变化和气候变暖有重要的理论意义.大气 VOCs中总量 90%以上的非甲烷碳氢化合物(NMHC)来自陆地生物圈排放,单萜烯类是植物排放最主要的 VOCs种类之一,是对流层中最主要的非甲烷烃种类之一,约占植物VOCs释放总量的11%[5-9].植物排放单萜烯速率随叶片温度增加而增加[5,10].全球气候正经历以变暖为主要特征的显著变化[11].随着全球气候变化,植物叶温将随之改变,进而将使植物单萜烯排放速率改变[9,12].这些变化将对大气化学成分和大气环境产生一定的影响[5,13].因此,系统分析气候变化对植物单萜烯排放速率的影响,对准确确定气候变化下植物VOCs排放特征及大气环境变化具有重要的理论和现实意义.
国际上对植物 VOCs排放研究广泛展开,包括发展植物单萜烯排放测定方法[14],分析植物单萜烯排放[15-20],或测定不同植物单萜烯排放并计算清单[21],或比较不同植物下土壤单萜烯排放速率[22],或分析植物单萜烯排放季节或年际变化[23-27].另外,一些研究分析影响植物单萜烯排放的因素,如分析温度升高[28]或有效水变化[29]或光照改变[30]及叶片发育[31]和植物气孔[32]及植物地下作用对 VOCs排放影响[33],或草食动物和气候因素等[34-35]及霉病[36]等对植物 VOCs排放影响等.近年来,气候变化对植物单萜烯排放影响颇受关注,包括分析气候变化对区域植被 VOCs排放影响[37],特别是气候变暖对极地植物和亚极地植物 VOCs排放的影响[38-41],以及水分变化对植物 VOCs排放的影响[42-47]等.另外,也观测了气候变暖与 CO2浓度或 O3浓度增加对植物解剖结构、生理过程及VOCs排放速率的共同影响[48-57].此外,也模拟分析了气候变化引起植被改变[58]或种类组成变化对单萜烯排放总量的影响[59-60],以及景观和气候变化对植物单萜烯排放影响[61]等总体上,这些研究极大提高了对气候变化对植物VOCs排放影响的认识,但研究还集中极地或亚极地或北美和欧洲部分地区气候变化对个别植物单萜烯排放影响,或分析气候变化引起的植被组成变化对单萜烯排放影响方面,对其它地区气候变化对植物单萜烯排放的影响研究还不多.我国对植物 VOCs排放研究也有许多报道,包括测定亚热带竹林[62]、长白山森林[63]、西双版纳三叶橡胶[64]、沈阳典型树种[65]、黄连木[66]、北京植物[67]单萜烯排放速率及南京紫金山植物群落VOCs组成[68],以及亚热带城乡复合系统 BVOC排放[69]或中国天然源 VOCs排放清单[70-71]等.这些研究对认识我国植被单萜烯排放规律有一定意义,但气候变化对植物单萜烯排放影响方面还没有研究报道.
油松(Pinus tabuliformis)为松科针叶常绿乔木,是我国特有树种,分布广泛.油松是典型的单萜烯排放植物[72-75],目前已对这种植物的单萜烯排放特征进行了一些观测分析[72-75],但气候变化对这种植物单萜烯排放影响还没有研究报道.为此,本文以全球气候模式 NorESM1-M 产生的RCP2.6,RCP4.5,RCP6.0和RCP8.5气候变化情景数据和植物 VOCs排放计算模型,模拟分析了未来气候变化对油松单萜烯排放速率的影响,希望为科学认识气候变化对植物 VOCs排放影响提供一定的依据,为相关的研究提供一定的参考.
1 材料与方法
1.1 研究区
为了集中分析气候变化对油松单萜烯排放速率的影响,本文选择了油松分布集中区域—山西省沁源县东部的太岳山林区中部马泉林场(36.42~36.83N,112.25~112.55E)为例,该区气候类型属暖温带半干旱大陆性季风气候,四季分明,近几十年气候变化趋势明显[77-78].
1.2 油松单萜烯排放计算
基于文献确定油松在标准状态下单萜烯排放速率为 4.3μg/(g·h)C[76].遵循植物排放单萜烯的一般计算模型,油松单萜烯排放通量按照公式(1)进行计算.
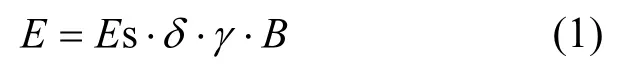
式中:E为植物单萜烯和其它排放通量,μg/(g·h);Es为标准条件下(T=303K) 植物单萜烯排放量,μg/(g·h);δ为考虑长期排放活性的控制因子,由于油松为常绿树种,δ取值为1;B为叶片生物量密度,由于本文是模拟计算单位重量油松叶生物量单萜烯排放速率,生物量密度取单位重量值为 1g;γ为活性排放因子,它为叶温的函数,具体计算利用公式(2).

式中:Ts为标准条件下叶温(303K);T为叶温(K);β一般取0.09/K.
以上公式计算获得单萜烯和其它排放速率是每小时值,且叶温也是小时值. 由于目前缺乏叶温的观测资料,用能量守衡方法计算叶温又非常复杂,在考虑到叶温和气温平均差别不是很大的情况下,本文参照文献[76,79]中做法,直接用气温代替叶温计算叶片每小时叶温.计算温度小时值方法具体见1.3.2温度日变化计算部分.
1.3 气候变化对油松单萜烯排放的影响分析
1.3.1 气候变化情景数据 采用全球气候模式NorESM1-M产生的RCP2.6,RCP4.5,RCP6.0和RCP8.5情景数据(RCP2.6,RCP4.5,RCP6.0和RCP8.5分别代表大气中辐射强迫为 2.6,4.5,6.0,8.5W/m2).在 RCP2.6情景中,未来人类将采取大力减排措施,使辐射强迫在21世纪达到顶峰并下降,到 2100年大气中 CO2浓度将达到 421×10-6,辐射强迫达2.6W/m2,全球升温幅度达0.3~1.7℃;RCP8.5是最高的温室气体排放情景,到 2100年大气中 CO2浓度将达 936×10-6,辐射强迫将持续上升,到2100年将达8.5W/m2,全球升温幅度将达2.6~4.8℃; RCP4.5和RCP6.0情景介于RCP2.6和RCP8.5之间,在RCP4.5情景下2100年辐射强迫达 4.5W/m2,升温幅度将达 1.1~2.6℃,在RCP6.0情景下2100年辐射强迫达6.0W/m2,升温幅度将达1.4~3.1℃[81-84].这些情景数据是由中国科学院地理与资源研究所从 ISI-MIP(多领域间影响模型比较计划)获取的经过空间降尺度,偏差校正的RCP情景下的全球气候模式模拟数据,由中国农业科学院进行了订正[85].
1.3.2 温度日变化计算 气候变化情景中温度是日值,在计算油松单萜烯排放中按照小时值进行计算,需要把温度日值转化为温度每小时值.参考文献[86],白天每小时温度值按公式(3)计算.
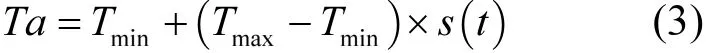
式中:Tmin为最低温度,Tmax为最高温度;s(t)为计算温度变化函数,按公式(4)计算.
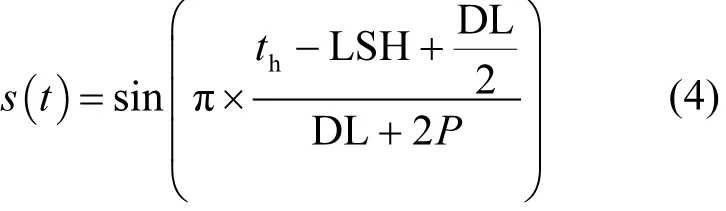
式中:π为常数;th为一天太阳时,按公式(5)计算;LSH为最大太阳高度时刻,一般取值 12h;DL为白昼长度,按照公式(8)计算;P为最高气温与最大太阳高度出现的时差,一般取值2.
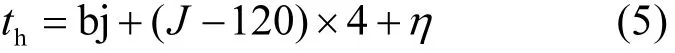
式中:bj为北京时,J为地理经度;η为时差,参考文献[87],按公式(6)计算.
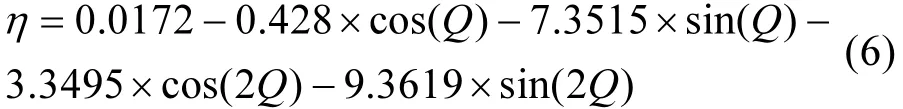
式中:Q按公式(7)计算.
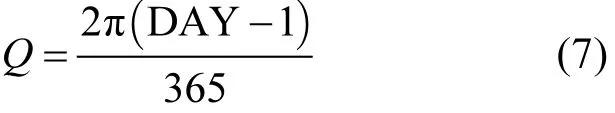
式中:DAY为1年中日序, 每年1月1日DAY=1,1月2日DAY=2,依次类推,12月31日DAY=365.

式中:L为地理纬度;δ中太阳赤纬,参考文献[87],按公式(9)计算.
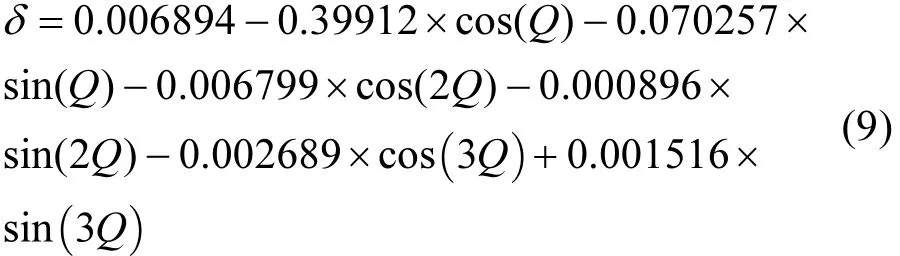
白天时刻按照公式(10)判断.
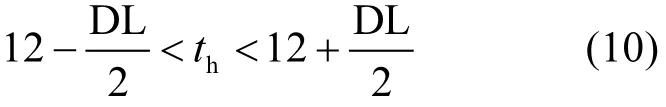
夜间时刻按照公式(11)判断.

夜间每小时温度值按公式(12)计算.
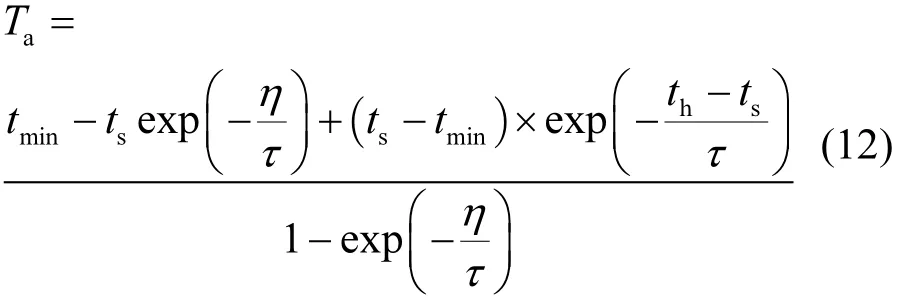
式中: tmin为日最低气温;th为一天太阳时,按公式(5)计算;ts为日落时间,取值;η为夜间长度,取值h=24-DL;τ为时间系数,取值4h.
1.3.3 气候变化影响下油松单萜烯排放速率计算 把基准情景和未来气候变化情景下每年逐日逐时温度值,代入公式(1)~(2),计算油松单萜烯每年逐日逐时的排放速率,在此基础上,再进行24h的累加,计算油松单萜烯每年逐日排放速率;基于油松单萜烯的每年逐日排放速率,经过全年逐日累加,再计算油松单萜烯每年排放速率值.通过比较基准情景和未来气候变化情景下不同时段油松单萜烯日排放速率及按年计算的排放速率的差异,分析气候变化对油松单萜烯排放速率影响.所有计算都是在Visual Fortran6.6平台中经过编程进行.
2 结果与分析
2.1 气候变化特征
以1951~2000年为基准,图1表明,2001~2050年太岳山林区中部年均气温呈现明显上升趋势,在4种情景下(RCP2.6,RCP4.5,RCP6.0和RCP8.5)变化幅度不同.到2050年,相比基准年,太岳山林区中部年均气温在 4种情景下分别增加 1.23,1.28,1.23,1.52℃.相比1951~2000年,在2001~ 2025年时段,太岳山林区中部年均气温在4种情景下分别增加 0.90,0.71,0.84,0.99℃;到 2026~2050 年时段,太岳山林区中部年均气温在 4种情景下分别增加1.56,1.85,1.61,2.04℃.
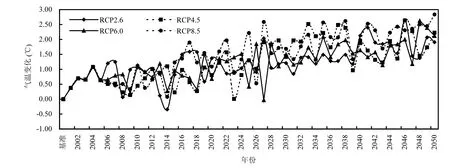
图1 2001~2050年相比基准情景太岳山林区中部平均气温变化趋势Fig.1 Changes in annual mean air temperature in 2001~2050 compared with baseline periods (1951~2000) in middle of Taiyue Mountains
以 1951~2000年为基准,图 2表明,2001~2050年太岳山林区中部年降水量呈较大波动,在RCP2.6,RCP4.5,RCP6.0和RCP8.5四种情景下变化不同.到 2050年,相比基准年,太岳山林区中部年降水量在 4种情景下分别减少11.61mm,增加1.38,15.84,11.71mm.相比基准年,到 2001~2025年时段,太岳山林区中部的年降水量在4种情景下分别减少23.77,2.40mm,增加23.54,16.56mm; 到 2026~2050年,太岳山林区中部年降水量在4种情景下分别增加0.55,5.16,8.13,6.86mm.
以1951~2000年为基准,图3表明2001~2050年太岳山林区中部辐射强度呈较大的波动,并呈下降趋势,在RCP2.6,RCP4.5,RCP6.0和RCP8.5 4种情景下变化程度不同.相比基准,到 2001~2050年在4种情景下太岳山林区中部的辐射强度分别平均减少0.10,0.18,0.35,0.25MJ/m2(图3).相比基准年,在2001~2025年太岳山林区中部的辐射强度在4种情景下平均减少幅度分别为 0.28,0.33,0.32,0.37MJ/m2;相比基准年,到 2026~2050年太岳山林区中部辐射强度在4种情景下平均减少幅度分别为0.08,0.03,0.37,0.14MJ/m2.
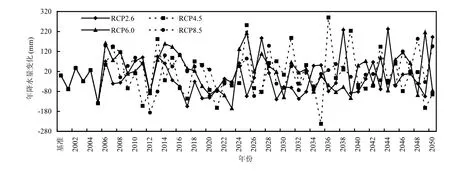
图2 2001~2050年相比基准情景太岳山林区中部年降水量变化趋势Fig.2 Changes in annual precipitation amount in middle of Taiyue Mountains in 2001~2050 compared with baseline periods (1951~2000)
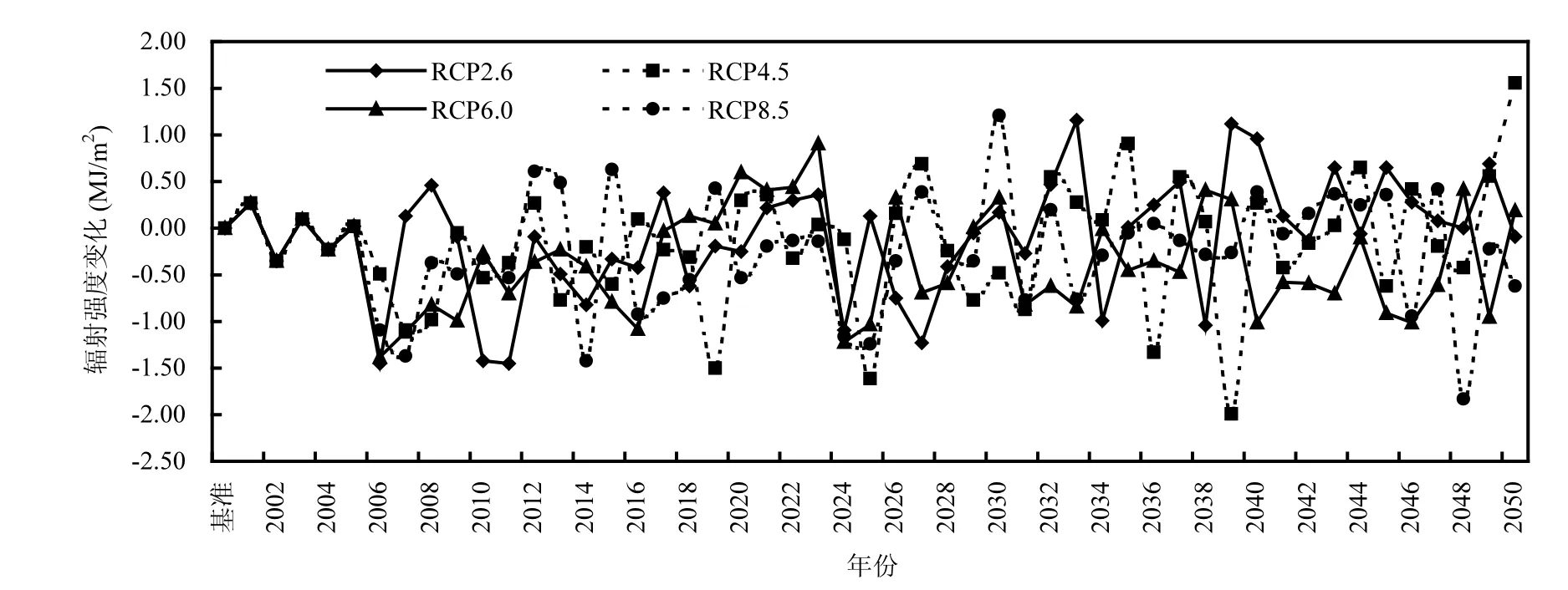
图3 2001~2050年相比基准情景太岳山林区中部太阳总辐射变化趋势Fig.3 Changes in total solar radiation intensity in the middle of Taiyue Mountains in 2001~2050 compared with baseline periods (1951~2000)
2.2 气候变化影响下油松单萜烯日排放速率变化
图4 为1951~2000年基准情景和2001~2050年RCP2.6,RCP4.5,RCP6.0和RCP8.5 4种情景下50a平均的油松单萜烯日排放速率值.图4显示,在基准情景和 4种未来情景下,油松单萜烯全年日排放速率变化较大.在1~210d油松单萜烯日排放速率呈现上升趋势, 在210~365d呈下降趋势.按照对应的月份,油松单萜烯日排放速率在 5~9月较高,在1~4月和9~12月较小.在基准情景和4种未来情景下,油松单萜烯全年的日排放速率平均 值 分 别 为 21.22,23.59,23.47,23.26,23.85µg/(g·d).显然,油松单萜烯全年日排放速率平均值在未来气候变化情景下比基准情景下要高约 2µg/(g·d),并且在RCP8.5情景下最高.

图4 基准和不同气候变化情景下50a平均的油松单萜烯日排放速率Fig.4 Daily Monoterpenes emission rate from leaves of Pinus tabuliformis under baseline and different climate change scenarios
图5 为2001~2050年RCP2.6,RCP4.5, RCP6.0和RCP8.5情景下与1951~2000年基准情景下50a平均的油松单萜烯日排放速率差值.如图 5所示,油松单萜烯日排放速率在4种未来情景下与基准情景下差值变化很大.在 1~95d,油松单萜烯日排放速率在未来气候变化情景与基准情景下的差异较小;在 95~295d,油松单萜烯日排放速率在未来气候变化情景与基准情景下差值呈现较大波动趋势;在 296~365d,油松单萜烯日排放速率在不同气候变化情景与基准情景下差异不大.总体上,油松单萜烯日排放速率在未来气候变化情景与基准情景下的差异平均在 2µg/(g·d)以上.另外,油松单萜烯日排放速率在 RCP2.6,RCP4.5,RCP6.0情景与基准情景下的差异相对较小(分别平均为2.37,2.24,2.03µg/(g·d)),在RCP8.5情景与基准情景下差异较大(平均 2.63µg/(g·d)).
图 6为 2001~2050年 4种未来情景相比1951~2000年基准情景下50a的油松单萜烯日排放速率相对变化百分率.相比基准情景,在 4种未来情景下,在 1~190d,油松单萜烯日排放速率相对变化百分率较高(相比基准情景平均增加12%~14%以上);在 191~315d,油松单萜烯日排放速率相对变化百分率较小(相比基准情景平均增加9%~13%以上);在316~365d,油松单萜烯日排放速率相对变化百分率在12%~18%以上.另外,与基准情景相比,在 4种未来情景下,油松单萜烯日排放速率变化幅度平均分别为 11.68%、12.37%、11.45%和13.99%, 在RCP8.5情景下较大.
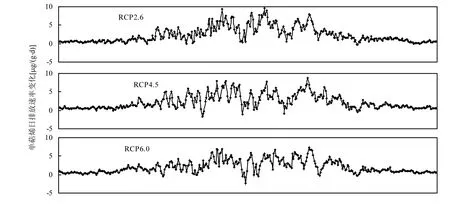
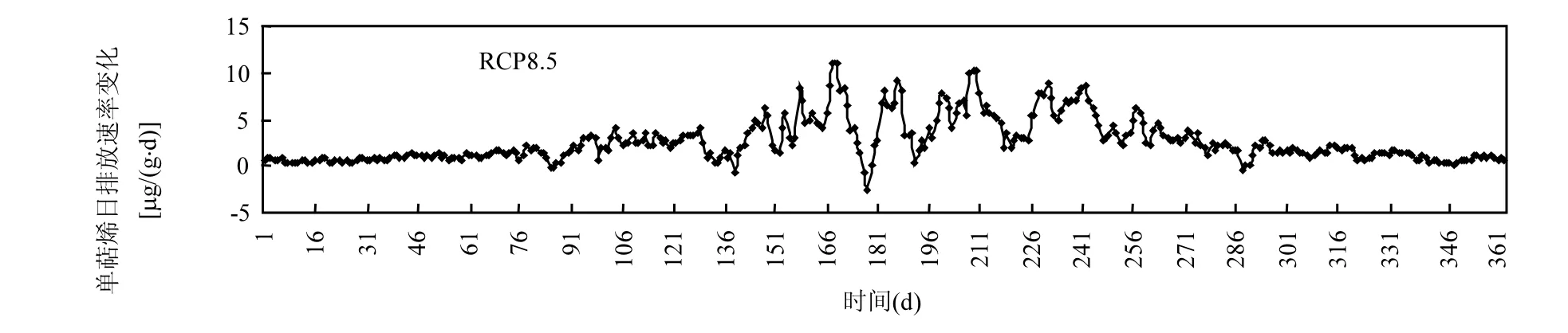
图5 不同气候变化情景与基准情景下50a平均的油松单萜烯日排放速率差异Fig.5 The difference of daily monoterpenes emission rate from leaves of Pinus tabuliformis under baseline and different climate change scenarios
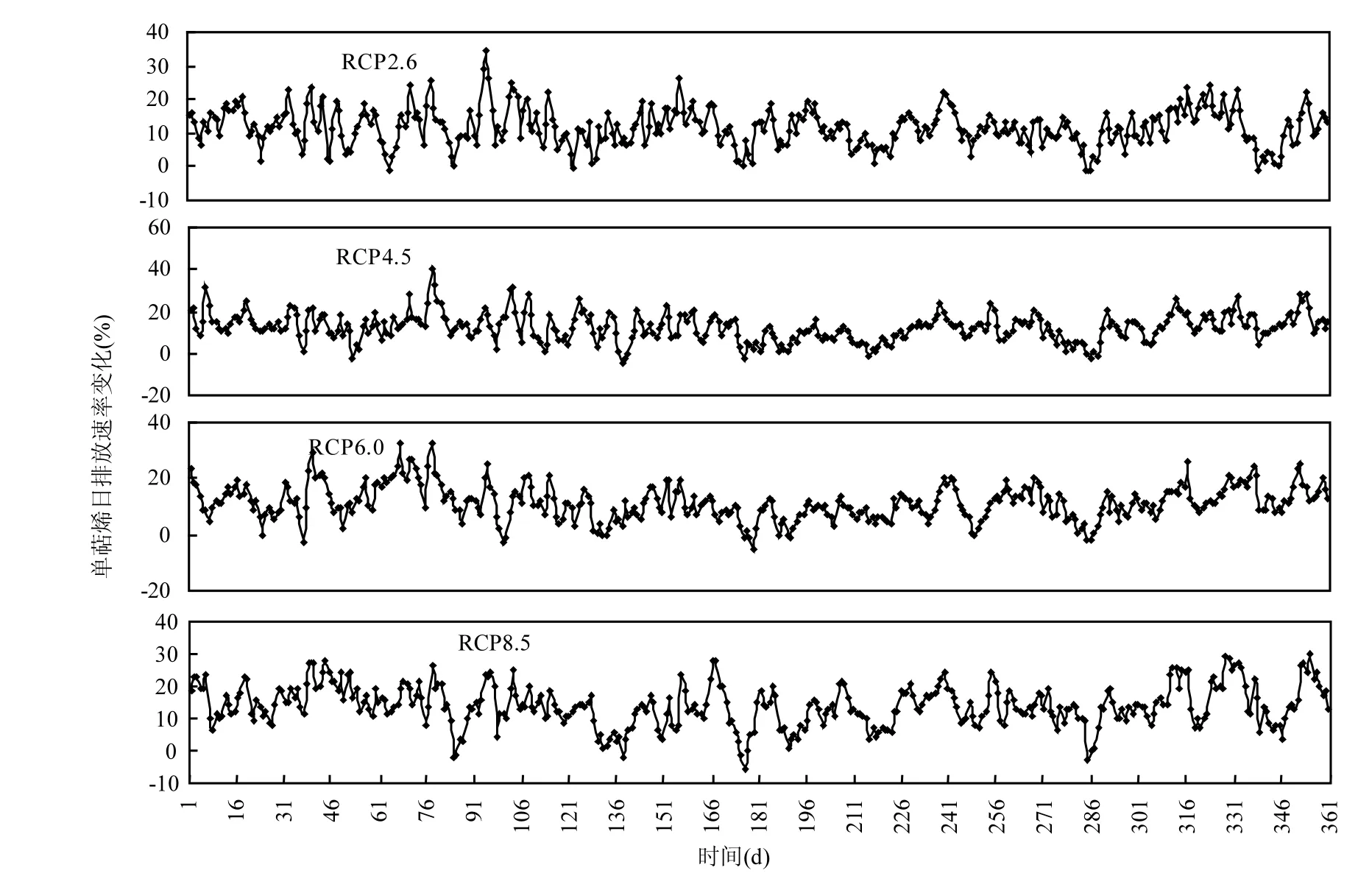
图6 相比基准情景不同气候变化情景50a平均油松单萜烯日排放速率变化Fig.6 The change in daily monoterpenes emission rate from leaves of Pinus tabuliformis under different climate change scenarios compared to the baseline scenario
2.3 气候变化影响下油松单萜烯年排放速率变化
图 7显示,与基准情景下相比,在 RCP2.6,RCP4.5,RCP6.0和 RCP8.5 4 种情景下,2001~2050年油松单萜烯年排放速率呈现增加趋势.在基准情景下,油松单萜烯年排放速率平均为7746µg/(g·a);在 4 种未来情景下,50a油松单萜烯年排放速率分别平均为 8610,8565,8488,8705µg/(g·a).总体上,未来气候变化情景下,50年油松单萜烯年排放速率平均比基准情景下高出约 1000µg/(g·a)以上,在 RCP8.5 情景下油松单萜烯年排放速率最大.相比基准情景,2001~2050年油松单萜烯年排放速率在4种未来情景下平均增加幅度为 9%~13%,50a在 4种未来情景下分别增加 11.15%、10.57%、9.58%和 12.37%.显然,在 RCP8.5情景下变化幅度最大.
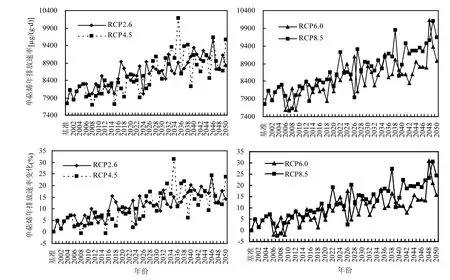
图7 不同气候变化情景与基准情景下油松单萜烯年排放速率变化Fig.7 Changes in annual emission rate of monoterpenes from leaves of Pinus tabuliformis under different climate change scenarios compared to the baseline scenario
3 讨论
本研究说明,未来气候变化影响下山西太岳山林区中部气温呈上升的趋势,这与全球趋势比较一致[11].另外,本研究也表明,未来气候变化下山西太岳山林区中部年降水量变化波动明显,总体上呈现增加或下降趋势.同时,气候变化下山西太岳山林区中部辐射强度波动也比较大,呈现下降趋势,这些趋势与全球气候变化预测中一致[11].当然,这里主要反映了山西太岳山林区中部区域的变化趋势,不同区域将有不同的变化特征.
一些研究表明未来气候变化下将使植物单萜烯排放速率增加.如Lindwall等[12]发现,夏天变暖4℃使极地冻原VOCs排放增加280%,积雪增加影响下VOCs排放变化却不大;Kramshøj等[41]发现,气候变暖使极地植物 VOCs排放增加,变暖使生态系统 VOCs排放速率增加 260%,植物VOCs排放速率增加 90%,减少太阳辐射使系统VOCs排放速率下降69%,植物VOCs排放速率下降61%~65%; Faubert等[60]发现气候变化使亚北极苔原 VOCs排放加倍,Rinnan等[40]发现气候变化引起灌木VOCs排放增加,Vedel-Petersen等[39]发现气候变化导致植物 VOCs排放增加.还有研究发现温度升高使植物 VOCs排放增加[28]或区域气候变化使VOCs排放增加[13].本研究也表明,气候变化下油松单萜烯日和年排放速率都呈现增加趋势,其中日增加幅度为 9%~18%,年增加幅度为 9%~13%.这些增加幅度没有前述文献[12,41,60]中高,这主要可能因为这些文献中基于控制试验结果,相比本研究模拟时间短,而本研究以 1950~2000年为基准情景,模拟未来 2001~2050年50a的变化趋势,并且文献中试验增温幅度比本研究模拟情景增温幅度要大,试验中植物与本研究选择的油松生理代谢等也不同.另外,本研究结果也表明,气候变化下油松单萜烯排放存在明显日期和气候变化情景的差异. 如油松单萜烯日排放速率 1~210d呈上升趋势,210~365d呈下降趋势, 在RCP8.5情景下较高;未来气候变化情景与基准情景下油松单萜烯日排放速率1~95d差异较小,95~295d波动较大,296~365d 差异不大;油松单萜烯日排放速率相对变化百分率1~190d较高, 191~315d变化较小, 316~365d变化在12%~18%以上,在RCP8.5情景下变化较大.这可能与研究区气温变化和植物生理活动时间差异有关.在本研究区,在基准和未来气候变化情景下,全年中 1~210d气温呈上升趋势,在 211~365d气温呈现下降趋势,植物单萜烯日排放速率也随之改变,但在1~90d和296~365d气温都不是很高,并且也不是植物最活跃生理活动期,而在 91~295d气温变化范围大,同时也是植物最活跃的生理活动期,并且相比基准情景,未来气候变化情景下春夏季气温增加相对明显,加之在春夏季植物生理活动活跃,所以使油松单萜烯日排放速率在基准和未来气候变化情景下差异增大.另外,从气候变化下温度增加相对程度来看,在春季和冬季气温增加相对幅度更高,使油松单萜烯日排放速率相对变化百分率在1~190d和315~365d较高,在191~315d变化较小.这些结果意味着未来气候变化强度和时间差异将导致植物单萜烯排放速度改变程度和时间差异.但也有研究发现,气候变化对植物 VOCs排放影响不确定.如 Schollert等[80]研究发现,气候变化改变了极地植物解剖结构,但对植物 VOCs排放却没有影响.说明植物发育过程对植物 VOCs排放影响较大,对此需要在以后研究中进行考虑.
一些研究认为气候变化下植物单萜烯排放改变与植物生物量改变有关,气候变化下植物生物量增加导致单萜烯排放增加[37].本研究没有考虑气候变化对油松生物量的影响而导致对单萜烯排放的改变.如果考虑气候变化对油松生物量的影响,可以推断气候变化下油松单萜烯排放增加程度将更明显.这些影响需要在以后研究中进一步考虑.同时,气候变化下植物单萜烯排放速率改变与植物生理活动改变有关.如研究发现在高温和CO2浓度升高下植物VOCs排放与光合作用和叶绿素结构关系密切[54]或植物单萜烯排放与光合作用,气孔通导性关系密切[32].另外,气候变化下植物单萜烯排放速率改变与植物解剖结构变化也关系密切.如研究发现温度升高和O3浓度变化下植物 VOCs排放与叶片结构关系密切[55]或植物 VOCs排放与植物地下结构变化关系密切[33],气候变化下植物叶片发育不同使植物VOCs排放季节变化[31].但也有研究发现气候变化虽然引起植物解剖结构改变,但对 VOCs排放没有影响[88];还有研究发现气候变暖和积雪增加使植物光合作用速率下降,但对植物 VOCs排放没有影响,主要是因为叶片结构改变[50].本研究中,假设气候变化下油松叶片生理活动与解剖结构没有变化,这些假设是否正确有待检验.
一些研究发现水分改变对植物 VOCs排放影响明显[29],气候变化引起的干旱对植物 VOCs排放影响较大[38,43,45],干旱使植物 VOCs排放增加[42,44],或洪水[36]或干旱再加水[46]或降水增加使植物 VOCs排放增加[23].同时,一些研究发现大气CO2浓度变化[49,51]及温度和CO2浓度变化[48,52-54]或 O3和 CO2浓度变化[56-57]对植物单萜烯排放都有一定影响.另外,土地利用、CO2浓度、植被组成和气候变化对单萜烯排放有不同影响[5,61].此外,植物霉变[36]或昆虫取食[34,57]或气候和昆虫取食共同对植物单萜烯排放产生一定的影响[35].本研究主要考虑了温度变化对油松单萜烯排放的影响, 没有考虑其它因素变化对油松单萜烯排放的影响.事实上,气候变化下随着降水和蒸发的改变将引起水分的变化,同时大气中CO2和O3浓度也将改变,并且将间接引起霉变或昆虫取食改变,这些变化将不同程度直接或者间接影响植物 VOCs排放.在本研究中,如果考虑水分或其它因素变化对油松单萜烯排放的影响,可以推断油松单萜烯排放变化将可能更加复杂,这需要在以后研究中进一步详细分析.
气象因素的误差可能对植物单萜烯排放模拟结果造成误差[89-91].在目前模拟分析植物单萜烯排放中,主要考虑了温度因子.虽然植物叶片温度与气温有关,但存在一定差异.在本文中,参考相关文献[76-77],忽略了叶片温度和气温差异,这可能对研究结果造成一些误差.但从分析气候变化对植物单萜烯排放影响宏观趋势来看,这些差异也可以忽略.
需要指出的是,本研究只采用了单一气候模式模拟的气候变化情景结果,不同气候模式下结果可能有一定差异,需要在以后研究中进一步分析.另外,一些研究发现气候变化引起植被变化导致 VOCs排放变化[58]或气候变化改变植物组成使 VOCs排放改变[60].而本研究只考虑了在山西省太岳山分布的油松,没有考虑其他区域油松单萜烯排放特征. 同时,本研究也没有考虑气候变化可能导致油松分布范围改变而对单萜烯排放影响.这可能使本研究结果存在一些不足,需要在以后研究中加强这些分析.尽管如此,本研究利用了目前新的气候变化情景数据,模拟分析了未来气候变化对油松单萜烯排放速率影响,对科学认识气候变化对植物 VOCs排放及大气环境的影响还是有一定的参考意义.
4 结论
4.1 在气候变化影响下,山西太岳山中部年均气温呈明显上升趋势,年降水量和日辐射强度都呈下降或者增加趋势,波动较大.
4.2 油松单萜烯日排放速率在未来气候变化情景与基准情景下差值在1~95d和296~365d较小,在 95~295d波动较大.油松单萜烯日排放速率相对变化百分率在 1~190d增加 12%~14%以上,在191~315d 增加 9%~13%以上,在 316~365d 增加12%~18%以上,在RCP8.5情景下较大.
4.3 相比基准情景,在未来气候变化下油松叶片单萜烯年排放速率和变化程度呈增加趋势,在气候变化情景下油松单萜烯年排放速率平均增幅在9%~13%,在RCP8.5情景下最大.
[1]Collins W J, Derwent R C, Johnson C E,etal. The oxidation of organic compounds in the troposphere and their global warming potentials [J]. Climatic Change, 2002,52:453-479.
[2]Day M C, Pandis S N. Predicted changes in summertime organic aerosol concentrations due to increased temperatures [J].Atmospheric Environment, 2011,45(36):6546-6556.
[3]唐孝炎,张远航,邵 敏,等.大气环境化学 [M]. 第 2 版.北京:高等教育出版社, 2010:74-77.
[4]Fehsenfeld F, Callvert J, Fall R, et al. Emissions of volatile of organic compounds from vegeration and the implications for atmospheric chemistry [J]. Global Biogeochemical Cycles, 1992,6(4):389-430.
[5]Laothawornkitkul J, Taylor J E, Paul N D, et al. Biogenic volatile organic compounds in the Earth system [J]. New Phytologist,2009,183(1):27-51.
[6]Guenther A, Hewitt C N, Erickson D, et al. A global model of natural volatile organic compounds emissions [J]. Journal of Geophysical Research, 1995,100:8873-8892.
[7]Monson R K, Holland E A. Biospheric trace gas fluxes and their control over tropospheric chemistry [J]. Annual Review of Ecology and Systematics, 2001,32:547-576.
[8]Levis S, Wiedinmyer C, Bonan G B, et al. Simulating biogenic volatile organic compound emissions in the Community Climate System Model [J]. Journal of Geophysical Research-Atmospheres, 2003,108(D21):ACH 1-9.
[9]Lathière J, Hauglustaine D A, Noblet-DucoudréDe N, et al. Past and future changes in biogenic volatile organic compound emissions simulated with a global dynamic vegetation model [J].Geophysical Research Letters, 2005,32(20):L20818 1-4.
[10]Guenther A B, Zimmerman P R, Harley P C, et al. Isoprene and monoterpene emission rate variability: model evaluations and sensitivity analyses [J]. Journal of Geophysical Research, 1993,98(D7):12609-12617.
[11]Stocker T F, Qin D, Plattner G K. et al. Climate Change 2013: the Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [R]. Cambridge, UK and New York, USA:Cambridge University Press, 2013:4-23.
[12]Lindwall F, Schollert M, Michelsen A, et al. Fourfold higher tundra volatile emissions due to arctic summer warming [J].Journal of Geophysical Research: Biogeosciences, 2016,121(3):895-902.
[13]Zhang Y, Hu X-M, Leung L R, et al. Impacts of regional climate change on biogenic emissions and air quality [J]. Journal of Geophysical Research: Atmospheres, 2008,113:D18310 1-24.
[14]Mochizuki T, Saito T, Hirai G, et al. Development of a reliable method to determine monoterpene emission rate of plants grown in an open-top chamber [J]. Journal of Agricultural Meteorology,2015,71(4):271-275.
[15]Janson R W. Monoterpene emissions from Scots pine and Norwegian spruce.Journal of Geophysical Research-Atmospheres,1993,98(D2):2839—2850.
[16]Noe S M, Peñuelas J, Niinemets Ü. Monoterpene emissions from ornamental trees in urban areas: a case study of Barcelona, Spain[J]. Plant Biology, 2008,10(1):163—169.
[17]Räisänen T, Ryyppö A, Kellomäki S. Monoterpene emission of a boreal Scots pine (Pinussylvestris L.) forest [J]. Agricultural and Forest Meteorology, 2009,149(5):808-819.
[18]Son Youn-Suk, Kim Ki-Joon, Jung In-Ha, et al. Seasonal variations and emission fluxes of monoterpene emitted from coniferous trees in East Asia: focused on Pinus rigida and Pinus koraiensis [J]. Journal of Atmospheric Chemistry, 2015,72:27—41.
[19]Maja M M, Kasurinen A, Holopainen T, et al. Volatile organic compounds emitted from silver birch of different provenances across a latitudinal gradient in Finland [J]. Tree Physiology,2015,35(9):975-986.
[20]Morrison E C, Drewer J, Heal M R. A comparison of isoprene and monoterpene emission rates from the perennial bioenergy crops short-rotation coppice willow and Miscanthus and the annual arable crops wheat and oilseed rape [J]. GCB Bioenergy, 2016,8:211—225.
[21]Stewart H E, Hewitt C N, Bunce R G H, et al. A highly spatially and temporally resolved inventory for biogenic isoprene and monoterpene emissions: Model description and application to Great Britain [J]. Journal of Geophysical Research-Atmospheres,2003,108(D20):ACH 7 1-18.
[22]Ludley K E, Jickells S M, Chamberlain P M, et al. Distribution of monoterpenes between organic resources in upper soil horizons under monocultures of Picea abies, Picea sitchensis and Pinus sylvestris [J]. Soil Biology and Biochemistry, 2009,41(6):1050-1059.
[23]Seco R, Karl T, Turnipseed A, et al. Springtime ecosystem-scale monoterpene fluxes from Mediterranean pine forests across a precipitation gradient [J]. Agricultural and Forest Meteorology,2017,150:237-238.
[24]Asensio D, Peñuelas J, Prieto P, et al. Interannual and seasonal changes in the soil exchange rates of monoterpenes and other VOCs in a Mediterranean shrubland [J]. European Journal of Soil Science, 2008,59(5):878-891.
[25]Holzke C, Hoffmann T, Jaeger L, et al. Diurnal and seasonal variation of monoterpene and sesquiterpene emissions from Scots pine (Pinussylvestris L.) [J]. Atmospheric Environment, 2006,40(17):3174-3185.
[26]Lim Jun-Ho, Kim Jo-Chun, Kim Ki-Joon, et al. Seasonal variations of monoterpene emissions from Pinus densiflora in East Asia [J]. Chemosphere, 2008,73(4):470-478.
[27]Llusia J, Peñuelas J, Guenther A, et al. Seasonal variations in terpene emission factors of dominant species in four ecosystems in NE Spain [J]. Atmospheric Environment, 2013,70:149-158.
[28]Filella I, Wilkinson M J, LlusiàJ, et al. Volatile organic compounds emissions in Norway spruce (Picea abies) in response to temperature changes [J]. Physiologia Plantarum, 2007,130(1):58-66.
[29]Filella I, Peñuelas J, Seco R. Short-chained oxygenated VOC emissions in Pinus halepensis in response to changes in water availability [J]. Acta Physiologiae Plantarum, 2009,31(2):311-318.
[30]Laffineur Q, Aubinet M, Schoon N, et al. Impact of diffuse light on isoprene and monoterpene emissions from a mixed temperate forest [J]. Atmospheric Environment, 2013,74:385-392.
[31]Brilli F, Gioli B, Fares S, et al. Rapid leaf development drives the seasonal pattern of volatile organic compound (VOC) fluxes in a‘coppiced’ bioenergy poplar plantation [J]. Plant, Cell &Environment, 2016,39(3):539-555.
[32]Llusia J, Roahtyn S, Yakir D, et al. Photosynthesis, stomatal conductance and terpene emission response to water availability in dry and mesic Mediterranean forests [J]. Trees, 2016,30(3):749-759.
[33]Henke A, Kunert M, Veit D, et al. Analysis of volatiles from Picea abies triggered by below-ground interactions [J]. Environmental and Experimental Botany, 2015,110:56-61.
[34]Vuorinen T, Reddy G V P, Nerg A-M, et al. Monoterpene and herbivore-induced emissions from cabbage plants grown at elevated atmospheric CO2concentration [J]. Atmospheric Environment, 2004,38(5):675-682.
[35]Trowbridge A M, Daly R W, Helmig D, et al. Herbivory and climate interact serially to control monoterpene emissions from pinyon pine forests [J]. Ecology, 2014,95:1591—1603.
[36]Copolovici L, Vaartnou F, Estrada M P, et al. Oak powdery mildew (Erysiphe alphitoides)-induced volatile emissions scale with the degree of infection in Quercus robur [J]. Tree Physiology,2014,34(12):1399-1410.
[37]Constable J V H, Guenther A B, Schimel D S, et al. Modelling changes in VOC emission in response to climate change in the continental United States [J]. Global Change Biology, 1999,5(7):791—806.
[38]Faubert P, Tiiva P, Rinnan Å, et al. Doubled volatile organic compound emissions from subarctic tundra under simulated climate warming [J]. New Phytologist, 2010,187(1):199—208.
[39]Vedel-Petersen I, Schollert M, Nymand J, et al. Volatile organic compound emission profiles of four common arctic plants [J].Atmospheric Environment, 2015,120:117-126.
[40]Rinnan R, Rinnan Å, Faubert P, et al. Few long-term effects of simulated climate change on volatile organic compound emissions and leaf chemistry of three subarctic dwarf shrubs [J].Environmental and Experimental Botany, 2011,72:377-386.
[41]Kramshøj M, Vedel-Petersen I, Schollert M, et al. Large increases in Arctic biogenic volatile emissions are a direct effect of warming [J]. Nature Geoscience, 2016,9(5):349-352.
[42]Seco R, Karl T, Guenther A, et al. Ecosystem-scale volatile organic compound fluxes during an extreme drought in a broadleaf temperate forest of the Missouri Ozarks (central USA)[J]. Global Change Biology, 2015,21:3657—3674.
[43]Feller U. Drought stress and carbon assimilation in a warming climate: Reversible and irreversible impacts [J]. Journal of Plant Physiology, 2016,203:84-94.
[44]Geron C, Daly R, Harley P, et al. Large drought-induced variations in oak leaf volatile organic compound emissions during PINOT NOIR [J]. Chemosphere, 2016,146:8-21.
[45]Huang L, McDonald-Buller E C, McGaughey G, et al. Annual variability in leaf area index and isoprene and monoterpene emissions during drought years in Texas [J]. Atmospheric Environment, 2014,92:240-249.
[46]Peñuelas J, Filella I, Seco R, et al. Increase in isoprene and monoterpene emissions after re-watering of droughted Quercus ilex seedlings [J]. Biologia Plantarum, 2009,53(2):351-354.
[47]Copolovici L, Niinemets Ü. Flooding induced emissions of volatile signalling compounds in three tree species with differing water logging tolerance [J]. Plant, Cell & Environment, 2010,33(9):1582-1594.
[48]Constable J V H, Litvak M E, Guenther A B, et al. Monoterpene emission from coniferous trees in response to elevated CO2concentration and climate warming [J]. Global Change Biology,1999,5(3):252—267.
[49]Loreto F, Fischbach R J, Schnitzler J-P, et al. Monoterpene emission and monoterpene synthase activities in the Mediterranean evergreen oak Quercus ilex L. grown at elevated CO2concentrations [J].Global Change Biology, 2001,7(6):709-717.
[50]Schollert M, Kivimäenpää M, Michelsen A, et al. Leaf anatomy,BVOC emission and CO2exchange of arctic plants following snow addition and summer warming [J]. Annals of Botany, 2017,119(3):433-445.
[51]Baraldi R, Rapparini F, Oechel W C, et al. Monoterpene emission responses to elevated CO2in a Mediterranean-type ecosystem [J].New Phytologist, 2004,161(56):17-21.
[52]Räisänen T, Ryyppö A, Kellomäki S. Effects of elevated CO2and temperature on monoterpene emission of Scots pine (Pinus sylvestris L.) [J]. Atmospheric Environment, 2008,42(18):4160—4171.
[53]Snow M D, Bard R R, Olszyk D M, et al. Monoterpene levels in needles of Douglas fir exposed to elevated CO2and temperature[J]. Physiologia Plantarum, 2003,117(3):352-358.
[54]Velikova V, Tsonev T, Barta C, et al. BVOC emissions,photosynthetic characteristics and changes in chloroplast ultrastructure of Platanus orientalis L. exposed to elevated CO2and high temperature [J]. Environmental Pollution, 2009,157(10):2629-2666.
[55]Hartikainen K, Nerg A-M, Kivimaenpaa M, et al. Emissions of volatile organic compounds and leaf structural characteristics of European aspen (Populus tremula) grown under elevated ozone and temperature [J]. Tree Physiology, 2009,29(9):1163-1173.
[56]Hartikainen K, Riikonen J, Nerg A-M, et al.Impact of elevated temperature and ozone on the emission of volatile organic compounds and gas exchange of silver birch (Betula pendula Roth) [J].Environmental and Experimental Botany, 2012,84:33-43.
[57]Kivimäenpää M, Ghimire R P, Sutinen S, et al. Increases in volatile organic compound emissions of Scots pine in response to elevated ozone and warming are modified by herbivory and soil nitrogen availability [J]. European Journal of Forest Research,2016,135(2):343-360.
[58]Valolahti H, Kivimäenpää M, Faubert P, et al. Climate change-induced vegetation change as a driver of increased subarctic biogenic volatile organic compound emissions [J].Global Change Biology, 2015,21(9):3478-3488.
[59]Kellomäki S, Rouvinen I, Peltola H, et al. Impact of global warming on the tree species composition of boreal forests in Finland and effects on emissions of isoprenoids [J]. Global Change Biology, 2001,7(5):531-544.
[60]Faubert P, Tiiva P, Michelsen A, et al. The shift in plant species composition in a subarctic mountain birch forest floor due to climate change would modify the biogenic volatile organic compound emission profile [J]. Plant & Soil, 2012,352(1/2):199—215.
[61]Wang Y-F, Owen S M, Li Q-J, et al. Monoterpene emissions from rubber trees (Heveabrasiliensis) in a changing landscape and climate: chemical speciation and environmental control [J].Global Change Biology, 2007,13:2270—2282.
[62]白建辉,Tiffany D,余树全,等.亚热带竹林挥发性有机物排放的模拟 [J]. 生态环境学报, 2015,24(12):1923-1937.
[63]白建辉,林凤友,万晓伟,等.长白山温带森林挥发性有机物的排放通量 [J]. 环境科学学报, 2012,32(3):545-554.
[64]王志辉,白郁华,王雪松,等.西双版纳地区三叶橡胶树异戊二烯和单萜烯排放机理初步研究 [J]. 北京大学学报, 2003,39(4):512-516.
[65]陈 颖,李德文,史 奕,等.沈阳地区典型绿化树种生物源挥发性有机物的排放速率 [J]. 东北林业大学学报, 2009,37(3):47-49.
[66]梁宝生,Baraldi R,Rapparini F.夏季黄连木排放萜烯类化合物浓度日变化及排放速率研究 [J]. 北京大学学报, 2003,39(4):517-521.
[67]王志辉,张树宇,陆思华,等.北京地区植物 VOCs排放速率的测定 [J]. 环境科学, 2003,24(2):7-12.
[68]梁珍海,刘海燕,陈 霞,等.南京紫金山不同植物群落 VOCs组成 [J]. 南京林业大学学报, 2011,25(1):4-38.
[69]常 杰,任 远,史 琰,等.亚热带城乡复合系统 BVOC 排放清单-以台州地区为例 [J]. 生态学报, 2012,32(2):641-649.
[70]闫 雁,王志辉,白郁华,等.中国植被VOC排放清单的建立 [J].中国环境科学, 2005,25(1):110-114.
[71]池彦琪,谢绍东.基于蓄积量和产量的中国天然源 VOC排放清单及时空分布 [J]. 北京大学学报, 2012,48(3):475-482.
[72]李金龙,白郁华,胡建信,等.油松排放萜烯类化合物浓度的日变化及排放速率的研究 [J]. 中国环境科学, 1994,14(3):165-169.
[73]侯慧波,李新岗,马养民,等.2种吸附剂对油松挥发物的吸附效果比较 [J]. 西北林学院学报, 2006,21(2):134-137.
[74]李继泉,金幼菊,沈应柏,等.环境因子对植物释放挥发性化合物的影响 [J]. 植物学通报, 2001,18(6):649-656.
[75]吕 迪,王得祥,谢小洋,等.油松释放萜烯类挥发性成分研究[J]. 西北林学院学报, 2016,31(1):231-237.
[76]周秀骥,唐孝炎,冯宗炜,等.长江三角洲低层大气与生态系统相互作用研究 [M]. 北京:气象出版社, 2004:96-102.
[77]高文华,李忠勤,张明军,等.西晋南地区近 50a气候变化特征,突变与周期分析 [J]. 干旱区资源与环境, 2011,25(7):124-127.
[78]赵桂香,赵彩萍,李新生,等.47a来山西省气候变化分析 [J]. 干旱区研究, 2006,23(3):499-505.
[79]张 莉,王效科,欧阳志云,等.中国森林生态系统的异戊二烯排放研究 [J]. 环境科学, 2003,24(1):8-15.
[80]Moss R H, Edmonds J A, Hibbard K A, et al. The next generation of scenarios for climate change research and assessment [J].Nature, 2010,463(7282):746-756.
[81]Taylor K E, Stouffer R J, Meehl G A. An overview of CMIP5 and experiment design [J]. Bulletin of the American Meterological Society, 2012,93(4):485-498.
[82]Meinshausen M, Smith S J, Calvin K, et al. The RCP greenhouse gas concentrations and their extensions from 1765 to 2300 [J].Climatic Change, 2011,109(16-2):213-241.
[83]Warszawaski L, Frieler K, Huber V, et al. the inter-sectoral impact model intercomparison project (isi-mip):project framework [J]. Proceedings of the National Academy Of Sciences,2013,119(9):3228-3232.
[84]Hempel S, Frieler K, Warszawski L, et al. A trend-preserving bias correction-the isi-mip approach [J]. Earth Syst Dynamo,2013,42920:219-236.
[85]吴建国.气候变化对生物多样性影响与风险研究 [M]. 北京:科学出版社, 2017:73-116.
[86]Ephrath J E, Goudriaan J, Marani A. Modelling diurnal patterns of air temperature, radiation wind speed and relative humidity by equations from daily characteristics [J]. Agricultural Systems,1996,51(4):377-393.
[87]盛裴轩,毛节泰,李建国,等.大气物理学 [M]. 北京:北京大学出版社, 2003:88-89.
[88]Schollert M, Kivimäenpää M,Valolahti H M, et al. Climate change alters leaf anatomy, but has no effects on volatile emissions from arctic plants [J]. Plant, Cell and Environment,2015,38:2048—2060.
[89]司徒淑娉,王雪梅,Guenther A,等.气象模拟误差对单萜烯排放估算的影响 [J]. 环境科学学报, 2010,30(12):2383-2391.
[90]毛红梅,张凯山,第宝锋.四川省天然源VOCs排放量的估算和时空分布 [J]. 中国环境科学, 2016,36(5):1289-1296.
[91]张 蕾,姬亚芹,赵 杰,等.乌鲁木齐市天然源 VOCs排放量估算与时空分布特征 [J]. 中国环境科学, 2017,37(10):3692-3698.

