中枢神经系统表面铁沉积症合并寡克隆区带:1例报告及专家解读
丁 婕,林 智,陈 莺,徐 群,李建萍,陈增爱,管阳太
1. 上海交通大学医学院附属仁济医院神经内科,上海 200127
2. 上海交通大学医学院附属仁济医院影像科,上海 200127
1 病例报告
1.1 主诉
患者,女性,54岁,因“双下肢感觉异常、行走不稳1年余”于2016年4月就诊于上海交通大学医学院附属仁济医院神经内科。患者自诉进行性加重双下肢及臀部感觉异常,伴有行走不稳、脚踩棉花感、排尿困难。
1.2 既往史
既往有10年反复发作性前额胀痛病史。
1.3 神经系统查体
双下肢肌张力增高,双侧腱反射亢进,双侧病理征阳性,双侧第8胸椎感觉平面以下针刺觉减退。其余神经系统查体未发现明显异常。
1.4 腰椎穿刺脑脊液检查
蛋白含量为550 mg/L,红细胞计数为1 690×106/L,白细胞计数为7×106/L。
水通道蛋白4(aquaprorin 4,AQP4)抗体、髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体、髓鞘碱性蛋白(myelin basic protein,MBP)抗体均为阴性。
脑脊液中可见深染的免疫球蛋白G(immunoglobulin G,IgG)寡克隆区带(oligoclonal band,OCB)。
1.5 影像学检查
1.5.1 头颅磁共振成像(magnetic resonance imaging,MRI)
双侧额叶皮质下多发小斑片状异常信号,T1加权成像呈略低信号(图1A),T2加权成像呈高信号(图1B),液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列呈高信号(图1C);增强后强化不明显(图1D)。
1.5.2 颈椎MRI
脊髓、脑干表面线状T1加权成像略高信号(图2A、D),T2加权成像呈线状低信号影(图2B、E);脊髓变细萎缩,脊髓可疑长节段T2加权成像高信号;增强后髓内未见明显异常强化(图2C、F)。
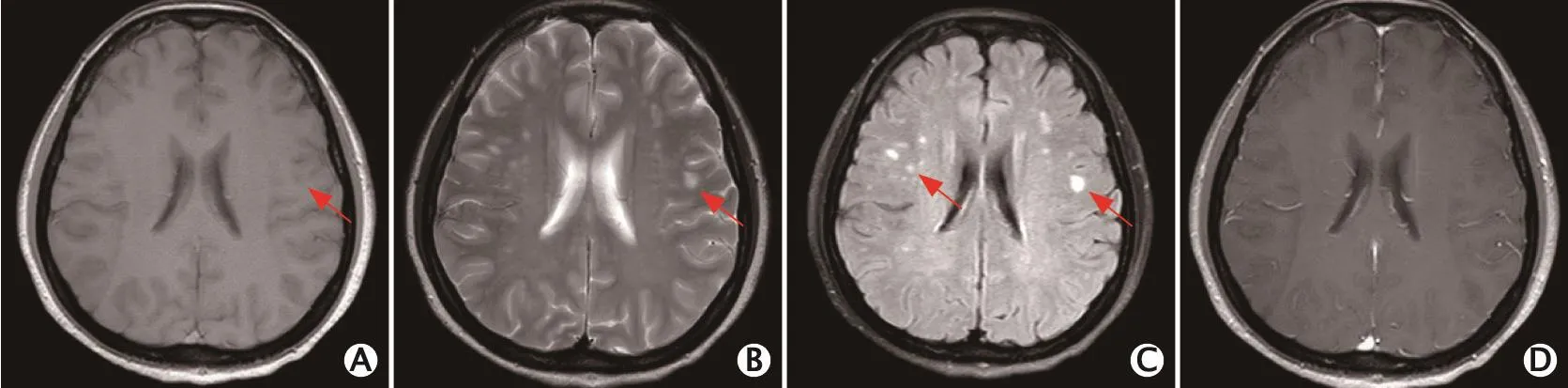
图1 1例54岁中枢神经系统表面铁沉积症女性患者头颅磁共振成像平扫增强扫描影像(2016年4月)。双侧额叶皮质下多发小斑片状异常信号影,T1加权成像呈略低信号(A),T2加权成像呈高信号(B),液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列呈高信号(C);增强后强化不明显(D)。
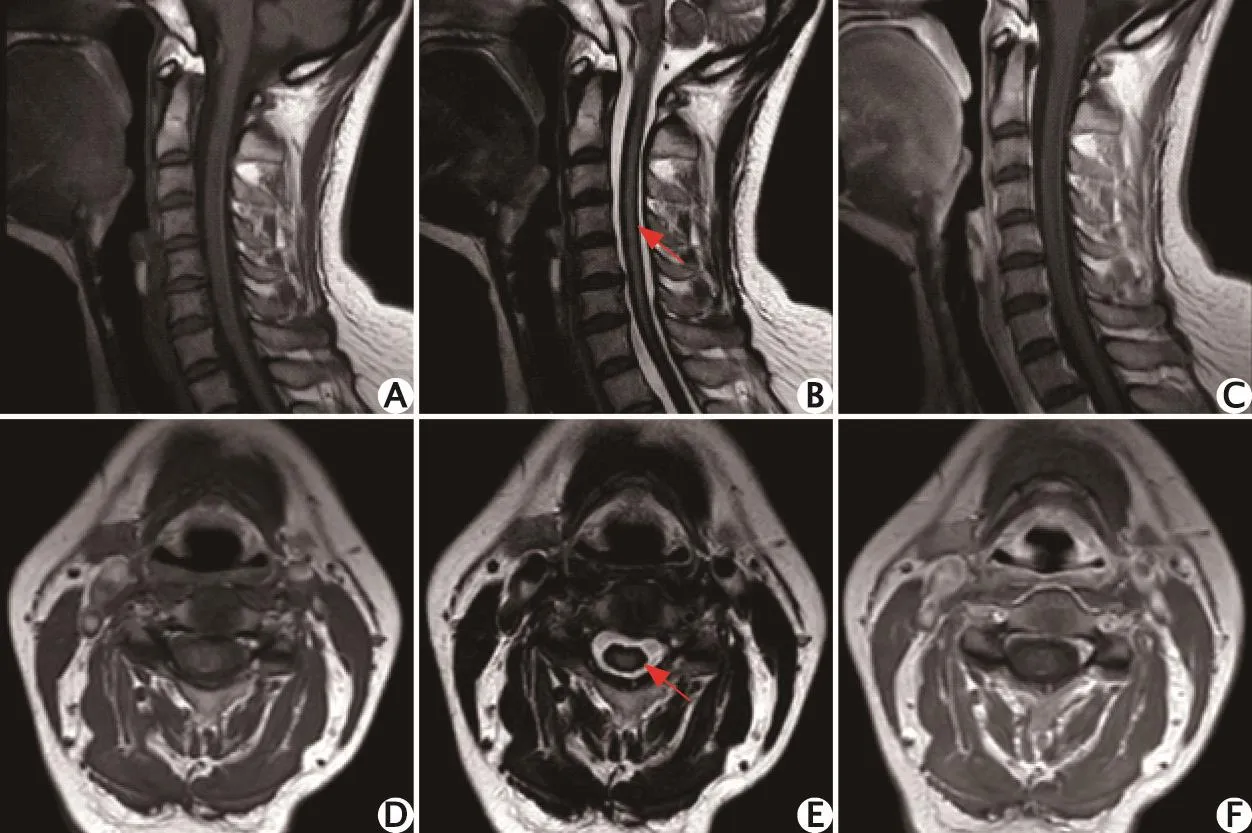
图2 1例54岁中枢神经系统表面铁沉积症女性患者颈椎磁共振成像平扫增强扫描影像(2016年4月)。脊髓、脑干表面线状T1加权成像略高信号影(A、D),T2加权成像呈线状低信号影(B、E);脊髓变细萎缩,脊髓可疑长节段T2加权成像高信号影;增强后(C、F)髓内未见明显异常强化。
1.6 诊断和治疗
根据患者双侧腱反射亢进、双侧病理征阳性、传导束感觉异常体征伴排尿障碍症状,病灶定位于高位颈髓。根据MRI影像、颅内及颈髓多发病灶、脑脊液中可见深染IgG OCB,病灶定性为中枢神经系统脱髓鞘。结合脊髓病灶呈长节段,初步诊断为抗体阴性视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)可能。
疑诊为NMOSD可能后,给予甲泼尼龙琥珀酸钠500 mg/d静脉滴注冲击治疗,连续治疗5 d后,排尿情况好转,其余症状未见明显好转。出院后,继续口服泼尼松(10 mg/次,1次/d)和硫唑嘌呤(50 mg/次,2次/d)治疗,但症状进行性加重。
2016年11月,头颅MRI T2加权成像和磁敏感加权成像(susceptibility weighted imaging,SWI)显示脑干和小脑蚓部脑表面线状低信号影(图3)。腰椎穿刺脑脊液检查:蛋白含量为1 008 mg/L,红细胞计数为9 600×106/L。遂变更诊断为中枢神经系统表面铁沉积症(superficial siderosis of central nervous system,SSCNS)。停用泼尼松和硫唑嘌呤,给予去铁酮片治疗,症状未再进行性加重。
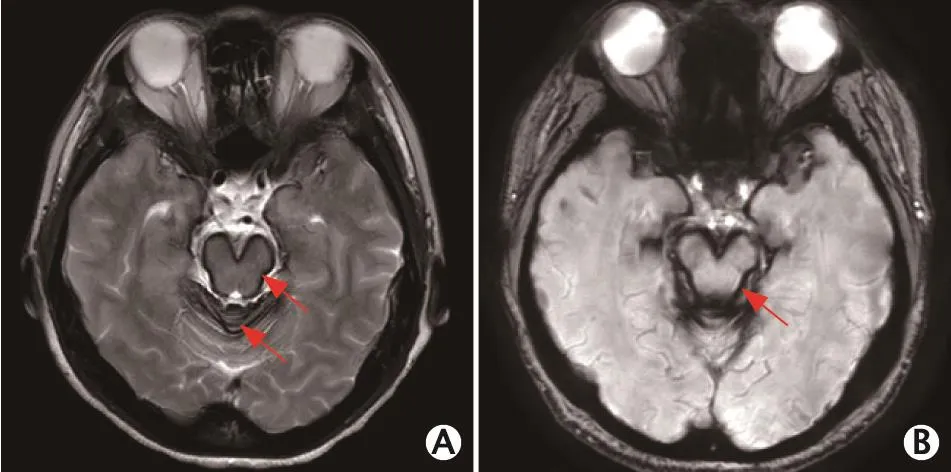
图3 1例54岁中枢神经系统表面铁沉积症女性患者头颅磁共振成像(magnetic resonance imaging,MRI)平扫磁敏感加权成像(susceptibility weighted imaging,SWI)(2016年11月)。头颅MRI T2加权成像(A)和SWI(B)显示中脑表面和小脑蚓部线状低信号影。
1.7 随访
2017年2月,患者至本科随访。复查腰椎穿刺脑脊液检查:蛋白含量为637.0 mg/L,红细胞计数为5 769×106/L,白细胞计数为15×106/L;脑脊液中未见OCB。
进一步行电测听、脑干听觉诱发电位(brainstem auditory evoked potential,BAEP)检查,均未见明显异常;全脑血管造影、全脊髓血管MRI,亦未见明显异常。
2 专家解读
2.1 临床讨论(上海交通大学医学院附属仁济医院神经内科,管阳太 教授)
SSCNS是一种罕见的慢性进展性中枢神经系统病变。该病从出血损伤至症状出现的时间可为数月至数十年,大多为10~15年[1]。一旦出现典型临床症状则不可逆,但若及时发现并给予治疗,可阻止其进一步恶化[2]。
慢性持续或反复的中枢神经系统蛛网膜下腔内出血及红细胞溶解,含铁血黄素逐渐沉积于小脑、脑干、颅神经、脊髓表面,引发SSCNS,并造成神经元不可逆性损害。文献报道,SSCNS常见病因为硬膜病变(47%),包括脑脊液腔隙病变(大脑半球切除术后、脑脊膜膨出、假性脑膜膨出、慢性硬膜下血肿等)及颈神经根撕脱;其次为肿瘤(35%),如室管膜瘤;以及脑血管畸形(18%),如动脉瘤、海绵状血管瘤等[1]。
SSCNS主要临床表现为双侧感觉神经性耳聋(95%)、小脑性共济失调(88%)、锥体束征(76%)[2];其他临床表现还包括认知功能下降(24%)、嗅觉障碍(17%)、排尿障碍(24%)、阵发性或直立性头痛(37%)、眼球震颤(19%)、坐骨神经痛(10%)、感觉异常(10%)和痫性发作(4%)等[3-5]。SWI或MRI(T2加权成像)显示脑和脊髓表面线状低信号影。此外,还有脑脊液黄变,脑脊液中红细胞和蛋白增多等。
根据患者临床特征,结合影像学典型特征及腰椎穿刺脑脊液陈旧性出血征象,可诊断SSCNS;同时,应与脊髓小脑共济失调、中枢神经系统慢性感染等其他可导致神经性耳聋、小脑性共济失调、锥体束征的疾病进行鉴别。
本例患者有明确的锥体束损害,如肌张力增高、腱反射亢进、病理征阳性;有脊髓、小脑功能受累,如共济失调、第8胸椎平面以下感觉异常、排尿障碍。患者3次腰椎穿刺脑脊液检查均发现红细胞计数增加,结合反复发作性头痛病史10年,考虑为活动性慢性蛛网膜下腔出血所致,同时影像学证明存在铁沉积,因此最终明确诊断为SSCNS。然而,患者慢性蛛网膜下腔出血的病因仍不明,尚需进一步随访。
此外,本例患者最初被误诊为NMOSD可能,因随访发现治疗效果不佳,行SWI检查发现蛛网膜下腔内铁沉积,同时结合患者临床症状、脑脊液特征,变更诊断为SSCNS。更改治疗方案后,患者症状未继续恶化。SSCNS常规影像学检查容易漏诊,应加强早期识别。值得注意的是,本例患者第一次脑脊液检查发现有深染的IgG OCB,而国内尚未有合并脑脊液OCB(cerebrospinal fluid-restricted OCB,CSF-OCB)阳性的中枢神经系统表面铁沉积症的报道,这也是导致误诊的原因之一。
SSCNS的发病机制尚未明确,有研究表明小胶质细胞在发病机制中起重要作用[6]。小胶质细胞活化可导致促炎因子、神经毒性因子的产生,在SSCNS发病机制中可能起到炎性、退行性作用[7]。CSF-OCB的出现往往高度提示有免疫球蛋白的鞘内合成,常提示多发性硬化或神经系统炎性疾病。国外报道1例合并OCB的SSCNS,该病例最初被误诊为多发性硬化,复查MRI发现新出现的铁沉积,结合肌电图检查后明确为神经根损伤所致的SSCNS[8]。本病例第一次腰椎穿刺发现CSF-OCB及蛋白含量升高,经治疗后CSFOCB转为阴性。因此,潜在的免疫炎性因素可能参与了SSCNS的发病,其具体机制仍有待进一步研究。
2.2 影像学讨论(上海交通大学医学院附属仁济医院影像科,陈增爱 教授)
MRI对SSCNS的诊断具有重要意义。以往只能经过尸检或外科手术被发现。当前,随着MRI技术的广泛应用及发展,部分患者能在症状出现之前就被发现,显著提高了SSCNS的早期诊断率。SWI对SSCNS的诊断较常规MRI更为敏感,能更清晰地显示含铁血黄素在特定部位的沉积,并且有利于发现微小的血管畸形及陈旧性微出血灶,有助于寻找病因。SSCNS的典型MRI表现为含铁血黄素选择性沉积于与脑脊液相邻的脑和脊髓表面,显示为线状T2加权成像以及SWI低信号灶,相应区域神经组织呈现不同程度的萎缩。SSCNS常见部位包括上蚓部、小脑叶、额颞叶、脑干、脊髓、颅神经(Ⅰ和Ⅷ)[2]。
本例患者MRI显示脑干、小脑蚓部和脊髓表面低信号影伴脊髓萎缩,符合SSCNS的典型影像学表现。然而,在临床实践中,脑脊髓表面的T2加权成像低信号易被忽视[9],本例患者最初也被误诊为抗体阴性的NMOSD可能,而后期的SWI在SSCNS诊断中发挥了重要作用。
对于T2加权成像低信号这一特征,一些顺磁物质,如铜、锰、钙等在MRI上可能形成相似表现,但可根据SWI表现及好发沉积部位、多发伴随症状等进行鉴别。此外,部分SSCNS患者会出现硬脑膜强化,此时需与颅内黑素瘤进行鉴别[10]。本例患者无脑膜强化,故颅内黑素瘤不予考虑。
SSCNS病因寻找通常较为困难,而MRI有时可起到一定的帮助作用。如T2加权成像低信号部分中断可提示神经根撕脱,其原因可能是由于撕裂部位的软脑膜缺失[11]。此外,脑、脊髓血管造影也是寻找出血源的常用技术之一,但由于SSCNS的慢性间歇性出血特征,其阳性检出率较低。本例患者全脑血管造影、全脊髓血管MRI均未见明显血管异常,但脊髓小静脉血管畸形、海绵状血管瘤仍不能排除,因此可进一步完善脊髓血管造影检查。
3 要点小结
SSCNS是一种罕见的慢性进展性中枢神经系统病变,铁沉积所致的中枢神经系统损害不可逆,因此必须早期识别、早期干预,以阻止该病的进一步恶化。鉴于SSCNS临床症状的不确定性,因此早期识别SSCNS及明确病因面临一定的挑战。影像学特征及脑脊液特征有助于SSCNS的早期诊断,因此有必要加强相关知识的普及。此外,CSF-OCB在SSCNS发病中的机制,仍有待进一步研究。
[1]FEARNLEY JM, STEVENS JM, RUDGE P. Superficial siderosis of the central nervous system[J].Brain, 1995, 118(Pt 4):1051-1066.
[2]RYU SM, KIM ES, KIM SK,et al. Superficial siderosis of the central nervous system originating from the thoracic spine: a case report[J].Korean J Spine, 2016, 13(2):83-86.
[3]TOSAKA M, SATO K, AMANUMA M,et al. Superficial siderosis of the central nervous system caused by hemorrhagic intraventricular craniopharyngioma: case report and literature review[J].Neurol Med Chir(Tokyo), 2015,55(1):89-94.
[4]KUMAR N, MILLER GM, PIEPGRAS DG,et al. A unifying hypothesis for a patient with superficial siderosis, low-pressure headache,intraspinal cyst, back pain, and prominent vascularity[J].J Neurosurg, 2010, 113(1):97-101.
[5]LUMMEL N, WOLLENWEBER FA,DEMAEREL P,et al. Clinical spectrum,underlying etiologies and radiological characteristics of cortical superficial siderosis[J].J Neurol, 2015, 262(6):1455-1462.
[6]KOEPPEN AH, DICKSON AC, CHU RC,et al. The pathogenesis of superficial siderosis of the central nervous system[J].Ann Neurol,1993, 34(5):646-653.
[7]WU W, SHAO J, LU H,et al. Guard of delinquency? A role of microglia in inflammatory neurodegenerative diseases of the CNS[J].Cell Biochem Biophys, 2014, 70(1):1-8.
[8]PAPADIMAS GK, RENTZOS M,ZOUVELOU V,et al. Superficial siderosis of central nervous system mimicking multiple sclerosis[J].Neurologist, 2009, 15(3):153-155.
[9]FRAGOSO YD, ADONI T, BROOKS JB,et al. Superficial siderosis of the central nervous system is a rare and possibly underdiagnosed disorder[J].Arq Neuropsiquiatr, 2017, 75(2):92-95.
[10]KUMAR N. Neuroimaging in superficial siderosis: an in-depth look[J].AJNR Am J Neuroradiol, 2010, 31(1):5-14.
[11]COHEN-GADOL AA, KRAUSS WE,SPINNER RJ. Delayed central nervous system superficial siderosis following brachial plexus avulsion injury. Report of three cases[J/OL].Neurosurg Focus, 2004, 16(5):E10(2004-04-02)[2017-12-02]. http://thejns.org/doi/abs/10.3171/foc.2004.16.5.11.

