以面-臂肌张力障碍发作为主要表现的抗LGI1抗体相关边缘性脑炎:3例报告及文献复习
杨晓岚,陆钦池
1. 上海交通大学医学院附属仁济医院南院神经内科,上海 201100
2. 上海交通大学医学院附属仁济医院神经内科,上海 200127
抗富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated 1,LGI1)抗体相关边缘性脑炎(limbic encephalitis,LE)是近年来发现的一种新型的自身免疫相关性脑炎[1],临床上大多呈急性或亚急性起病,主要症状包括癫痫发作、近事记忆力下降、精神行为异常,部分患者合并语言障碍、睡眠障碍、小脑性共济失调和抗利尿激素分泌不当综合征(顽固性低钠血症)[2]。在抗LGI1抗体相关LE患者中,癫痫发作是其最主要的临床表现,占首发症状的70%,且面-臂肌张力障碍发作(faciobrachial dystonic seizure,FBDS)是其特征性癫痫发作类型[3],主要表现为短暂性、同侧面部和上肢为著的肌张力障碍样发作。FBDS发作短暂,仅持续数秒(<3 s),伴或不伴意识障碍,发作频率高,可以达到每日数百次(中位数为50次/d)。本病对免疫治疗反应良好,但对抗癫痫药物反应欠佳[4]。FBDS可能是抗LGI1抗体相关LE的早期症状,因此认识这一特殊的癫痫发作有利于早期诊断和早期治疗。本文对上海交通大学医学院附属仁济医院收治的3例以FBDS为主要表现的抗LGI1相关LE病例进行回顾性分析,并对相关文献进行复习。
1 病例报告
1.1 病例1
患者,男性,70岁,因“进行性反应迟钝1年伴发作性肢体抽搐1个月”于2015年6月27日收住上海交通大学医学院附属仁济医院神经内科病房。
患者于1年前开始出现反应迟钝,懒言少语,言语不利,行为异常,当时由于家人未予重视,因此未进行诊治。2015年5月初开始出现发作性肢体抽搐,表现为口角及上肢抽动,意识清楚,每次发作持续数秒至数分钟,最多发作10余次/d。2015年6月25日出现意识丧失伴四肢强直阵挛发作1次,持续数分钟自行停止;之后,患者反复出现嘴角抽搐发作,间歇期为30 min,发作间期意识无转清。2015年6月25日当日即至上海交通大学医学院附属仁济医院急诊就诊,先后给予丙戊酸钠和地西泮等静脉治疗,但控制欠佳。为进一步诊治,于2015年6月27日收住上海交通大学医学院附属仁济医院神经内科病房。患者发病前无感染、发热、腹泻、脱水病史。自发病以来,精神可,胃纳可,二便如常,体质量未见明显下降。既往无高血压、冠心病、糖尿病等慢性病史,无手术史,无输血史。
2015年6月28日入院后查体:体温为36.6℃,心率为66次/min,呼吸频率为20次/min,收缩压为110 mm Hg(1 mm Hg=0.133 kPa),舒张压为60 mm Hg。患者呈昏睡状态,双侧瞳孔直径均为0.2 cm,对光反应(+);双侧鼻唇沟对称,伸舌居中,咽反射不合作;颈软,四肢肌张力正常,肌力检查不合作;压眶试验有痛苦表情及各肢体回避动作,右侧活动较左侧减少,双侧肢体腱反射正常,右侧巴宾斯基征可疑(+),脑膜刺激征(-)。
入院后完善相关辅助检查。2015年6月29日血电解质:钠为132 mmol/L,钾为3.52 mmol/L,氯为104 mmo/L;肿瘤标志物:糖类抗原125为40.33 U/mL,糖类抗原724为7.8 U/mL,甲胎蛋白、癌胚抗原、糖类抗原199和神经元特异性烯醇化酶水平均正常;血常规、肝肾功能、甲状腺功能(包括甲状腺素、三碘甲状腺原氨酸、游离甲状腺素、游离三碘甲状腺原氨酸、促甲状腺激素)均正常;自身免疫指标(包括抗核抗体谱、类风湿因子、甲状腺过氧化物酶抗体和促甲状腺激素受体抗体)均位于正常范围内;梅毒相关检测和人类免疫缺陷病毒(human immunodeficiency virus,HIV)检测均为阴性。
2015年7月1日动态脑电图检查发现低电位β波变化(不排除药物因素);胸部计算机断层成像(computed tomography,CT)检查提示双肺多发支气管扩张伴感染、胸腔积液。肝、胆、胰、脾、肾超声检查未见明显异常。单光子发射计算机断层成像(single-photon emission computed tomography,SPECT)检查发现大脑双侧颞叶及额叶见斑片状显像剂摄取减低。2015年7月2日头颅增强磁共振成像(magnetic resonance imaging,MRI)提示双侧额叶皮层下少许腔隙灶(图1A、B)。头颅磁共振血管造影(magnetic resonance angiography,MRA)提示右侧大脑前动脉A1段略纤细,左侧大脑后动脉P2段局灶可疑狭窄(图1C)。
2015年7月2日行腰椎穿刺脑脊液检查,测得脑脊液压力为120 mm H2O(1 mm H2O=9.806 Pa)。脑脊液常规检查:红细胞计数为0×106/L,白细胞计数为8×106/L;脑脊液生化检查:葡萄糖为2.89 mmol/L,氯为122 mmol/L,蛋白为377 mg/L,潘式试验(-);脑脊液免疫学检查:免疫球蛋白G为42.6 mg/L,免疫球蛋白M为0.325 mg/L,免疫球蛋白A为6.15 mg/L;脑脊液肿瘤细胞学检查未见肿瘤细胞;脑脊液寡克隆带(-);脑脊液副肿瘤抗体(包括抗Hu、抗Yo、抗Ri、抗Ma2、抗CV2、抗amphiphysin、抗ANNA-3、抗Tr、抗PCA-2、抗GAD)检测均(-)。自身免疫性脑炎相关抗体检测:脑脊液抗LGI1抗体(+),效价为1∶3.2;同步血清抗LGI1抗体(+),效价为1∶32;其余脑脊液及同步血清抗N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)、抗α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,AMPA)1型和2型抗体、抗接触蛋白相关蛋白2(contactin-associated protein 2,Caspr2)抗体、抗γ-氨基丁酸(γ-amino-hutyric acid,GABA)B受体抗体均为(-)。
该患者最终诊断为抗LGI1抗体相关LE。2017年7月4日开始接受丙种球蛋白冲击治疗[30 g(0.4 g·kg-1·d-1)]静脉滴注,1次/d,连续5 d。同时,联合地塞米松20 mg/次静脉滴注,1次/d,连续5 d;之后,地塞米松减量至10 mg/次静脉滴注,1次/d,连续5 d;之后,改为醋酸泼尼松片口服20 mg/次,1次/d。自2015年6月28日起给予左乙拉西坦抗癫痫治疗(500 mg/次,2次/d)。
丙种球蛋白治疗5 d后,患者病情明显好转,由昏睡转至嗜睡;癫痫发作得到有效控制,无大发作发生,时有发作性凝视,每次维持数秒钟,FBDS由10余次/d减少至1~3次/d。2017年7月12日出院。
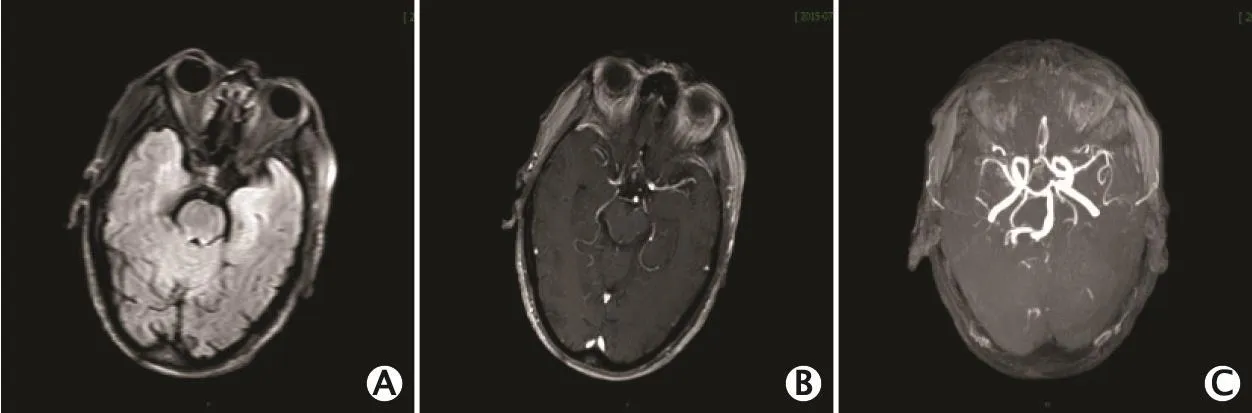
图1 1例抗富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated 1,LGI1)抗体相关边缘性脑炎(limbic encephalitis,LE)患者神经影像学表现。A、B:2015年7月2日增强磁共振成像(magnetic resonance imaging,MRI)提示双侧额叶皮质下少许腔隙灶。C:磁共振血管造影(magnetic resonance angiography,MRA)提示右侧大脑前动脉A1段略纤细,左侧大脑后动脉P2段局灶可疑狭窄。
患者出院后病情平稳,继续醋酸泼尼松片口服20 mg/次(1次/d),同时联合左乙拉西坦口服500 mg/次(2次/d)。出院1个月后随访,患者自诉偶有肢体发作性抖动,每次持续数秒钟,仍遗留认知障碍。
1.2 病例2
患者,男性,71岁,因“反复跌倒伴左侧肢体时有抽动4个月”于2015年10月8日收住上海交通大学医学院附属仁济医院神经内科病房。
患者2015年6月2日无明显诱因下出现发作性左面部及左上肢抽动样发作,每次持续数秒钟自行缓解,自测血压过高(收缩压为200 mm Hg,舒张压为100 mm Hg),当日至外院就诊并收入心内科病房。2015年6月3日晨再次出现类似发作,6月4日行头颅MRI检查提示右侧基底节区微量出血灶可能,复查头颅CT提示左侧基底节区腔隙脑梗死灶。之后,患者肢体抽动发作频繁,每日发作数次,每次发作持续时间为数秒至1 min。2015年6月15日中午,患者在如厕时突发意识丧失伴跌倒,伴尿失禁,给予地西泮治疗;当晚突发神志不清,双眼向右上翻,测指脉氧饱和度为75%,遂转至重症监护病房,进行气管插管和机械通气,并给予抗癫痫药物(丙戊酸钠、卡马西平,具体药物剂量不详)治疗,并转至神经内科。此后,患者病情好转,并顺利脱机,于2015年7月8日出院。出院后,患者服用丙戊酸钠片200 mg/次,3次/d。2015年7—9月,患者在家期间仍有反复发作性左口角及左上肢抽动,神志清楚,每次发作持续时间约为10余秒,发作频繁,严重时每日发作10~20次。2015年9月初,患者再次出现意识丧失伴跌倒1次,持续时间约为2~3 min;9月28日至上海交通大学医学院附属仁济医院急诊,加用左乙拉西坦口服500 mg/次,2次/d,仍控制欠佳,为进一步诊治于2015年10月8日收入院。患者否认发病前有前驱感染;发病期间精神、胃纳可,二便正常,体质量无明显改变;有情绪低落,夜眠欠佳,夜间睡眠时有不自主手足异常活动。既往有高血压、糖尿病病史,血糖控制欠佳。否认癫痫家族史,否认吸烟、酗酒史。
2015年10月9日入院查体:体温为37.1 ℃,心率为89次/min。神志清晰,构音尚清,反应迟钝,交流困难(双耳聋);眼球活动可,双侧瞳孔等大等圆,直径为0.3 cm,对光反应灵敏;双侧鼻唇沟基本等对,伸舌居中,咽反射正常;颈软,四肢肌张力正常,四肢肌力基本为5级;双侧面部及肢体针刺觉对称,双侧腱反射减弱,双侧巴宾斯基征(+),双侧指鼻及跟膝胫试验(-),闭目难立征(+),阔基底步态,行走或坐位时易倾倒,脑膜刺激征(-)。卧立位血压:卧位收缩压为182 mm Hg,舒张压为64 mm Hg;立位收缩压为166 mm Hg,舒张压为62 mm Hg。简易智力状态检查量表(Mini-Mental State Examination,MMSE)评分为21分(患者为高中文化程度)。
入院后完善各项辅助检查。2015年10月9日血常规检查:白细胞计数为9.6×109/L,血红蛋白为123 g/L;高敏C反应蛋白为53.10 mg/L;空腹血糖为11.11 mmol/L,糖化血红蛋白为9.4%;肿瘤标志物:神经元特异性烯醇化酶为16.42 ng/mL,糖类抗原125、糖类抗原724、甲胎蛋白、癌胚抗原、糖类抗原199和糖类抗原50均位于正常范围内;血电解质:钠为140 mmol/L,钾为3.6 mmol/L,氯为112 mmol/L[2015年10月18日复查血电解质:钠为130 mmol/L(期间未使用利尿剂等可引起血钠降低的药物)];肝肾功能、甲状腺功能正常,自身免疫指标均在正常范围内,梅毒相关检测、HIV检测均为阴性。
2015年9月30日,急诊头颅增强MRI提示左侧基底节腔隙脑梗死(图2A、B)。头颅磁敏感加权成像(susceptibility weighted imaging,SWI)提示左侧基底节区环形低信号影,考虑含铁血黄素沉积(图2C)。2015年10月19日视频脑电图检查提示低电位β波变化(视频中见多次左口角及双上肢抽动发作,每次持续数秒)。2015年10月23日复查头颅增强MRI提示双侧额顶颞部硬膜下积血可能,左侧基底节区腔隙脑梗死(图2D)。头颅MRA提示颅内动脉粥样硬化,双侧大脑后动脉及中动脉M1段多发狭窄(图2E)。2015年10月30日头颅CT提示双侧额顶颞部硬膜下积液伴左侧少量积血可能(图2F)。该患者家属拒绝行腰椎穿刺脑脊液检查。2015年10月20日血清自身免疫性脑炎相关抗体检测:抗LGI1抗体(++),效价为1∶32;副肿瘤抗体检测均为(-)。
患者入院后继续口服左乙拉西坦500 mg/次(2次/d),同时给予口服美多芭0.125 g/次(3次/d)、左洛复50 mg/次(1次/d)。住院期间未见明显意识丧失及肢体强直阵挛样发作,但睡眠时多次发生发作性左侧肢体肌阵挛样发作,每次发作持续数秒;仍有跌倒,行走困难较入院前加重;睡眠差,多浅睡,易惊醒,睡眠中有不自主动作。因血清抗LGI1抗体检测(+),考虑患者为抗LGI1抗体相关LE,遂于2015年10月21日起接受丙种球蛋白[27.2 g(0.4 g·kg-1·d-1)]冲击治疗,1次/d,连续治疗5 d。因患者住院期间血糖控制欠佳,因此未予激素治疗。丙种球蛋白冲击治疗后第3天,患者症状即有所改善,表现为FBDS频率明显减少,从20~30次/d下降至约10次/d,夜间睡眠较前好转,睡眠时异常行为动作减少。然而,由于多次跌倒发作,患者发生迟发性硬膜下血肿,且住院期间复查头颅CT显示双侧硬膜下血肿明显扩大,遂于2015年12月7日转神经外科行硬膜下血肿清除术。
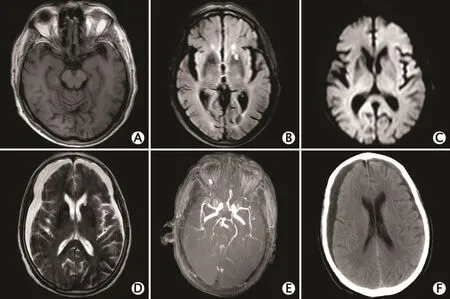
图2 1例抗富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated 1,LGI1)抗体相关边缘性脑炎(limbic encephalitis,LE)伴硬膜下血肿患者神经影像学表现。A、B:2015年9月30日头颅增强磁共振成像(magnetic resonance imaging,MRI)提示左侧基底节腔隙脑梗死;C:头颅磁敏感加权成像(susceptibility weighted imaging,SWI)提示左侧基底节区环形低信号影,考虑含铁血黄素沉积;D:10月23日复查头颅MRI增强提示双侧额顶颞部硬膜下积血可能,左侧基底节区腔隙脑梗死;E:头颅磁共振血管造影(magnetic resonance angiography,MRA)提示颅内动脉粥样硬化,双侧大脑后动脉及中动脉M1段多发狭窄;F:2015年10月30日头颅CT提示双侧额顶颞部硬膜下积液伴左侧少量积血可能。
由于患者转至神经外科接受手术治疗,因此未能获得患者的门诊随访信息。2个月后电话随访患者,自诉术后恢复良好,未使用激素和抗癫痫药物,但仍有FBDS(1~2次/d),步态及睡眠情况均较前好转。
1.3 病例3
患者,女性,51岁,因“认知功能下降伴精神行为异常半年”于2017月2月8日收住上海交通大学医学院附属仁济医院神经内科病房。
患者于2016年7月无明显诱因下出现头痛、头晕,呈顶部轻微胀痛,无视物旋转,其间发生一次不明原因发热,体温达38 ℃,无鼻塞咽痛,无咳嗽咳痰,未治疗即自行热退。2016年9月开始出现记忆力减退,贪睡,间歇性肢体抖动,有时抖动后伴有胡言乱语;11月开始出现性格改变,情绪低落,少言寡语,发作性脾气暴躁,反应迟钝,有自言自语、阵发性惊恐样发作、阵发性面部或肢体“紧张样抖动”,每次持续10余秒后可自行缓解,最多20余次/d。2016年12月至外院诊治,给予西酞普兰联合重酒石酸卡巴拉汀(具体剂量不详)治疗,但症状无好转,每日仍发作数十次。为进一步诊治,2017年2月6日就诊于上海交通大学医学院附属仁济医院神经内科门诊,并于2月8日收入院。患者从事医院保洁工作,既往体健,否认高血压、糖尿病等慢性病史。发病以来精神胃纳可,夜眠欠佳,无明显消瘦。
2016年2月9日入院查体:心率为72次/min,收缩压为115 mm Hg,舒张压为70 mm Hg;神志清楚,对答部分切题,定时定向可,计算力稍差,近事记忆力减退;双侧瞳孔直径均为0.25 cm,对光反应灵敏,眼动充分;双侧鼻唇沟对称,伸舌居中;颈软,四肢肌张力正常,肌力为5级,四肢轻瘫试验(-);双侧指鼻及跟膝胫试验(-),双侧腱反射对称,双侧面部及肢体针刺觉对称,双侧病理征(-),脑膜刺激征(-)。认知评估:MMSE评分为22分,蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评分为12分(患者为初中文化程度)。
入院后完善各项辅助检查。2016年2月9日血电解质:钠为130 mmol/L,钾为3.5 mmol/L,氯为110 mmol/L;维生素B为12 168 pg/mL;血常规、肝肾功能、血糖、甲状腺功能、自身免疫抗体、肿瘤标志物、梅毒相关检测、HIV检测均未见明显异常。2016年2月10日完善腰椎穿刺脑脊液检查:脑脊液压力为130 mm H2O;白细胞计数为1×106/L,红细胞计数为1×106/L;蛋白为639 mg/L,糖为4.45 mmol/L,氯为110 mmol/L;免疫球蛋白G为64.8 mg/L,免疫球蛋白A为8.04 mg/L,免疫球蛋白M为1.58 mg/L;细菌、结核菌、真菌涂片培养均为阴性;脑脊液免疫球蛋白G指数为0.6,血脑屏障功能轻度受损,寡克隆区带(-)。血清及脑脊液副肿瘤抗体(包括抗Hu、抗Yo、抗Ri、抗Ma2、抗CV2、抗amphiphysin、抗ANNA-3、抗Tr、抗PCA-2、抗GAD)均为(-)。自身免疫性脑炎相关抗体:脑脊液抗LGI1抗体(+),效价为1∶3.2;血清抗LGI1抗体(+),效价为1∶100;抗NMDA抗体、抗AMPA1型和2型、抗Caspr2抗体、抗GABAB受体抗体均为(-)。
2016年2月9日动态脑电图提示轻度弥漫性异常。胸部CT平扫提示右肺中叶微小结节灶,不考虑肿瘤性病变(图3A)。头颅SPECT检查提示双侧额叶、双侧顶叶血流灌注降低(图3B)。甲状腺以及肝、胆、胰、脾、肾超声和妇科超声检查均未见明显异常。头颅增强MRI及海马MRI平扫检查提示双侧颞叶信号异常,双侧海马头、杏仁体肿胀(图3C、D)。
在完善相关检查后,患者被诊断为抗LGI1抗体相关LE。入院后,给予左乙拉西坦口服500 mg/次,2次/d;2016年2月12日起给予甲基强的松龙500 mg/次静脉滴注(1次/d,连续治疗5 d),之后减量至240 mg/次(1次/d,连续治疗3 d),之后减量至120 mg/次(1次/d,连续治疗3 d),之后减量至80 mg/次(1次/d,连续治疗3 d),然后更换为醋酸泼尼松片口服60 mg/次(1次/d),之后逐渐减量(每2周递减5 mg);2月15日给予丙种球蛋白[22.5 g(0.4 g·kg-1·d-1)]冲击治疗,1次/d,连续治疗5 d。治疗后,患者症状明显好转,口角及肢体抽动明显减少,每日偶有发作,惊恐发作消失,认知功能好转。出院当日(2017年2月28日)复查认知功能:MMSE评分为27分,MoCA评分为23分。出院后,继续口服左乙拉西坦500 mg(2次/d);醋酸泼尼松片60 mg(1次/d),之后逐渐减量(每2周递减5~20 mg)。患者出院1个月后接受门诊随访,认知功能基本好转,MMSE评分为30分,仍略有反应迟钝,癫痫发作完全消失。
1.4 病例小结
3例抗LGI1抗体相关LE患者的诊治资料见表1。
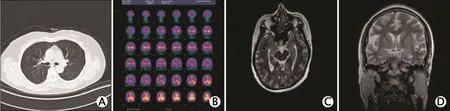
图3 1例抗富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated 1,LGI1)抗体相关边缘性脑炎(limbic encephalitis,LE)患者影像学检查结果。A:胸部计算机断层成像(computed tomography,CT)平扫提示右肺中叶微小结节灶;B:头颅单光子发射计算机断层成像(single-photon emission computed tomography,SPECT)提示双侧额叶、双侧顶叶血流灌注降低;C:头颅增强磁共振成像(magnetic resonance imaging,MRI)轴位液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列提示双侧颞叶信号异常;D:双侧海马MRI平扫冠状位FLAIR检查结果提示双侧海马头、杏仁体肿胀。

表1 3例抗富亮氨酸胶质瘤失活1蛋白(leucine-rich glioma inactivated 1,LGI1)抗体相关边缘性脑炎(limbic encephalitis,LE)患者的诊治情况总结
2 讨 论
抗LGI1抗体相关LE是最常见的电压门控钾离子通道(voltage-gated potassium channel,VGKC)复合物抗体相关LE。2010年,发现VGKC抗体的靶抗原是LGI1(80%~90%)和Caspr2(10%~20%)[5]。
目前,全球已报道超过250例抗LGI1抗体相关LE病例[6]。该病主要见于中年男性,男性与女性患者之比为2∶1,平均发病年龄为60岁[7]。LGI1是突触前膜释放的糖蛋白,可与突触前膜的去整合素金属蛋白酶(a disintegrin and metalloproteinase,ADAM)22和ADAM23结合,从而影响VGKC突触之间的信号传递,并与突触后膜AMPA受体(AMPA receptor,AMPAR)调节相关[8],这种结合是抑制性信号转导的基础。LGI1抗体可阻止LGI1与ADAM相互结合及AMPAR的聚集,引起可逆的中枢神经突触功能障碍。LGI1抗体与LE、癫痫和反复低钠血症有关,与肿瘤相关性较小[9]。
2.1 抗LGI1抗体相关LE的主要临床表现及诊治
2.1.1 癫痫发作及其诊治
癫痫发作是抗LGI1抗体相关LE最常见的临床表现(80%)。癫痫发作可表现为多种形式,包括FBDS、颞叶癫痫发作、全身强直阵挛发作和猝倒发作等。FBDS是LGI1抗体相关LE最常见及特征性的临床表现[3],可由情绪激动和噪音等诱发,特点为短暂、频繁的同侧面部、手臂乃至下肢的肌张力障碍样发作,持续时间通常<3 s,每日发作频率平均高达50次。本文3例病例中,癫痫发作均为病程早期的临床表现。第1例同时有FBDS和强直阵挛发作,且早期仅为FBDS,病程后期出现强直阵挛发作,在病程早期未使用抗癫痫药物治疗,最后一次大发作时在急诊科曾使用丙戊酸钠和地西泮静脉滴注治疗,但FBDS并未减少。第2例表现为FBDS、强直阵挛发作和可疑的猝倒发作,且由于反复跌倒外伤并发硬膜下血肿,口服左乙拉西坦后强直阵挛发作消失,但仍有越来越频繁的FBDS和反复可疑的猝倒发作。第3例单纯表现为FBDS,入院前未使用过抗癫痫药物治疗。这3例在接受免疫治疗后,FBDS发作均显著减少。目前,关于FBDS究竟属于癫痫发作还是锥体外系反应,尚存在争议,其突发突止的发作性、刻板性发作特点均提示为癫痫发作,然而发作形式又与运动障碍和肌张力障碍相似。ANDRADE等[10]通过对3例FBDS患者进行视频脑电图检查,发现在长时程FBDS的起始阶段存在脑电图异常痫性活动,然而在短时发作的FBDS中未发现异常活动,因此认为FBDS是强直性癫痫而非运动障碍。然而,STRIANO[11]指出,FBDS缺少意识改变和发作期脑电图异常(仅一小部分患者表现为异常)、对抗癫痫药物无反应以及无法识别癫痫灶起源,而上述特点均强烈不支持FBDS为癫痫发作,因此将FBDS定义为偏侧的肌张力障碍。BOESEBECK等[12]在1例右侧FBDS患者中发现左侧前额叶内侧和纹状体异常,从而提出FBDS同时起源于皮质和皮质下部位。并且,最近提出的皮质-皮质下神经网络假说[13]可以解释FBDS现象。从本质上来看,额-颞-基底节回路是FBDS的起始和扩布路径,LGI1抗体首先引起基底节病变,继而影响颞叶,从而导致先FBDS、后LE的症状。从额叶皮质至皮质下,再扩布至基底节区,这一扩布路径可以解释一些FBDS在起始时其发作期脑电图的异常改变。肌张力障碍样发作与基底节的扩布相关,皮质受累可以解释一些先兆样发作,后期颞叶受累可以解释肌张力发作后的意识状态改变、恐慌和易激惹等现象,由此可以解释为什么短时程FBDS时脑电图正常而长时程FBDS时却可以出现脑电图的异常改变。如此广泛的皮质和皮质下回路受累也可能是FBDS对抗癫痫药物反应欠佳的原因。本文报告的3例患者中,前2例患者的长时程脑电图检查均显示低电位β波变化,而第3例患者提示为轻度弥漫性异常;导致这一现象的原因可能是,虽然前2例患者均有强直阵挛发作,但由于检查前使用了足量的抗癫痫药物,因此脑电图未监测到明显的痫性放电,而第3例患者虽然只有FBDS,但入院前并未接受抗癫痫治疗,且发作时程偏长,因此脑电图有轻度异常改变。
FBDS对抗癫痫治疗效果欠佳,免疫治疗为其主要治疗方式。2013年报道10例伴FBDS表现的抗LGI1抗体相关脑炎患者接受免疫治疗,其中9例接受类固醇激素治疗(其中4例同时联合丙种球蛋白冲击治疗),1例接受血浆置换;结果显示,3例在1周内癫痫得到完全控制,6例在2个月内癫痫得到完全控制;随访结果显示,4例在激素减量过程中出现癫痫反复发作,予以激素加量后,癫痫得到控制[14]。
本文3例患者中,前2例在发病早期使用抗癫痫药物均疗效欠佳。第1例经免疫治疗(地塞米松、丙种球蛋白)后癫痫基本得到控制;第2例在接受丙种球蛋白冲击治疗后,短期内FBDS次数由数十次/d下降至数次/d;第3例患者早期未使用抗癫痫药物治疗,入院后接受左乙拉西坦、甲基强的松龙和丙种球蛋白治疗,FBDS基本得到控制,偶有短暂发作,门诊随访FBDS完全消失。
2.1.2 认知功能障碍及其诊治
抗LGI1抗体相关LE患者的认知功能障碍主要表现为急性或亚急性出现的近事记忆力下降和定向力障碍[15]。本文3例患者中,第1例在出现明显癫痫发作的1年前即出现反应迟钝、言语不流利等表现,经免疫治疗后仍遗留有明显的认知障碍;第2例患者在病程中未提及明确的认知障碍,但入院后的神经系统查体却发现有认知功能减退(MMSE评分为21分),遗憾的是因转至神经外科行手术治疗而无法进一步随访其认知功能的变化;第3例患者在出现FBDS后2个月开始出现明显的记忆力减退,经治疗后认知功能得到改善,并且在随访期间认知功能进一步好转,可以回归工作岗位。有文献报道,LGI1抗体相关LE的认知功能障碍通常起病隐匿,并且与LGI1抗体相关LE病程相关。MAJOIE等[16]指出,LGI1抗体相关LE病程中最易出现记忆和语言流利性障碍。
2.1.3 精神障碍及其诊治
精神障碍主要表现为人格改变和行为障碍,有易激惹、焦虑、强迫等行为,一些患者还伴有情感障碍和幻视、幻听等症状。以这些症状起病的患者往往会延误治疗,因为其通常先就诊于精神科[7,15]。本文报告的第1例患者在癫痫起病的1年前就已出现性格改变、懒言少语、行为异常等表现,但未引起家人重视;第3例患者在病程中出现性格改变、自言自语,并在入院前曾就诊于精神科,使用过西酞普兰等抗抑郁治疗。经免疫治疗后,精神症状可好转或消失。由此可见,精神障碍也是抗LGI1抗体相关LE的主要临床表现,从某种程度上也反映了疾病的严重程度[7]。
2.2 辅助检查
2.2.1 血清及脑脊液抗体
与既往研究发现一致,本文中3例患者的脑脊液检查均未见白细胞计数明显增多、蛋白含量明显增加(仅第3例的蛋白含量轻度增加)及寡克隆区带[3]。脑脊液LGI1抗体阳性是抗LGI1抗体相关LE的特异性标志,是诊断金标准。VINCENT等[17]报道,脑脊液VGKC抗体值是血清抗体值的1%~10%。此外,在非典型LE临床表现的患者中,也同样检测到血清LGI1抗体。因此,检测脑脊液LGI1抗体而非血清LGI1抗体更能提高诊断的准确性[18]。随着免疫治疗后病情的好转,抗体效价降低;如病情反复,抗体效价可再次升高。LGI1抗体阳性合并肿瘤的概率不足10%,少数病例合并胸腺瘤或肺癌,部分病例为LGI1抗体同时合并副肿瘤抗体(如抗Yo抗体)阳性,因此该抗体阳性虽不提示副肿瘤性脑炎,但相关的肿瘤筛查还是很有必要的,特别是老年患者或对免疫治疗效果欠佳的患者[19]。本文报告的第1例患者同时检测了脑脊液和血清LGI1抗体,效价分别为1∶3.2和1∶32,脑脊液LGI1抗体效价是血清LGI1抗体的10%;第2例患者未行脑脊液检查,血清LGI1抗体效价为1∶32;第3例患者脑脊液和血清LGI1抗体效价分别为1∶3.2和1∶100,脑脊液LGI1抗体效价是血清LGI1抗体的3%。遗憾的是,这3例患者出院后均未复查LGI1抗体效价,因此无法随访到病情改善后抗体效价的下降水平。此外,本文报告的3例患者的入院后相关辅助检查及随访期间的检查,均未发现有潜在的肿瘤性病变。
2.2.2 低钠血症
低钠血症是LGI1抗体相关LE的一个特征性实验室表现,与抗利尿激素异常分泌有关[20-21],报道发生率为60%~88%[3]。本文报告的3例患者中,第1例和第3例入院时电解质检查均提示低钠血症,第2例患者入院时首次查血钠水平正常,但在随后的复查中同样发现低钠血症。低钠血症的发病机制与LGI1抗体在下丘脑和肾脏的协同表达有关,通常表现为轻至中度血钠水平降低且血钠水平不难纠正[22]。
2.2.3 影像学表现
LGI1抗体相关LE患者头颅MRI大多可见单侧或双侧颞叶内侧(杏仁体和海马)异常信号,部分可见杏仁体肥大,以T2液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列更为敏感,部分患者可见基底区异常信号[6]。IRANI等[14]研究显示,即使急性期头颅MRI显示脑和海马区均无异常信号,但在恢复后的随访期间仍可发现患者的脑和海马体积明显小于匹配的正常对照者,由此认为抗LGI1抗体相关LE导致了脑萎缩的发生。本文报告的前2例患者的头颅MRI未提示双侧颞叶病变,其中第2例患者左侧基底节区有异常信号,第3例患者双侧颞叶信号异常,海马冠状位MRI提示双侧海马和杏仁体肿大。近年来,国外报道氟代脱氧葡萄糖正电子发射计算机断层成像(fluorodeoxyglucose positron emission tomography,FDG-PET)检查阳性率可达90%,比MRI更为敏感,尤其是在疾病早期。除颞叶内侧外,基底节区异常代谢亦多见[23]。
2.3 治疗及预后
抗LG1抗体相关LE主要推荐免疫治疗,包括丙种球蛋白、大剂量糖皮质激素和血浆置换。糖皮质激素联合静脉注射用免疫球蛋白的疗效优于单用糖皮质激素,血清抗体效价可以作为疗效的检测指标之一。免疫治疗的总体预后良好。常见的癫痫发作类型,尤其是FBDS的好转快于认知功能障碍的改善[6]。抗LGI1抗体相关LE的二线治疗数据有限,曾报道使用利妥昔单抗治疗5例抗LG1抗体脑炎病例,仅1例得到临床改善[24]。抗LGI1抗体脑炎复发率为0%~20%,临床上的二次复发往往发生在首次发作7年之后,因此需要进行更长期的追踪随访[2,19]。本文报告的3例患者经免疫治疗后(糖皮质激素联合丙种球蛋白,其中第2例患者因严重糖尿病而未使用糖皮质激素)均取得了显著的疗效,随访期间未见病情波动及复发。本课题组将继续对这3例患者进行追踪随访。
综上所述,通过对3例抗LGI1抗体相关LE病例临床病程的介绍及相关文献复习,有助于提高临床上对该病特征性表现的认识,尤其是在FBDS为主要表现或唯一临床表现时,需要第一时间考虑该病的可能性,并早期进行诊断和治疗,从而提高患者的预后。
[1]BUCKLEY C, OGER J, CLOVER L,et al.Potassium channel antibodies in two patients with reversible limbic encephalitis[J].Ann Neurol, 2001, 50(1):73-78.
[2]VAN SONDEREN A, SCHREURS MW,WIRTZ PW,et al. From VGKC to LGI1 and Caspr2 encephalitis: the evolution of a disease entity over time[J].Autoimmun Rev, 2016,
15(10):970-974.
[3]IRANI SR, MICHELL AW, LANG B,et al.Faciobrachial dystonic seizures precede Lgi1 antibody limbic encephalitis[J].Ann Neurol,2011, 69(5):892-900.
[4]IRANI SR, STAGG CJ, SCHOTT JM,et al.Faciobrachial dystonic seizures: the influence of immunotherapy on seizure control and prevention of cognitive impairment in a broadening phenotype[J].Brain, 2013, 136(Pt 10):3151-3162.
[5]IRANI SR, ALEXANDER S, WATERS P,et al. Antibodies to Kv1 potassium channelcomplex proteins leucine-rich, glioma inactivated 1 protein and contactin-associated protein-2 in limbic encephalitis, Morvan’s syndrome and acquired neuromyotonia[J].Brain,2010, 133(9):2734-2748.
[6]SHIN YW, LEE ST, SHIN JW,et al. VGKC-complex/LGI1-antibody encephalitis:clinical manifestations and response to immunotherapy[J].J Neuroimmunol, 2013,265(1-2):75-81.
[7]LI Z, CUI T, SHI W,et al. Clinical analysis of leucine-rich glioma inactivated-1 protein antibody associated with limbic encephalitis onset with seizures[J/OL].Medicine (Baltimore),2016, 95(28):e4244(2016-07-01)[2017-09-15].DOI:10.1097/MD.0000000000004244.
[8]LAI M, HUIJBERS MG, LANCASTER E,et al. Investigation of LGl1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series[J].Lancet Neurol, 2010,9(8):776-785.
[9]WANG M, CAO X, LIU Q,et al. Clinical features of limbic encephalitis with LGI1 antibody[J].Neuropsychiatr Dis Treat, 2017,13:1589-1596.
[10]ANDRADE DM, TAI P, DALMAU J,et al.Tonic seizures: A diagnostic clue of anti-LGI1 encephalitis?[J].Neurology. 2011, 76(15):1355-1357.
[11]STRIANO P. Faciobrachial dystonic attacks:seizures or movement disorder?[J].Ann Neurol,2011, 70(1):179-180.
[12]BOESEBECK F, SCHWARZ O, DOHMEN B,et al. Faciobrachial dystonic seizures arise from cortico-subcortical abnormal brain areas[J].J Neurol, 2013, 260(6):1684-1686.
[13]IYER RS, RAMAKRISHNAN TCR,KARUNAKARAN,et al. Faciobrachial dystonic seizures result from fronto-temporobasalganglial network involvement[J].Epilepsy Behav Case Rep, 2017, 8:47-50.
[14]IRANI SR, STAGG CJ, SCHOTT JM,et al.Faciobrachial dystonic seizures: the influence of immunotherapy on seizure control and prevention of cognitive impairment in a broadening phenotype[J].Brain, 2013, 136(Pt 10):3151-3162.
[15]PATERSON RW, ZANDI MS, ARMSTRONG R,et al. Clinical relevance of positive voltagegated potassium channel (VGKC)-complex antibodies: experience from a tertiary referral centre[J].J Neurol Neurosurg Psychiatr, 2014,85(6):625-630.
[16]MAJOIE HJ, DE BAETS M, RENIER W,et al. Antibodies to voltage-gated potassium and calcium channels in epilepsy[J].Epilepsy Res,2006, 71(2-3):135-141.
[17]VINCENT A, BUCKLEY C, SCHOTT JM,et al. Potassium channel antibody-associated encephalopathy: a potentially immunotherapyresponsive form of limbic encephalitis[J].Brain,2004, 127(Pt 3):701-712.
[18]LANCASTER E, DALMAU J. Neuronal autoantigens-pathogenesis, associated disorders and antibody testing[J].Nat Rev Neurol, 2012,8(7):380-890.
[19]MALTER MP, FRISCH C, SCHOENE-BAKE JC,et al. Outcome of limbic encephalitis with VGKC-complex antibodies: relation to antigenic specificity[J].J Neurol, 2014, 261(9):1695-1705.
[20]LAI M, HUIJBERS MG, LANCASTER E,et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series[J].Lancet Neurol, 2010,9(8):776-785.
[21]ANDRADE DM, TAI P, DALMAU J,et al.Tonic seizures: a diagnostic clue of anti-LGI1 encephalitis?[J].Neurology, 2011, 76(15):1355-1357.
[22]VINCENT A. Developments in autoimmune channelopathies[J].Autoimmun Rev, 2013,12(6):678-681.
[23]PARK S, CHOI H, CHEON GJ,et al.18F-FDG PET/CT in anti-LGI1 encephalitis:intial and follow-up findings[J].Clin Nucl Med,2015, 40(2):156-158.
[24]IRANI SR, GELFAND JM, BETTCHER BM,et al. Effect of rituximab in patients with leucine-rich, glioma-inactivated 1 antibodyassociated encephalopathy[J].JAMA Neurol,2014, 71(7):896-900.

