24例神经梅毒回顾性分析
施国文,李仁刚,顾海燕
1. 上海交通大学医学院附属仁济医院神经内科,上海 200126
2. 上海交通大学医学院附属仁济医院病案科,上海 200126
3. 上海交通大学医学院附属仁济医院影像科,上海 200126
神经梅毒是梅毒螺旋体感染神经系统而导致的疾病。由于该病的临床表现没有特异性,且患者倾向于隐瞒相关病史,因此临床误诊时有发生,而神经梅毒早期诊断和治疗对改善患者的预后颇为重要。本研究对上海交通大学医学院附属仁济医院神经内科收治的24例神经梅毒患者的临床资料进行回顾性分析,探讨疾病的临床表现和实验室指标及影像学表现等,以期为及时而准确地诊断神经梅毒提供临床参考,从而减少神经梅毒的临床误诊。
1 资料与方法
1.1 病例选择标准
收集2013年1月—2017年1月上海交通大学医学院附属仁济医院神经内科收治的具有神经系统症状的梅毒患者125例,其中通过脑脊液检查明确诊断为神经梅毒的患者24例。所有神经梅毒患者均符合《2015年美国疾病控制中心性传播疾病诊断和治疗指南(续)——梅毒的诊断和治疗指南》[1]中的诊断标准:(1)血清学检查阳性;(2)有神经系统症状及体征;(3)脑脊液检查异常[细胞计数或蛋白测定结果异常,以及脑脊液性病研究实验室实验(venereal disease research laboratory test,VDRL)阳性]。
1.2 实验室诊断方法和辅助检查
入院后,所有患者均接受血清梅毒螺旋体明胶颗粒凝集试验(treponema pallidum particle assay,TPPA)和非梅毒螺旋体抗原血清试验——甲苯胺红不加热血清试验(tolulized red unheated serum test,TRUST)。如果试验结果为阳性,则进行脑脊液TPPA和梅毒螺旋体血凝试验——快速血浆反应素试验(rapid plasma regain test,RPR)。脑脊液TPPA和RPR阳性者,还需完善头颅和脊髓的电子计算机断层成像(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)和磁共振血管成像(magnetic resonance angiography,MRA)检查,部分患者还接受了神经心理测评。
1.3 观察指标
收集24例神经病毒患者的年龄、性别、既往史、临床表现、临床表型、脑脊液检查、影像学检查、诊断和治疗资料。
1.4 统计学方法
进行描述性统计分析。
2 结 果
2.1 一般资料
24例患者中,2013年收治2例,2014年收治4例,2015年收治7例,2016—2017年收治11例;男性21例,女性3例;中位年龄为55岁(范围:28~75岁);均已婚;否认吸毒史、冶游史、输血史;均未感染人类免疫缺陷病毒(human immunodeficiency virus,HIV)。
明确诊断时间为入院后3~10 d。入院前,部分患者曾被误诊为脑血管病、脑膜脑炎、重症肌无力、吉兰-巴雷综合征、急性脊髓炎、老年性痴呆等。
2.2 临床表现
首发临床表现为癫痫者3例,表现为癫痫频发;麻痹型痴呆者3例,表现为记忆力下降、反应迟钝,简易智力状态检查量表(Mini-Mental State Examination,MMSE)评分≤20分;脑血管病样发作者5例,表现为偏身肢体乏力,行走不稳,言语不能,吞咽困难等;有脊髓症状者5例,表现为双下肢乏力,行走不稳。24例神经病毒患者的临床表现、临床分型及辅助检查结果见表1。
2.3 实验室检查结果
24例神经病毒患者血清TRUST均为阳性,效价为1∶1~1∶256;血清TPPA均为阳性,效价均>1∶80。脑脊液TPPA均为阳性。21例患者的脑脊液细胞计数异常;红细胞计数最高为385×106/L,中位数为1.5×106/L;白细胞计数最高为250×106/L,中位数为16.5×106/L。脑脊液蛋白含量正常4例,脑脊液蛋白含量>1 000 mg/L者7例,450~1 000 mg/L者13例,蛋白含量中位增加值为797.0 mg/L。
2.4 神经心理测评结果
3例患者神经心理检测异常,表现为MMSE评分或蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评分下降。
2.5 影像学检查结果
所有患者均接受头颅和脊髓CT及MRI检查。24例神经梅毒患者的影像学表现多样(图1),其中腔隙脑梗死10例,血管狭窄、变细、不显影5例,核团异常信号1例,脊髓感染性肉芽肿1例,脊髓异常信号1例,脑叶异常信号2例,急性脑梗死3例,脑出血1例,脑萎缩及海马萎缩2例,颅内无异常表现4例。
2.6 治疗
24例神经病毒患者在明确诊断后,均即刻接受青霉素钠盐治疗(水剂青霉素钠盐静脉注射320万U/次,1次/4 h,连续治疗1~2周),然后改为长效青霉素肌内注射。治疗后,患者症状均有不同程度的改善。治疗过程中均未观察到赫克斯海默尔反应(Jarisch-Herxheimer reaction)。
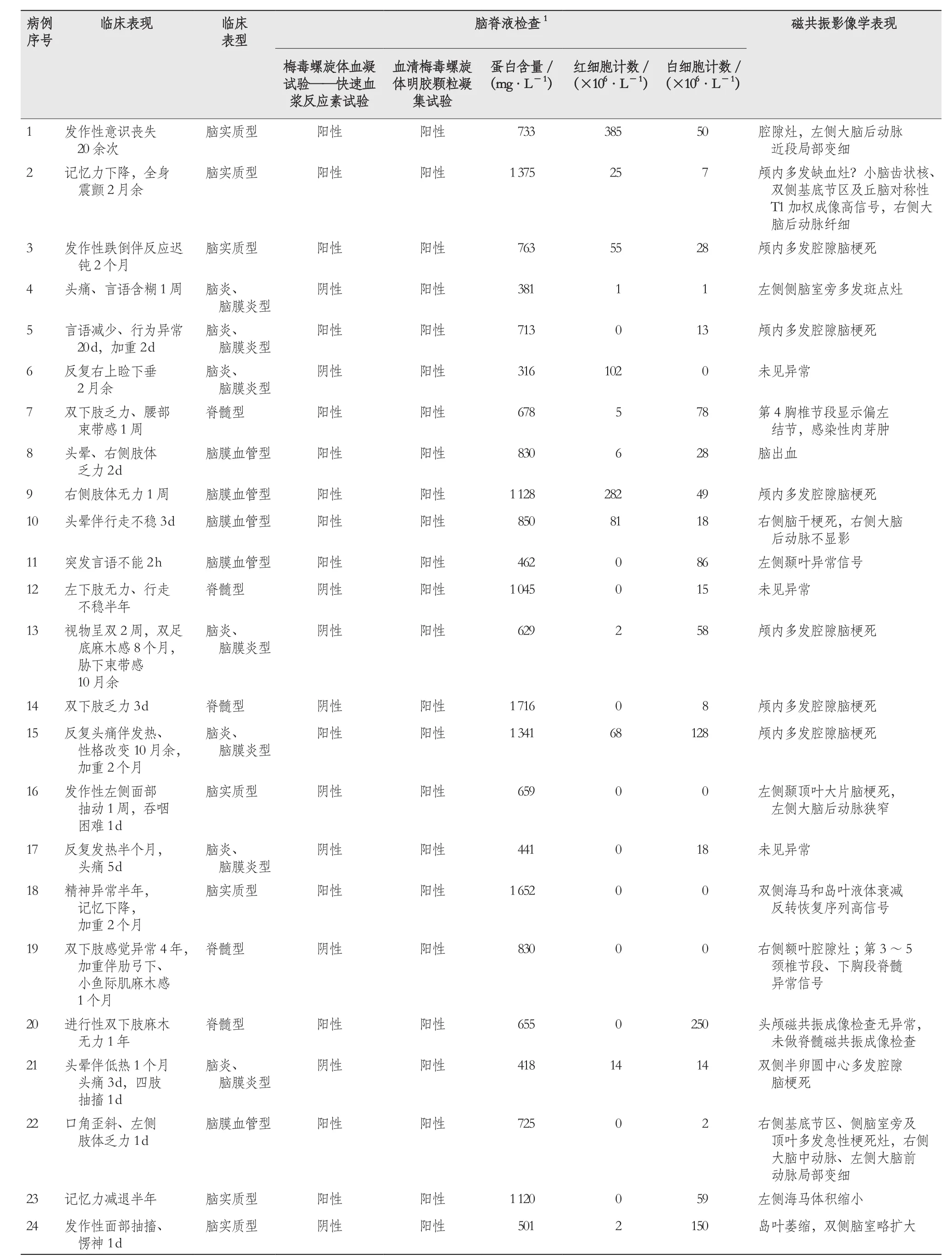
表1 24例神经梅毒患者的临床表现、临床分型及辅助检查结果
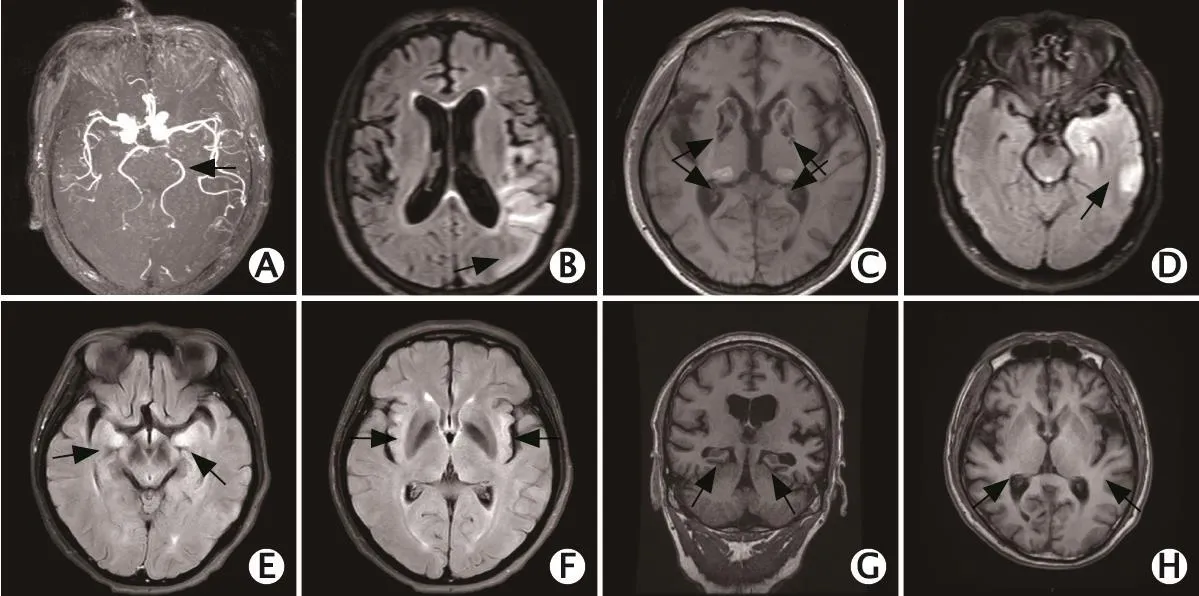
图1 神经梅毒患者常见影像学异常表现。A、B:1例64岁男性患者,发作性左侧面部抽动1周,吞咽困难1 d,头颅磁共振成像显示左侧颞顶叶大片脑梗死,左侧大脑后动脉狭窄。C:1例57岁男性患者,记忆力下降,全身震颤2月余,头颅磁共振成像显示双侧基底节区及丘脑对称性T1加权成像高信号。D:1例48岁男性患者,突发言语不能2 h,头颅磁共振成像显示左侧颞叶异常信号。E、F:1例38岁男性患者,精神异常半年,头颅磁共振成像显示双侧海马及岛叶高信号。G:1例53岁男性患者,记忆力减退半年,头颅磁共振成像显示海马萎缩。H:1例45岁男性患者,发作性面部抽搐、愣神1 d,头颅磁共振成像显示岛叶萎缩,双侧脑室略扩大。
3 讨 论
自20世纪90年代起,随着中国性病发病率的上升,在临床上开始观察到神经梅毒,其发病率逐年递增。本组24例神经梅毒患者中,男性人数明显多于女性,这与荷兰一项流行病学调查[2]的结果相似。中国迄今为止还缺少神经梅毒发病率的确切数据。由于神经梅毒的临床表现复杂多变,且患者经常隐瞒冶游史,因此容易导致误诊,据统计神经梅毒误诊率可高达73.3%[3]。重视和认识神经梅毒的临床表现、实验室检查和影像学表现,对于神经梅毒的防治十分重要。
神经梅毒的发病机制是梅毒螺旋体侵犯神经系统。梅毒螺旋体可存在于患者的皮肤、血液、精液、乳汁和唾液中,其主要传播途径是性传播和垂直传播(即母体通过胎盘、脐带传播给胎儿),通过输血和密切接触也可被传染。梅毒螺旋体进入血液后产生螺旋体血症,通过血行播散进入神经系统而引起脑膜梅毒和实质型梅毒。在梅毒螺旋体感染后10~21 d,机体可产生中和抗体,此抗体不能限制梅毒螺旋体的繁殖和扩散。当机体细胞免疫功能下降时,易导致梅毒进展,迅速出现症状;而当机体细胞免疫功能正常时,梅毒进展缓慢,甚至可以终生无症状[4]。神经梅毒的基本病理机制是脑(脊)膜的炎症和小动脉的血管内膜炎,主要是淋巴细胞和浆细胞浸润滋养血管和外膜,最终亦可累及中动脉和大动脉的血管平滑肌和中层弹力纤维,导致血管腔逐渐变窄,最终引起血栓形成。
根据梅毒螺旋体侵犯部位不同,神经梅毒可分为5种主要的临床类型:(1)无症状型神经梅毒;(2)脑脊膜梅毒(包括梅毒性脑膜炎、梅毒性硬脊膜炎);(3)脑脊膜血管梅毒(包括脑血管梅毒、脊髓脑膜血管梅毒);(4)实质型神经梅毒(包括麻痹性痴呆、脊髓痨、视神经梅毒);(5)神经系统树胶肿[5]。NAGAPPA等[6]根据患者的临床表现及神经系统检查结果,将其分为以下5种临床表型:(1)脑实质型,主要表现为行为认知障碍、癫痫发作等神经精神症状;(2)脑炎、脑膜炎型,主要表现为头痛、发热、视力下降、精神紊乱等;(3)脑膜血管型,表现为由于局灶性缺血引起的神经系统变化,如卒中、行为紊乱和性格改变等;(4)脊髓型,主要症状为脊髓病变引起的功能障碍,表现为胸背部疼痛伴束带感、双上肢及双下肢功能及感觉异常等;(5)无症状型,即无任何神经系统症状。以上临床表现如发生重叠,则以其最突出的临床表现进行分型。与传统分型相比,NAGAPPA等[6]的方法更适合临床操作。本组患者按NAGAPPA等[6]的方法确定临床表型。脑实质型神经梅毒可引起癫痫和麻痹性痴呆,本组资料中有3例患者首发症状为癫痫频繁发作。以癫痫或癫痫持续状态为首发症状的神经梅毒,目前在中国的报道还不多,国外报道其比例为14%~60%[7-8],其中约2/3的患者可出现周期性单侧痫样放电。本组患者中有3例表现为记忆力下降、行为异常、言语功能障碍而诊断为麻痹型痴呆。麻痹型痴呆常见临床表现包括记忆力障碍、人格改变、情感障碍、感知障碍和言语障碍,并呈逐渐进展趋势,最终出现全面的认知功能减退[9],临床上容易误诊为老年性痴呆或血管性痴呆。因此,进展性痴呆或伴有精神情感异常的患者,应注意询问有无冶游史、皮肤性病史,及时进行血清梅毒抗体筛查。脑炎、脑膜炎型神经梅毒表现为头痛、意识水平轻度下降,如果侵犯眼神经或其他颅神经可出现相应体征。本组患者中,4例伴有头痛或意识水平改变,1例表现为反复发作性右眼睑下垂,1例出现视物成双提示有颅神经损害。脑膜血管型神经梅毒引起的脑部急性局灶性损害表现为卒中样发作,其临床表现很难与动脉粥样硬化导致的卒中相鉴别。本组患者中有5例类似患者,其中第11例为中年男性,表现为急性起病,突发言语不能2 h,头颅MRI检查可见颞叶急性病灶,急诊医师误诊为急性脑梗死而给予静脉溶栓治疗。入院后,血清TRUST和TPPA均为阳性,进一步检查脑脊液而明确诊断。脊髓型神经梅毒(亦称脊髓痨)起病多隐袭,其典型三联征包括闪电样疼痛、感觉障碍和尿潴留,特征性表现为脊髓后束损害,表现为步态不稳、踩棉花样感,也可出现截瘫、神经根痛等症状。据报道,脊髓痨占神经梅毒的11.1%[10]。本组患者中有5例脊髓型,表现为双下肢无力、腰部束带感等。无症状型神经梅毒无任何神经系统异常表现,仅有梅毒血清学试验阳性和脑脊液实验室检查异常;由于无症状,因此患者不会主动就诊,也不会进行脑脊液检查,所以常被漏诊。本组患者中,未发现无症状型神经梅毒。由此可见,神经梅毒的临床表现复杂多样,单纯依靠临床表现无法确诊。除此之外,还有其他一些病变表现,如梅毒性树胶肿等,因其影像学表现更像占位性病变,所以也易被漏诊或误诊。
神经梅毒影像学表现通常缺乏特异性,常见的影像学异常表现包括脑萎缩、白质病变、肉芽肿、皮质或皮质下梗死、脑膜强化及动脉炎等。临床常见脑膜炎型和脑膜血管型,其MRI表现为双侧顶叶、额叶、颞叶及基底节区点、片状的稍长T1、长T2加权成像信号,病灶呈散在分布,可符合或不符合血管分布路径,大多数病灶不强化,可累及皮质和核团[11]。2014年,向涛等[12]报告了7例伴颞叶病变的神经梅毒的MRI影像学特点,显示病变多累及单侧或双侧颞叶内侧、海马、外侧颞叶和岛叶等部位,通常不对称,病变多呈长T1、长T2加权成像信号,液体衰减反转恢复序列呈高信号,多无明显强化;其病理生理机制可能是梅毒螺旋体早期易在厌氧条件下增殖,随血流易定植在较小血管内,使小血管管壁塌陷、闭塞,继而导致颞叶、额叶、顶叶和边缘系统(海马、基底节和丘脑)等部位脑血流量减少,其中尤以颞叶最为明显。这些影像学表现与病毒性脑炎和自身免疫性脑炎的影像学表现相似,因此单凭影像学表现不足以确定其病因,需要借助其他辅助资料,如病史和实验室检查等予以鉴别。脑梅毒性肉芽肿可以发生在脑的任何部位,形成树胶肿。大的树胶肿有占位效应,CT检查显示病灶呈低或等密度,可有环形强化灶,MRI检查显示T1加权成像可以是低、高、等或混杂信号,需要与肿瘤性疾病进行鉴别。本研究未纳入此类患者,推测原因可能是由于肿瘤样病变患者通常会至其他科室就诊,而未就诊于神经内科。
血清和脑脊液免疫学指标是诊断神经梅毒的关键指标。免疫学检查包括梅毒非特异性抗体检测和梅毒确诊试验。非梅毒螺旋体抗体效价可能与疾病活动度相关,并可用于预后评估;而梅毒螺旋体抗体在大多数患者体内可呈终身阳性,与治疗无关。在临床实践中,这2种检测结果均为阴性即可排除梅毒可能;这2种检测结果均为阳性即提示现症感染;非梅毒螺旋体抗体检测阴性而梅毒螺旋体抗体检测阳性,则提示既往感染。因此,联合应用2种检测方法,可以较好地避免梅毒的漏报、误报和误诊。常用的检测方法包括RPR、VDRL、TRUST、TPPA、荧光密螺旋体抗体吸收试验(fluorescent treponemal antibodyabsorption test,FTA-ABS)和梅毒螺旋体血球凝集试验(trepomema palidum hemagglutination assay,TPHA)[13]。本组患者的血清免疫学检测方法为TRUST和TPPA,脑脊液免疫学检测方法为RPR和TPPA。除此以外,脑脊液生化指标异常可以作为神经梅毒的辅助诊断标准。神经梅毒患者脑脊液常规检查可见压力正常或轻度升高,细胞计数轻度增加且以淋巴细胞为主,蛋白含量轻至中度增加,糖和氯化物含量正常,部分患者的寡克隆区带免疫球蛋白G为阳性。
迄今为止,神经梅毒的诊断标准并不统一。根据《2015年美国疾病控制中心性传播疾病诊断和治疗指南(续)——梅毒的诊断和治疗指南》中的诊断标准,脑脊液检查包括脑脊液细胞计数、蛋白含量测定和脑脊液VDRL。脑脊液VDRL诊断神经梅毒的特异度高,但灵敏度低。如果患者有神经系统症状及体征,脑脊液VDRL阳性,在排除血液污染后,即可诊断为神经梅毒。如果脑脊液VDRL阴性、患者有神经梅毒的症状和体征、梅毒血清学检查结果阳性时,如果脑脊液细胞计数或蛋白含量测定结果为异常,则考虑诊断为神经梅毒。
4 小 结
综上所述,神经梅毒的临床表现复杂多样,影像学表现缺乏特异性,加之患者倾向于隐瞒相关病史,致使此类疾病极易被误诊。临床上常将脑炎、脑膜炎型神经梅毒误诊为病毒性脑膜炎、边缘性脑炎、自身免疫性脑炎、结核性脑膜炎和隐球菌性脑膜炎等;将脑膜血管型误诊为急性卒中等;将脑实质型神经梅毒误诊为阿尔茨海默病、血管性痴呆等;将脊髓型神经梅毒误诊为脊髓炎等;梅毒性树胶肿容易被误诊为占位性病变或脓肿。除此以外,神经梅毒还可表现为帕金森综合征,类似于进行性核上性麻痹、皮质基底节变性和舞蹈病的症状,部分患者还可出现肌阵挛和小脑共济失调等,亦有部分患者出现听力障碍或视神经萎缩,易被误诊为临床表现相似的相关疾病。因此,诊断时应同时结合患者的临床表现、影像学表现、血清及脑脊液生化和免疫指标进行综合判断,以提高神经梅毒诊断的准确率。为防止误诊或漏诊神经梅毒,建议对患者常规进行梅毒血清免疫学检测,如果检测结果为阳性,同时伴有神经系统症状,就应进一步进行脑脊液常规和免疫学检查,确认或排除神经梅毒。
本研究为回顾性研究,因此存在一定的局限。未来研究可采取多学科合作方式,联合皮肤科、性病科、影像科、病理科、神经内科和神经外科等,开展神经梅毒的全国多中心研究,以获取中国神经梅毒流行病学和临床诊治的确切资料,切实提高神经梅毒的诊治水平。
[1]樊尚荣, 梁丽芬. 2015年美国疾病控制中心性传播疾病诊断和治疗指南(续)——梅毒的诊断和治疗指南[J]. 中国全科医学,2015, 18(27):3260-3264.
[2]DAEY OUWENS IM, KOEDIJK FD,FIOLET AT,et al. Neurosyphilis in the mixed urban-rural community of the Netherlands[J].Acta Neuropsychiatr, 2014, 26(3):186-192.
[3]YANG T, TONG M, XI Y,et al. Association between neurosyphilis and diabetes mellitus:resurgence of an old problem[J].J Diabetes,2014, 6(5):403-408.
[4]吴颖之. 神经梅毒诊疗进展[J]. 中国麻风皮肤病杂志, 2010, 26(8):574-576.
[5]韩国柱, 蒋明军, 张心保. 神经梅毒的诊断和治疗[J]. 中华皮肤科杂志, 2000, 33(3):205-207.
[6]NAGAPPA M, SINHA S, TALY AB,et al. Neurosyphilis: MRI features and their phenotypic correlation in a cohort of 35 patients from a tertiary care university hospital[J].Neuroradiology, 2013, 4(55):379-388.
[7]PRIMAVERA A, SOLARO C, COCITO L. De novo status epilepticus as the presenting sign of neurosyphilis[J].Epilepsia, 1998, 39(12):1367-1369.
[8]ANCES BM, SHELLHAUS R, BROWN MJ,et al. Neurosyphilis and status epilepticus: case report and literature review[J].Epilepsy Res,2004, 59(1):67-70.
[9]吕传真, 周良辅. 实用神经病学[M]. 4版.上海: 上海科学技术出版社, 2014:608-611.
[10]BERGER JR. Neurosyphilis and the spinal cord: then and now[J].J Nerv Ment Dis, 2011,199(12):912-913.
[11]李 洁, 王小宜, 倪 军. 神经梅毒的MRI表现[J]. 中国医学影像技术, 2009, 25(3):380-382.
[12]向 涛, 李国良, 肖 岚, 等. 伴颞叶病变的神经梅毒的MRI特点[J]. 中华放射学杂志, 2014, 48(3):248-249.
[13]何立娟, 徐 飞, 袁 慧. 三种方法对梅毒的临床诊断价值[J]. 中国医药, 2015,10(12):1856-1858.

