抗犬细小病毒单链抗体库构建及其亲和力检测
李德山,车瑞香,郭 瑞,王宇阳,黄 涛,郭笑辰,任桂萍
抗犬细小病毒单链抗体库构建及其亲和力检测
李德山,车瑞香,郭 瑞,王宇阳,黄 涛,郭笑辰,任桂萍
(东北农业大学生命科学学院,哈尔滨 150030)
为获得高亲和力抗犬细小病毒单链抗体,构建抗犬细小病毒(CPV)细菌展示单链抗体文库。研究提取犬脾脏总RNA,反转录cDNA,以此为模板,分别扩增犬抗体VH和VL编码序列,插入克隆载体pTlinker。利用SfiⅠ酶切位点将scFv基因构建至细菌展示载体pBSD中,将重组质粒电转化入E.coli DH5α构建pBFD-scFv细菌展示库。通过标记FITC的VP2蛋白,利用流式细胞术筛选12株阳性scFv。将12株scFv基因分别插入pET-28a,构建重组表达质粒pET28a-scFv。转化到E.coli Rosetta中诱导表达,获得约28 ku目的蛋白。经ELISA检测,纯化scFv对VP2蛋白P/N值均大于2.1,其中scFv-23、scFv-33、scFv-34对VP2蛋白亲和力较强。研究通过免疫本动物源动物,在获得高价抗体同时,避免传统单克隆抗体的免疫排斥现象;结合流式细胞术和细菌展示技术可对单链抗体文库高效、快速筛选。抗犬细小病毒同源单链抗体研究在填补市场同源基因工程抗体空白的同时,可为研制具有中和活性全长抗体奠定基础。
CPV;单链抗体;流式细胞术;亲和力
犬细小病毒病是犬细小病毒引起的急性传染病,表现为出血性肠炎或非化脓性心肌炎,多发生于幼犬,病死率10%~50%[1]。主要特征是剧烈呕吐、腹泻、粪便恶臭、出血性肠炎及白细胞数量减少[2];可感染不同年龄、性别和品种犬,全年发病率较高。CPV属细小病毒科,细小病毒属,无囊膜结构,核衣壳为对称等轴20面体单链DNA分子。CPV仅一个抗原型,但不同亚型、毒株间抗原性存在差别。目前CPV-2已突变为CPV-2a亚型、CPV-2b亚型、CPV-2c(a)亚型和 CPV-2c(b)亚型[3]。国内2011年首次检测到CPV-2c亚型[4],但目前流行CPV主要以CPV-2a亚型和CPV-2b亚型为主。CPV核酸呈线性单链,可编码非结构蛋白和结构蛋白,其中CPV编码VP1,VP2,NS1,NS2蛋白是其主要生物学特性及抗原性决定单位;VP1和VP2为结构蛋白[5]。VP2既是CPV衣壳蛋白主要成分,包含CPV中和抗原位点,可诱导机体产生中和抗体[6-7]。
目前,临床治疗犬细小病毒病主要通过注射抗血清、传统单克隆抗体等药物。抗血清存在水平传播疾病风险,传统单克隆抗体尽管治愈率较高,但注入体内会出现半衰期短、免疫排斥等现象。本研究中犬源基因工程重组抗体可克服上述缺点,具有本动物源、高亲和性等优点,在犬细小病毒病治疗方面日益受到关注。
单链抗体作为重要基因工程抗体,由三部分构成,抗体轻链可变区、重链可变区及一段连接桥梁多肽链[8]。单链抗体不仅具较强靶向性,同时不易解离、结构简单、易于操作及改造,利于抗体库筛选[9-10]。
根据细菌颗粒较大细菌展示技术,可将抗体展示于细菌表面,用荧光标记物通过流式细胞技术(Flow Cytometry,FCM)实时监测抗原和抗体结合情况[11],分选亲和力高抗体表达菌株[12-13]。本研究应用细菌内膜展示技术,原理是外源基因与NlpA信号肽共同融合表达[12],将目的蛋白展示于细菌内膜。NlpA信号肽可将与其融合目的基因运送至细菌周质空间,在跨膜过程中利用CDQSSS 6个氨基酸与细菌内膜外侧脂类形成脂苷键,锚定于细菌内膜外侧[14-15],形成细菌展示抗体库。利用溶菌酶处理细菌外膜,通过荧光标记特异性抗原结合FCM筛选抗体库。该方法利用6个氨基酸组成短肽锚定外源蛋白,对表达抗体蛋白构象无影响,并保持基因型和表型联系[16]。本研究旨在筛选具有亲和力抗CPV基因重组抗体,为后续研究具有中和活性抗体奠定基础,中和抗体可与病毒上中和表位结合,阻止病毒与细胞表面相应受体结合[17],防治疾病。试验成功构建抗CPV细菌展示单链抗体(scFv)库并表达抗CPVscFv,采用ELISA试验方法检测纯化后抗体,获12株具有较高特异性和亲和力抗CPV的scFv,为抗CPV基因工程抗体药物筛选提供依据,也为研制中和活性全长抗体奠定基础。
1 材料与方法
1.1 试验材料
克隆载体pMD19-T Simple Vector购自TaKaRa公司,原核表达载体pET-28a(东北农业大学生物制药教研室保存),scFv抗体文库构建载体pTlinker(东北农业大学生物制药教研室保存),细菌表面展示载体pBSD(东北农业大学生物制药教研室保存)。HRP-Sheep anti-Canine IgG(H+L)购自abcam公司,VP2、FITC标记VP2及免疫狗的阳性血清由本实验室制备。限制性内切酶、cDNA反转录试剂盒,抗生素,RNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒均购自TaKaRa公司;CPV抗体检测试纸条购自ASan Easy Test。
1.2 犬脾脏RNA提取和cDNA合成
CPV抗体检测试纸条检测抗体水平,取免疫后犬全血,滴入检测孔30 μL,同时滴入90 μL检测液,静止20 min后读取结果。取HI>320,抗体水平呈极强阳性,按照RNA提取试剂盒步骤,提取总RNA,按照反转录试剂盒步骤逆转录合成犬cDNA。
1.3 细菌展示scFv抗体库构建
1.3.1 大肠杆菌电转化感受态细胞制备
挑取冻存大肠杆菌DH5α菌液,于LB固体平板培养基表面划线,37℃培养过夜,同时设含Amp LB培养板划线培养作对照。次日挑取中等大小单一菌落,接种于10 mL LB液体培养基中,37℃、200 r·min-1振荡培养约10 h。用接种环沾取菌液接入10 mL LB液体培养基中,37℃、200 r·min-1振荡培养约10 h。将上述已活化菌种以1∶1 000比例接入200 mL LB液体培养基中,37℃、200 r·min-1振荡培养,当OD600达0.35~0.40时,收集菌液至50 mL离心管中,4℃、3 000 r·min-1,离心10 min。弃上清,加入40~50 mL预冷去离子水重悬菌体,4℃、3 000 r·min-1,离心10 min,重复操作一次。弃上清,加入40~50 mL预冷10%甘油重悬菌体,4℃、3 000 r·min-1,离心10 min,重复操作一次。取上清,加少量新鲜预冷10%甘油将菌体重悬后分装,每管100 μL冻存备用。
每管感受态细胞加5 ng pUC19标准质粒,3 kV、25 μF、200 Ω条件下电转,400 μL SOC培养基37℃振荡培养1 h,涂布平板,37℃培养12~16 h,次日观察电转化结果并计算转化率。
1.3.2 pTlinker-scFv库构建
根据GenBank上已发表抗体核酸序列,分析可变区骨架区,设计PCR扩增简并引物,在重链上游先后引入SfiⅠ和HindⅢ两个酶切位点,下游引入NheⅠ酶切位点;轻链上游引入BamHⅠ酶切位点,下游引入XhoⅠ和SfiⅠ两个酶切位点。引物由哈尔滨博仕生物有限公司合成。
以犬脾脏cDNA为模板,VH上游引物、VH下游引物扩增重链可变区基因,将VH及pTlinker酶切片段利用T4Ligase连接,连接产物电转化构建VH抗体库。次日,收集所有菌落并提取质粒,BamHⅠ、XhoⅠ双酶切,同时BamHⅠ、XhoⅠ双酶切VL回收产物,T4Ligase连接,连接电转化产物,收集菌落并提取质粒,即为pTlinker-scFv库。
1.3.3 pBSD-scFv细菌展示抗体文库构建
利用SfiⅠ酶切割分离VH-linker-VL片段与SfiⅠ酶切细菌展示载体pBSD相连,将重组质粒电转化入E.coli DH5α,构成pBFD-scFv细菌展示库。
1.4 流式细胞仪筛选细菌展示scFv库
pBFD-scFv库所有菌落,用液体培养基稀释至OD600≈0.2, 37 ℃摇床培养,当OD600≈0.4后,加IPTG至终浓度为0.25 mmol·L-1,37℃摇床诱导4 h。
取适量样品组和对照组培养物于1.5 mL Eppendorf管,离心,收集菌体;沉淀用350 μL Sucrose(0.75mmol·L-1)/Tris(0.1mol·L-1)solution 充分悬起;加35 μL(10 mg·mL-1)新鲜配制溶菌酶;同时伴随涡旋,逐滴加700 μL EDTA溶液(1 mmol·L-1)并混匀;冰上孵育15 min;加入50 μL MgCl2溶液(0.5 mol·L-1)混匀,冰上孵育10 min,离心,原生质球沉淀用PBS溶液重悬涤[17],离心;沉淀用100 μL PBS重新悬浮,含10 μL 2%(质量体积比)BSA贮存液和5 μg FITC标记后重组VP2蛋白100 μL PBS(pH7.4)重新悬起原生质体,避光冰上孵育1 h,离心,1 mL PBS洗涤沉淀3次,离心弃上清,吸尽残液,沉淀用300 μL PBS重悬。
将阴性对照和样品用流式细胞仪在488 nm波长激光下检测,相对于阴性对照,收集荧光强度最高部分。将质粒电转化大肠杆菌DH5α中,构建次级筛选库,按照相同方法第二轮筛选,分选荧光强度较高1%细胞,提取质粒后再次转化大肠杆菌DH5α,构建成三级筛选库,作第三轮筛选。
三轮筛选后,平板上挑取100个单菌落,扩增培养后流式细胞仪检测,检测操作同筛选方法,将荧光信号强于阴性对照克隆提取质粒,PCR及酶切鉴定,测定并分析克隆序列。
1.5 抗CPV scFv基因的克隆及重组表达
1.5.1 引物设计与合成
以scFv-2、scFv-11、scFv-12、scFv-13、scFv-23、scFv-25、scFv-31、scFv-33、scFv-34、scFv-35、scFv-65、scFv-84为模板,用Primer premier 5软件设计12对引物,在上游引入酶切位点EcoRⅠ,下游引入酶切位点XhoⅠ。引物由哈尔滨博仕生物有限公司合成。
1.5.2 构建重组表达载体pET28a-scFv
以阳性重组质粒pBSD-scFv为模板,PCR扩增scFv基因,胶回收后用EcoRⅠ、XhoⅠ双酶切,获得pET28a载体和scFv基因用T4DNA连接酶,16℃金属浴连接过夜。连接后产物转入Rosetta感受态细胞,37℃培养,超净工作台中挑取单菌落,次日提取质粒,将双酶切鉴定正确后质粒测序。菌液与50%甘油混合,-80℃保存。
将pET28a空载体及阳性重组质粒pET28a-scFv接种到含有100 μg·mL-1卡那霉素 LB培养基中,37℃摇床过夜,取1mL菌液,加入500mL锥形瓶扩大培养。活化后菌液37℃摇床培养2 h至吸光度达 0.6~0.9。加入IPTG至浓度为0.25 mmol·L-1,37℃诱导4 h。另设不加IPTG对照组。收集诱导菌和对照菌,经超声破碎后离心,分别取上清液和沉淀,SDS-PAGE电泳分析。
1.6 包涵体纯化
诱导后菌体离心弃上清,适量PBS重悬并加溶菌酶至终浓度为1 mg·mL-1,冰上放置60 min,超声破碎,4℃,12000 r·min-1离心30 min,收集沉淀、洗涤,用溶解缓冲液(8 mol·L-1尿素溶液,pH 8.0)充分溶解。以尿素梯度性降低比例溶解缓冲液和复性缓冲液(10 mmol·L Tris-buffer,pH 8.0)混合物平衡HiLoad 16/60 Superdex75 pg柱(购自GE公司)。溶于溶解缓冲液的蛋白上柱,复性缓冲液缓慢洗脱蛋白,PBS过夜透析,SDS-PAGE电泳分析纯度。
1.7 ELISA检测重组scFv亲和力和特异性
纯化后scFv蛋白分别用包被液稀释至3.125、6.25、12.5、25、50和100 μg·mL-1,包被于ELISA板,同时设置只加显色液和终止液阴性对照1、不加二抗阴性对照2、不加一抗阴性对照3和hIL-1β代替VP2蛋白阴性对照4,ELISA方法检测scFv对VP 2蛋白的亲和力和特异性,样品及对照均设置三个平行孔。用5%脱脂奶粉37℃封闭,加入50 μg·mL-1VP2蛋白100 μL,37℃孵育,1∶50倍稀释犬血清作为一抗,1∶100 000倍HRP-Sheep anti-Canine IgG(H+L)为二抗,显色液显色,加入终止液,酶标仪检测波长450 nm下OD值,P/N≥2.1判为阳性。具体操作见文献[18]。
2 结果与分析
2.1 细菌展示scFv库构建
以合成cDNA第一条链为模板,利用VH上下游简并引物扩增重链可变区,如图1A所示,VH片段大小约380 bp。利用VL上下游简并引物扩增轻链可变区,如图1B所示,VL片段大小约338 bp。将二者胶回收产物分别插入克隆载体pTlinker中。利用sfiⅠ限制性内切酶,分别对pTlinker-scFv和pBSD载体酶切,胶回收后连接酶切产物,电转化DH5α感受态细胞中,构建细菌展示scFv库(见图1 C),scfv片段长度约750 bp,感受态转化效率为1.1×109。
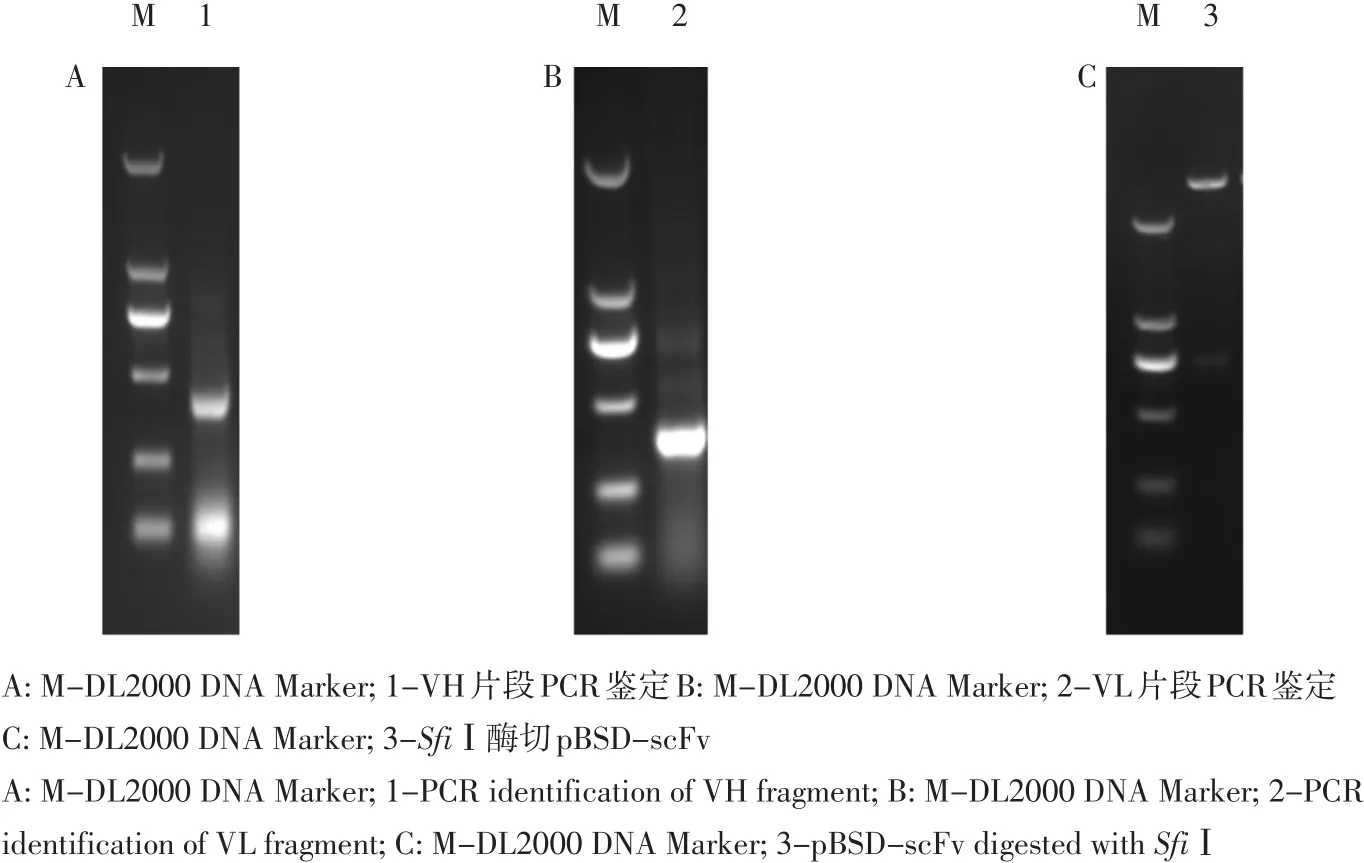
图1 细菌展示scFv库构建Fig.1 Construction of pBSD-scFv library
2.2 细菌展示scFv库筛选
将含有pBSD-scFv抗体库阳性菌诱导表达,制备展示所需原生质体,用已标记FITC VP2蛋白孵育,同时将空白菌DH5α(不含pBSD-scFv重组质粒)以同样方法孵育,设为阴性对照。流式细胞仪在488 nm波长激光下,以阴性对照为标准检测并分选待检样品。
由图2(A、B)可见,含有pBSD-scFv抗体库阳性菌峰相对阴性峰具阳性拖尾,阳性菌比例达9.7%,说明部分阳性菌可表达与CPV VP2蛋白特异性结合scFv蛋白。收集阳性部分菌物,提取质粒。
将提取质粒重新电转化至大肠杆菌E.coli DH5α,展开2轮、3轮筛选,如图2(C、D)所示,阳性部分不断增加。第2轮筛选,阳性原生质体比例升至28.9%,第3轮筛选,阳性率升至47.5%。
经过第3轮筛选后,收集原生质体,提取质粒,再次转化,挑取单菌落,分别扩增培养并处理后,流式细胞仪检测,获得12株阳性峰偏移率较高单链抗体。分别命名为pBSD-scFv-2、pBSD-scFv-11、 pBSD-scFv-12、 pBSD-scFv-13、pBSD-scFv-23、 pBSD-scFv-25、 pBSD-scFv-31、pBSD-scFv-33、 pBSD-scFv-34、 pBSD-scFv-35、pBSD-scFv-65、pBSD-scFv-84(见图3)。
2.3 目的蛋白纯化
对重组质粒pET28a-scFv作PCR及EcoRⅠ、XhoⅠ双酶切鉴定,结果与预期相符。测序结果表明成功构建原核表达载体。
SDS-PAGE分析,可知目的蛋白主要以包涵体形式表达,scFv蛋白分子量约28 ku,与预期相符(见图4)。对包涵体变性、复性、纯化及透析,SDS-PAGE分析,约28 ku处出现目的蛋白条带(见图5)。
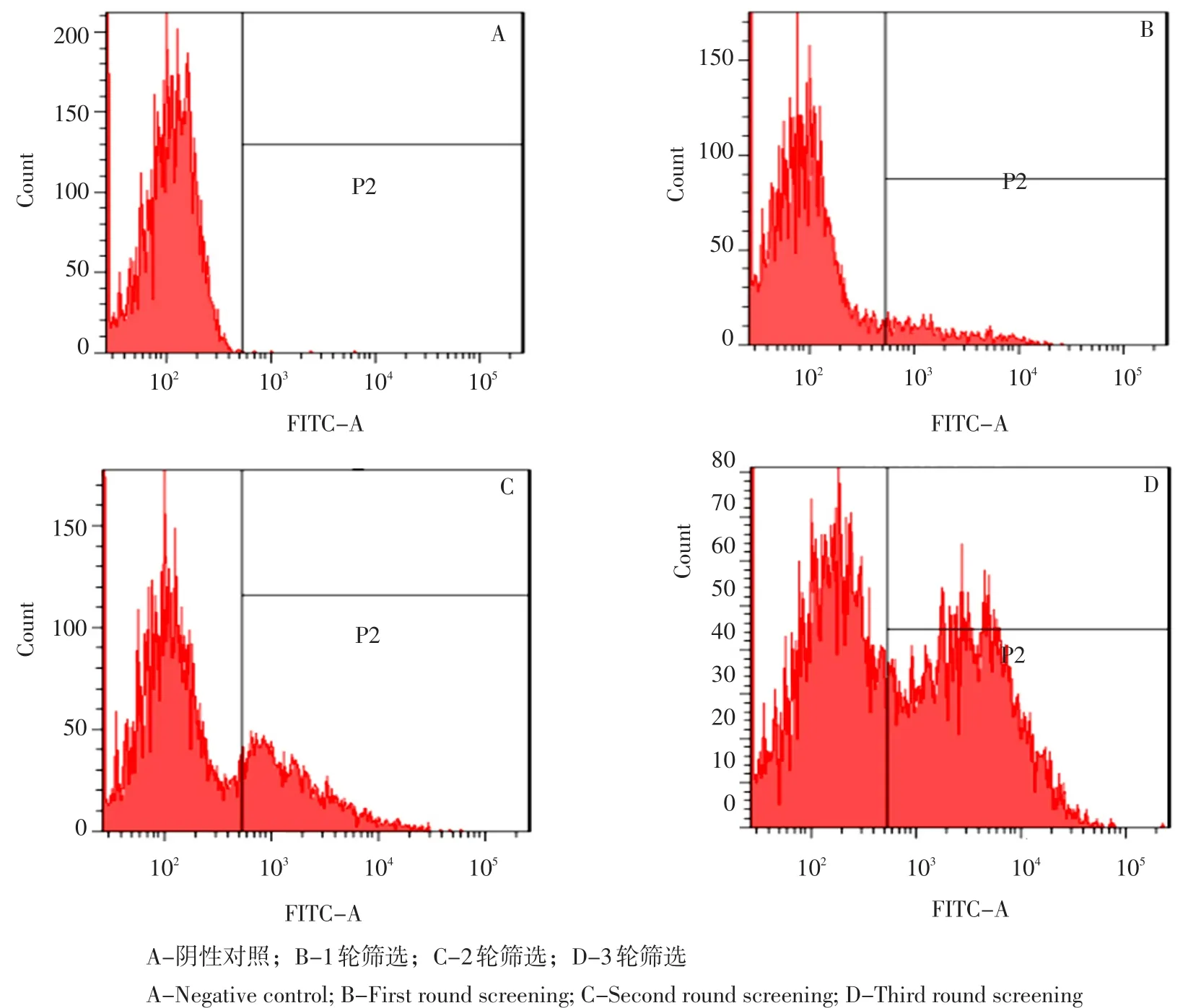
图2 scFv库的流式细胞仪筛选结果Fig.2 Screening of scFv library by FCM
2.4 ELISA检测重组scFv与VP2蛋白特异性和亲和力检测
使用本实验室表达纯化VP2蛋白对12株scFv作ELISA检测,试验组数值均高于对照组,P/N比值均大于2.1,呈阳性。
随scFv蛋白浓度梯度增加,反应数值呈上升趋势,且平行性较好。说明12个scFv均可与VP2蛋白特异性结合,且有一定亲和力,其中scFv-23、scFv-33、scFv-34对VP2亲和力较强(见图6)。
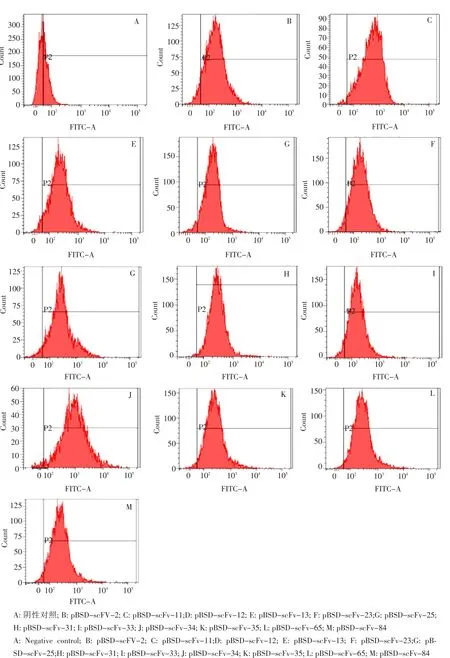
图3 亲和能力检测结果Fig.3 Affinity detection of scFvs by FCM

图4 scFv蛋白表达Fig.4 Expresstion of scFv protein
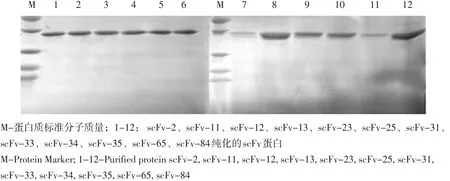
图5 目的蛋白纯化Fig.5 The purified of scFvs protein
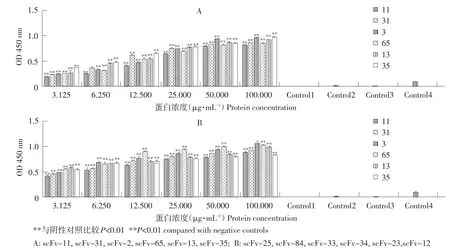
图6 scFv库流式细胞仪筛选结果Fig.6 Screening of scFv library by FCM
3 讨论
单链抗体scFv作为基因工程抗体一种形式,具有分子量小,结构简单,较强靶向性等优势[20-21]。目前,单链抗体构建主要有两种方式:①从杂交瘤细胞株中扩增抗体轻链和重链可变区,但构建单链抗体存在排斥反应。②从犬脾脏B淋巴细胞中提取RNA,反转录成cDNA,获抗体可变区。本文选择免疫本动物源动物犬,通过克隆犬重链可变区和轻链可变区,构建pBSD-scFv细菌展示抗体库。
周兵等应用噬菌体展示系统和细菌展示技术筛选鸡抗体文库,为应用细菌展示技术筛选犬抗体文库提供参考[17]。细菌展示技术可根据需要选择合适展示系统,控制展示蛋白拷贝数,根据需要实现N端或C端融合表达或嵌合表达。由于细菌表面展示系统具细胞结构,可应用于FACS高通量筛选,提高筛选效率[22-24]。目前,可成功展示抗体片段细菌展示平台较少[25-26],抗体片段分子量偏大、抗体蛋白上与抗原结合区域易被封闭、scFv折叠能力有限[27]。本试验使用免疫后文库,而非天然抗体库,抗体基因片段克隆自经抗原免疫过供体,因此该文库具有较强抗原特异性和亲和力,细菌展示系统选择106库容量,抗体文库可满足本研究需求。
细菌内膜展示技术与具有高通量、高灵敏度和准确分选优势的流式细胞筛选法结合,将单链抗体通过NlpA leader C端6个氨基酸残基锚定到细菌内膜外侧,通过一系列处理将细菌外膜穿孔制备为原生质体,标记FITC VP2蛋白与其孵育后,构建抗CPV单链抗体库中获12株对VP2蛋白具有特异性结合能力和亲和力单链抗体,为进一步筛选具有中和活性单链抗体奠定基础。
在表达单链抗体时,scFV为单顺反子[28-30],对表达载体要求较低,选择pET28a表达载体表达,使用Superdex75 pg柱子,将溶于溶解缓冲液蛋白上柱后,复性缓冲液缓慢洗脱蛋白,将蛋白于PBS中过夜透析,定时更换透析液,为下一步试验奠定基础。检测重组scFv与VP2蛋白特异性和亲和力时,应设对照和复孔。结果显示12株scFV均对VP2蛋白具有亲和力,其中scFv-23、scFv-33、scFv-34对VP2蛋白亲和力较强,后续将对12株单链抗体作中和活性鉴定,确定其是否具有中和病毒能力,构建全长抗体[31]。
[1] 蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001.
[2] 孙梅,吴建华,白文军.犬细小病毒研究进展[J].北京农业,2013(12):175-179.
[3] 吴清民.兽医传染病学[M].北京:中国农业大学出版社,2002.
[4] 王净,李英俊,李刚,等.犬细小病毒北京分离株VP2基因克隆及变异分析[J].中国兽医学报,2011,31(5):649-653.
[5] 颜文卿,吴德峰,戴亚东,等.犬细小病毒病的病原学研究进展[J].动物医学进展,2006,27(1):48-51.
[6] 李河林,焦铁军,刘淑红,等.犬细小病毒研究进展[J].动物医学进展,2008,29(5):73-77.
[7] 夏咸柱.养犬大全[M].长春:吉林人民出版社,1993.
[8] 罗厚强,宋显章,王清艳,等.温州地区犬细小病毒病门诊的流行病学调查[J].浙江农业学报,2014,26(4):887-891.
[9] Parrish C R,Aquadro C F,Strassheim M L,et al.Rapid antigenic-type replacement and DNA sequence evolution of canine parvovirus[J].Journal of Virology,1991,65(12):6544-6522.
[10] 宋桂强,龙贵伟,廖金,等.犬细小病毒病的研究进展[J].中国畜牧兽医,2007,34(3):98-100.
[11] 刘新星,霍转转,云慧,等.流式细胞术在细菌快速检测中的应用[J].微生物学通报,2014,41(1):161-168.
[12] Daugherty P S,Olsen M J,Iverson B L,et al.Development of an optimized expression system for the screening of antibody libraries displayed on the Escherichia coli surface[J].Protein Engineering,1999,12(7):613-621.
[13] 徐黎明,尹成凯,任桂萍,等.筛选Fab抗体库的细菌展示技术的建立[J].细胞与分子免疫学杂志,2011,27(10):1090-1093.
[14] Miroux B,Walker J E.Over-production of proteins in Escherichia coli:Mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels[J].Journal of Molecular Biology,1996,260(3):289-298.
[15] Mingarro I,Von H G P.Membrane-protein engineering[J].Trends in Biotechnology,1997,15(10):432-437.
[16] 勾蓝图,杨金亮.抗体库技术与策略进展[J].生物技术通讯,2009,20(6):859-861.
[17] 周兵,李天鹤,李宁,等.抗鸡传染性法氏囊病病毒单链抗体库的构建及其中和抗体的筛选[J].中国预防兽医学报,2014,36(3):227-231.
[18] Guo X,Cao H,Wang Y,et al.Screening scFv antibodies against infectious bursal disease virus by co-expression of antigen and antibody in the bacteria display system[J].Vet Immunol Immunopathol,2016,180:45-52.
[19] 董江丽,李武,额日贺,等.应用聚合酶链式反应检测犬细小病毒[J].内蒙古大学学报,2000,31(3):289-292.
[20] 尹成凯,徐黎明,任桂萍,等.酵母展示筛选scFv方法的建立[J].细胞与分子免疫学杂志,2009,25(12):1204-1203.
[21] 梁波流,沈粤春,李君.单链抗体在肿瘤靶向治疗中的研究进展[J].中国医学工程,2013,21(11):193-194.
[22] Georgiern G,Stathopoulos C,Daugherty P S,et al.Display of heterologous proteins on the surface of microorganisms[J].Nature Biotechnology,1997,15(1):29-34.
[23] Kieke M C,Cho B K,Boder E T,et al.Isolation of anti-T cell receptor scFv mutants by yeast surface display[J].Protein Engineering,1997,10(11):1303-1310.
[24] 许国双,黄长形.表面展示技术研究进展[J].国外医学:免疫学分册,1998,21(3):126-129.
[25] Cornelis P.Expressing genes in different Escherichia coli compartments[J].Current Opinion in Biotechnology,2000,11(5):450-454.
[26] Lee S Y,Choi J H,Xu Z.Microbial cell-surface display[J].Trends in Biotechnology,2003,21(1):45-52.
[27] Chen W,Georgiou G.Cell-Surface display of heterologous proteins:From high-throughput screening to environmental applications[J].Biotechnology and Bioengineering,2002,79(5):496-503.
[28] 李菁,林彤,宋帅,等.基因工程抗体研究进展[J].生物技术通报,2009(10):40-44.
[29] 李研东,宫彬彬,柳增善,等.单链抗体的制备及其应用[J].中国饲料,2009(13):33-36.
[30] 程朝飞,宫苗苗,李刚,等.抗狂犬病病毒核蛋白单链抗体的表达及活性鉴定[J].中国兽医科学,2013,43(9):963-968.
[31] 李德山,刘春香,姜媛媛,等.Anti-hEGFR轻、重链共表达及高表达细胞株快速筛选[J].东北农业大学学报,2015,46(10):56-62.
Construction and affinity detection of an anti-CPV scFv library
LI Deshan,
CHE Ruixiang,GUO Rui,WANG Yuyang,HUANG Tao,GUO Xiaochen,REN Guiping
(School of Life Science,Northeast Agricultural University,Harbin 150030,China)
In order to obtain high affinity anti-canine parvovirus single chain antibody,bacteriadisplayed recombinant scFv libraries of Canine parvovirus were constructed.Total RNA was extracted from the spleen of an immunized canine and reverse transcribed into cDNA as template.VH and VL coding sequences of the canine antibody were inserted into the cloning vector pTlinker,respectively.The scfv gene was constructed into the bacterial display vector pBSD bySfiI digestion site,and the recombinant plasmid was electroconductive intoE.coliDH5αto construct pBFD-scFv bacteria display library.Twelve VP2-binding scFv clones with unique sequences were obtained after screening scFv library by FCM with FITC-labeled VP2.The 12 recombinant scFv genes were inserted into pET-28a to construct the recombinant expression plasmid pET28a-scFv.They were transformed intoE.coliRosetta for induction and expression,in order to obtain about 28 ku of the target protein.ELISA results showed that all scFvs exhibited binding abilities and specifities to VP2,among them scFv-23,scFv-33 and scFv-34 were stronger than others.In this study,canine was immunized in order to acquire high-pricedantibodies,which avoiding the traditional immune rejection of monoclonal antibodies.Flow cytometry and bacterial display technology was combined for screening in more efficient and rapid.Anti-canine parvovirus homologous single-chain antibodies fill the gaps in homologous antibodies in the market and bulid the foundation for the development of full-length antibodies with neutralization activity.
Canine parvovirus;single chain antibody;flow cytometry;bacterial display
R392
A
1005-9369(2017)11-0026-09
时间2017-12-7 12:34:11 [URL]http://kns.cnki.net/kcms/detail/23.1391.S.20171207.1233.006.html
李德山,车瑞香,郭瑞,等.抗犬细小病毒单链抗体库构建及其亲和力检测[J].东北农业大学学报,2017,48(11):26-34.
Li Deshan,Che Ruixiang,Guo Rui,et al.Construction and affinity detection of an anti-CPV scFv library[J].Journal of Northeast Agricultural University,2017,48(11):26-34.(in Chinese with English abstract)
2017-10-15
国家重点研发计划项目(2016YFD0501003)
李德山(1950-),男,教授,博士生导师,研究方向为生物制药。E-mail:deshanli@163.com

