盐、碱条件下水稻剑叶形态相关性状QTL分析
邹德堂,张恩源,孙 健,王敬国,刘化龙,郑洪亮
盐、碱条件下水稻剑叶形态相关性状QTL分析
邹德堂,张恩源,孙 健,王敬国,刘化龙,郑洪亮
(东北农业大学农学院,哈尔滨 150030)
以东农425和耐盐碱的长白10号杂交获得重组自交系(RIL)为作图群体,对亲本重测序,利用差异设计120对Indel引物,在实验室原有102个SSR标记基础上增加113个多态性较好Indel标记,构建遗传连锁图谱,鉴定水稻耐盐、碱性。以浓度6 ds·m-1的NaCl水溶液,pH 9.0 Na2CO3水溶液作全生育期处理,正常水灌溉为对照。2016~2017年盐、碱胁迫和自然条件下测定水稻抽穗期对剑叶形态相关性状,并对各性状作QTL定位。结果表明,在两年试验中亲本和RIL群体受碱胁迫影响大于盐胁迫,亲本每个性状在盐、碱两种条件下均表现显著相关性,在盐、碱胁迫条件下共检测到26个与剑叶形态性状相关QTL。qSLl9和qALl8在两年试验中均被检出,是两个主效QTL。研究结果可为水稻抽穗期耐盐、碱性QTL精细定位和分子辅助育种提供理论依据。
水稻;盐胁迫;碱胁迫;QTL
水稻(OryzasativaL.)是主要粮食作物之一,占全球谷类作物种植面积1/3[1-2]。近年来,由于不合理开垦荒地和发展灌溉农业,土地盐碱化加剧[3-4]。水稻对盐碱中度敏感[5],土地盐碱化成为限制水稻高产、稳产重要因素之一[6]。水稻受盐胁迫危害主要表现在离子毒害、渗透胁迫和营养不平衡[7],碱胁迫对水稻造成中性盐危害[8],表现为植物根系渗透吸水困难,Na+和Cl-在叶片中大量积累[9],植株水势下降,造成生理干旱,叶片水分过量消耗,气孔关闭,限制蒸腾,减少叶肉细胞CO2,破坏植物叶绿体光合结构,影响水稻体内正常生理生化反应[10],新生叶生长受阻,生物量积累减少。严重影响水稻产量。孙健等以6个水稻品种为试验材料,研究水稻剑叶形态特征及耐盐碱性相关性,结果表明盐、碱胁迫对剑叶形态影响较大,可作为耐盐碱筛选指标[11]。因此,以剑叶形态相关性状作为耐盐碱指标,研究水稻耐盐、碱性遗传机制,培育耐盐碱水稻品种对提高水稻盐碱区产量有重要意义。
Thomson等利用NILs群体定位苗期耐盐相关性状27个QTL[12]。Kim等利用BC3F5群体在盐处理下定位有关苗高、叶干重、叶鲜重和叶面积8个QTL[13]。祁栋灵等以粳粳交“高产106/长白9号”F2:3代200个家系为群体,鉴定水稻耐碱性,检测到与碱胁迫相关QTL26个[14]。李宁等以彩稻与WD20342杂交衍生F2:3群体,在苗期作耐碱性QTL定位,检测到3个与碱胁迫相关QTL,其中qASH-7贡献率最大为20.09%[15]。邢军等对水稻苗期耐盐性和耐碱性作QTL检测分析,发现两种胁迫条件下各性状之间均未呈显著相关性,检测QTL在两种胁迫条件下位于染色体不同区间,认为水稻耐盐性和耐碱性之间存在差异[16]。现有研究利用不同群体和品种对水稻耐盐碱性相关性状作QTL定位,但在盐、碱条件下相关研究大多集中在芽期和苗期,大田生育期研究相对较少,且仅单一研究水稻耐盐性或耐碱性QTL。
本研究以盐碱敏感型粳稻品种东农425和强耐盐碱粳稻品种长白10为亲本衍生RIL群体为材料,分别在盐、碱两种胁迫条件下,探究抽穗期水稻剑叶叶长、叶宽、叶面积和叶片卷曲度,利用完备区间作图法对其QTL定位,以期获得耐盐、碱主效QTL,为水稻在盐、碱条件下QTL精细定位提供理论依据,为耐盐、碱性水稻选育奠定基础。
1 材料与方法
1.1 材料
试验以黑龙江省盐碱敏感粳稻品种东农425(DN425)为母本,吉林省农业科学院水稻研究所选育强耐盐碱粳稻品种长白10号(CB10)为父本配置杂交组合,通过“单粒传”获180个家系F8和F9代重组自交系群体为试验材料。
1.2 田间试验方法
试验于2016~2017年在东北农业大学阿城实验基地开展。亲本和F8(2016年)RIL群体于2016年4月20日播种,亲本和F9(2017年)RIL群体于2017年4月25日播种,采用旱育秧苗方法,分别于2016年5月25日和2017年5月29日移栽大田。
将试验材料分别种植于盐池、碱池和对照池,采用随机排列,3行区,行长2 m,行距30 cm,穴距10 cm,3次重复。于水稻返青后开始盐、碱处理,盐胁迫处理采用灌溉6 ds·m-1NaCl水溶液(相当于0.64%浓度),碱胁迫处理采用灌溉pH 9.0 Na2CO3水溶液[17-18],对照为正常水灌溉。田间管理同大田生产一致。为确保盐、碱处理强度稳定,每日在早、中、晚监测盐池内NaCl浓度和碱池内pH,若遇降雨或高温干旱天气及时排水,重新灌溉。
1.3 性状调查
对照及盐、碱胁迫3种条件共6个环境:E1(2016年对照)、E2(2017年对照)、E3(2016年盐处理)、E4(2017年盐处理)、E5(2016年碱处理)和E6(2017年碱处理)。于抽穗期对六个环境亲本及F8、F9群体调查取样,每个样本随机选取非边3个单株主茎剑叶测定。测量自然卷曲宽度(Ln),叶片展开测其宽度(Lw),测叶片长度(Ll),计算叶片卷曲度和叶面积,公式如下:LAR(叶面积)=Ll×Lw× 0.75;LRI(叶片卷曲度)=(Lw-Ln)/Lw×100%,以3次重复平均值作为统计单元。
1.4 DNA提取及PCR扩增
选取亲本及F8代180个家系分蘖盛期叶片于-80℃超低温冰箱保存备用。DNA提取按照Doyle等CTAB法并稍作改进[19]。PCR反应总体积为20 μL,体系包括3 μL模板DNA(25ng · μL-1)、2 μL 10×PCR缓冲液、1.5 μL MgCl2(25mmol·L-1)、2 μL SSR引物(12 ng·μL-1)、0.2 μL dNTP(10 mmol·L-1)、0.3 μLTap酶(5 U· μL-1),ddH2O补至20 μL,最后加入石蜡覆盖体系。PCR扩增步骤94℃预变性6 min,94℃下变性30 s,55℃下退火30 s,72℃下延伸30 s,重复2~4步共35个循环,72℃下延伸5 min,4℃下保存。将扩增产物作6%聚丙烯酰胺凝胶电泳,银染法检测[16]。
1.5 数据处理及QTL分析
利用Excel处理剑叶形态相关性状,SPSS 19.0软件对各性状作统计分析和相关性分析。
对亲本东农425和长白10号基因组重测序,根据序列位点之间差异合成120对Indel引物,由哈尔滨博仕生物科技有限公司合成。利用120对Indel引物对F8代RIL群体180个株系DNA作PCR扩增,确定多态性较好Indel标记113个。将其结合本实验室已构建的102个SSR标记图谱[16]构建新遗传连锁图谱。应用Mapmaker软件分子标记遗传连锁图谱,利用Kosambi函数将重组率转化为遗传距离(cM),遗传连锁图谱共覆盖水稻基因组约2 387.33 cM,标记间平均距离为11.10 cM,Map⁃chart 2.3软件绘制遗传连锁图谱,QTLIciMappingv 4.0完备区间作图法(ICIM)定位QTL,取LOD=2.5为QTL阈值,选取临界阈值P=0.05,当QTL效应P≤0.05时,判断QTL存在。利用McCouch等方法QTL命名[20]。
2 结果与分析
2.1 盐、碱胁迫条件下水稻剑叶形态表现
由表1可知,两年自然条件下各性状亲本之间无显著差异。2016年盐胁迫条件下,叶宽在两亲本之间差异极显著,叶长、叶面积和叶片卷曲度差异显著。2017年盐胁迫条件下,叶长、叶宽、叶面积均在两亲本之间表现极显著性差异,叶片卷曲度在两亲本之间表现显著性差异。在两年碱胁迫条件下,叶长和叶宽在两亲本之间均表现极显著性差异,叶面积和叶片卷曲度表现显著性差异。
2016年自然条件下,RIL群体叶长31.65 cm,叶宽1.46 cm,叶面积34.67 cm2,叶片卷曲度4.73%。盐胁迫条件下,RIL群体叶长24.61 cm,叶宽1.26 cm,叶面积23.23 cm2,叶片卷曲度11.18%。碱胁迫条件下,RIL群体叶长23.82 cm,叶宽1.25 cm,叶面积22.29 cm2,叶片卷曲度12.28%。2017年自然条件下,RIL群体叶长29.45cm,叶宽1.50 cm,叶面积33.07 cm2,叶片卷曲度3.36%。盐胁迫条件下,RIL群体叶长21.82 cm,叶宽1.31 cm,叶面积21.44 cm2,叶片卷曲度10.33%。碱胁迫条件下,RIL群体叶长20.22 cm,叶宽1.21 cm,叶面积18.27 cm2,叶片卷曲度12.38%。
在两年盐、碱两种胁迫条件下亲本和RIL群体均受胁迫影响,在两种胁迫下叶长、叶宽和叶面积均减小,叶片卷曲度增大,但这些性状在盐胁迫条件下变异幅度均小于碱胁迫,说明碱胁迫影响大于盐胁迫;在耐盐、碱方面亲本表现显著差异,DN425在两种胁迫下受影响更大,CB10表现较强耐盐、碱性,为QTL分析提供良好遗传背景。RIL群体在两种胁迫下变异范围较大,存在超亲分离现象。对数据作正态分布适合性检验,发现峰度和偏斜度均小于1,基本符合正态分布,表现典型数量性状遗传特性,适合QTL定位。
2.2 盐、碱胁迫下剑叶形态相关性状相关性
由表2可知,2016年在盐、碱胁迫条件下,各性状相关关系基本一致,叶长与叶宽、叶片卷曲度呈显著或极显著负相关,叶长与叶面积呈显著正相关,叶宽与叶面积呈极显著正相关,其中叶长与叶面积在两种胁迫条件下相关系数分别为0.78和0.72,叶宽与叶面积在两种条件下相关系数分别为0.51和0.46。2017年在两种胁迫条件下,叶长和叶宽均与叶面积呈极显著正相关,且相关系数相对较大,叶长与叶面积相关系数均为0.81,叶宽与叶面积相关系数为0.62和0.52。两年重复试验中,叶长和叶宽与叶面积相对系数较大,盐、碱条件下,水稻对营养吸收和运输较少,叶长长势影响叶片宽度,叶长增长使叶片卷曲度减小,叶长和叶宽共同控制叶面积。两年试验中在盐胁迫与碱胁迫条件下各性状相关性不显著。
2.3 盐、碱条件下剑叶形态相关性状QTL分析
在盐、碱两种胁迫条件下共检测到26个与叶片形态相关QTL(见表3),分布在除第7、10和11染色体上,LOD值范围为2.50~4.78,对表型变异贡献率范围为3.72%~22.40%。
在盐胁迫下共检测到13个与叶片形态相关性状有关QTL,分布在1、2、3、4、5、8和9染色体(见图1)。
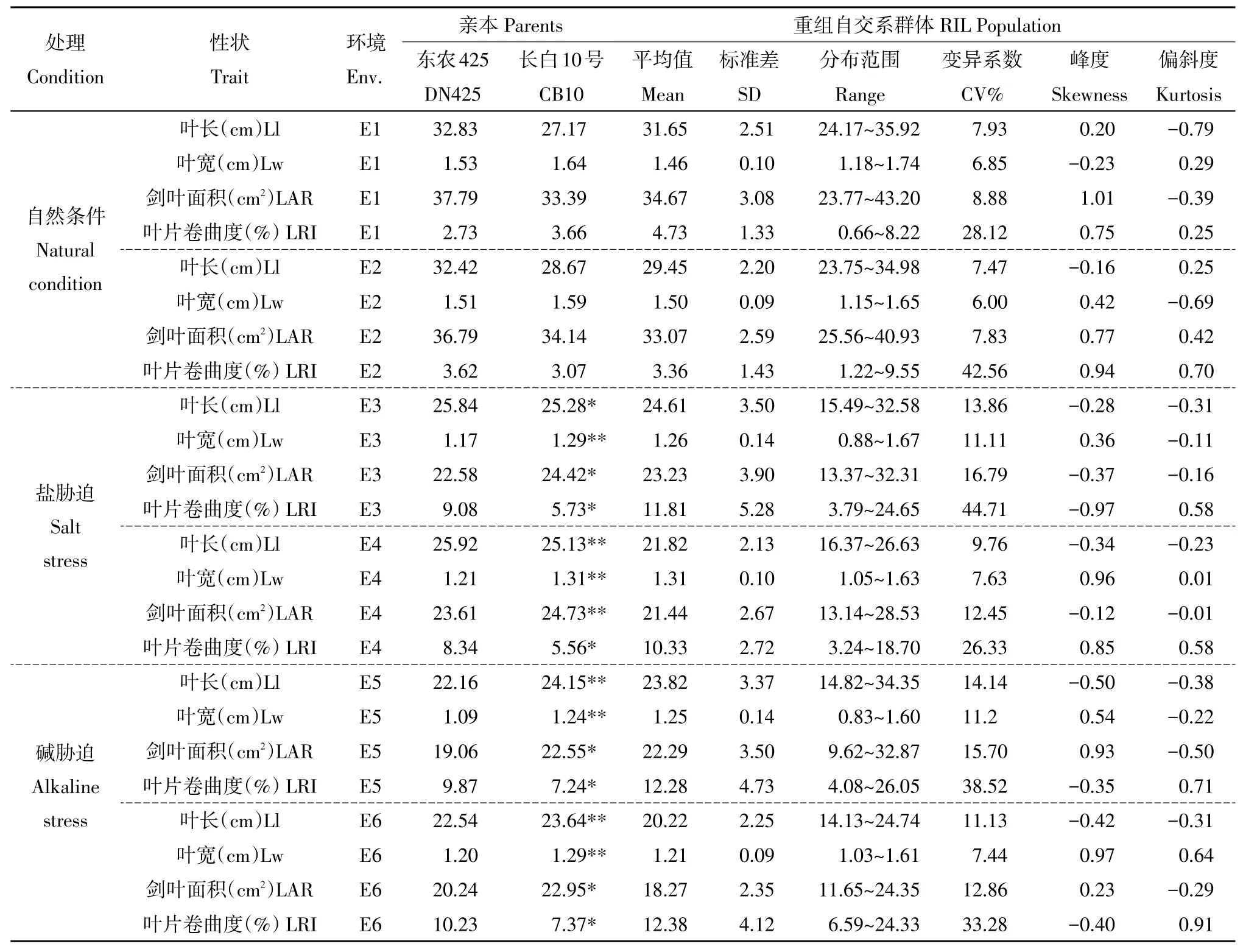
表1 在不同环境下亲本及重组自交系群体孕穗期叶片形态相关性状表型分析Table 1 Leaf shape related traits for RIL population and parents at he booting stage in different environments
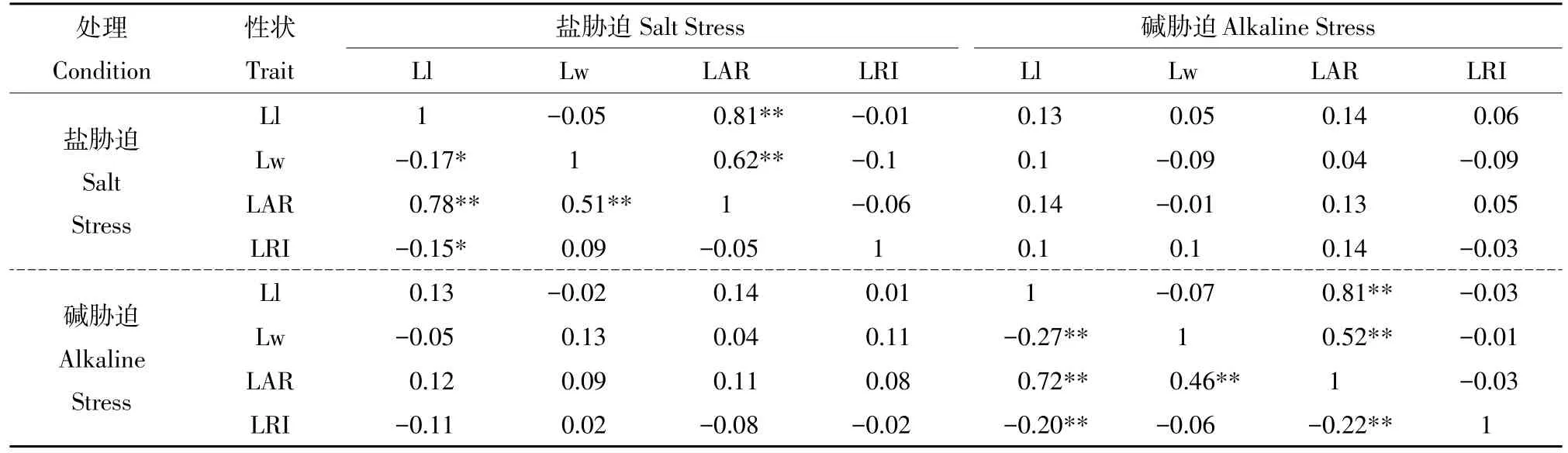
表2 叶片形态相关性状间相关系数Table 2 Correlation coefficients among leaf shape related traits
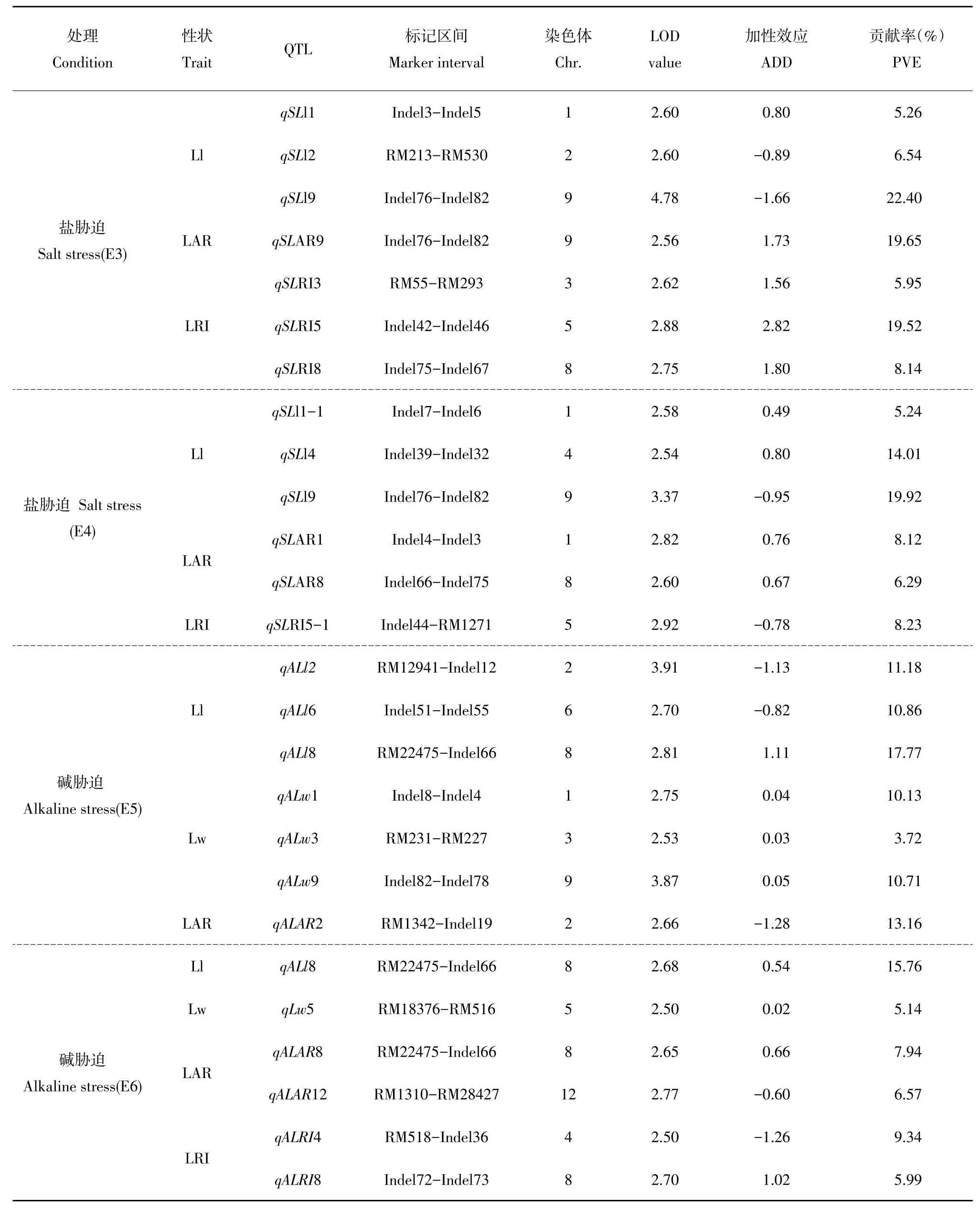
表3 RIL群体耐盐、碱相关性状QTL及遗传效应Table 3 QTL mapping for salt and alkali tolerant related traits of the RIL poupulation


图1 水稻耐盐、碱相关性状加性QTL在染色体上分布Fig.1 Additive QTL of salt and alkali tolerant related traits in rice on chromosomes
由表3和图1可知,2016年检测到3个与Ll有关QTL,分别位于第1染色体Indel3-Indel5、第2染色体RM213-RM530和第9染色体Indel76-Indel82区间上,其中qSLl9贡献率最大,为22.40%。来自DN425增效等位基因仅有qSLl1,其余2个QTL增效等位基因均来自CB10;与LAR有关QTL1个,位于第9染色体Indel76-Indel82内,贡献率为19.65%,增效等位基因来自DN425;与LRI有关3个QTL,分别位于第3、5和8染色体上,其中,qSLRI5贡献率最大,为19.52%,增效等位基因均来自DN425。2017年检测到与Ll相关QTL3个,分别位于第1、4、9号染色体上,其中qSLl9贡献率最大为19.92%。来自CB10增效等位基因仅有qSLl9,其余QTL增效等位基因均来自DN425;与LAR有关QTL2个,分布于第1,8号染色体,其增效等位基因均来自DN425;与LRI相关QTL1个,位于第5染色体Indel44-RM1271区间内,贡献率为8.23%,增效等位基因来自CB10;两年盐胁迫条件下均未检测到与Lw相关QTL,两年盐胁迫条件下均未检测到与Lw相关QTL。qSLl9于两年内均被检测,可能是盐胁迫条件下主效QTL。qSLl9两年内均被检测,可能是盐胁迫条件下主效QTL。
在碱胁迫下共检测到与叶片形态相关性状有关QTL13个,分布于1、2、3、4、5、6、8、9和12染色体。2016年检测到与Ll相关QTL3个,分别位于第2染色体RM12941-Indel12、第6染色体In⁃del51-Indel55和第8染色体RM22475-Indel66区间内,贡献率分别为11.18%、10.86%和17.77%。来自DN425增效等位基因仅有qALl8,其余2个QTL增效等位基因均来自CB10;与Lw相关QTL3个,分别位于第1、3、9染色体上,贡献率分别为10.13%、3.72%和10.71%,增效等位基因均来自DN425;与LAR有关QTL1个,位于第2染色体RM1342-Indel19区间上,贡献率为13.16%,其增效等位基因来自CB10;未检测到与叶片卷曲度相关QTL。2017年检测1个与Ll相关QTL,位于第8染色体RM22475-Indel66区间内,贡献率为15.76%,增效等位基因来自DN425;1个与Lw相关QTL,位于第5染色体RM183776-RM516区间内,贡献率为5.14%,增效等位基因来自DN425;与LAR相关QTL2个,分别位于第8和12染色体上,qALAR8增效等位基因来自DN425,qALAR12增效等位基因来自CB10;与LRI相关QTL有2个,位于第4和8染色体上,qALRI4增效等位基因来自CB10,qALRI8增效等位基因来自DN425;未检测到与LAR相关QTL。qALl8两年内均被检测,可能是碱胁迫条件下一个主效QTL;两种胁迫下未检测到共同QTL。
3 讨论与结论
3.1 水稻盐、碱胁迫表现
水稻耐盐碱性由多基因控制,土壤盐碱化影响水稻生理生化反应[21]。高显颖研究认为,水稻在不同环境下遗传力不同,环境不适导致遗传力较低[9]。曲英萍研究指出,水稻苗期控制盐胁迫下死叶率和死苗率QTL均分布在相同区间,水稻在苗期耐盐性和耐碱性具有相关性[22]。梁银培等研究表明,盐胁迫和碱胁迫下控制水稻产量性状QTL大多数被定位于不同区间,水稻在生育后期耐盐和耐碱机制存在差别[18]。本试验结果表明,RIL群体在盐、碱胁迫条件下叶长、叶宽、叶面积和叶片卷曲度均呈正态连续分布,由多基因控制数量性状,与前人研究一致。亲本和RIL群体在碱胁迫下水稻叶长、叶宽、叶面积、叶片卷曲度变化幅度大于盐胁迫,与高显颖等水稻、玉米、燕麦等作物研究结果一致[9,23-25]。碱胁迫下pH较高破坏水稻生物原生质膜,难以进行正常生理生化反应[26-27],营养和生殖生长受抑制,叶片变黄、卷曲,细胞分裂和伸长减慢,生长缓慢,造成叶片面积变小,产量显著降低。两种胁迫条件下剑叶形态相关性状相关性不显著,未在相同染色体区间检测到相同QTL,与邢军等研究一致[16,18],说明水稻在生育后期耐盐性和耐碱性遗传机制不同,相互独立;与曲英萍等研究结论不同,说明水稻在苗期和大田生育期耐盐、碱机制存在差异[22]。
3.2 水稻耐盐、碱性QTL定位
控制相关性状QTL通常被定位在相同或相邻染色体区间[28]。两年盐胁迫下在Indel76-Indel82区间同时检测到qSLl9和qSLAR9,两年碱胁迫下在RM 22475-Indel66区间上重复检测到qALl8和qALAR8;第9染色体相邻位置检测到qSLl9与qALw9,第1染色体相邻区间检测到qSLAR1与qSLl1,第8染色体相邻区间检测到qSLAR8与qALAR8。这些基因被定位在相同或相邻位置,控制相同或不同剑叶形态相关性状,说明可能存在一因多效或基因紧密遗传连锁,需进一步培育等位基因系开展研究。多数QTL未被定位到相同染色体区间内,说明这些剑叶形态性状由多基因控制。根据相同标记或比较图谱[29],将本试验定位QTL与前人耐盐、碱QTL结果比较。在盐胁迫条件下本研究定位到qSLl1与控制苗高相关qSH1.1定位在相同区间[30],qSLl2与控制根数有关NY-8定位在相同区间[31],qSLl9与控制单株分蘖qTn9定位在相同区间[32],qSLRI3与影响根部钠离子浓度qSRNC3-2在相同区间[33],qSLRI5与影响根部钠离子含量qRNC定位在相同区间[34],qSLRI8与控制盐害级别qSST8定位在相同区间[35],qSLAR9与影响苗期根部钾离子浓度qRkc9在相同区间[32]。在碱胁迫条件下,本研究定位到qALl2、qA⁃Ll6、qALl8、qALw1、qALw3、qALw9和qALAR2分别与控制根部钾离子浓度qARKC2[33]、根数相对碱害率有关qRRN6-2[14]、控制根长qRL8[35[33]、控制单株有效穗数qPN3-3[18]、控制死叶率qDLRa9-1[36]、幼苗期死苗率相关qDLR3(2)位于相同或相邻区间[37]。这些QTL可在不同生育期、性状、环境或遗传背景下被检测,表明这些QTL稳定、可靠,存在一因多效或基因连锁,对水稻耐盐、碱机制研究具有重要意义。
[1] 王月华,何虎,潘晓华.我国水稻育种技术发展历程回顾[J].江西农业学报,2012,24(2):26-28.
[2] 周锡跃,徐春春,李凤博,等.世界水稻产业发展现状、趋势及对我国的启示[J].农业现代化研究,2010,31(5):525-528.
[3] Kumar K,Kumar M,Kim S R,et al.Insights into genomics of salt stress response in rice[J].Rice,2013(6):27-42.
[4]蒋海秀.渭南卤阳湖盆地土地盐碱化成因分析及治理方案研究[D].杨凌:西北农林科技大学,2013.
[5] 王志欣,邹德堂,刘华龙,等.东北粳稻芽期耐盐碱性差异研究[J].黑龙江农业科学,2012(8):6-11.
[6] 祁栋灵,郭桂珍,李明哲,等.水稻耐盐碱性生理和遗传研究进展[J].植物遗传资源学报,2007,8(4):486-493.
[7] 陈丽珍,叶剑秋,王荣香.水稻盐胁迫的研究进展[J].热带农业科学,2011,31(3):87-93.
[8] 易善军,孙振元,韩蕾,等.植物耐碱机理及相关基因研究进展[J].世界林业研究,2011,24(1):28-32.
[9] 高显颖.不同浓度盐碱胁迫对水稻生长及生理生态特性影响[D].长春:吉林农业大学,2014.
[10] Leonova T G,Goncharova E A,Khodorenko A V,et al.Character⁃istics of salt-tolerant and salt-susceptible cultivars of barley[J].Russian Journal of Plant Physiology,2005,52(6):774-778.
[11] 孙健,赵宏伟,王敬国,等.水稻孕穗期剑叶形态和蒸腾特性与耐盐性的关系[J].华北农学报,2012,27(6):84-91.
[12] Thomson M J,Ocampo M,Egdane J,et al.Characterizing the Saltol quantitative trait locus for salinity tolerance in rice[J].Rice,2010,3(2-3):148-160.
[13] Kim D M,Ju H G,Kwon,et al.Mapping QTLs for salt tolerance in an introgression line population between Japonica cultivars in rice[J].Journal of Crop Science and Biotechnology,2009,12(3):121-128.
[14] 祁栋灵,郭桂珍,李明哲,等.碱胁迫下粳稻幼苗前期耐碱性的数量性状基因座检测[J].作物学报,2009,35(2):301-308.
[15] 李宁,孙健,王敬国,等.一个新的水稻苗期耐碱主效QTL的定位[J].分子植物育种,2016,14(2):417-423.
[16] 邢军,常汇琳,王敬国,等.盐、碱胁迫条件下粳稻Na~+、K~+浓度的QTL分析[J].中国农业科学,2015,48(3):604-612.
[17] Sun J,Zou D T,Luan F S,et al.Dynamic QTL analysis of the Na+content,K+content,and Na+/K+ratio in rice roots during the field growth under salt stress[J].Biologia Plantarum,2014,58(4):689-696.
[18] 梁银培,孙健,索艺宁,等.水稻耐盐性和耐碱性相关性状的QTL定位及环境互作分析[J].中国农业科学,2017,50(10):1747-1762.
[19] Doyle J J,Doyle J I.Isolation of plant DNA fr zom fresh tissue[J].Focus,1990,12:13-15.
[20]McCouch S R,Cho Y G,Yano M,et al.Report on QTL nomencla⁃ture[J].Rice Genetics Newsletter,1997,14(11):11-131.
[21] Flower T J.Improving crop salt tolerance[J].Journal of Experi⁃mental Botany,2004,55(396):307-319.
[22] 曲英萍.水稻耐盐碱性QTLs分析[D].北京:中国农业科学院,2007.
[23] 程海涛,苏展,曹萍,等.NaCl和Na2CO3胁迫对水稻籼粳杂交后代群体发芽与幼苗生育的影响[J].沈阳农业大学学报,2010,41(1):73-77.
[24] Li M Z,Xiang G L,Xin N Q,et al.Early Transcriptomic Adapta⁃tion to Na2CO3stress altered the expression of a quarter of the to⁃tal genes in the maize genome and exhibited shared and distinc⁃tive profiles with NaCl and high pH stresses[J].Journal of Integra⁃tive Plant Biology,2013,55(11):1147-1165.
[25] 萨如拉,刘景辉,刘伟,等.盐碱胁迫对燕麦幼苗Na~+、K~+含量及产量的影响[J].西北农业学报,2014,23(3):50-54.
[26] 华春,王仁雷.水稻幼苗叶绿体保护系统对盐胁迫的反应[J].西北植物学报,2004,24(1):136-140.
[27] 刘建新,王金成,贾海燕.燕麦幼苗对盐胁迫和碱胁迫的生理响应差异[J].水土保持学报,2015,29(5):331-336.
[28] Xiao J,Yuan L P,Tanksley S D.Identification of QTLs affecting traits of agronomic importance in a recombinant inbred popula⁃tion derived from a subspecific rice cross[J].Theoretical and Ap⁃plied Genetics,1996,92(2):230-244.
[29] Ware D,Jaiswal P,Ni J J,et al.Gramene:A resource for compara⁃tive grass genomic[J].Nucleic Acid Research,2002,30(1):103-105.
[30] Zhou F W,Jin P C,Zhi W C,et al.Identification of QTLs with main,epistatic and QTL×environment interaction effects for salt tolerance in rice seedling sunder different salinity conditions[J].Theoretical and Applied Genetics,2012,125(6):807-815.
[31] 王奉斌,张燕红,文孝荣,等.两个粳稻材料芽期和苗期耐盐性的QTL定位[J].新疆农业科学,2011,48(12):2205-2210.
[32] 藏金萍.水稻抗旱、耐盐QTL表达的遗传背景效应及抗旱、耐盐的遗传重叠研究[D].北京:中国农业科学院,2008.
[33] 邢军.粳稻耐盐性和耐碱性的QTL分析[D].哈尔滨:东北农业大学,2015.
[34] 孙健.水稻耐盐相关性状的发育动态QTL分析[D].哈尔滨:东北农业大学,2013.
[35] 邹德堂,马婧,王敬国,等.粳稻幼苗前期耐碱性的QTL检测[J].东北农业大学学报,2013,44(1):12-18.
[36] 梁晶龙.利用重组自交系群体的水稻耐盐/碱性QTL定位分析[D].重庆:重庆师范大学,2013.
[37] 祁栋灵.水稻耐碱性数量性状座位(QTLs)初步分析[D].成都:四川农业大学,2006.
QTL analysis on characters related to flag leaf morphology of rice under salt and alkali conditions/
ZOU Detang,ZHANG Enyuan,SUN Jian,WANG Jingguo,LIU Hualong,ZHENG Hongliang
(School of Agriculture,Northeast Agricultural University,Harbin 150030)
The recombinant inbred lines(RIL)population derived from a cross Dongnong 425 and the salt and alkaline tolerant Changbai 10 was used as the mapping population.A genetic linkage map was constructed with 102 SSR makers and 113 Indel makers to identify the saline and alkali tolerance in rice.The whole growth period was treated with 6 ds·m-1NaCl solution as salt stress,Na2CO3solution PH 9.0 as alkaline stress and the normal water irrigation as control conditions.Traits of flag leaf were determined in the heading stage of rice in 2016 and 2017,and each trait was for QTL analysis.The results showed that the parents and RIL populations were more affected by alkali stress than salt stress in two years,each trait of parents showed significant correlation under the two conditions of salt and alkali,a total of 26 QTL related to flag leaf morphological traits were detected under two stress conditions of salt and alkali.qSLl9 andqALl8 were detected in two years and possibly were the major QTL.The results can provide theoretical basis for salt tolerance,basic QTL fine location and molecular assisted breeding of rice at heading stage.
rice;salt tolerance;alkaline tolerance;QTL(quantitative trait locus)
2017-10-30
黑龙江省自然科学基金青年基金(QC2017015);国家自然科学基金青年基金(31701507);东北农业大学“青年才俊项目”(16QC03)
邹德堂(1965-),男,教授,博士,博士生导师,研究方向为水稻遗传育种。E-mall:zoudt@163.com
S331
A
1005-9369(2017)11-0009-09
时间2017-12-7 12:33:35 [URL]http://kns.cnki.net/kcms/detail/23.1391.S.20171207.1233.002.html
邹德堂,张恩源,孙健,等.盐、碱条件下水稻剑叶形态相关性状QTL分析[J].东北农业大学学报,2017,48(11):9-17.
Zou Detang,Zhang Enyuan,Sun Jian,et al.QTL analysis on characters related to flag leaf morphology of rice under salt and alkali conditions[J].Journal of Northeast Agricultural University,2017,48(11):9-17.(in Chinese with English abstract)

