水稻回交群体剑叶性状综合评价及QTL定位
李杰 田蓉蓉 白天亮 朱春艳 宋佳伟 田蕾,* 马帅国,2 吕建东 胡慧 王震宇 罗成科 张银霞 李培富
水稻回交群体剑叶性状综合评价及QTL定位
李杰1田蓉蓉1白天亮1朱春艳1宋佳伟1田蕾1,*马帅国1,2吕建东1胡慧1王震宇1罗成科1张银霞1李培富1
(1宁夏大学 农学院/宁夏优势特色作物现代分子育种重点实验室, 银川 750021;2白银市农业农村局, 宁夏 白银 730900;*通信联系人,E-mail: tianlei2012@nxu.edu.cn)
【】通过对水稻剑叶性状的综合评价,明确剑叶相关性状间及与6个农艺性状的关系。检测剑叶相关性状的QTL,为优良株型品种选育,剑叶性状基因的精细定位和克隆奠定基础。以日本优质粳稻品种越光和葡萄牙粳稻地方种Bertone构建的回交群体两个世代为实验材料,利用BC3F1群体基因型构建遗传连锁图谱;测定亲本和BC3F2群体各株系剑叶SPAD、剑叶长、剑叶宽,计算剑叶长宽比、剑叶面积;利用隶属函数和标准差系数赋予权重法获得剑叶性状综合评价值(值),分析其与6个农艺性状间的关系。分别利用单标记分析(SPA)和区间作图(IM)检测水稻剑叶相关性状QTL。在抽穗灌浆期,两亲本剑叶SPAD值呈现先升高后降低的动态变化。BC3F2群体的5个剑叶相关性状变异丰富,总体表现趋向轮回亲本越光。4个剑叶形态性状间相关性均达到极显著水平,与剑叶SPAD的相关性不显著。主成分和逐步线性回归分析表明剑叶宽、剑叶SPAD、剑叶长、剑叶面积是影响剑叶综合评价值(值)的主要因子。高值株系的株高、穗长、茎基粗和单株产量均极显著高于低值株系,两者的分蘖数和有效穗数差异不显著。共检测到18个控制剑叶性状的QTL,分布在水稻第1、4、7和8染色体上,贡献率分布范围为4.00%~28.00%(SPA)和3.41%~27.00%(IM),除之外的17个QTL增效基因均来自Bertone。在第8染色体上的RM22720−RM404区间发现1个QTL簇,含6个主效QTL,分别为、、、、和。获得了剑叶宽、剑叶SPAD、剑叶长和剑叶面积4个评价剑叶性状的关键指标;明确了剑叶性状与单株产量之间的正相关关系;检测到18个剑叶相关性状QTL,位于第8染色体RM22720−RM404区间的QTL簇,是影响剑叶性状的1个重要染色体区域。
水稻;回交群体;剑叶性状;综合评价;QTL定位
叶片是水稻光合产物形成的重要源器官,光合量占植株总光合量的90%以上,为水稻生长发育提供了必需的光合同化产物与能量物质[1]。其中,剑叶合成籽粒中一半以上的碳水化合物,直接影响水稻产量[2-5]。理想的剑叶大小有利于水稻抽穗后光合产物的增加,对提高成穗率,促进籽粒灌浆具有重要作用[6-7]。剑叶主要通过调节光合叶面积、群体透光性、光合效率和净同化率来影响水稻产量[8]。剑叶性状包括叶长、叶宽、叶倾角、卷曲度、叶绿素含量等。剑叶长、宽直接决定长宽比和剑叶面积,影响净光合速率和群体透光性[6]。剑叶叶倾角是影响光截获量、光合效率和种植密度最重要的冠层结构参数之一[9],叶倾角较小的直立型叶有利于提高光合能力,增加籽粒充实度[10]。剑叶的适度卷曲有利于叶片挺直,从而改善水稻群体结构、提高光能利用率[11]。叶绿素是植物吸收、传递、转化光能的主要色素,较高的剑叶叶绿素含量,有利于保持较高的光合速率,促进水稻产量的提高[7, 12]。
与水稻剑叶相关的性状是由多基因控制的复杂数量性状,易受环境和遗传背景的影响[13-15]。目前,众多学者利用不同的遗传群体检测到许多剑叶性状QTL,分布于水稻12对染色体上[3-8, 12-20]。阿加拉铁等[12]以春江06/台中本地1号的F1花培加倍DH群体为材料,在水稻第4、6和8染色体上共检测到7个与剑叶叶绿素含量相关的QTL,分析了各个位点在水稻灌浆不同时期的分布和作用特点。彭伟业等[16]利用粳稻魔王谷和籼稻CO39配组衍生的重组自交系,检测到分布于水稻第1、3、4、6、7和9染色体上的12个控制剑叶性状的QTL,贡献率分布范围为4.26%~38.40%;Chen等[17]在第4染色体上检测到1个控制水稻剑叶宽的主效QTL,两年贡献率均在20%以上;Wang等[21]利用珍汕97和9311的回交群体精细定位了1个位于第1染色体上控制剑叶大小的主效QTL,该位点同时影响剑叶长和宽、剑叶面积和多个产量相关性状。目前,对水稻剑叶相关性状的研究主要集中在单一或少数几个剑叶相关性状的分析和评价,利用多元统计方法综合评价水稻剑叶特性的报道较少。本研究以剑叶性状差异显著的Bertone和越光为亲本构建的回交群体两个世代为材料,对5个剑叶相关性状进行测定和综合评价;探究剑叶相关性状对其他农艺性状的影响,开展QTL分析,旨在为优良剑叶性状基因的发掘和克隆奠定基础。
1 材料与方法
1.1 试验材料和种植方法
以葡萄牙粳稻地方品种Bertone为供体,日本粳稻品种越光为轮回亲本连续回交3代构建了1个包含260个株系的回交渗入系群体,包括BC3F1和BC3F2两个世代。2018年和2019年5月分别将两亲本及其后代群体BC3F1和BC3F2种植于宁夏大学教学实验农场(38.28°N,106.24°E)。试验材料单株移栽,每行12株,行长1.2 m,行株距为0.3 m×0.1 m。BC3F1群体无重复,BC3F2群体采用随机区组设计,每株系种植2行,3次重复。
1.2 剑叶和农艺性状调查
1.2.1 剑叶相关性状的测定
为了减少边际效应对表型的影响,待剑叶完全展开后,测量BC3F1群体除边行外的260个单株主茎穗及两个分蘖穗的剑叶SPAD、剑叶长和剑叶宽。两亲本和BC3F2群体每株系每重复随机选择中间5株,测量主茎穗的剑叶SPAD、剑叶长和剑叶宽。参照阿加拉铁等[12]的方法,利用SPAD-502型便携式叶绿素仪测量剑叶SPAD值;参照谈聪等[22]的方法计算剑叶面积,计算公式为剑叶面积=剑叶长×剑叶宽×0.75。5个剑叶相关性状分别取3个剑叶(BC3F1)或3个重复(BC3F2)的均值。
1.2.2 农艺性状的测定
利用隶属函数和标准差系数赋予权重法获得剑叶性状综合评价值(值)。选择BC3F2群体中值排名1~15和246~260的30个株系分别组成高值株系和低值株系,在成熟期分别测量株高、穗长、分蘖数、有效穗数、茎基粗,收获后考查单株产量。取样方法同剑叶性状。参考穆平等[23]方法,在乳熟期,以游标卡尺测量主茎茎秆基部2 cm处椭圆截面长度表示茎基粗。
1.3 数据统计分析
使用Excel 2013整理和计算试验数据,利用Excel 2013和Origin 2018软件绘图。利用SPSS 25.0软件对5个剑叶相关性状进行差异显著性、相关性、主成分和线性回归分析;对高、低值株系的6个农艺性状开展差异显著性分析,剑叶和农艺性状的相关性分析。参照田蕾等[24]的方法计算剑叶性状综合评价值(值)。
1.4 遗传连锁图谱构建、Bertone渗入系全基因组图示基因型绘制和QTL分析
参照王小雷等[25]的方法提取水稻叶片DNA,进行PCR扩增和电泳。利用Mapmanager QTXb 20软件的Morgan函数将重组率转化为遗传图距(cM),利用亲本间多态性SSR标记构建BC3F1遗传连锁图谱;利用Mapchart 2.2绘制连锁图[26];运用GGT 2.0软件绘制Bertone渗入系基因型图谱。参照Fu等[27]的方法分别利用单标记分析法(Single-point analysis,SPA)和区间作图法(Interval mapping,IM)进行水稻剑叶相关性状QTL检测,以step=1 cM,通过排列组合10 000次计算QTL阈值。分别以<0.01、LOD>2.53和LOD>2.02作为两种方法检测QTL存在的阈值,同时估算每个QTL的加性效应值和贡献率。QTL的命名原则遵循McCouch等[28]的方法。
2 结果与分析
2.1 亲本及回交群体剑叶相关性状分析
为了探究剑叶SPAD最佳测量时间和变化规律,2018年夏季对Bertone和越光的剑叶SPAD值进行动态监测。结果表明,两亲本剑叶SPAD值均随着生育期的推进呈现先增加再降低的趋势;越光剑叶SPAD峰值出现在叶片完全展开后7 d,Bertone推迟2 d出现峰值(图1-A)。与越光相比,Bertone的剑叶SPAD值变化幅度较大,为42.5~49.2,越光基本稳定在35.7。两亲本剑叶SPAD值在剑叶完全展开1~25 d内均表现出极显著差异,9 d时差异最大。因此,确定剑叶完全展开9 d为SPAD值的最佳测定时间,应用于两亲本及BC3F2群体的剑叶SPAD测定。
图1-B展示了两亲本和10个BC3F2代表性株系的剑叶形态学特征。1~3号株系剑叶长显著低于轮回亲本越光,其中2号株系叶片深绿,剑叶较宽;9、10号株系剑叶显著长于供体亲本Bertone;4~8号株系剑叶长、宽趋向于Bertone,其中6号株系剑叶黄绿,叶宽与越光相近。与两亲本相比,BC3F2群体的剑叶SPAD、剑叶长、剑叶宽和剑叶面积均极显著低于Bertone,剑叶长宽比显著高于Bertone(表1,辅助性图S1)。在两亲本中,剑叶长和剑叶长宽比均表现出较大的变异范围,剑叶SPAD、剑叶宽和剑叶面积的变异范围较小。
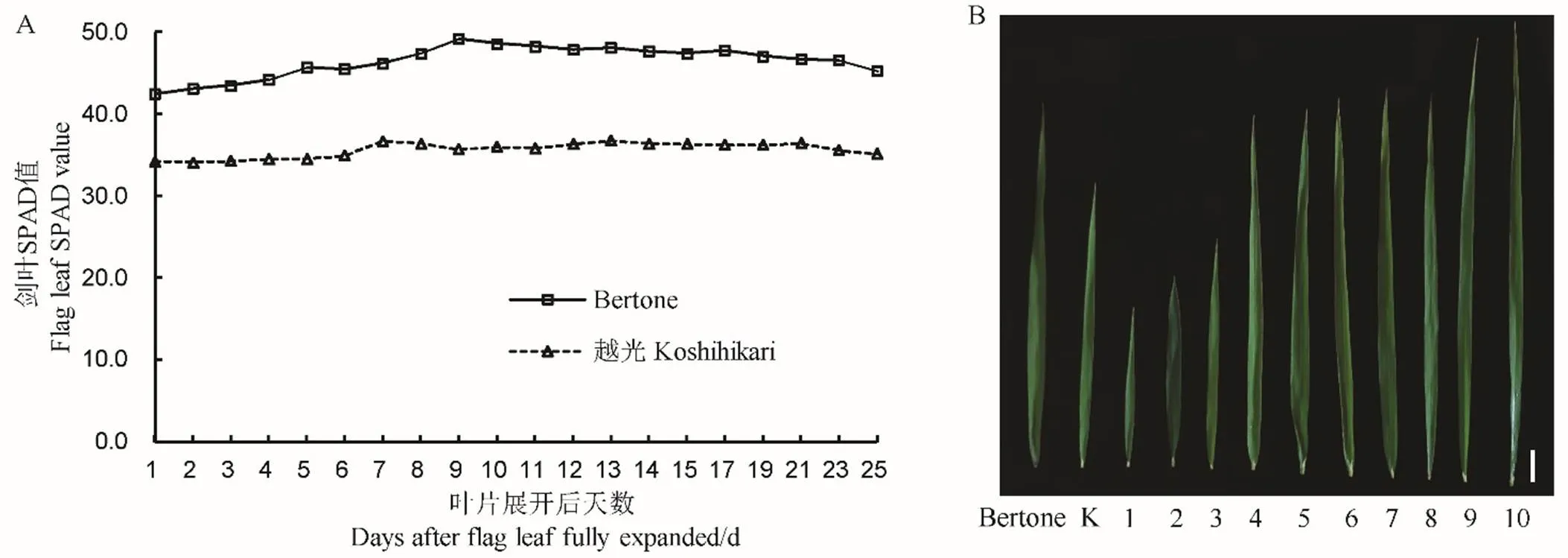
A-2018年Bertone和越光剑叶SPAD值动态变化;B-亲本和BC3F2代表性株系的剑叶形态学特征。K−越光;1~10表示10个BC3F2代表性株系;竖线代表5 cm。
Fig. 1. Flag leaf traits of parents and BC3F2population.

表1 越光和Bertone及其两个回交群体5个剑叶性状表现
FLSPAD, Flag leaf SPAD; FLL, Flag leaf length; FLW, Flag leaf width; FLWR, Length to width ratio of flag leaf; FLA, Flag leaf area.
两亲本间剑叶SPAD、剑叶宽、剑叶面积呈极显著差异,剑叶长和剑叶长宽比呈显著差异(表1);两个回交世代5个剑叶性状变异丰富。BC3F1群体变异系数分布范围为8.75%~22.80%;BC3F2群体变异系数分布范围为5.00%~12.81%。其中,剑叶面积的分布范围均为最广。与BC3F1群体相比,BC3F2群体各剑叶性状变异系数均表现出不同程度的降低,剑叶宽的变异系数降幅最大,为57.16%。根据5个剑叶性状的峰度、偏度检验结果(表1)及频率分布(图2),发现BC3F2群体各剑叶性状和综合评价值(值)均表现为连续性变异的正态分布,表明这6个性状均为多基因控制的数量性状,符合QTL检测及作图要求。
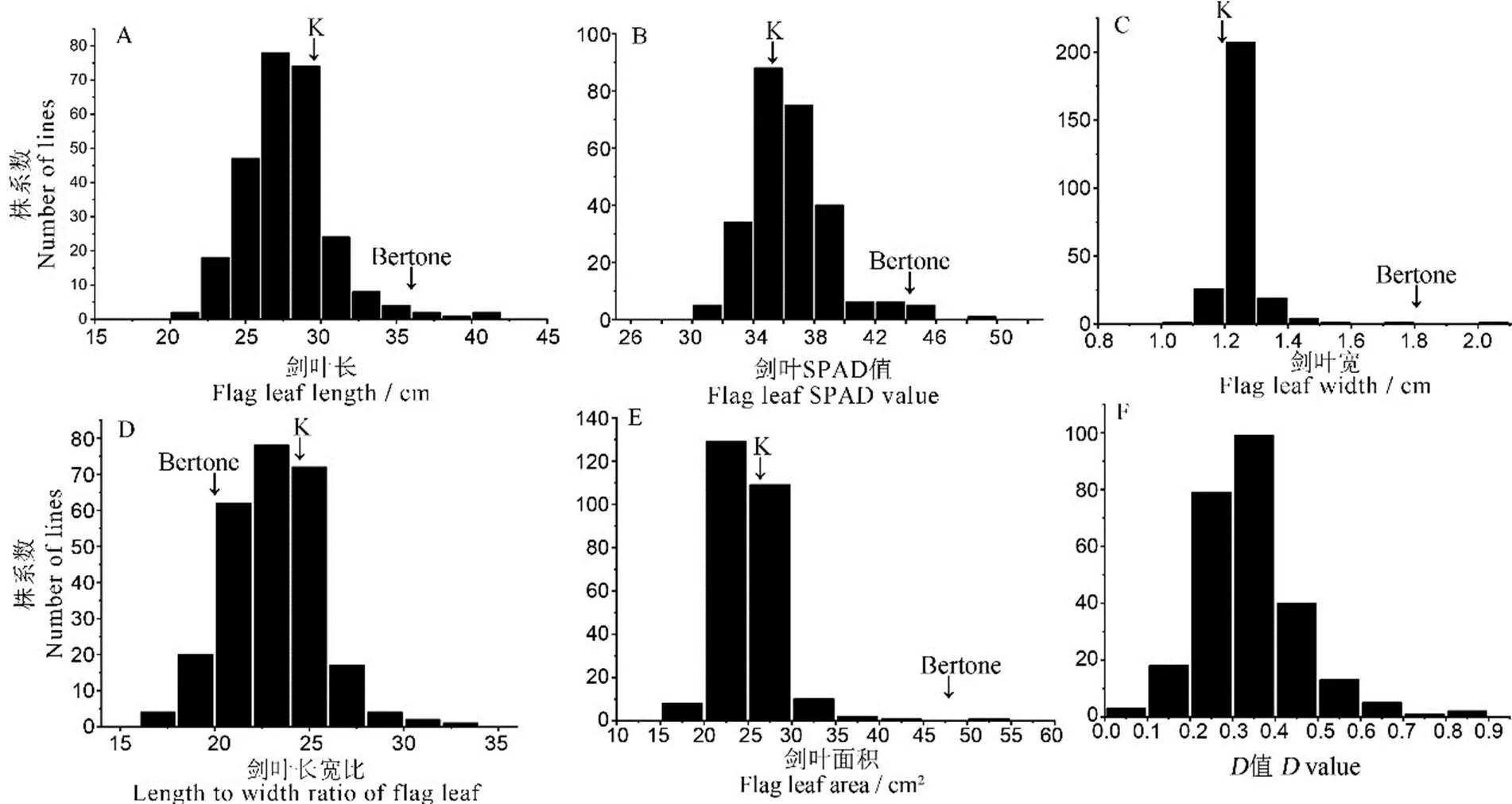
K代表越光。K,Koshihikari.
Fig. 2. Distribution of five flag leaf-related traits and comprehensive evaluation (value) for BC3F2population.
2.2 5个剑叶性状的相关性分析
对BC3F2群体的5个剑叶性状进行相关性分析(表2)。结果表明,剑叶SPAD与剑叶长、剑叶宽、剑叶长宽比和剑叶面积相关未达显著水平;剑叶长与剑叶宽、剑叶长宽比和剑叶面积均呈极显著正相关,其中与剑叶面积的相关系数最大,为0.913;剑叶宽与剑叶面积呈极显著正相关,与剑叶长宽比呈极显著负相关;剑叶长宽比与剑叶面积呈极显著正相关。
2.3 水稻剑叶性状的主成分分析及综合评价
2.3.1 主成分分析
对BC3F2群体5个剑叶性状进行主成分分析,提取到3个主成分,特征值分别为2.709、1.302和0.984,累积贡献率99.897%(表3),已概括原来5个剑叶性状指标的绝大部分信息。主成分CI1的贡献率为54.171%,剑叶长、剑叶长宽比和剑叶面积是该主成分的主要作用因子,载荷值分别为0.991、0.838和0.954;主成分CI2的贡献率为26.043%,剑叶宽和长宽比是该主成分的主要作用因子,载荷值分别为0.948和−0.545,其中,长宽比对CI2表现为负效应;主成分CI3的贡献率为19.683%,剑叶SPAD是其主要作用因子,载荷值为0.985,另外4个剑叶性状对该主成分的贡献较小,均起负效应作用。综合3个主成分所携带的信息,5个剑叶性状对剑叶综合评价均有重要作用,长宽比的影响较小。
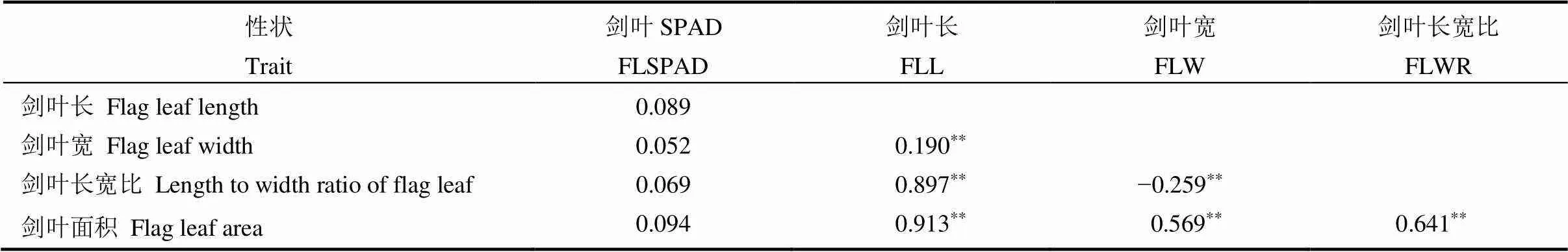
表2 BC3F2群体剑叶性状间相关性分析
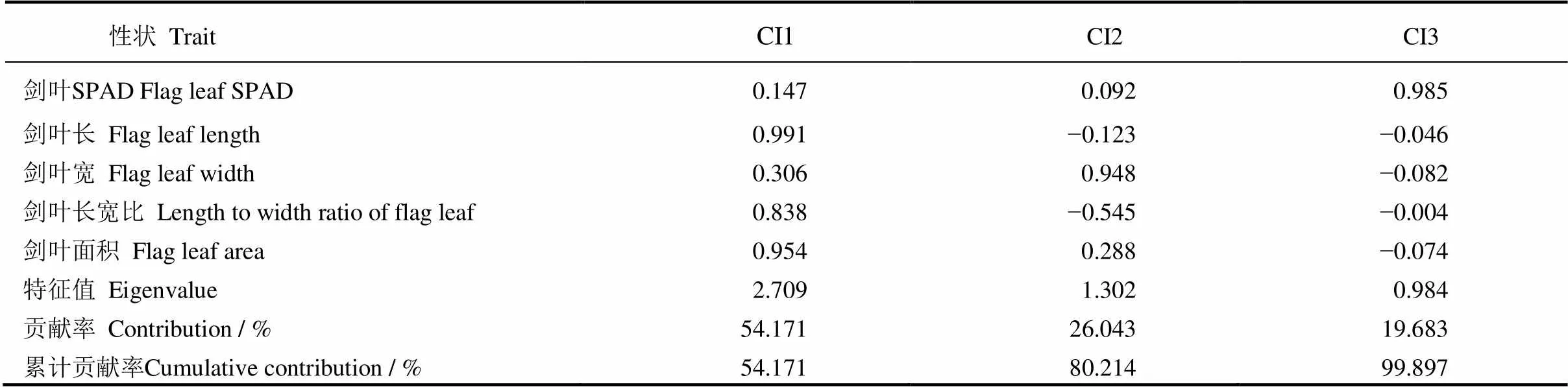
表3 5个剑叶性状3个主成分的载荷值、特征值及贡献率
2.3.2 隶属函数及剑叶性状综合评价
利用提取到的3个主成分综合性状值(CI1、CI2和CI3)计算BC3F2群体260个株系的隶属函数值(X)。对于同一综合指标如CI1,BIL22株系(X)最大,其值为1,表明该株系在主成分CI1表现为最佳,而BIL122的(X)最小,其值为0,表明该株系在这一主成分上表现为最差。依据提取到的3个主成分指标贡献率大小,依次求出3个剑叶相关性状综合指标的权重,分别为0.5423、0.2607和0.1970。以隶属函数(X)、(X)和(X)结合权重处理并累加得到剑叶性状综合评价值,并依此对BC3F2群体的260个株系进行排名。
综合评价值(值)客观反映了BC3F2群体260个株系剑叶性状的表现情况,数值越大说明剑叶综合表现越好。选取综合排名前1~15名作为高值株系,其值均在0.535以上,其中BIL22为值最高的株系,值为0.8482。选取第246~260名作为低值株系,值均在0.188以下,BIL210的值最低,仅为0.0666。
2.3.3 高、低值株系农艺性状差异显著性分析
为探究剑叶性状与农艺性状间的关系,对高、低值株系的株高、穗长、分蘖数、有效穗数、单株产量和茎基粗6个农艺性状进行差异显著性分析。结果表明,高值株系的株高、穗长、单株产量和茎基粗均极显著高于低值株系(图3),尤其在单株产量上差异最明显;二者在分蘖数和有效穗数2个性状的差异均未达到显著水平。
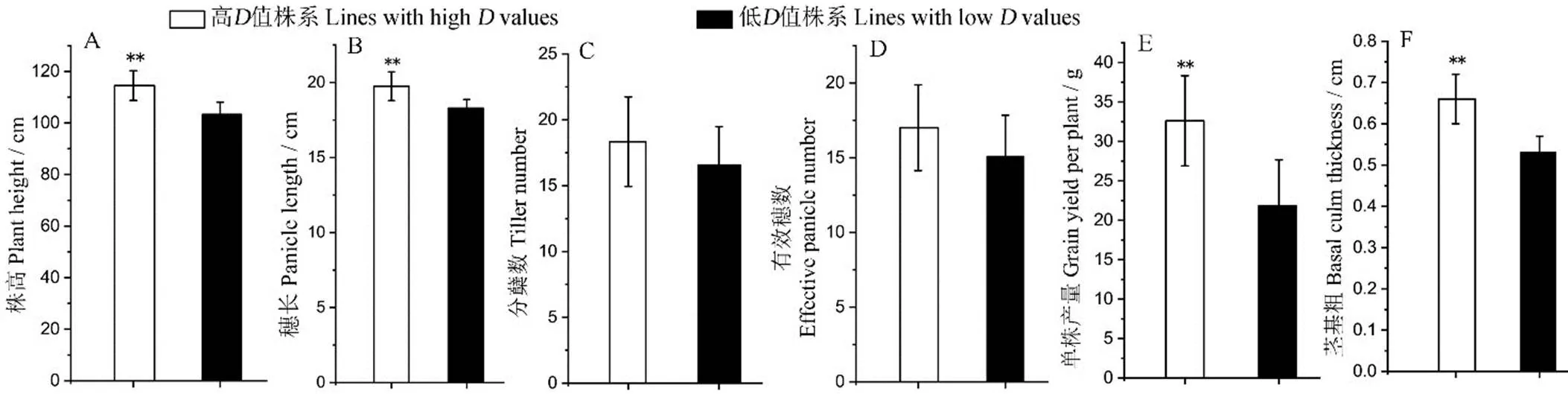
图3 高、低剑叶综合评价值(D值)株系6个农艺性状表现
Fig. 3. Six agronomic traits of BC3F2lines with high and low comprehensive evaluation value (value).
2.3.4 高、低值株系农艺性状与剑叶性状的相关性分析
将包括综合评价值在内的6个剑叶相关性状与6个农艺性状进行相关性分析,结果如表4。茎基粗与6个剑叶相关性状均呈极显著正相关,它是与综合评价值相关系数最大的1个农艺性状;单株产量与剑叶SPAD、剑叶长、剑叶宽、剑叶面积和综合评价值呈极显著正相关,与剑叶长宽比呈显著正相关;分蘖数和有效穗数与6个剑叶相关性状之间的相关性均未达到显著水平;穗长与剑叶长、剑叶长宽比、剑叶面积和值均呈极显著正相关,与剑叶SPAD呈显著正相关;株高与6个剑叶相关性状均呈极显著或显著正相关。
6个农艺性状之间,茎基粗与株高、穗长和单株产量均呈极显著正相关;单株产量与株高、分蘖数、有效穗数和茎基粗均呈极显著正相关,与穗长呈显著正相关;有效穗数与分蘖数和单株产量呈极显著正相关;分蘖数与有效穗数和单株产量呈极显著正相关;穗长与株高、单株产量和茎基粗呈极显著正相关;株高与穗长、单株产量和茎基粗呈极显著正相关。
2.3.5 回归模型的建立及主要剑叶相关性状筛选
利用6个剑叶相关性状(含值)建立可用于水稻剑叶性状评价的数学回归模型,将综合评价值作为因变量,将其余5个剑叶相关性状作为自变量进行逐步线性回归分析,建立最优回归方程如下:
=−1.527+0.017+0.015+0.381+0.014(=1.000,2=0.999,=83898.282);
由方程可知,5个剑叶相关性状中有4个性状均对值有显著性影响,分别是剑叶SPAD、剑叶长、剑叶宽和剑叶面积,它们与值均呈极显著相关。结合这4个剑叶性状的偏回归系数,剑叶SPAD、剑叶长、剑叶宽和剑叶面积可作为剑叶性状评价的关键指标。

表4 高、低D值株系剑叶相关性状与农艺性状的相关系数矩阵
*<0.05;**<0.01.
FLSPAD, Flag leaf SPAD; FLL, Flag leaf length; FLW, Flag leaf width; FLWR, Length to width ratio of flag leaf; FLA, Flag leaf area; PH, Plant height; PL, Panicle length; TN, Tiller number; EP, Effective panicle number; YPP, Grain yield per plant;BCT, Basal culm thickness.
2.4 遗传连锁图谱构建及Bertone渗入系图示基因型绘制
选择均匀分布于水稻12对染色体上的1392对SSR引物(http://www.gramene.org)对Bertone和越光进行差异引物筛选,共筛选出209对具有明显差异的多态性引物,多态性频率为15.01%。选用其中81对分布均匀且扩增效果好的引物对BC3F1群体260个单株进行基因型鉴定,构建了1张覆盖水稻全基因组约2067.9 cM的遗传连锁图谱,标记间平均距离为25.5 cM,平均每对染色体上的标记数为6.75个。根据BC3F1群体的260个单株81个SSR标记基因型,通过GGT 2.0软件获得了Bertone渗入系的图示基因型(图4),可覆盖大约90% Bertone基因组。

蓝色区域,杂合基因型;红色区域,Bertone纯合基因型;灰白色区域,越光纯合基因型。
Fig. 4. Graphical genotypes of the 260 BC3F1lines of Bertone with Koshihikari genetic background.
2.5 剑叶相关性状QTL定位
利用已构建的遗传连锁图谱,结合BC3F2群体各株系的6个剑叶相关性状值,采用Mapmanager QTXb 20软件的单标记分析法(SPA)和区间作图法(IM)同时检测到18个剑叶相关性状QTL(图5和表5),分布于水稻第1、4、7和8染色体。SPA法检测到的QTL LOD值介于2.53~18.26,贡献率分布范围为4.00%~28.00%。IM法检测到的QTL LOD值介于2.02~17.79之间,贡献率分布范围为3.41%~27.00%。在第8染色体的RM22720-RM404区间发现1个QTL簇,在RM22720-RM6032和RM6032-RM404区间检测到控制不同剑叶性状的多个QTL。
2.5.1 剑叶SPAD
共检测到3个控制剑叶SPAD QTL,分别位于水稻第1和4染色体上,LOD值分布范围分别为3.91~9.91(SPA)和3.16~4.47(IM)。表型贡献率分别介于7.00%~17.00%(SPA)和5.00%~7.69%(IM)之间。其中,的贡献率最高,分别为17.00%(SPA)和7.69%(IM),加性效应值分别为−2.83和−1.46,说明增效等位基因来自Bertone,能增加水稻剑叶SPAD值。而位于第1染色体上的加性效应值为1.21,表明增效等位基因来自越光。
2.5.2 剑叶长
共检测到2个控制剑叶长QTL,均位于第8染色体上,二者的遗传距离比较接近。和的贡献率均大于10%,分别为19.00%和20.00%(SPA),19.00%和18.00%(IM),认为这两个QTL均为剑叶长主效QTL。2个剑叶长QTL的加性效应均小于−3.0 cm,说明来自Bertone的等位基因能使剑叶长至少增加3 cm。
2.5.3 剑叶宽
共检测到4个控制剑叶宽QTL,分别位于水稻第7和8染色体上。表型贡献率分别介于4.00%~16.00%(SPA)和3.41%~14.83%(IM);加性效应分布范围为−0.07 ~ −0.02 cm,表明剑叶宽增效等位基因均来自Bertone。两种方法检测到的和的贡献率均高于10%,为控制剑叶宽的主效位点。
2.5.4 剑叶长宽比
共检测到2个控制剑叶长宽比QTL,均位于第8染色体。和的LOD值分别为4.22、5.15(SPA)和3.70、4.16(IM),但贡献率较低,两种检测方法均低于10%。2个长宽比QTL的加性效应值均为负,表明其增效等位基因来自Bertone。
2.5.5 剑叶面积
共检测到4个控制剑叶面积QTL,分别位于第1和8染色体,贡献率分别介于5.00%~28.00%(SPA),7.26%~27.00%(IM)。其中,和贡献率均低于10%,属于微效QTL。和贡献率均高于20%,为控制剑叶面积的主效QTL,其加性效应值均为负,增效等位基因来自Bertone,它们对水稻剑叶面积增效明显,分别可增加3.96 cm2(SPA)、4.43 cm2(IM)和4.24 cm2(SPA)、4.05 cm2(IM)。
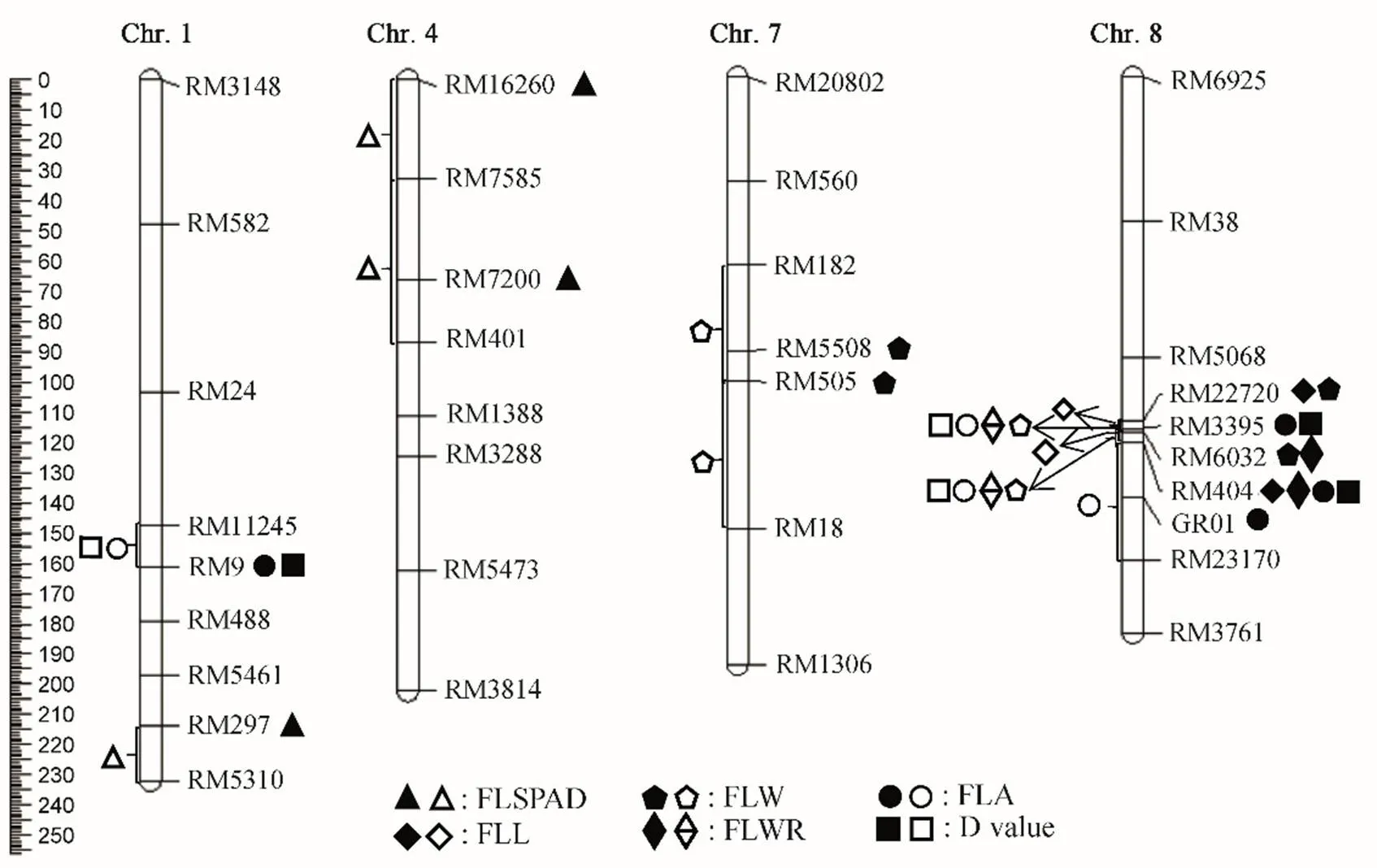
实心符号表示SPA检测到的QTL;空心符号表示IM检测到的QTL。
Fig. 5. Location and the distribution of QTLs for flag leaf related traits in BC3F1population on chromosomes in rice.

表5 两种方法定位到的水稻剑叶相关性状QTL
PVE, Percentage of variance explained; Add, Additive effect.
2.5.6 剑叶性状综合评价值(值)
共检测到3个控制值QTL,分布于第1和第8染色体。检测到的值QTL位点与剑叶宽、剑叶长宽比和剑叶面积QTL存在部分重叠,但贡献率及加性效应表现不同。贡献率分布范围分别为7.00%~26.00%(SPA)和 4.35%~25.50%(IM),加性效应为−0.16~−0.05,增效等位基因来自Bertone。
3 讨论
3.1 水稻剑叶叶绿素含量及相关QTL的动态变化
叶绿素是植物吸收、传递和转换光能的关键色素,是水稻光合作用的物质基础[29]。改善水稻剑叶叶绿素含量、维持较长的叶绿素含量相对稳定期可以调节光合生理,有效提高水稻光合速率、产量和品质[30]。水稻剑叶的叶绿素含量是一个动态的变化过程。殷延勃等[31]发现不同水稻品种的剑叶SPAD值存在较大差异,同一品种的剑叶SPAD在抽穗灌浆期大多表现为先升高后降低的趋势,只是峰值出现的时间不同,多表现为剑叶完全展开后3~4周;Huang等[32]和阿加拉铁等[12]的研究发现剑叶SPAD的峰值出现在剑叶完全展开后10~14 d。本研究通过对两亲本剑叶完全展开后1~25 d剑叶SPAD的监测,发现SPAD值均随着生育期的推进表现为先增加再降低的趋势,峰值分别出现在剑叶完全展开后7 d和9 d,且两亲本的剑叶SPAD值在整个抽穗灌浆期内均表现为极显著差异。
水稻剑叶叶绿素含量QTL也表现为明显的动态变化,灌浆期不同阶段调控剑叶叶绿素含量的QTL是有差异的[12, 33-34]。胡茂龙等[33]在水稻抽穗后7 d检测到1个贡献率为11.2%的QTL(),该位点在30 d时未检测到,其遗传效应表现为随水稻叶片的衰老而降低;也有研究发现控制水稻剑叶SPAD值的QTL主要在灌浆中后期表达,是不同的位点,贡献率表现为逐渐上升[12,34]。Huang等[32]在水稻抽穗后0 d、10 d、20 d和30 d分别检测到多个控制剑叶SPAD的QTL,其中和分别为0 d和30 d特有的QTL位点,不同时期共有的QTL位点间存在明显的上位性关系,表明水稻剑叶叶绿素含量的动态变化可能是多个基因表达和互作的综合结果。
3.2 水稻剑叶性状与理想株型和产量的关系
剑叶形态性状是水稻理想株型的重要组成部分,改良剑叶大小是水稻株型和超高产育种的重要目标之一[14, 16]。水稻理想株型中剑叶性状主要通过长、宽、叶面积、叶倾角、披垂度等调节水稻的光合面积和群体透光率来影响水稻产量[8],一般表现为叶片较长、宽度和叶面积适中、叶倾角较小的直立型叶[10, 20]。在剑叶与产量构成因素的相关性研究方面,周丽慧等[13]发现剑叶长、剑叶宽和剑叶面积均与主穗颖花数呈极显著正相关,剑叶宽与主穗千粒重呈极显著正相关,上述指标与主穗结实率的相关性均未达到显著水平;张强等[14]发现剑叶宽与千粒重呈显著正相关,剑叶长与千粒重呈显著负相关;彭伟业等[16]则发现剑叶长、宽与千粒重之间相关性未达到显著水平。水稻剑叶长[6, 8, 22]、宽[4, 6, 22]和剑叶面积[6, 22]均与单株产量呈极显著正相关;在水稻种质资源中,上述3个剑叶大小性状与单株产量的相关程度较低,表明单一改良剑叶长、剑叶宽或剑叶面积对提高水稻产量存在局限性,水稻产量与剑叶性状之间存在复杂的遗传关系[6]。本研究中除剑叶长宽比外,5个剑叶相关性状均与水稻单株产量呈极显著正相关,其中剑叶综合评价值与单株产量的相关系数最大,为0.686,高值株系的单株产量极显著高于低值株系,表明对水稻剑叶性状的综合改良可有效提高水稻产量。
3.3 水稻剑叶性状QTL定位和基因克隆
目前,已报道的剑叶相关性状QTL主要是一些控制剑叶长[4, 8, 16, 18]、剑叶宽[18-20,35]、剑叶长宽比[4, 15, 26]、剑叶面积[15, 16]、剑叶叶绿素含量[12, 29, 32]、剑叶倾角[10, 20]、剑叶卷曲度[11]、剑叶干重[3, 14]等性状的位点。精细定位的剑叶性状QTL主要有调控剑叶叶绿素含量的[7],控制剑叶卷曲的[11],调节剑叶倾角的[10],影响剑叶长的[21]、[5]和[36],控制剑叶宽的[4]、[37]和[17]。其中,源于基因的可变剪切,编码1个植物特有蛋白[38],通过控制细胞分裂和生长,影响水稻生长素的极性运输和维管束排列模式,对剑叶横向生长起重要作用[39];在粳稻中的等位基因可使其超表达株系剑叶大小和叶绿素含量显著提高,穗型也得到了改良[40]。基因是1个同时控制水稻每穗粒数、株高和抽穗期的主效QTL[41],谈聪等[22]研究发现,该基因超表达植株的剑叶长、宽和面积与受体亲本合江19相比均极显著增加,证实了对剑叶大小的调控作用。本研究利用回交群体对水稻6个剑叶相关性状(含值)进行QTL检测,共定位到18个QTL,分布于水稻第1、4、7和8染色体。与前人研究结果比较发现,控制剑叶宽的与张玲等[26]检测到的位于相同区间,与邵高能等[42]报道的区间重叠。Yue等[35]报道的控制剑叶SPAD值QTL和与本研究定位到的位于相同区间,可能是同1个QTL位点。上述3个QTL位点可以在不同的群体和环境下重复检测到,其中与Zhang等[4]精细定位的位于相近的定位区间,是1个客观、准确、重复性好的剑叶宽QTL。
3.4 QTL簇及其多效性
在水稻基因组中,控制相关性状的QTL常在同一对染色体上成簇分布,这些QTL往往表现出不同程度的多效性[16,43]。Wang等[44]利用珍汕97和9311构建的BRIL群体在水稻第1、3、6、7、8、9和11染色体上均检测到了控制剑叶形态性状的QTL簇。童汉华等[3]利用珍汕97和HR5构建的RIL群体,在水稻第3染色体的RM5474-RM3392区间定位到同时控制剑叶宽()、剑叶鲜质量()和剑叶干质量()的1个QTL簇。Ye等[7]在第6染色体的47.05-55.47 cM区间和第7染色体的47.78-52.17 cM区间均检测到1个同时控制水稻上三叶叶绿素含量的QTL簇。本研究在第8染色体的RM22720-RM404区间内发现1个QTL簇,其中涵盖同时控制剑叶长、剑叶宽、剑叶长宽比、剑叶面积和综合评价值的多个QTL,贡献率分布范围分别为7.00%~28.00%(SPA)和6.33%~27.00%(IM),来自Bertone的等位基因可不同程度地对上述剑叶相关性状起增效作用。本研究检测到的贡献率>15%的主效QTL均分布于该区间内,控制剑叶长、剑叶面积和值QTL的LOD值曲线表现为明显的双峰分布(数据未列出),表明该QTL簇可能来源于两个紧密连锁的多效性QTL。区间作图(IM)结果表明,控制值的主效QTL与位于第8染色体上影响剑叶长、剑叶宽、剑叶长宽比和剑叶面积的QTL之间表现为明显的遗传重叠,这与上述性状间的极显著正相关一致,与最优回归方程中,剑叶宽等剑叶形态性状是影响值的主要因子相一致。
QTL簇的多效性不仅表现在相关性状间,也有同时控制多个不同类型性状的报道。Zhang等[4]利用9311和培矮64S构建的RIL群体,在水稻第7染色体上的45.30-53.34 cM 区间内同时检测到控制剑叶宽的和控制单株产量的。Tian等[19]在第1染色体的RM3521-RM8111区间同时定位到控制水稻剑叶宽的和每穗粒数的。Xu等[45]在第3染色体的GL3−RM15578区间内检测到同时控制剑叶长、籽粒长宽比和千粒重的QTL簇。这种QTL成簇分布的现象,通常是由于基因的一因多效或连锁重叠造成的[43],要研究其调控机理还需开展精细定位、克隆及功能验证等工作进一步分析。
4 结论
通过对剑叶相关性状的综合评价,获得剑叶宽、剑叶SPAD、剑叶长、剑叶面积4个影响值的主要因子。6个剑叶相关性状均与单株产量呈极显著或显著正相关,其中值的相关系数最大。高值株系的株高、穗长、茎基粗和单株产量均极显著高于低值株系。利用区间作图法共检测到18个QTL,分布于水稻第1、4、7和8染色体,贡献率超过15%的有6个,贡献率最高,为27.00%。在第8染色体上发现1个QTL簇,涵盖了控制值和剑叶形态性状的10个QTL,表现为明显的多效性。
在线辅助信息:在线辅助性图S1放在中国水稻科学网上,网址为http://www.ricesci.cn。
[1] 李可, 禹晴, 徐云姬, 杨建昌. 水稻叶片早衰突变体的农艺与生理性状研究进展[J]. 中国水稻科学, 2020, 34(2): 104-114.
Li K, Yu Q, Xu Y J, Yang J C. Research progress in agronomic and physiological traits of early leaf senescence mutants in rice[J]., 2020, 34(2): 104-114. (in Chinese with English abstract)
[2] Lü W K, Hu H, He L P, Zhang X C, Ou X X, Chen H Y, Yu S B, Xu J L, Qiu X J, Li Z X, Xu J Y, Wang X Y, Liu Z Y, Wang C R, Jiang J F, Lou J. Characterization and fine mapping of two white panicle genes with duplicated effect in rice[J]., 2018, 20: 2805-2811.
[3] 童汉华, 梅捍卫, 邢永忠, 曹一平, 余新桥, 章善庆, 罗利军. 水稻生育后期剑叶形态和生理特性的QTL定位[J]. 中国水稻科学, 2007, 21(5): 493-499.
Tong H H, Mei H W, Xing Y Z, Cao Y P, Yu X Q, Zhang S Q, Luo L J. QTL analysis for morphological and physiological characteristics of flag leaf at the late developmental stage in rice[J]., 2007, 21(5): 493-499. (in Chinese with English abstract)
[4] Zhang B, Ye W J, Ren D Y, Tian P, Peng Y L, Gao Y, Ruan B P, Wang L, Zhang G H, Guo L B, Qian Q, Gao Z Y. Genetic analysis of flag leaf size and candidate genes determination of a major QTL for flag leaf width in rice[J]., 2015, 8(1):1-10.
[5] Shen B, Yu W D, Zhu Y J, Fan Y Y, Zhuang J Y. Fine mapping of a major quantitative trait locus,, controlling flag leaf length and yield traits in rice (L.)[J]., 2012, 184(1): 57-64.
[6] 朱双兵, 吕文恺, 何丽萍, 邢丹英, 杨隆维, 邱先进, 徐建龙. 全基因组关联分析解析水稻剑叶及单株产量的遗传基础[J]. 植物遗传资源学报, 2020, 21(3): 663-673.
Zhu S B, Lü W K, He L P, Xing D Y, Yang L W, Qiu X J, Xu J L. Genetic dissection of flag leaf related traits and grain yield per plant using genome-wide association analysis[J]., 2020, 21(3): 663-673. (in Chinese with English abstract)
[7] Ye W J, Hu S K, Wu L W, Ge C W , Cui Y T, Chen P, Xu J, Dong G J, Guo L B, Qian Q. Fine mapping a major QTLqFCC7for chlorophyll content in rice (L.) cv. PA64s[J]., 2017, 81(1): 81-90.
[8] 周勇, 陶亚军, 姚锐, 李畅, 谭文琛, 裔传灯, 龚志云, 梁国华. 利用染色体片段代换系定位水稻叶片形态性状QTL[J]. 作物学报, 2017, 43(11): 1650-1657.
Zhou Y, Tao Y J, Yao R, Li C, Tan W C, Yi C D, Gong Z Y, Liang G H. QTL mapping for leaf morphological traits of rice using chromosome segment substitution lines[J]., 2017, 43(11): 1650-1657. (in Chinese with English abstract)
[9] 胡娟, 林晗, 徐娜, 焦然, 戴志俊, 鲁草林, 饶玉春, 王跃星. 水稻叶倾角分子机制及育种应用的研究进展[J]. 中国水稻科学, 2019, 33(5): 391-400.
Hu J, Lin H, Xu N, Jiao R, Dai Z J, Lu C L, Rao Y C, Wang Y X. Advances in molecular mechanisms of rice leaf inclination and its application in breeding[J]., 2019, 33(5): 391-400. (in Chinese with English abstract)
[10] 朱长丰, 梁利君, 曾思远, 李天伟, 董冠杉, 洪德林. 水稻剑叶角度位点的精细定位[J]. 中国水稻科学, 2016, 30(1): 27-34.
Zhu C F, Liang L J, Zeng S Y, Li T W, Dong G S, Hong D L. Fine mapping offor flag leaf angle in rice[J]., 2016, 30(1): 27-34. (in Chinese with English abstract)
[11] 张孝波, 谢佳, 张晓琼, 田维江, 何沛龙, 刘思岑, 何光华, 钟秉强, 桑贤春. 水稻矮化剑叶卷曲突变体的鉴定与基因精细定位[J]. 中国农业科学, 2017, 50(9): 1551-1558.
Zhang X B, Xie J, Zhang X Q, Tian W J, He P L, Liu S C, He G H, Zhong B Q, Sang X C. Identification and gene mapping of a dwarf and curled flag leaf mutantin rice [J]., 2017, 50(9): 1551-1558. (in Chinese with English abstract)
[12] 阿加拉铁, 曾龙军, 薛大伟, 胡江, 曾大力, 高振宇, 郭龙彪, 李仕贵, 钱前. 水稻灌浆期不同阶段叶绿素含量的QTL分析[J]. 作物学报, 2008, 34(1): 61-66.
A J L T, Zeng L J, Xue D W, Hu J, Zeng D L, Gao Z Y, Guo L B, Li S G, Qian Q. QTL analysis for chlorophyll content in four grain-filling stage in rice[J]., 2008, 34(1): 61-66. (in Chinese with English abstract)
[13] 周丽慧, 赵春芳, 赵凌, 张亚东, 朱镇, 陈涛, 赵庆勇, 姚姝, 于新, 王才林. 利用染色体片段置换系群体检测水稻叶片形态QTL[J]. 中国水稻科学, 2013, 27(1): 26-34.
Zhou L H, Zhao C F, Zhao L, Zhang Y D, Zhu Z, Chen T, Zhao Q Y, Yao S, Yu X, Wang C L. QTL detection for leaf morphology of rice using chromosome segment substitution lines[J].2013, 27(1): 26-34. (in Chinese with English abstract)
[14] 张强, 陈凯, 梁云涛, 章禄标, 郑天清, 徐建龙, 张文忠, 黎志康. 利用双向导入系剖析水稻源、库相关性状的QTL[J]. 核农学报, 2013, 27(3): 261-271.
Zhang Q, Chen K, Liang Y T, Zhang L B, Zheng T Q, Xu J L, Zhang W Z, Li Z K. QTL mapping of sink-source related traits using two sets of reciprocal introgression lines in rice[J]., 2013, 27(3): 261-271. (in Chinese with English abstract)
[15] 王兰, 黄李超, 代丽萍, 杨窑龙, 徐杰, 冷语佳, 张光恒, 胡江, 朱丽, 高振宇, 董国军, 郭龙彪, 钱前, 曾大力. 利用日本晴/9311重组自交系群体定位水稻成熟期叶形相关性状QTL[J]. 中国水稻科学, 2014, 28(6): 589-597.
Wang L, Huang L C, Dai L P, Yang Y L, Xu J, Leng Y J, Zhang G H, Hu J, Zhu L, Gao Z Y, Dong G J, Guo L B, Qian Q, Zeng D L. QTL analysis for rice leaf morphology at maturity stage using a recombinant inbred line population derived from a cross between Nipponbare and 9311[J]., 2014, 28(6): 589-597. (in Chinese with English abstract)
[16] 彭伟业, 孙平勇, 潘素君, 李魏, 戴良英. 水稻品种魔王谷粒形、剑叶性状和株高QTL定位[J]. 作物学报, 2018, 44(11): 1673-1680.
Peng W Y, Sun P Y, Pan S J, Li W, Dai L Y. Mapping QTLs for grain shape, flag leaf traits, and plant height in rice variety Mowanggu[J]., 2018, 44(11): 1673-1680. (in Chinese with English abstract)
[17] Chen M L, Luo J, Shao G N, Wei X J, Tang S Q, Sheng Z H, Song J, Hu P S. Fine mapping of a major QTL for flag leaf width in rice,, which might be caused by alternative splicing of[J]., 2012, 31(5): 863-872.
[18] Farooq M, Tagle A G, Santos R E, Ebron L A, Kobayashi N. Quantitative trait loci mapping for leaf length and leaf width in rice cv. IR64 derived lines[J]., 2010, 52(6): 578-584.
[19] Tian Y H, Zhang H Y, Xu P Z, Chen X Q, Liao Y X, Han B L, Chen X B, Fu X D, Wu X J. Genetic mapping of a QTL controlling leaf width and grain number in rice[J]., 2015, 202(1): 1-11.
[20] Bian J M, He H H, Shi H, Zhu G Q, Li C J, Zhu C L, Peng X S , Yu Q Y, Fu J R, He X P , Chen X R, Hu L F, Lin J, Ou-Yang L J. Quantitative trait loci mapping for flag leaf traits in rice using a chromosome segment substitution line population[J]., 2014, 133(2): 203-209.
[21] Wang P, Zhou G L, Yu H H, Yu S B. Fine mapping a major QTL for flag leaf size and yield-related trait in rice[J]., 2011, 123: 1319-1330.
[22] 谈聪, 翁小煜, 鄢文豪, 白旭峰, 邢永忠. 多效性基因调控水稻剑叶面积[J]. 遗传, 2012, 34(7): 901-906.
Tan C, Weng X Y, Yan W H, Bai X F, Xing Y Z., a pleiotropic gene controlling flag leaf area in rice[J].2012, 34(7): 901-906. (in Chinese with English abstract)
[23] 穆平, 李自超, 李春平, 张洪亮, 王象坤. 水、旱条件下水稻茎秆主要抗倒伏性状的QTL分析[J]. 遗传学报, 2004(7): 717-723.
Mu P, Li Z C, Li C P, Zhang H L, Wang X K. QTL analysis for lodging resistance in rice using a DH population under lowland and upland ecosystems[J]., 2004(7): 717-723. (in Chinese with English abstract)
[24] 田蕾, 陈亚萍, 刘俊, 马晓刚, 王娜, 杨兵, 李莹, 郭海东, 李娟, 胡慧, 张银霞, 李培富. 粳稻种质资源芽期耐盐性综合评价与筛选[J]. 中国水稻科学, 2017, 31(6): 631-642.
Tian L, Chen Y P, Liu J, Ma X G, Wang N, Yang B, Li Y, Guo H D, Li J, Hu H, Zhang Y X, Li P F. Comprehensive evaluation and selection of rice () germplasm for saline tolerance at germination stage[J]., 2017, 31(6): 631-642. (in Chinese with English abstract)
[25] 王小雷, 李炜星, 曾博虹, 孙晓棠, 欧阳林娟, 陈小荣, 贺浩华, 朱昌兰. 基于染色体片段置换系对水稻粒形及千粒重QTL检测与稳定性分析[J]. 作物学报, 2020, 46(10): 1517-1525.
Wang X L, Li W X, Zeng B H, Sun X T, Ou-Yang L J, Chen X R, He H H, Zhu C L. QTL detection and stability analysis of rice grain shape and thousand-grain weight based on chromosome segment substitution lines[J]., 2020, 46(10): 1517-1525. (in Chinese with English abstract)
[26] 张玲, 李晓楠, 王伟, 杨生龙, 李清, 王嘉宇. 水稻株型相关性状的QTL分析[J]. 作物学报, 2014, 40(12): 2128-2135.
Zhang L, Li X N, Wang W, Yang S L, Li Q, Wang J Y. Analysis of QTLs for plant type traits in rice ()[J]., 2014, 40(12): 2128-2135. (in Chinese with English abstract)
[27] Fu Q, Zhang P J, Tan L B, Zhu Z F, Ma D, Fu Y C, Zhan X C, Cai H W, Sun C Q. Analysis of QTLs for yield-related traits in Yuanjiang common wild rice (Griff.)[J]., 2010, 37(2): 147-157.
[28] McCouch S R. Gene nomenclature system for rice[J].,2008,1(1):72-84.
[29] 顾骏飞, 周振翔, 李志康, 戴琪星, 孔祥胜, 王志琴, 杨建昌. 水稻低叶绿素含量突变对光合作用及产量的影响[J]. 作物学报, 2016, 42(4): 551-560.
Gu J F, Zhou Z X, Li Z K, Dai Q X, Kong X S, Wang Z Q, Yang J C. Effects of the mutant with low chlorophyll content on photosynthesis and yield in rice[J]., 2016, 42(4): 551-560. (in Chinese with English abstract)
[30] Takai T, Kondo M, Yano M, Yamamoto T. A quantitative trait locus for chlorophyll content and its association with leaf photosynthesis in rice[J]., 2010, 3(2): 172-180.
[31] 殷延勃, 马洪文. 粳稻剑叶不同发育时期SPAD值遗传效应分析[J]. 西北农业学报, 2008, 17(5): 171-173, 193.
Yin Y B, Ma H W. Analysis of genetic effects at different growth stages SPAD values in flag leaf of paddy rice[J]., 2008, 17(5): 171-173, 193. (in Chinese with English abstract)
[32] Huang L C, Dai L P, Wang L, Leng Y J, Yang Y L, Xu J, Hu J, Rao Y C, Zhang G H, Zhu L, Dong G J, Guo L B, Qian Q, Zeng D L. Genetic dissection for chlorophyll content of the top three leaves during grain filling in rice (L.)[J]., 2015, 34(2): 381-391.
[33] 胡茂龙, 王春明, 杨权海, 翟虎渠, 陆巍, 张荣铣, 万建民. 水稻光合功能相关性状QTL分析[J]. 遗传学报, 2005, 32(8): 818-824.
Hu M L, Wang C M, Yang Q H, Zhai H Q, Lu W, Zhang R X, Wan J M. QTL analysis for traits associated with photosynthetic functions in rice (L. )[J]., 2005, 32(8): 818-824. (in Chinese with English abstract)
[34] 刘进, 王嘉宇, 姜树坤, 徐正进. 水稻叶绿素含量动态QTL分析[J]. 植物生理学报, 2012, 48(6): 577-583.
Liu J, Wang J Y, Jiang S K, Xu Z J. Detection and analysis of dynamic QTL of leaf chlorophyll content in rice (L.)[J], 2012, 48(6): 577-583. (in Chinese with English abstract)
[35] Yue B, Xue W Y, Luo L J, Xing Y Z. QTL analysis for flag leaf characteristics and their relationships with yield and yield traits in rice[J]., 2006, 33(9): 824-832.
[36] Jiang S K, Zhang X J, Wang J Y, Chen W F, Xu Z J. Fine mapping of the quantitative trait locuscontrolling flag leaf length in rice[J]., 2010, 176(3): 341-347.
[37] Tang X X, Gong R, Sun W Q, Zhang C P, Yu S B. Genetic dissection and validation of candidate genes for flag leaf size in rice (L.)[J]., 2018, 131(4): 801-815.
[38] Lin L H, Zhao Y F, Liu F, Chen Q, Qi J C. Narrow leaf 1 () regulates leaf shape by affecting cell expansion in rice (L.)[J]., 2019, 516(3): 957-962.
[39] Qi J, Qian Q, Bu Q Y, Li S Y, Chen Q, Sun J Q, Liang W X, Zhou Y H, Chu C C, Li X G, Ren F G, Palme K, Zhao B R, Chen J F, Chen M S, Li C Y. Mutation of the ricegene, which encodes a novel protein, affects vein patterning and polar auxin transport[J]., 2008, 147(4): 1947-1959.
[40] Zhang G H, Li S Y, Wang L, Ye W J, Zeng D L, Rao Y C, Peng Y L, Hu J, Yang Y L, Xu J, Ren D Y, Gao Z Y, Zhu L, Dong G J, Hu X M, Yan M X, L, Guo L B, Li C Y, Qian Q.fromcultivar, which is allelic to, increases yield ofsuper rice 93-11[J]., 2014, 7(8): 1350-1364.
[41] Xue W Y, Xing Y Z, Weng X Y, Zhao Y, Tang W J, Wang L, Zhou H J, Yu S B, Xu C G, Li X H, Zhang Q F. Natural variation inis an important regulator of heading date and yield potential in rice[J]., 2008, 40(6): 761-767.
[42] 邵高能, 唐绍清, 罗炬, 焦桂爱, 唐傲, 胡培松. 水稻剑叶形态与稻米粒形QTL分析及相应剩余杂合体衍生群体的构建[J]. 分子植物育种, 2009, 7(1): 16-22.
Shao G N, Tang S Q, Luo J, Jiao G A, Tang A, Hu P S. QTL analysis for flag leaf and grain shape and populations construction derived from related residual heterozygous lines in rice[J]., 2009, 7(1): 16-22. (in Chinese with English abstract)
[43] 吴亚辉, 陶星星, 肖武名, 郭涛, 刘永柱, 王慧, 陈志强. 水稻穗部性状的QTL分析[J]. 作物学报, 2014, 40(2): 214-221.
Wu Y H, Tao X X, Xiao W M, Guo T, Liu Y Z, Wang H, Chen Z Q. Dissection of QTLs for panicle traits in rice ()[J]., 2014, 40(2): 214-221. (in Chinese with English abstract)
[44] Wang P, Zhou G L, Cui K H, Li Z K, Yu S B. Clustered QTL for source leaf size and yield traits in rice (L.)[J]., 2012, 29(1): 99-113.
[45] Xu F F, Huang Y, Bao J S. Identification of QTLs for agronomic traits in indica rice using an RIL population[J]., 2015, 37(10): 809-817.
Comprehensive Evaluation and QTL Analysis for Flag Leaf Traits Using a Backcross Population in Rice
LI Jie1, TIAN Rongrong1, BAI Tianliang1, ZHU Chunyan1, SONG Jiawei1, TIAN Lei1,*, MA Shuaiguo1, 2, LÜ Jiandong1, HU Hui1, WANG Zhenyu1, LUO Chengke1, ZHANG Yinxia1, LI Peifu1
(1College of Agriculture, Ningxia University/Key Laboratory of Modern Molecular Breeding for Dominant and Specific Crops in Ningxia, Yinchuan 750021, China;2Baiyin Municipal Bureau of Agriculture and Rural Affairs, Baiyin 730900, China;*Corresponding author, E-mail: tianlei2012@nxu.edu.cn)
【】In order to clarify the correlations between flag leaf-related traits and their relationships with six agronomic traits, a comprehensive evaluation of flag leaf traits was made. The identification of QTLs associated with flag leaf traits will lay a foundation for fine mapping and cloning of the functional genes underlying rice flag leaf-related traits, which is helpful to breed elite cultivars with excellent flag leaf traits. 【】A backcross population with two generationsderived from an eliterice cultivarKoshihikari (recipient)and a Portuguese rice landrace Bertone (donor) was used as plant materials. The genetic linkage maps were constructed by using SSR markers with the BC3F1population. Several parameters including flag leaf SPAD, flag leaf length, flag leaf width, length to width ratio of flag leaf as well as flag leaf area were measured in the parental varieties and BC3F2population. In order to analyze the relationship betweenvalue and the six agronomic traits, membership functions and the index weight methodwere used to comprehensively evaluate the flag leaf traits of these260BC3F2lines. Single-point analysis (SPA) and interval mapping (IM) were used to identify QTLs for traits related to flag leaf in rice.【】After the flag leaf was fully expanded, the flag leaf SPAD values of the two parents showed a dynamic change, increasing at first and reduced subsequently. The five flag leaf-related traits of the BC3F2population exhibited diverse phenotypic variations, whose overall performance resembled the recurrent parent (Koshihikari). The results revealed that four morphological traits of flag leaf were significantly correlated with each other, while there were no significant correlations with flag leaf SPAD. Using principal component analysis (PCA) and stepwise regression analysis, flag leaf width, flag leaf SPAD, flag leaf length and flag leaf area were selected as the key indexesofvalue out of the flag leaf comprehensive evaluation. The results showed that except for tiller number and effective panicle number, the other four traits including plant height, panicle length, basal culm thickness and grain yield per plant were all significantly higher in lines with a highervalue than that in lines with a smallvalue. A total of 18 QTLswere detected, which were located on chromosomes 1, 4, 7 and 8 with phenotypic variation explained ranging from 4.00% to 28.00% (SPA) and 3.41% to 27.00% (IM), respectively. Except for, the other 17 QTLs showed synergistic effect from Bertone alleles. Moreover,a QTL cluster was found in the RM22720-RM404 interval on chromosome 8, containingsix major QTLs(,,,,and). 【】Flag leaf width, flag leaf SPAD, flag leaf length and flag leaf area were the important indicators that affect the comprehensive evaluation of flag leaf. The flag leaf traits were significantly or extremely significantly positively correlated with the yield per plant. Here we identified 18 QTLs for flag leaf traits and a QTL cluster detected in the RM22720-RM404 interval on chromosome 8, which is an important chromosomal region affecting flag leaf-related traits.
rice; backcross population; flag leaf traits; comprehensive evaluation; QTL mapping
10.16819/j.1001-7216.2021.210110
2021-01-12;
2021-03-20。
国家自然科学基金资助项目(31760374); 宁夏自然科学基金资助项目(2020AAC03096); 宁夏农业育种专项(2018NYYZ0301, 2018NYYZ0302)。

