转录因子OsNAC2对逆境下水稻产量性状的影响
余江涛 李凌云 陈秋伶 钟群 梅雨辰 娄玉霞 金越 明凤
摘 要: 以水稻OsNAC2过表达、RNAi转基因株系和野生型(日本晴)为材料,分别在苗期和生殖期进行干旱和盐胁迫处理,探索逆境条件下OsNAC2对水稻产量性状的影响。结果表明,不论是在苗期还是生殖期,OsNAC2-RNAi株系的叶相对含水量均比野生型更高,对干旱胁迫具有更强的适应能力;而OsNAC2过表达株系则相反。虽然苗期和生殖期遭遇盐胁迫的OsNAC2-RNAi株系相比野生型具有更高的叶相对含水量,但是OsNAC2的过量表达与RNAi株系的产量性状跟野生型相比并没有明显不同。生殖期干旱和盐胁迫下转基因株系的产量性状分析显示:干旱胁迫下,OsNAC2-RNAi株系的结实率与野生型相比显著提高了20.8%~29.2%,千粒重则无明显差异;而OsNAC2过表达株系每株粒数和千粒重相比野生型株系均显著降低。虽然盐胁迫下OsNAC2-RNAi株系的分蘖数和有效穗数明显比野生型高,但单株粒数和千粒重则无明显差异。上述结果表明,OsNAC2-RNAi株系具有更强的耐旱性,对于干旱胁迫下水稻的产量有顯著的提高作用。
关键词: OsNAC2; 水稻; 干旱; 盐胁迫; 产量
中图分类号: Q 945 文献标志码: A 文章编号: 1000-5137(2020)05-0581-08
The effects of rice transcription factor OsNAC2 on yield traits under stresses
YU Jiangtao1,2?, LI Lingyun1,2?, CHEN Qiuling1,2, ZHONG Qun1,2, MEI Yuchen1,2, LOU Yuxia1,2, JIN Yue1,2*, MING Feng1,2*
(1.College of Life Sciences, Shanghai Normal University, Shanghai 200234, China;2.Development Center of Plant Germplasm Resources, Shanghai Normal University, Shanghai 200234, China)
Abstract: The OsNAC2-over expression,OsNAC2-RNAi and wild-type (Oryza sativa L.japonica.cv.Nipponbare)plants were used to study the effects of OsNAC2 on rice yield under drought and salt stresses during the seedling stage and reproductive stage respectively.The results showed that leaf relative water content of OsNAC2-RNAi plants was higher after drought stress during both of the seedling and reproductive stages,indicating that OsNAC2-RNAi plants exhibited higher tolerance to drought;meanwhile the performance of OsNAC2-OE plants was precisely in reverse.Although the leaf relative water content of OsNAC2-RNAi plants suffered from salt stress during both of the seedling and reproductive stages was higher than that of the wild-type plants,there was no obvious difference in rice yield among OsNAC2-OE,OsNAC2-RNAi and wild-type plants.The analysis of yield traits of transgenic lines during reproductive stage under drought or salt stresses showed that the seed setting rate of OsNAC2-RNAi lines was increased by 20.8%-29.2% more than that of wild-type plants after drought stress,with no significantly difference in 1 000-grain weight.Further,the total grain number/plant and 1 000-grain weight of OsNAC2-OE lines were significantly decreased compared with that of wild type lines.Although the number of tiller and effective panicle of OsNAC2-RNAi plants were significantly higher than those of wild-type plants under salt stress,there was no significant difference in grain number and 1 000-grain weight per plant.These results suggested that OsNAC2-RNAi transgenic plants had more significant tolerance and higher yield under drought conditions.
Key words:OsNAC2; rice; drought; salt stress; yield
0 引 言
水稻是世界上最主要的粮食作物之一,也是单子叶植物的模式物种。研究发现,作为中国水稻主要种植地的南方和东北等湿润和半湿润地区发生骤发性干旱的可能性较大[1]。此外,盐分也是影响水稻生长和产量的一个重要环境因子,盐胁迫给农业生产带来巨大的危害[2]。因此,探索水稻抗旱耐盐机制,培育耐盐耐旱的优良品种是科研工作者的主要目标之一。决定水稻产量的3个主要因素为:单株有效穗数、每穗结实率和粒重。其中,穗数是水稻产量的基础;结实率决定每穗粒数;粒重一般以千粒重表示,与粒长、粒宽、粒厚和籽粒饱满度密切相关[3]。
NAC(NAM,ATAF1/2,CUC2)是植物特有的转录因子超家族之一,在植物生长发育中起着关键作用[4-5]。目前,在水稻和拟南芥中分别发现151和117个NAC家族的成员[6]。研究表明:NAC转录因子在植物次生代谢、激素调控、信号转导、生物和非生物胁迫等方面发挥着重要的作用[4,7-8]。例如,ANAC019过量表达会显著提高拟南芥的耐旱性[9];OsSNAC1过量表达会显著提高水稻干旱和高盐胁迫下的结实率,进而增加水稻产量[10];此外,OsNAC5过量表达会增大水稻的根系,从而提高植物的耐旱性[11]。因此,NAC转录因子可以显著提高植物对非生物逆境的抗性。
OsNAC2属于NAC家族成员,由本实验室的前期工作以及其他研究者的工作发现OsNAC2可以调控多种生物学途径,例如可以负调控分蘖数量以及分蘖角度[12]、株高性状[13],提高盐、干旱等非生物胁迫耐性[14],促进叶片的衰老[15]等。最近又发现OsNAC2的过表达和RNAi转基因株系有明显的根长表型特征[16-18]。为了确定OsNAC2是否参与胁迫下产量的稳产,本文作者利用实验室已获得的OsNAC2的过表达和RNAi株系在营养期进行20%(质量分数)PEG6000渗透胁迫(模拟干旱胁迫)和150 mmol?L-1NaCl处理,观察并记录植株的叶相对含水量的变化;通过在水稻生殖期进行干旱和盐胁迫处理,检测转基因株系和野生型(WT)株系的叶相对含水量、分蘖数、结实率以及千粒重等,共同评价OsNAC2对水稻产量的影响。
1 材料与方法
1.1 植物材料
日本晴水稻种子(Oryza sativa L.japonica. cv. Nipponbare);OsNAC2过表达株系(ON7,ON11);RNAi株系(Ri25,Ri31)水稻种子为本实验室保存,相关表达量参考文献[18]。
1.2 实验方法
1.2.1 种子萌发
选用饱满的种子,用3%(质量分数)过氧化氢溶液浸泡30 min,再用灭菌水冲洗5次。30 ℃清水浸泡2 d,37 ℃过夜催芽。挑选露白一致的种子放进96孔板,置于培养箱(苗期)或大棚(生殖期处理)中培养,生长条件为28 ℃,16 h光照/22 ℃,8 h黑暗,湿度为70%。
1.2.2 苗期20% PEG6000渗透和盐胁迫实验
采用培养2周的野生型和转基因水稻苗作为实验材料,挑选长势良好并且一致的苗置于20% PEG6000或150 mmol?L-1NaCl营养液中进行处理,对照组用常规水稻营养液培养,3次生物学重复。20% PEG6000实验组胁迫处理7 d后,测定各株系的叶相对含水量。盐处理实验组用150 mmol?L-1NaCl处理3 d后,测定各株系的叶相对含水量。
1.2.3 生殖期干旱和盐胁迫实验
采用正常培養4周(花序原基刚刚形成)的野生型和转基因水稻苗作为实验材料。对照组用去离子水浇灌处理,干旱组做不浇灌处理,每日测量水稻的土壤含水量,大约1周后,土壤水分含量降至30%左右时,将其维持在该水平1周;盐处理实验组做150 mmol?L-1NaCl水溶液浇灌处理,胁迫2周后观察转基因株系和野生型的表型,测定各株系的叶相对含水量,成熟时统计分蘖数、千粒重、结实率等指标。3次生物学重复。
1.2.4 叶相对含水量测量方法
取水稻相同部位的一片叶子,在分析天平中称量鲜重,再进行烘干称量干重,叶相对含水量=(鲜重-干重)/鲜重。
1.2.5 分蘖数测量方法
分蘖是禾本科植物在地面以下或接近地面处所发生的分枝。直接从主茎基部分蘖节上发出的称一级分蘖,在一级分蘖基部又可产生新的分蘖芽和不定根。本研究中只测量一级分蘖,也就是在主茎基部分蘖节上发出的分蘖。
1.2.6 千粒重测量方法
千粒重是以g为单位的1 000粒种子的质量,是体现种子大小与饱满程度的一项指标。
2 结果与分析
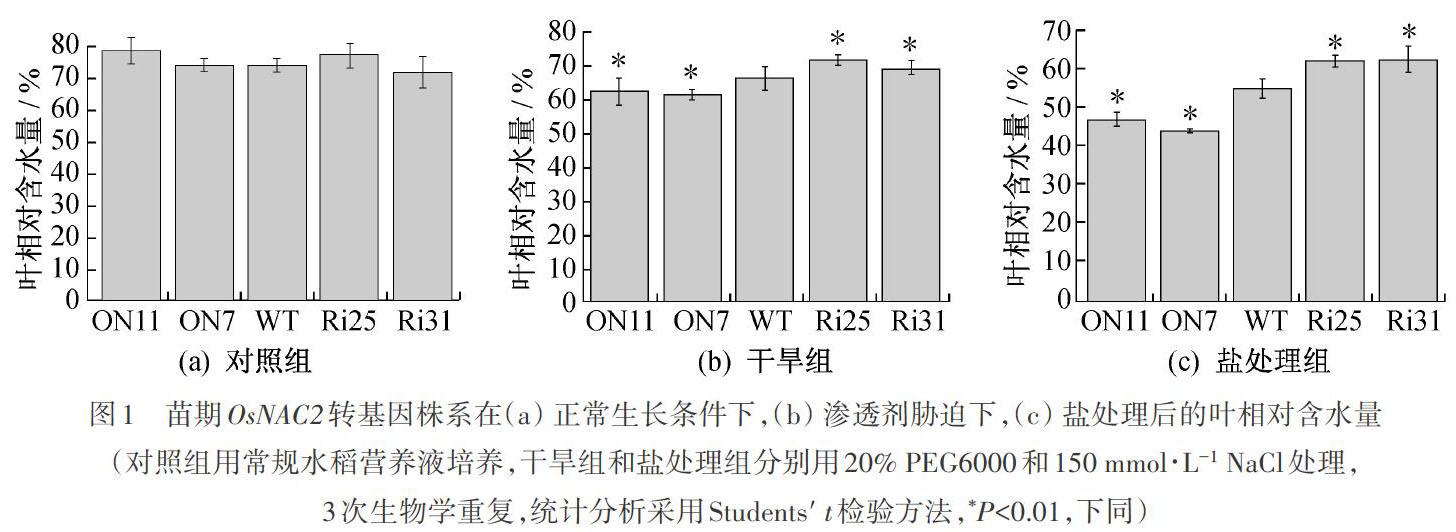
2.1 渗透和盐胁迫对苗期OsNAC2转基因株系的影响
所用的OsNAC2过表达株系(ON7和ON11)和RNAi株系(Ri25和Ri31)均是本实验已构建成功的转基因株系[18]。选用正常培养2周的水稻苗,用20% PEG6000渗透胁迫模拟干旱胁迫;用150 mmol?L-1NaCl进行盐胁迫处理,处理3 d后测定相关生理指标。在正常生长条件下,OsNAC2转基因株系和野生型的叶相对含水量均一致,如图1(a)所示;干旱胁迫条件下,Ri25和Ri31的叶相对含水量比野生型分别增加6.6%和5.0%,如图1(b)所示;OsNAC2过表达株系ON7和ON11的叶相对含水量则与野生型相比分别降低7.3%和6.7%。这些数据说明苗期的OsNAC2过表达株系耐旱能力较弱,而OsNAC2-RNAi株系有较强的耐旱能力。
盐处理条件下,Ri25和Ri31的叶相对含水量比野生型分别增加14.7%和14.9%,而OsNAC2过表达株系ON7和ON11的叶相对含水量则分别降低19.0%和14.2%,如图1(c)所示。结果说明苗期时的OsNAC2-RNAi株系对盐胁迫有一定的适应能力。
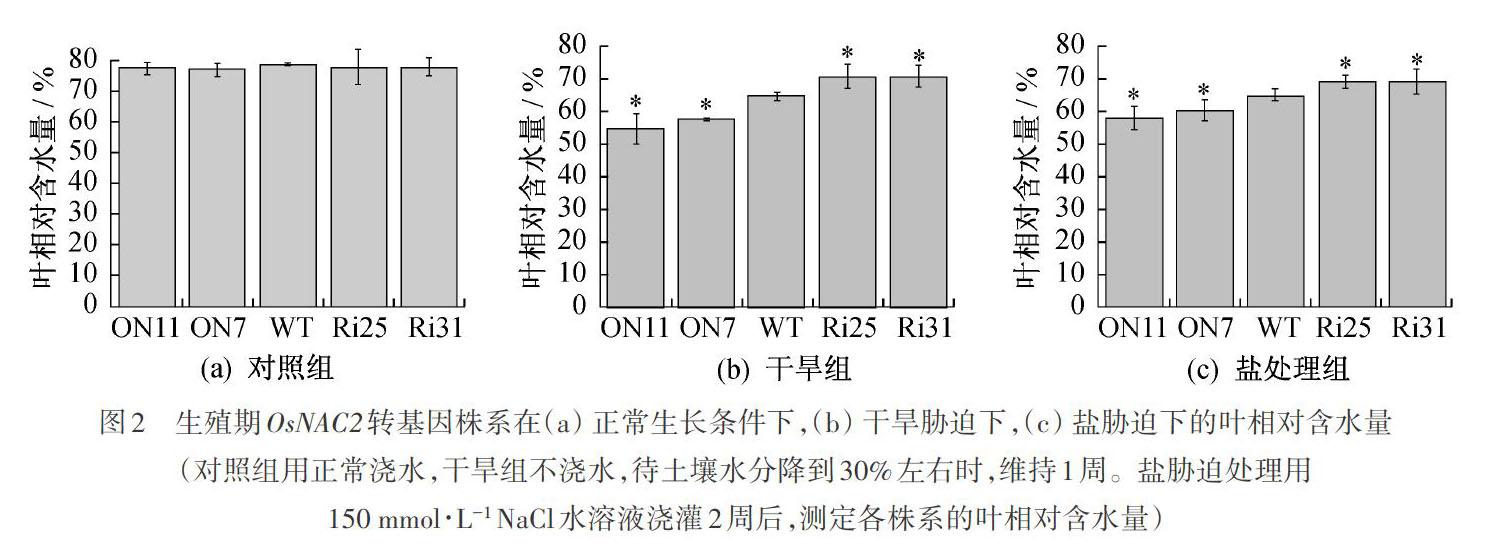
2.2 干旱和盐胁迫对生殖期OsNAC2转基因株系的影响
将正常培养4周的OsNAC2过表达(ON7和ON11),RNAi(Ri25和Ri31)和野生型株系进行干旱处理2周(见方法1.2.3)。干旱胁迫条件下,叶相对含水量最高的是RNAi株系,其次是野生型,最低的是OsNAC2过表达株系;RNAi株系Ri25和Ri31的叶相对含水量比野生型分别增加了12.0%和13.5%;OsNAC2过表达株系ON7和ON11的叶相对含水量比野生型分别降低了16.9%和9.6%,如图2(b)所示。这些数据说明,OsNAC2过表达株系对干旱胁迫较为敏感,而RNAi株系对干旱胁迫有更强的适应性。
将正常培养4周的ON7,ON11,Ri25,Ri31和野生型株系进行盐胁迫处理,由图2(c)可知:盐胁迫条件下,OsNAC2-RNAi株系Ri25和Ri31的叶相对含水量比野生型分别增加11.6%和11.7%,OsNAC2过表达株系ON7和ON11的叶相对含水量分别降低10.8%和7.2%。这些数据表明,OsNAC2过表达株系对盐胁迫比较敏感,而RNAi株系有更强的耐盐性。
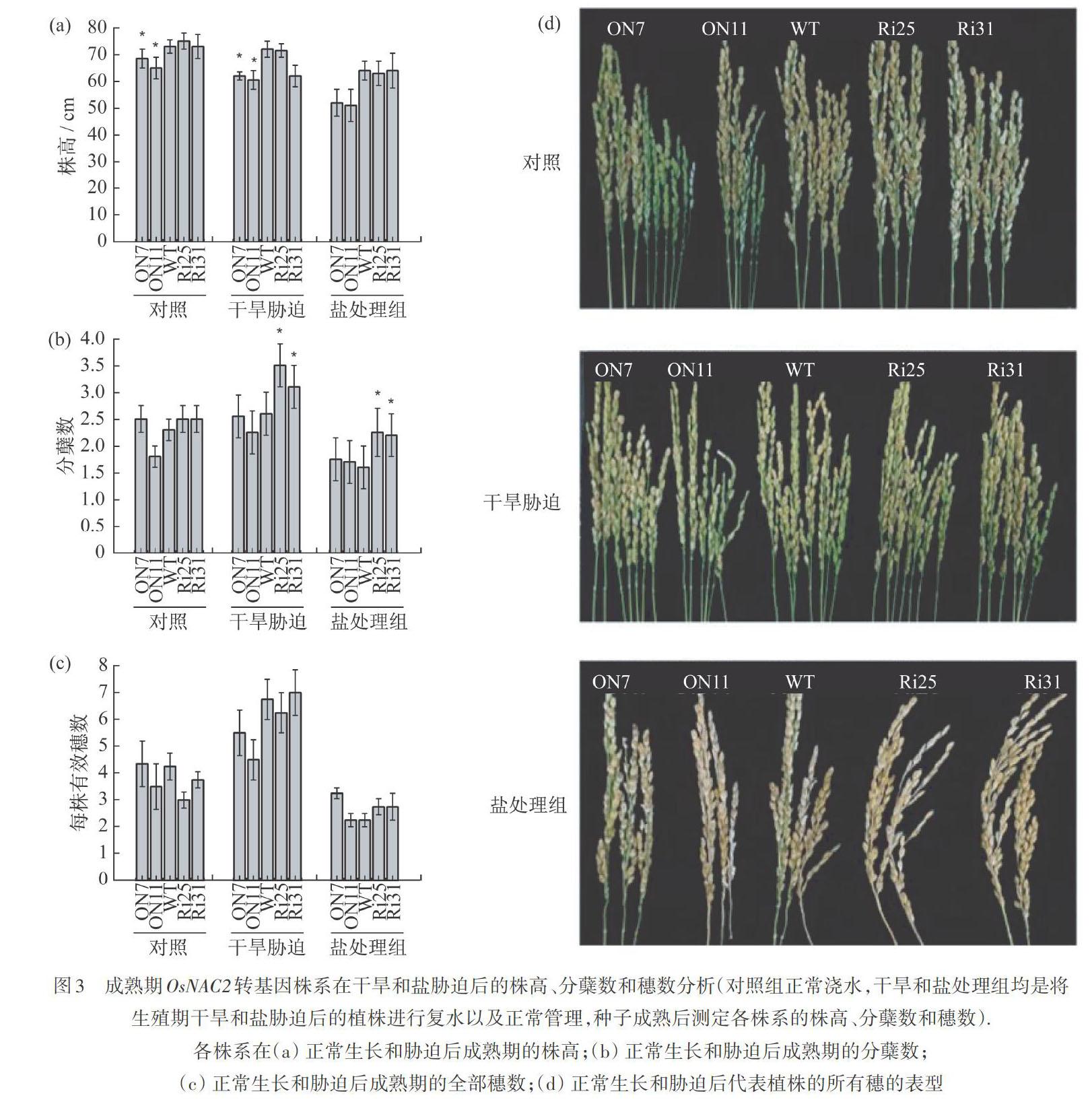
2.3 干旱和盐胁迫对OsNAC2转基因株系的株高、分蘖数和穗数指标的影响
将生殖期干旱和盐胁迫的植株胁迫后进行复水和正常管理,种子成熟后分别测定各株系的株高、分蘖数以及穗数(图3),不论是对照组还是实验组,OsNAC2过表达株系的株高显著低于野生型与RNAi株系,而RNAi与野生型株系的株高相对持平,如图3(a)所示,这与文献[13-14]的结果一致。RNAi株系的分蘖数在干旱和盐处理下均比其他株系显著增加,如图3(b)所示。但是,所有株系的有效穗数并无显著差异,而且在盐胁迫下,所有株系的穗数均降低,如图3(c)和3(d)所示。
2.4 干旱和盐胁迫对OsNAC2转基因株系产量性状的影响
将生殖期干旱和盐胁迫的植株胁迫后进行复水和正常管理,种子成熟后分别测定各株系的结实率、粒数和千粒重等产量性状指标(图4)。RNAi株系的结实率比野生型分别增加29.2%和20.8%;而OsNAC2过表达株系ON7和ON11的结实率则分别降低27.1%和12.5%,如图4(a)和4(b)所示。而在盐胁迫条件下,所有株系的结实率和粒数都比较低,并且各株系之间并无显著差异,如图4(a)~4(c)所示。在正常生长条件下,OsNAC2过表达株系每株粒数和千粒重均显著低于野生型,野生型与RNAi株系持平;在干旱胁迫条件下,RNAi株系的总粒数均显著高于野生型,如图4(c)和4(d)所示。根据上述数据可得,RNAi株系在干旱胁迫下,通过增加水稻的结实率进而增加每株的水稻粒数。
3 讨论及结论
NAC转录因子是植物特有的转录因子之一,目前,对于NAC家族下游基因的研究已经有了较大的进展,尤其是关于植物生长发育、胁迫应答和激素调节等方面[19-20]。相信随着分子生物技术和生物工程的发展,与NAC转录因子有关的一些良好的生物学指标能够得到定向改良,而其中最重要性状之一就是产量。
干旱和盐胁迫是限制水稻产量的重要因素,而目前没有报道OsNAC2在水稻干旱和盐胁迫下对产量性状的具体分析。本研究选用OsNAC2过表达和RNAi株系,分别在苗期和生殖期进行干旱和盐胁迫处理,通过测量叶片相对水含量和产量性状的指标,发现RNAi株系虽然在盐胁迫下的叶相对水含量比野生型和过量表达株系均高,但是RNAi株系的穗數、结实率、粒数和千粒重与野生型相比均未有明显差异,说明在盐胁迫条件下,OsNAC2的缺失可以增强营养器官的耐盐性,但是对于产量性状并无明显影响。
OsNAC2-RNAi株系在干旱胁迫下比野生型和过表达株系的叶相对含水量均高,可能与叶片失水导致气孔关闭、降低蒸腾、减少植株体内水分的散失有关。有研究发现:在干旱胁迫条件下,ONAC022过表达使植株的失水速率、蒸腾速率和气孔开放率降低,脯氨酸和可溶性糖含量增加,显著提高植物的耐旱性[21]。另外,RNAi株系的分蘖数在干旱和盐处理下均比其他株系显著增加,但是所有株系的有效穗数并没有明显差异,这可能由于干旱胁迫影响水稻生长,无法保障后期进行有效的灌浆和物质转运造成的。此外,在干旱胁迫下各株系的分蘖数最多,可能是因为水稻在干旱条件下分蘖期需水量相对最少[22]。并且,RNAi株系的结实率比野生型显著提高20.8%~29.2%,进而显著提高水稻的产量。综上所述,OsNAC2功能敲除株系可以应用于水稻耐旱品种的育种工作中,是耐旱稳产的育种材料。
參考文献:
[1] WANG L,YUAN X,XIE Z,et al.Increasing flash droughts over China during the recent global warming hiatus [J].Scientific Reports,2016,6:30571.
[2] BOYER J S.Plant productivity and environment [J].Science,1982,218(4571):443-448.
[3] 易亚科.土壤pH值对低镉积累水稻品种镉吸收及生长发育的影响 [D].长沙:湖南农业大学,2017.
YI Y K.Effect of soil pH value and Cd content of soil on yield and Cd accumulation in different organs of rice [D].Changsha:Hunan Argricultural University,2017.
[4] RURANIK S,SAHUP P,SRIVASTAVA P S,et al.NAC proteins:regulation and role ins tress tolerance [J].Trends in Plant Science,2012,17(6):369-381.
[5] KIKUCHI K,UEGUCHI T M,YOSHIDA K T,et al.Molecular analysis of the NAC gene family in rice [J].Molecular and General Genetics,2000,262 (6):1047-1051.
[6] NURUZZAMAN M,MANIMEKALAI R,SHARONI A M,et al.Genome-wide analysis of NAC transcription factor family in rice [J].Gene,2010,465(1/2):30-44.
[7] 李鹏,黄耿青,李学宝.植物NAC转录因子 [J].植物生理与分子生物学,2010,46(3):294-300.
LI P,HUANG G Q,LI X B,et al.Plant NAC transcription factor [J].Plant Physiology and Molecular Biology,2010,46(3):294-300.
[8] SEO P J,KIM M J,PARK J Y,et al.Cold activation of a plasma membrane-tethered NAC transcription factor induces a pathogen resistance response inArabidopsis[J].The Plant Journal,2010,61(4):661-671.
[9] TRAN L S,NAKASHIMKA K,SAKUMA Y,et al.Isolation and functional analysis ofArabidopsisstress inducible NAC transcription factors that bind to a drought responsiveciselement in the early responsive to dehydration stress promoter [J].The Plant Cell,2004,16(9):2481-2498.
[10] HU H H,DAI M Q,YAO J L,et al.Overexpressing aNAM,ATAF,andCUC(NAC) transcription factor enhances drought resistance and salt tolerance in rice [J].Proceedings of the National Academy of Sciences of the United States America,2006,103(35):12987-12992.
[11] JEONG S J,KIM Y S,REDILLAS M C F R,et al.OsNAC5overexpression enlarges root diameter in rice plant leading to enhanced drought tolerance and increased grain yield in the field [J].Plant Biotechnology Journal,2013,11(1):101-114.
[12] MAO C Z,DING W N,WU Y R,et al.Overexpression of a NAC-domain protein promotes shoot branching in rice [J].The New Phytologists,2007,176(2):288-298.
[13] CHEN X,LU S H,WANG Y F,et al.OsNAC2encoding a NAC transcription factor that affects plant height through mediating the gibberellic acid pathway in rice [J].The Plant Journal,2015,82(2):302-314.
[14] SHEN J B,LV B,LUOL Q,et al.The NAC-type transcription factorOsNAC2regulates ABA-dependent genes and abiotic stress tolerance in rice [J].Scientific Reports,2017,7:46890.
[15] MAO C,LU S,LV B,et al.A rice NAC transcription factor promotes leaf senescence via ABA biosynthesis [J].Plant Physiology,2017,174(3):1747-1763.
[16] JIANG D G,ZHOU L Y,CHEN W T,et al.Overexpression of a micro RNA-targeted NAC transcription factor improves drought and salt tolerance in rice via ABA-mediated pathways [J].Rice,2019,12(1):76.
[17] MAO C J,HE J M,LIU L N,et al.OsNAC2integrates auxin and cytokinin pathways to modulate rice root development [J].Plant Biotechnology Journal,2020,18(2):427-442.
[18] 何建美,吕波,奚丹丹,等.OsNAC2转录因子介导生长素代谢通路调节水稻早期根的发育 [J].复旦学报(自然科学版),2017,56(4):411-420.
HE J M,LYU B,XI D D,et al.OsNAC2transcription factor mediates auxin metabolism pathway to regulate early root development in rice [J]. Journal of Fudan University (Natural Science),2017,56(4):411-420.
[19] 张慧珍,白雪芹,曾幼玲.植物NAC转录因子的生物学功能 [J].植物生理学报,2019,55(7):915-924.
ZHANG H Z,BAI X Q,ZENG Y L,et al.Biological functions of plant NAC transcription factors [J].Journal of Plant Physiology,2019,55(7):915-924.
[20] SUN Q W,HUANG J F,GUO Y F,et al.A cotton NAC domain transcription factor,GhFSN5,negatively regulates secondary cell wall biosynthesis and anther development in transgenicArabidopsis[J].Plant Physiology and Biochemistry,2020,146:303-304.
[21] HONG Y B,ZHANG H J,HUANG L,et al.Overexpression of a stress-responsive NAC transcription factor geneONAC022 improves drought and salt tolerance in rice [J].Frontiers in Plant Science,2016,7:4.
[22] 袁夢,李冰,尹航,等.不同激素和环境胁迫调控水稻分蘖的研究进展 [J].黑龙江农业科学,2019(2):134-139.
YUAN M,LI B,YIN H,et al.Advances in studies on the regulation of tillering in rice by different hormones and environmental stresses [J].Heilongjiang Agricultural Sciences,2019(2):134-139.
(责任编辑:顾浩然)

