水稻分蘖调控基因HTD3的克隆与功能研究
吴先美 李三峰 胡萍 何瑞 焦然 毛一剑 鲁草林 胡娟 林晗 吴荣梁 朱旭东 饶玉春,* 王跃星, *
水稻分蘖调控基因的克隆与功能研究
吴先美1, #李三峰1, #胡萍1何瑞1焦然2毛一剑1鲁草林1胡娟2林晗2吴荣梁1朱旭东1饶玉春2,*王跃星1, *
(1中国水稻研究所 国家水稻改良中心/水稻生物学国家重点实验室, 杭州 310006;2浙江师范大学 化学与生命科学学院, 浙江 金华 321004;#共同第一作者;*通信联系人, E-mail: wangyuexing@caas.cn, ryc@zjnu.cn)
【】克隆水稻分蘖相关基因,为构建理想株型水稻,提高粮食产量提供理论基础及有利基因资源。在常规大田种植条件下分别比较突变体()与野生型在幼苗期、抽穗期和成熟期表型及主要农艺性状差异,利用图位克隆方法克隆候选基因,利用荧光定量PCR方法分析及独脚金内酯和脱落酸相关基因的表达水平,测序比对分析在147份种质资源中的自然变异情况。与野生型相比,突变体的分蘖芽生长较快,分蘖数和有效穗数显著增多,株高、一次枝梗数和每穗粒数显著降低,结实率和千粒重没有显著变化。遗传分析表明,多分蘖的性状受一对隐性核基因控制。图位克隆将基因定位在第12染色体CM8和CM10之间约63.5 kb的物理区间内,互补转基因实验证明该区间内为控制突变体多分蘖表型的基因。在野生型和突变体中呈组成型表达,该基因突变会引起部分独脚金内酯和脱落酸相关基因的表达水平上调。水稻品种中编码区G2674A自然变异使得分蘖数显著增多。是最近报道的基因的一个新的等位基因,突变导致水稻出现分蘖适度增加,株高略矮的表型,在培育理想株型水稻和高产育种上具有较大的应用潜力。
水稻;多分蘖;图位克隆;生物学功能
每株有效穗数、每穗粒数和粒重是决定水稻产量的3个关键因素,而有效分蘖数直接决定了水稻的每株穗数,进而影响水稻的产量[1],同时分蘖也是构成水稻理想株型的重要因素之一。因此,克隆水稻分蘖相关基因并对其功能进行研究,可以为构建理想株型水稻和提高粮食产量提供理论基础及有利基因资源。
水稻分蘖是一个复杂的过程,受自身遗传因素、内源激素以及栽培环境等多种因素的调控[2]。水稻分蘖的发育是由分蘖芽形成与伸长两个过程调控的。是第一个被克隆的正向调控水稻分蘖的关键基因,编码GRAS家族蛋白,功能缺失后导致水稻分蘖芽无法形成[3]。和是位于上游的两个基因,通过影响MOC1蛋白水平,共同负调控水稻的分蘖数目,其突变体表现出矮化,分蘖数量增多的表型[4-5]。植物激素在水稻分蘖萌发、生长以及衰老各环节中都有着重要的调控作用[6]。生长素在水稻的茎尖与幼嫩的叶片中产生,通过主动运输由上而下运输到分蘖芽,因其具有顶端优势的作用,从而会抑制分蘖芽的产生[7]。基因是生长素合成途径中的一个重要的基因,该基因的缺失会导致生长素的合成减少,顶端优势消减,从而让休眠中的分蘖芽打破休眠开始生长[8]。编码生长素转运蛋白,该基因的缺失会使植株顶端运输到基部的生长素显著减少,降低其对分蘖芽生长发育的抑制作用,从而增加水稻的分蘖数[9]。独脚金内酯(strigolactone)是近年来发现的一种新的植物激素,由植物根部产生,向上运输至腋芽,在抑制腋芽伸长生长的过程中发挥核心作用[10]。独脚金内酯通过生物合成途径和信号转导途径来调控水稻分蘖,、和是独脚金内酯合成途径中的关键基因[11-13],而、和则在独脚金内酯感知和信号转导中起主要作用[14-15]。编码一种定位在叶绿体上的含铁蛋白,主要在地上部和幼叶以及节和节间的维管束细胞中表达,该基因突变以后可以加强生长素极性运输,导致不能抑制分蘖芽向外生长,表现出多分蘖表型[11]。编码胡萝卜素裂解双加氧酶OsCCD7,主要在维管束中表达,负向调控水稻侧芽生长,该基因突变会使得植株出现分蘖数增多,株高降低的表型。外源施加生长素可提高的表达[12]。编码类胡萝卜素裂解双氧化酶OsCCD8,突变体株高变矮,分蘖增多[13]。编码独脚金内酯的受体蛋白,参与独脚金内酯的感应或生物合成途径基因的反馈调节[16-18]。编码一个富含亮氨酸重复序列的F-box蛋白,是独脚金内酯信号转导过程中的关键因子,参与蛋白泛素化并介导蛋白质降解[19]。活化后的D14能与D3互作形成SKP-CULLIN-F-BOX (SCF) 复合体SCFD3-D14[20-22]。编码一个在结构上与I类Clp ATP酶类似的蛋白,它能够与SCFD3-D14蛋白复合体互作,是独脚金内酯信号途径的抑制因子。在依赖和的条件下,独脚金内酯通过蛋白酶体途径诱导降解,抑制其活性,促进水稻侧芽生长[23]。编码TCP蛋白转录因子,通过调控水稻分蘖芽的生长来影响水稻的分蘖数,过表达该基因会导致分蘖数量显著地减少,而突变体则表现出分蘖数量显著增加[24]。植株体内的激素都拥有各自的特征和作用,但是水稻分蘖生长发育的过程十分复杂,各激素不能单独调节,而是依靠相关激素之间的交叉协作,共同完成对侧芽生长的调控作用[25]。
前期从中花11的EMS诱变突变体库中鉴定到了性状能稳定遗传的矮秆多分蘖突变体。本研究拟利用图位克隆方法克隆候选基因,基于荧光定量PCR方法分析及独脚金内酯和脱落酸相关基因的表达水平,阐述与分蘖数之间的关系,为进一步完善水稻分蘖调控的分子机制提供参考。
1 材料与方法
1.1 试验材料
是从粳稻中花11经EMS诱变之后,经连续多代自交,筛选鉴定得到的能稳定遗传的矮秆多分蘖突变体。将作为母本,台中本地1号(TN1)作为父本杂交,构建遗传分析和基因定位群体。所有亲本和群体材料都种植于中国水稻研究所杭州富阳试验基地,栽培管理方式与大田生产相同。
1.2 农艺性状考查与分蘖芽形态学观察
在大田管理条件下,于成熟期随机选取野生型与突变体各15株,对其农艺性状进行考查,主要包括株高、有效穗数、穗长、一次和二次枝梗数、每穗粒数、每株总粒数、千粒重和结实率,以各个指标的平均值进行数据分析。另外,自播种后每隔7d测量与野生型株高和分蘖数的动态变化;自一叶期开始用镊子剥出主茎分蘖芽,用徕卡S9体视显微镜对分蘖芽进行观察拍照,用游标卡尺测量分蘖芽的长度。
1.3 遗传分析与基因的图位克隆
以作为母本,台中本地1号(TN1)作为父本配制杂交组合,观察F1的分蘖表型并收获种子。在分蘖期统计/TN1的F2分离群体中正常分蘖和多分蘖的水稻株数,分析突变体多分蘖性状是否受单隐性核基因控制。取多分蘖表型的隐性单株提DNA,利用均匀分布于12条染色体上有多态的SSR标记,先使用21个隐性单株进行连锁分析。确定连锁位点后,增加多态性标记和隐性单株的数量,对突变体基因进行精细定位,明确目的基因的区间,所用引物见表1。利用水稻基因组注释数据库(http://rice.plantbiology.msu.edu/)预测定位区间内的开放阅读框(open reading frames,ORF),用Primer 3.0设计引物,分别扩增出这些ORF的序列,测序并比对分析其在野生型和突变体中的序列差异。
1.4 载体构建与遗传转化
利用引物对-CPT-RI-F/-CPT-dIII-R(表2),从野生型中花11中扩增出5.8 kb(包含ATG前1.2 kb自身启动子序列,3.6 kb完整基因组序列,1.0 kb TGA下游序列)的互补序列,通过同源重组的方法克隆到双元表达载体中构建互补载体。将构建成功的互补载体利用农杆菌介导的转化法转化到突变体的愈伤之中。同步转化空载体作为对照。
1.5 RNA的提取及qRT-PCR
分别取野生型和突变体的根、茎秆、叶、叶鞘、穗和分蘖芽,用RNA提取试剂盒(RNAprep Pure Plant Kit,AP-MN-MS-RNA-250,Axygen)按说明书提取不同组织中的总RNA,用逆转录试剂盒(FSQ-301,ToYoBo)反转录成cDNA。采用ABI 7500实时荧光定量PCR仪,以水稻为内参进行PCR。反应体系包括cDNA模板1 μL(约100 ng)、前后引物各1 μL(10 μmol/L)、PCR预混液(SYBR Green Real-time PCR Master Mix) 5 μL、去离子水2 μL,3次生物学重复。扩增程序:95℃下30 s,95℃下5 s,60℃下30 s,共40个循环。采用2方法对基因表达数据进行分析处理。

表1 HTD3精细定位所用分子标记

表2 扩增HTD3完整表达单元的引物
2 结果与分析
2.1 htd3的表型及主要农艺性状考查
在大田正常种植条件下,与野生型相比,突变体在苗期、分蘖期和成熟期的分蘖数显著增多(图1-A~C)。对播种后21~91 d的分蘖数和株高进行动态观察,发现在播种后49 d和野生型的分蘖数差异最大,野生型在播种后77 d达到稳定的最大分蘖数,而在播种后84 d才达到稳定的最大分蘖数,91 d时两者的差异趋于平稳,此时的分蘖数是野生型的2.5倍(图1-D)。的株高自播种后56 d开始一直显著低于野生型,91 d时的株高是野生型的85%(图1-E)。在成熟期,的株高、一次枝梗数和每穗粒数均显著低于野生型,有效穗数和每株总粒数极显著多于野生型,穗长、二次枝梗数、千粒重和结实率无显著差异(表3)。
2.2 htd3的分蘖芽生长较快
对野生型和突变体在5~7叶期的分蘖芽生长情况进行观察,发现在同一个叶期突变体的分蘖芽生长较野生型更快(图2-A~F)。为进一步比较分蘖芽的生长速度,我们对野生型和突变体各叶位腋芽在不同时期的长度进行了统计(为方便分析,将已成蘖叶位的分蘖芽长度固定在成蘖时的长度),结果表明自5叶期开始突变体的分蘖芽总长度显著长于野生型(图2-G)。野生型和突变体中各叶位分蘖芽均能正常长成分蘖,最终突变体的有效穗数显著多于野生型(表3)。

表3 野生型和htd3的主要农艺性状比较
数据为平均值±标准差(=15);采用测验,**表示在0.01水平上差异显著,*表示在0.05水平上差异显著。
Values are means ± SD (=15),-test, *, ** indicate significant difference at<0.05 and<0.01, respectively.

A~C−野生型和htd3在苗期(A),分蘖期(B)和成熟期(C)的植株表型,标尺为6 cm;D,E−野生型和htd3的分蘖数(D)和株高(E)随播种后日期的动态变化。数据为平均值±标准差(n=15);采用t测验,**表示在0.01水平上差异显著,*表示在0.05水平上差异显著。
Fig. 1. Morphological characterization of WT and

A~F−野生型和突变体htd3在5叶期、6叶期、7叶期的分蘖芽表型, A~C为野生型, D~F为突变体, 标尺为1 cm;G−野生型和突变体htd3在各叶期的分蘖长度, n/0中n表示叶位, 0表示主茎, 即1/0表示主茎第一片叶对应的分蘖芽, 2/0表示主茎第2片叶对应的分蘖芽, 以此类推。
Fig. 2. Phenotypic observation of tillering buds of WT and
2.3 HTD3基因的图位克隆和互补验证
以分蘖数作为突变表型的判断依据,将突变体与籼稻品种TN1进行杂交,F1均表现正常分蘖的表型。F1自交得到的F2群体中正常分蘖表型的有666株,多分蘖表型的有198株,分离比经卡方检验符合3∶1(χ2=2 < χ20.05=3.84,表4),表明该突变性状受一对隐性核基因控制。
从上述F2分离群体中挑选与突变体亲本表型一致的多分蘖单株用于的精细定位。先用196个隐性单株将位点初步定位在第12染色体B12-6和B12-9之间(图3-A)。进一步加密标记,用1650个突变单株将精细定位在标记CM8 和CM10之间约63.5 kb的物理区间内(图3-B)。查询基因预测网站(http://rice.plantbiology.msu.edu/ cgi-bin/gbrowse/rice/),发现该区间内含有11个ORF(图3-C)。对这11个ORF进行测序比对分析,发现突变体中基因第一外显子上出现10 bp的缺失,导致蛋白的翻译提前终止(图3-D),因此预测就是基因。将完整的基因组序列克隆到双元表达载体中并进行转基因实验,结果表明两个独立的转基因T2代阳性植株在分蘖期均能够恢复到野生型的分蘖数和株高表型,而转入空载体植株的分蘖数和株高与突变体相比没有显著差异(图3)。综上所述,就是控制突变体多分蘖性状的基因,该基因编码叶绿体ζ-胡萝卜素异构酶,参与类胡萝卜素及其代谢物独脚金内酯和脱落酸的生物合成。

表4 水稻矮秆多分蘖突变体htd3的遗传分析

A−HTD3的初定位;B−HTD3的精细定位;C−定位区间内预测的ORF;D−候选基因LOC_Os12g21710的基因结构及在野生型和htd3中的序列差异,黑色方框代表外显子,白色方框代表UTR,黑色线条代表内含子;E−野生型、htd3和互补转基因T2代植株分蘖期表型,标尺为6 cm;F~G−野生型、htd3和互补转基因T2代植株分蘖期的分蘖数(F)和株高(G)统计,数据为平均值±标准差(n=5)。用新复极差法进行多重比较,相同小写字母表示在0.05水平上无显著差异。
Fig. 3. Map-based cloning ofand verification of complementary transgene.
2.4 独脚金内酯和脱落酸相关基因在突变体htd3中的表达水平发生改变
qRT-PCR的分析结果表明在水稻中呈组成型表达,在突变体的茎、叶、叶鞘和分蘖芽中的表达水平显著高于野生型,在根和穗中的表达水平与野生型相比没有显著差异(图4-A)。独脚金内酯合成相关基因和以及信号转导基因和在中的表达水平极显著上调,而独脚金内酯信号转导基因的表达水平极显著下调(图4-B)。前人的研究结果表明脱落酸通过抑制独脚金内酯的生物合成负向调控水稻分蘖的发育[26]。本研究中脱落酸相关的基因、、和在中的表达水平极显著上调(图4-C)。
2.5 HTD3的单倍型分析
为了研究水稻品种中的自然变异是否会影响分蘖数的变化,我们选择了147份品种用来测序比对的序列差异。比对分析结果表明在的5′-UTR区分别存在9 bp的插入和6 bp的缺失,在第4外显子上存在G2674A单碱基的替换。基于这些自然变异我们将划分为4个单倍型(图5-A),根据Wang等[26]报道的147份水稻品种的分蘖和株高数据进行分析,结果表明的分蘖数最多,与在分蘖数上存在显著差异,与和差异不显著,这4个单倍体的株高没有显著差异(图5-B~C)。
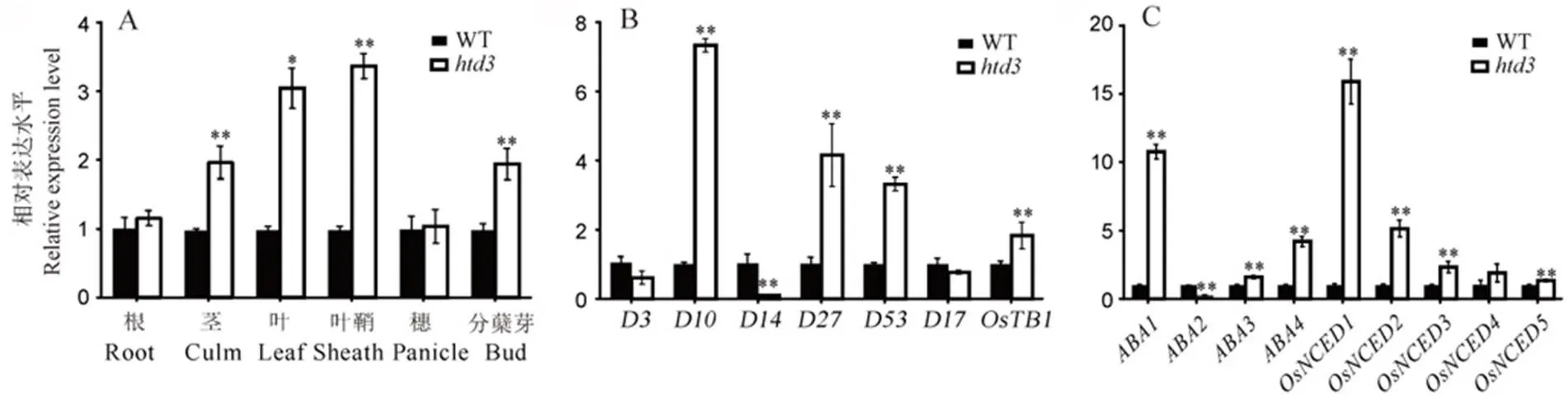
A−HTD3基因在野生型和突变体htd3各组织中相对表达水平;B~C−独脚金内酯(B)和ABA(C)相关基因在野生型和突变体htd3叶片中的相对表达水平。以相应基因在野生型中的表达水平作为参考并设为1, 数据为平均值±标准差, 3次生物学重复;采用t测验, *表示在0. 05水平上差异显著, **表示在0. 01水平上差异显著。
Fig. 4. Expression analysis ofand hormone related genes.

A−HTD3的基因结构及147份水稻品种中HTD3的5'-UTR和编码区上核苷酸多态性, 黑色方块代表外显子, 白色方框代表UTR, 黑色方框之间的黑色线条代表内含子, Hap代表单倍型, 数字代表相对起始密码子ATG的碱基位置;B−每种单倍型对应的分蘖数和株高。用新复极差法进行多重比较, 相同小写字母表示在0.05水平上无显著差异。
Fig. 5. Analysis of thegene haplotypes.
3 讨论
本研究以多分蘖突变体为研究材料,图位克隆的结果表明是基因的等位基因,它们突变以后分蘖增多,株高变矮,但是由于突变方式的不同表型上也存在一定差异。突变会大幅度增加高位分蘖的数量,同时株高也明显变矮,利用CRISPR/Cas9技术在日本晴背景中敲除,转基因纯合后代第1外显子上单碱基的插入或2 bp的缺失都会导致突变体的分蘖数增加2~3倍,株高降低35%[27]。第2内含子和第3外显子连接处10 bp的缺失导致突变体的分蘖数增多,株高降低20%[28]。本研究中第1外显子上10 bp的缺失导致突变体的分蘖数增加至野生型的2.5倍,且增加的是基部分蘖,株高降低15%。另外,突变在显著增加有效穗数和每穗粒数的同时不会降低千粒重和结实率。不同品种中第4外显子上G2674A单碱基的替换可显著增加分蘖数,该结果与之前报道一致[28]。
分蘖由分蘖芽发育而成。独脚金内酯主要合成于根部,由类胡萝卜素代谢产生,从形态学下端向形态学上端运输,在抑制分蘖芽伸长生长过程中起着非常关键的作用[29]。、和、分别参与独脚金内酯的生物合成和信号转导过程,都是分蘖芽生长的负向调控基因。在本研究中的表达水平在突变体中极显著上调,这与前人的研究结果一致[27-28]。此外,、和在叶片中的表达水平也都极显著上调,而、、和在根中的表达水平与野生型相当[27],和在茎基部中的表达水平下调[28]。我们推测这种同一个基因表达水平的差异可能是由于qRT-PCR的过程中模板选择部位的不同造成的。脱落酸作为第二信使受IAA的诱导,在抑制侧芽的生长和衰老过程中起着调控作用[30-31]。外源脱落酸不能完全抑制分蘖的生长,所以推测脱落酸不是控制分蘖芽生长的主要因素,而是受到其他激素的诱导而产生作用[32]。研究发现独脚金内酯和脱落酸之间存在相互调控的关系:独脚金内酯信号途径能够上调转录因子编码基因的表达,进而提高脱落酸合成关键基因的表达水平,因此可以促进茎秆基部脱落酸的合成,推测这是独脚金内酯抑制侧芽伸长的重要机制[33-34];本研究中在中的表达水平极显著上调,我们推测茎秆基部中脱落酸的含量可能会增加,从而抑制高节位水稻分蘖的形成,因此在突变体中增加的都是基部分蘖而不是高位分蘖。另外,脱落酸含量的增加会抑制独脚金内酯合成,结合在/突变体中独脚金内酯的合成都发生缺陷的结果,我们推测在突变体中独脚金内酯的含量也会减少,从而减缓独脚金内酯对分蘖芽的抑制作用,促进分蘖的适度增加。综上,本研究结果和前人的报道共同表明基因在育种上具有潜在的利用价值,可以为构建理想株型水稻,提高粮食产量提供理论基础和基因资源。
[1] 李学勇, 钱前, 李家洋. 水稻分蘖的分子机理研究[J]. 中国科学院院刊, 2003, 18(4): 274-276.
Li X Y, Qian Q, Li J Y. Progress in elucidating the molecular mechanism of rice tillering[J]., 2003, 18(4): 274-276. (in Chinese with English abstract)
[2] Wu T, Shen Y, Zheng M, Yang C, Chen Y, Feng Z, Liu X, Liu S, Chen Z, Lei C, Wang J, Jiang L, Wan J. Gene SGL, encoding a kinesin-like protein with transactivation activity, is involved in grain length and plant height in rice[J]., 2014, 33(2): 235-244.
[3] Li X Y, Qian Q, Fu Z M, Wang Y H, Xiong G S, Zeng D L, Wang X Q, Liu X F, Teng S, Hiroshi F, Yuan M, Luo D, Han B, Li J Y. Control of tillering in rice[J]., 2003, 422(6932): 618-621.
[4] Xu C, Wang Y, Yu Y, Duan J, Liao Z, Xiong G, Meng X, Liu G, Qian Q, Li J. Degradation of MONOCULM 1 by APC/C(TAD1) regulates rice tillering[J]., 2012, 3(1): 1-9.
[5] Liang W H, Shang F, Lin Q T, Lou C, Zhang J. Tillering and panicle branching genes in rice[J]., 2014, 537(1): 1-5.
[6] Kim H, Hwang H, Hong J W, Lee Y N, Ahn I P, Yoon I S, Yoo S D, Lee S, Lee S C, Kim B G. A rice orthologue of the ABA receptor, OsPYL/RCAR5, is a positive regulator of the ABA signal transduction pathway in seed germination and early seedling growth[J]., 2012, 63(2): 1013-1024.
[7] Ljung K, Bhalerao R P, Sandberg G. Sites and homeostatic control of auxin biosynthesis induring vegetative growth., 2001, 28(4):465-474.
[8] Lee M, Jung J H, Han D Y, Seo P J, Park W J, Park C M. Activation of a flavin monooxygenase gene YUCCA7 enhances drought resistance in[J]., 2012, 235(5): 923-938.
[9] Xu M, Zhu L, Shou H, Wu P. A PIN1 family gene, OsPIN1, involved in auxin-dependent adventitious root emergence and tillering in rice[J]., 2005, 46(10): 1674-1681.
[10] Xu J X, Ding C Q, Ding Y F, Tang S, Zha M R, Luo B J, Wang S H. A proteomic approach to analyze differential regulation of proteins during bud outgrowth under apical dominance based on the auxin transport canalization model in rice (L.)[J]., 2015, 34(1): 122-136.
[11] Lin H, Wang R, Qian Q, Yan M, Meng X, Fu Z, Yan C, Jiang B, Su Z, Li J, Wang Y. DWARF27, an iron-containing protein required for the biosynthesis of strigolactones, regulates rice tiller bud outgrowth[J]., 2009, 21(5): 1512-1525.
[12] Zou J, Zhang S, Zhang W, Li G, Chen Z, Zhai W, Zhao X, Pan X, Xie Q, Zhu L. The rice HIGH-TILLERING DWARF1 encoding an ortholog ofMAX3 is required for negative regulation of the outgrowth of axillary buds[J]., 2006, 48(5): 687-698.
[13] Arite T, Iwata H, Ohshima K, Maekawa M, Nakajima M, Kojima M, Sakakibara H, Kyozuka J. DWARF10, an RMS1/MAX4/DAD1 ortholog, controls lateral bud outgrowth in rice[J]., 2007, 51(6): 1019-1029.
[14] Fang Z, Ji Y, Hu J, Guo R, Sun S, Wang X. Strigolactones and brassinosteroids antagonistically regulate the stability of the D53-OsBZR1 complex codetermine FC1 expression in rice tillering[J]., 2020, 13(4): 586-597.
[15] Zhao J, Wang T, Wang M, Zhao J, Wang T, Wang M, Liu Y, Yuan S, Gao Y, Yin L, Sun W, Wan J, Li X. DWARF3 participates in an SCF complex and associates with DWARF14 to suppress rice shoot branching[J]., 2014, 55(6): 1096-1109.
[16] Arite T, Umehara M, Ishikawa S, Hanada A, Maekawa M, Yamaguchi S, Kyozuka J., a strigolactone-insensitive mutant of rice, shows an accelerated outgrowth of tillers[J]., 2009, 50(8): 1416-1424.
[17] Liu W, Wu C, Fu Y, Hu G, Si H, Zhu L, Luan W, He Z, Sun Z. Identification and characterization of HTD2: A novel gene negatively regulating tiller bud outgrowth in rice[J]., 2009, 230(4): 649-658.
[18] Gao Z, Qian Q, Liu X, Yan M, Feng Q, Dong G, Liu J, Han B. Dwarf 88, a novel putative esterase gene affecting architecture of rice plant[J]., 2009, 71(3): 265-276.
[19] Ishikawa S, Maekawa M, Arite T, Onishi K, Takamure I, Kyozuka J. Suppression of tiller bud activity in tillering dwarf mutants of rice[J]., 2005, 46(1): 79-86.
[20] De S A, Clavé G, Badet-Denisot M A, Pillot J P, Cornu D, Le Caer J P, Burger M, Pelissier F, Retailleau P, Turnbull C, Bonhomme S, Chory J, Rameau C, Boyer F D. An histidine covalent receptor and butenolide complex mediates strigolactone perception [J]., 2016, 12(10): 787-794.
[21] Sharma R, De V D, Sharma M K, Ronald P C. Recent advances in dissecting stress-regulatory crosstalk in rice[J]., 2013, 6(2): 250-260.
[22] Yao R, Ming Z, Yan L, Li S, Wang F, Ma S, Yu C, Yang M, Chen L, Li Y, Yan C, Miao D, Sun Z, Yan J, Sun Y, Wang L, Chu J, Fan S, He W, Deng H, Nan F, Li J, Rao Z, Lou Z, Xie D. DWARF14 is a non-canonical hormone receptor for strigolactone[J]., 2016, 536(7617): 469-473.
[23] Zhou F, Lin Q, Zhu L, Ren Y, Zhou K, Shabek N, Wu F, Mao H, Dong W, Gan L, Ma W. D14-SCF(D3)- dependent degradation of D53 regulates strigolactone signaling[J]., 2013, 504(7480): 406-410.
[24] Takeda T, Suwa Y, Suzuki M, Kitano H, Ueguchi- Tanaka M, Ashikari M, Matsuoka M, Ueguchi C. Thegene negatively regulates lateral branching in rice[J]., 2003, 33(3): 513-520.
[25] Umehara M, Hanada A, Magome H, Takeda K N, Yamaguchi S. Contribution of strigolactones to the inhibition of tiller bud outgrowth under phosphate deficiency in rice[J]., 2010, 51(7): 1118-1126.
[26] Wang Y, Shang L, Yu H, Zeng L, Hu J, Ni S, Rao Y, Li S, Chu J, Meng X, Wang L, Hu P, Yan J, Kang S, Qu M, Lin H, Wang T, Wang Q, Hu X, Chen H, Wang B, Gao Z, Guo L, Xiong G, Li J, Qian Q. A strigolactone biosynthesis gene contributed to the green revolution in rice[J]., 2020, 13(6): 923-932.
[27] Liu X, Hu Q, Yan J, Sun K, Liang Y, Jia M, Meng X, Fang S, Wang Y, Jing Y, Liu G, Wu D, Chu C, Smith S M, Chu J, Wang Y, Li J, Wang B. ζ-carotene isomerase suppresses tillering in rice through the coordinated biosynthesis of strigolactone and abscisic acid[J]., 2020, 13(12): 1784-1801.
[28] Liu L, Ren M, Peng P, Chun Y, Li L, Zhao J, Fang J, Peng L, Yan J, Chu J, Wang Y, Yuan S, Li X., encoding a 15--ζ-carotene isomerase, regulates tiller number and stature in rice[J]., 2021, 48(1): 88-91.
[29] 陈彩艳, 邹军煌, 张淑英, 朱立煌. 独角金内酯能抑制植物的分枝并介导植物与枞枝真菌及寄生植物间的相互作用[J]. 中国科学: 生命科学, 2009(6): 525-533.
Chen C, Zou J, Zhang S, Zhu L. Strigolactones are a new-defined class of plant hormones which inhibit shoot branching and mediate the interaction of plant-AM fungi and plant-parasitic weeds[J]., 2009(6): 525-533. (in Chinese with English abstract)
[30] Wang P, Gao J, Wan C, Zhang F, Xu Z, Huang X, Sun X, Deng X. Divinyl chlorophyll(ide) a can be converted to monovinyl chlorophyll(ide) a by a divinyl reductase in rice[J]., 2010, 153(3): 994-1003.
[31] Cline M G, Oh C. A reappraisal of the role of abscisic acid and its interaction with auxin in apical dominance[J]., 2006, 98(4): 891-897.
[32] 刘杨. 水稻分蘖芽萌发与休眠相互转换的激素学机制[D]. 南京: 南京农业大学, 2011.
Liu Y. The Mechanism of hormonal regulation of the transformation between germination and dormancy of rice tiller buds[D]. Nanjing: Nanjing Agricultural University. (in Chinese with English abstract)
[33] Zang G, Zou H, Zhang Y. The De-Etiolated 1 homolog ofmodulates the ABA signaling pathway and ABA biosynthesis in rice[J]., 2016, 171(2): 1259-1276.
[34] Bang S W, Park S H, Jeong J S, Kim Y S, Jung H, Ha S H, Kim J K. Characterization of the stress-inducible OsNCED3 promoter in different transgenic rice organs and over three homozygous generations[J]., 2013, 237(1): 211-224.
Cloning and Functional Analysis of Rice Tillering Regulatory Gene
WU Xianmei1, #, LI Sanfeng1, #, HU Ping1, HE Rui1, JIAO Ran2, MAO Yijian1, LU Caolin1, HU Juan2, LIN Han2, WU Rongliang1, ZHU Xudong1, RAO Yuchun2, *, WANG Yuexing1, *
(1China National Center for Rice Improvement / State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006, China;2College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China;#These authors contributed equally to this work;*Corresponding author, E-mail: wangyuexing@caas.cn, ryc@zjnu.cn)
【】Cloning of rice tiller-related genes lays a theoretical basis and provides beneficial genetic resources for constructing ideal plant-type rice and increasing grain yield.【】We compared phenotypes and main agronomic traits between the mutant() and its wild type under conventional field planting conditions, used map-based cloning method to clone candidate genes, analyzed the expression levels of, SL and ABA-related genes by fluorescence quantitative real-time PCR. Sequencing comparison was performed to analyze the natural variation ofin 147 germplasm resources.【】Compared with the wild type, the axillay bud of the mutantgrow faster, the number of tillers and effective panicles were significantly increased, the plant height, the number of primary rachis branches and grains per panicle were significantly decreased, and the seed setting rate and 1000-grain weight were not significantly changed. Genetic analysis indicated that the high-tillering trait ofwas controlled by single recessive nuclear gene, which was mapped to a 63.5 kb region between the marker CM8 and CM10 on chromosome 12, and the complementary transgenic experiment proved thatwas the gene controlling the high-tillering phenotype.is constitutively expressed in wild-type and mutant, and the mutation of this gene could up-regulate the expression level of some stratolactones and ABA-related genes.The natural variation of G2674A in thecoding region in rice varieties significantly increase the number of tillers.【】is a new allele of the recently reportedgene. Themutation leads to the phenotype of moderate increase in tillers and slightly shorter plant height in rice, which has great application potential in cultivating ideal plant type rice and high-yield breeding.
rice; high-tillering; gene cloning; biological function
10.16819/j.1001-7216.2021. 210205
2021-02-16;
2021-03-23。
浙江省自然科学杰出青年基金资助项目(LR20C130001); 国家自然科学基金面上资助项目 (31971921); 浙江省万人计划青年拔尖人才资助项目(ZJWR0108023)。

